化学人教版(2019)必修第一册4.1原子结构与元素周期表 课件(共71张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.1原子结构与元素周期表 课件(共71张ppt) |
|
|
| 格式 | pptx | ||
| 文件大小 | 24.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-16 12:28:34 | ||
图片预览










文档简介
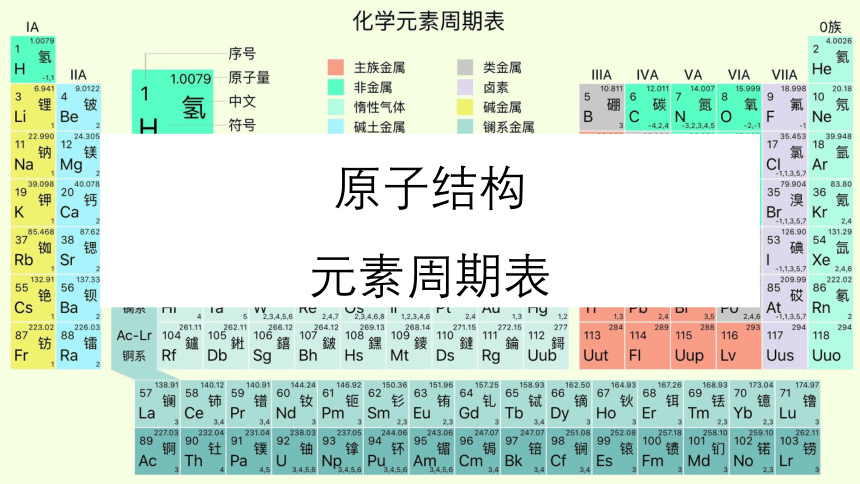
(共71张PPT)
原子结构
元素周期表
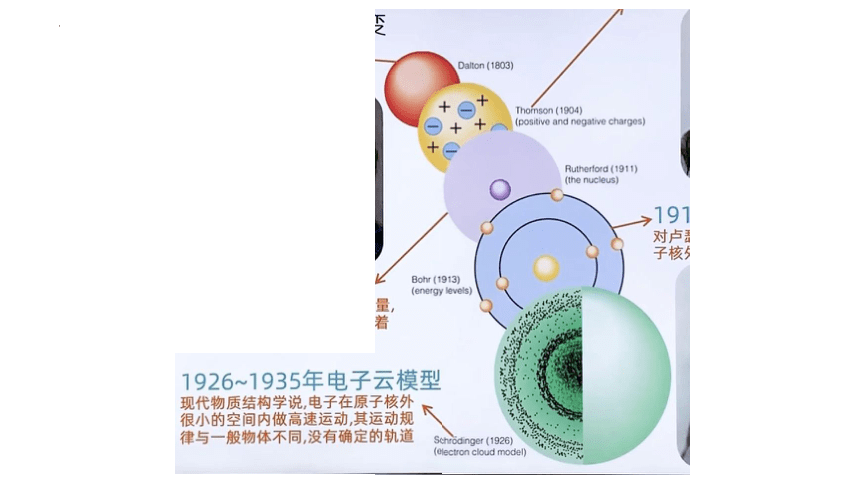
一、人类认识原子结构的历程
1.德谟克利特的古代原子学说(atom)
古希腊哲学家德谟克利特认为物质都是由不可分割的微粒即 构成的,原子的结合和分离是万物变化的根本原因。
2.道尔顿的近代原子学说(实心球模型)
19世纪初,英国科学家道尔顿提出了 学说。他认为物质由 组成,原子不能被创造,也不能被毁灭,在化学变化中不可再分割,它们在化学反应中保持本性不变。
原子
原子
原子
3.汤姆生的“葡萄干面包式”的原子结构模型
1904年,英国物理学家汤姆生提出“ ”原子结构模型,他在1897年发现了原子中存在 。
4.卢瑟福的带核原子结构模型
1911年,英国物理学家卢瑟福提出“ 模型”或“ 模型”。
他通过“α粒子散射实验”,推测原子中心存在 ,带 。电子带负电,在其周围 ,就像行星围绕太阳运转一样。
葡萄干面包式
电子
有核
行星
原子核
正电
高速运动
5.玻尔的轨道原子结构模型
1913年,丹麦物理学家玻尔引入 观点。
他提出了新的原子结构模型:原子核外,电子在一系列稳定的 上运动,每个轨道都具有一个 的能量值;核外电子在这些稳定的轨道上运动时,既不 ,也不 。
6.现代原子结构学说——电子云模型
原子结构理论在20世纪末和21世纪初又有了新的飞速发展。
量子论
轨道
确定
放出能量
吸收能量
人类的认知是循环往复,不断发展的,中间或许会有歧路,但从宏观整体上把握是呈现螺旋式上升趋势的。
二、原子结构
1.原子的组成
(1)原子
原子核
质子:带 个单位正电荷
中子:不带电
核外电子:带 个单位负电荷
1
1
(2)质量数:将原子核内所有的 和 的相对质量取整数加起来所得的数值,用 表示。
(3)构成原子的微粒间的两个关系
①质量数(A)=_____________________
②质子数=核外电子数= =原子序数。
质子
中子
A
质子数(Z)+中子数(N)
核电荷数
(4)原子组成的表示方法
质量数
质子数
_______
_______
元素符号
12
6
天然存在的 同位素相互间保持一定的比率。如12C为98.892%,13C为1.108%,14C为1.2×10—10%。12C、13C为稳定同位素,14C为放射性同位素,半衰期为5730年,常被用来研究生物过程、生物化学过程等反应途径的指示剂。
俗称 - 重氢 超重氢
符号 ___ ___ ___
质子数 1 1 1
中子数 __ __ ___
氢元素的三种核素
H
D
T
0
1
2
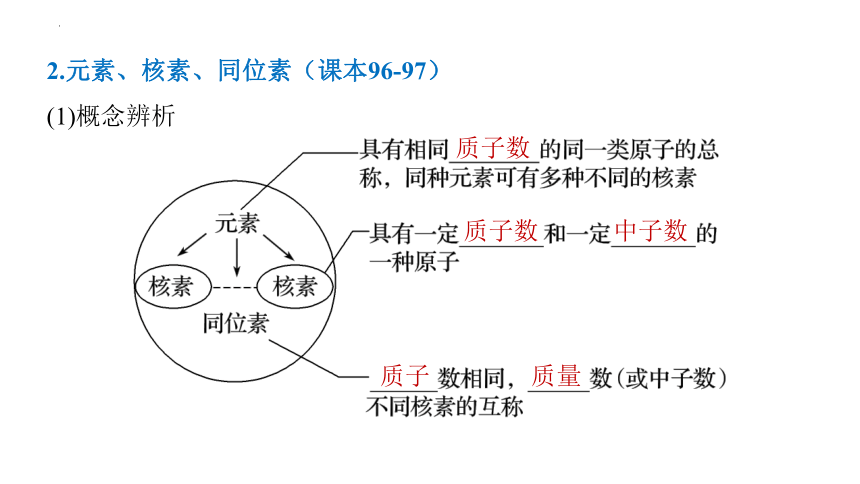
2.元素、核素、同位素(课本96-97)
(1)概念辨析
质子数
质子数
中子数
质子
质量
(2)同位素的应用
①____在考古工作中用于测定文物的年代;
② 用于制造原子弹、核发电;
③ 用于制造氢弹;
④放射性同位素释放的射线可用于育种、治疗恶性肿瘤等。
14C
核外电子排布决定原子的化学性质,在多电子原子中,电子是如何排布的呢?
三、核外电子排布
1.核外电子的分层排布
在多电子的原子里,电子的能量并不相同。能量低的,通常在离核 的区域运动;能量高的,通常在离核 的区域运动。核外电子的分层运动,又叫核外电子的分层排布。其关系如下:
电子层 层数(n) 1 2 3 4 5 6 7
符号 ___ ___ ___ N O P Q
离核远近 由___到___ 能量高低 由___到___ 近
远
K
L
M
近
远
高
低
原子中电子处在原子核的引力场中,电子一般总是先从内层排起,一层充满后再填充下一层。每个电子层最多可以排布多少电子呢?
2
8
2
8
8
2
+2
+10
+18
2
8
18
8
+36
+54
2
8
18
8
18
+86
2
8
18
32
8
18
KLMNOP
2n2
8
2
18
2.原子核外电子排布的一般规律
3.核外电子排布的表示方法——原子结构示意图
(1)钠原子的结构示意图如下,请注明其意义:
电子层
电子数
原子核
核电荷数
(2)离子结构示意图:
①阳离子:元素的原子失去最外层所有电子变为离子时,电子层数减少一层,形成与上一周期稀有气体元素原子相同的电子层结构,其核外电子数= 。
如
质子数-所带电荷数
②阴离子:元素的原子得到电子变成简单阴离子时,形成和同周期稀有气体元素原子相同的电子层结构,其核外电子数= 。
如
质子数+所带电荷数
在练习本上依次画出1~18号元素的原子结构示意图,分析总结它们的核外电子排布特点(填元素符号):
(1)最外层电子数为1的原子有____________;最外层电子数为2的原子有________________。
(2)最外层电子数与次外层电子数相等的原子有________________。
(3)最外层电子数是次外层电子数2倍的原子有_____________,3倍的原子有_____________。
(4)次外层电子数是最外层电子数2倍的原子有________________。
(5)电子层数与最外层电子数相等的原子有________________。
(6)最外层电子数是电子层数2倍的原子有________________。
元素周期表 核素
现在发现和合成的元素一共有118种,如果每种元素都去仔细研究,耗费的人力、物力相当大。
如何做?
——分门别类去研究
如何分类?
找到规律,找到元素内在的联系。
(2)元素周期表的演变
①演变:随着科学发展,为__________留下的空位先后被填满。
②编排依据:由相对原子质量改为原子的_________。
(1)第一张元素周期表
①诞生:1869年,俄国化学家_________绘制出
②绘制依据:将元素按照_____________由小到大的顺序排列,将_______________的元素放在一个纵行。
门捷列夫
相对原子质量
化学性质相似
未知元素
核电荷数
元素周期表的发展历程
[思考与交流] (观察元素周期表)
按照元素在周期表中的顺序给元素编号,
得到原子序数。
结合1-20号元素原子的结构示意图和元素周期表中1-20号元素的排列,分析一下我们现在使用的元素周期表的排列规律。
原子序数=核电荷数=质子数=核外电子数
钾(K) 钙(Ca)
+19 2 8 8 1
⑴ 把电子层数相同的元素,按原子序数递增的顺序从左到右排列
⑵ 把最外层电子数相同的元素按电子层数递增的顺序从上到下排列
元素周期表排列的规律
周期(横行)
第一周期:2 种元素
第二周期:8 种元素
第三周期:8 种元素
第四周期:18 种元素
第五周期:18 种元素
第六周期:32 种元素
第七周期:32种元素
(镧系元素)
(锕系元素)
周期序数 = 电子层数
短周期
长周期
族
纵行
主族:
副族:
ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA
第Ⅷ族:
稀有气体元素
0族:
共七个主族
ⅠB , ⅡB , ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB
共七个副族
三个纵行(8、9、10),位于Ⅶ B 与ⅠB中间
主族序数=最外层电子数
①周期
a.个数:元素周期表中有____个周期。
b.特点:每一周期中元素的_________相同
c.分类:
短周期:包括_______________________。
长周期:包括_____________________。
元素周期表的结构
7
电子层数
第一、二、三周期
第四、五、六、七周期
②族
a.个数:元素周期表有___个纵行,但只有__ 个族。
b.特点:元素周期表中主族元素的族序数等于其____________________。
c.分类:
主族:在族序数后标A,如周期表中第14纵行表示为第________族。
18
16
原子的最外层电子数
ⅣA
副族:在族序数后标B,如周期表中第6纵行表示为
第________族。
0族:最外层电子数___(He为___),其化合价定为__。
Ⅷ族:周期表中第__________纵行。
ⅥB
8
2
0
8、9、10
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
ⅠA ⅡA ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB ⅢA ⅣA ⅤA ⅥA ⅦA 0
族的别称
第ⅠA族称为 元素 ,
第ⅡA族称为 元素
第ⅣA族称为 元素,
第ⅤA族称为 元素
第ⅥA族称为 元素
第ⅦA族称为 元素
零族称为 元素
碱金属
碱土金属
碳族
氮族
氧族
卤族
稀有气体
思考:Cl的位置的描述:
第七主族
VII族
VIIA族
第III周期
第三周期
第3周期
第三周期第VIIA族
1、氦元素原子最外层有两个电子,
为什么不把它排在ⅡA族?
2、哪周期元素种类最多?族呢?
第ⅢB
第六周期、第七周期
元素规律性的总结
预测新元素,为未知元素预留了“房间”。
元素周期表的应用
原子结构与元素性质
门捷列夫曾预言有这样一种元素,性质上和铝相似,称其为“类铝”,密度为5.9—6克/立方厘米。
1875年,法国化学家布瓦博德兰从闪锌矿中发现了镓元素,元素符号定为Ga,中文名为“镓”。镓元素,大部分数据和性质都和门捷列夫预言的类铝相近,只是测定的密度为4.7克/立方厘米,与预测值相距较大。
1876年5月,法国科学院在院刊上公布了布瓦博德兰关于镓的新发现。不久,布瓦博德兰就收到了门捷列夫写来的信件,信中说让他重新测定一下镓的比重。于是,布瓦博德朗把镓提纯之后重新进行了测量,镓的比重实测值为5.96,与门捷列夫的预测十分吻合!此事在欧洲的震动很大。而若干年之后,发现钪和锗的喜讯也相继传来,并且,钪和锗的理化性质都与门捷列夫的预测相一致,从而为门捷列夫周期律的科学性提供了有力的证据。
科学史话
元素的化学性质与原子结构的关系
(1)活泼金属元素的原子最外层电子数 ,容易 电子;具有金属性
(2)活泼非金属元素的原子最外层电子数 ,容易 电子;具有非金属性
较少
失去
较多
得到
碱金属元素
1. 位置
ⅠA 族(除氢外)的元素称为碱金属,它们的原子结构有何异同?
元素名称 元素符号 核电荷数 原子结构示意图 最外层电子数 电子层数 原子半径(nm)
碱 金 属 元 素 锂 0.152
钠 0.186
钾 0.227
铷 0.248
铯 0.265
Li
Na
K
Rb
Cs
3
11
19
37
55
1
1
1
1
1
2
3
4
5
6
2、原子结构
2、原子结构
①相似性:
原子结构的 相同, 都为 。
最外层电子数
1个
②递变性:
从Li到Cs:
核电荷数依次 ;
电子层数逐渐 ;
原子半径逐渐 ;
增大
增多
增大
结构决定性质
从碱金属原子的结构角度推测其化学性质
易失去1个电子
形成+1价阳离子
表现出还原性
可与非金属、水等反应
Li
Na
K
Rb
Cs
3、碱金属单质的化学性质
复习回顾:
Na有哪些化学性质?
与非金属单质(如O2反应)
与水反应
常温下:4Na+O2=== 2Na2O
加热条件下:2Na+O2 === Na2O2
2Na + 2H2O = 2NaOH + H2↑
(1)与水反应
3、碱金属单质的化学性质
钠和钾与水反应的比较
物理性质:质软、银白色、密度比水小
(1)与水反应
钠
与水反应
反应方程式
浮、熔、游、响、红
浮、熔、游、响、红,有微弱爆炸
2Na + 2H2O 2NaOH + H2↑
2K + 2H2O 2KOH + H2↑
钾
2 M + 2 H2O === 2 MOH + H2↑
( M = Li, Na, K, Rb, Cs )
3、碱金属单质的化学性质
反应剧烈程度↑,产物碱性↑
3、碱金属单质的化学性质
(2)与非金属的反应(以O2为例)
3、碱金属单质的化学性质
(2)与非金属的反应(以O2为例)
钠、钾化学性质比较
钠 钾
与氧气 反应 剧烈燃烧, 火焰 色,生成 色的固体 燃烧更剧烈,火焰呈 色 (透过蓝色钴玻璃观察)
黄
淡黄
紫
碱金属 化学反应方程式 反应剧烈程度 产物复杂程度 活
泼
性
Li 逐 渐 逐 渐
逐
渐
Na K Rb Cs 增大
增大
4Li+O2===2Li2O
2Na+O2===Na2O2
K+O2===KO2
为什么碱金属单质化学性质具有相似性和递变性?
结构 性质
相 似 性 最外层都只有__________ 单质都具有较强的 _____ ;
都能与_________反应。
递 变 性 从Li→Cs:电子层数逐渐_____;原子半径逐渐____:原子核对最外层电子的引力逐渐 ___ 。 失电子能力逐渐_____;与O2、H2O反应剧烈程度逐渐____;
碱性逐渐_____,如LiOH< ____ < ____ < ____决定
1个电子
增多
增大
减弱
还原性
O2、H2O
增强
增大
增强
NaOH
KOH
RbOH
增强
金属元素的金属性强弱判断依据:
1、根据金属单质与水或者与酸反应置换出氢的难易程度。
置换出氢越容易,则金属性越强。
2、根据金属元素最高价氧化物对应水化物碱性强弱。
碱性越强,则原金属元素的金属性越强。
锂 Li
铷 Rb
钠 Na
略带金属光泽
4、碱金属单质的物理性质
阅读课本P101 表4-2,
试着归纳碱金属物理性质的相似性和递变性
碱金属单质 颜色和状态 密度 (g.cm3) 熔点 (℃) 沸点(℃)
Li 银白色,柔软 0.534 180.5 1347
Na 银白色,柔软 0.97 97.81 882.9
K 银白色,柔软 0.86 63.65 774
Rb 银白色,柔软 1.532 38.89 688
Cs 略带金属光泽,柔软 1.879 28.40 678.4
表4-2 碱金属单质的主要物理性质
熔沸点
逐渐降低
最轻的金属
密度反常
4、碱金属单质的物理性质
总结:碱金属元素的递变规律
碱金属元素 原子结构 化学性质 物理性质 核电荷数 电子层数 原子半径 核对最外层电子的吸引力 金 属 性 对应碱的碱性 密度
熔沸点
Li Na K Rb Cs
增
加
增
加
增
加
减
弱
增
强
增
大
(K
除
外)
降
低
增
强
1.锂电池是一种高能电池。
4.铷铯主要用于制备光电管、真空管。铯原子钟是目前最准确的计时仪器。
3.钾的化合物最大用途是做钾肥。硝酸钾还用于做火药。
碱金属元素的用途:
2.钠钾合金可以作核反应堆的传热剂
5、碱金属单质规律的应用
锂电池
电池原材料Li2CO3价格飞涨
→钠电池
二者工作原理几乎一致,研发成本低
卤族元素
1. 位置
氯气
液溴
碘
氟气
2、卤素单质的物理性质
卤素单质 颜色和状态 密度 熔点 (℃) 沸点(℃) 水溶性
F2 淡黄绿色,气体 1.69 g L-1 -219.6 -188.1 反应
Cl2 黄绿色,气体 3.214 g L-1 -101 -34.6 溶解
Br2 深红棕色,液体 3.119 g cm-3 -7.2 58.78 溶解
I2 紫黑色,固体 4.93g cm-3 113.5 184.4 微溶
表4—3 卤素单质的主要物理性质
常温下,唯一的液态非金属单质
2、卤素单质的物理性质
颜色
逐渐加深
气液固,密度逐渐增大
熔沸点
逐渐增大
逐渐减小
递变性
相似性
都有颜色,不易溶于水(氟除外),易溶于苯、四氯化碳等有机溶剂(萃取原理)。
结合下表,推测卤族元素的原子结构和性质有什么相似性和递变性?
元素名称 元素符号 核电荷数 原子结构 示意图 最外层电子数 电子层数 原子半径(nm)
氟 0.071
氯 0.099
溴 0.114
碘 0.133
F
Cl
Br
I
9
17
35
53
7
7
7
7
2
3
4
5
3、原子结构
①相同点:最外层上都有____个电子;
②递变性:从F→I,核电荷数逐渐________,电子层数逐渐_____,原子半径逐渐_____。
7
增多
增多
增大
3、原子结构
具有氧化性
易得1个电子
(1)都能与金属反应生成金属卤化物
(2)都能与氢气反应生成卤化氢(HX)
(3)都能与水反应
(4)都能与碱反应
4、卤素单质的化学性质
(1)卤素单质与氢气反应
卤素 单质 反应 条件 剧烈程度 化学方程式 产物稳
定性
F2 暗处 剧烈,发生爆炸 ________________ 很稳定
Cl2 光照或点燃 剧烈 _______________________ 较稳定
Br2 加热 不剧烈 __________________ 不如氯
化氢稳定
I2 不断 加热 不剧烈 _____________ 不稳定
H2+F2===2HF
通式 H2+X2===2HX
条件
4、卤素单质的化学性质
从卤素单质与氢气反应的条件及产物稳定性来看,请你判断Cl、Br、I单质的氧化性强弱,并用简单的实验验证你的想法。
提供药品:新制氯水、溴水、KCl溶液、KBr溶液、KI溶液
实 验 现 象 反应方程式
(2)卤素单质间的置换反应
实 验 现 象 反应方程式
溶液由无色变为橙黄色
溶液由无色变为褐色
溶液由无色变为褐色
Cl2+2KBr === 2KCl+Br2
2KI+Br2 === 2KBr+I2
2KI+Cl2 === 2KCl+I2
实验①②③结论:Cl2→I2氧化性逐渐减弱,相应卤素离子还原性逐渐增强。
① ② ③
4、卤素单质的化学性质
归纳:卤族元素原子结构和性质的相似性和递变性
1.卤族元素原子结构和性质的相似性:
(1)最外层均有7个电子;
(2)最高正价除F外均显+7价,最低负价为-1价;
最高价氧化物对应水化物的通式为HXO4(F除外)。
2.卤族元素原子结构和性质的递变性:
结构及性质 规 律
原子半径
单质的氧化性
阴离子的还原性
与H2化合的难易程度
氢化物的稳定性
卤素的非金属性强弱
最高价氧化物对 应水化物的酸性
F、Cl、Br、I:原子半径逐渐增大
F-、Cl-、Br-、I-:还原性逐渐增强
F2、Cl2、Br2、I2与H2化合:越来越难
F2、Cl2、Br2、I2的氧化性:越来越弱
HF、HCl、HBr、HI稳定性:逐渐减弱
HClO4、HBrO4、HIO4酸性:逐渐减弱
F2、Cl2、Br2、I2非金属性:逐渐减弱
一般情况下,元素的非金属性强弱可以从以下两个方面判断:
①单质与氢气生成气态氢化物的难易程度及氢化物的稳定性;
②最高价氧化物对应水化物的酸性强弱。
最外层电子数相同
结构
电子层数增加
原子半径增加
性质
失电子能力增强,金属性增强
得电子能力减弱,非金属减弱
决定
总结归纳
反映
原子结构
元素周期表
一、人类认识原子结构的历程
1.德谟克利特的古代原子学说(atom)
古希腊哲学家德谟克利特认为物质都是由不可分割的微粒即 构成的,原子的结合和分离是万物变化的根本原因。
2.道尔顿的近代原子学说(实心球模型)
19世纪初,英国科学家道尔顿提出了 学说。他认为物质由 组成,原子不能被创造,也不能被毁灭,在化学变化中不可再分割,它们在化学反应中保持本性不变。
原子
原子
原子
3.汤姆生的“葡萄干面包式”的原子结构模型
1904年,英国物理学家汤姆生提出“ ”原子结构模型,他在1897年发现了原子中存在 。
4.卢瑟福的带核原子结构模型
1911年,英国物理学家卢瑟福提出“ 模型”或“ 模型”。
他通过“α粒子散射实验”,推测原子中心存在 ,带 。电子带负电,在其周围 ,就像行星围绕太阳运转一样。
葡萄干面包式
电子
有核
行星
原子核
正电
高速运动
5.玻尔的轨道原子结构模型
1913年,丹麦物理学家玻尔引入 观点。
他提出了新的原子结构模型:原子核外,电子在一系列稳定的 上运动,每个轨道都具有一个 的能量值;核外电子在这些稳定的轨道上运动时,既不 ,也不 。
6.现代原子结构学说——电子云模型
原子结构理论在20世纪末和21世纪初又有了新的飞速发展。
量子论
轨道
确定
放出能量
吸收能量
人类的认知是循环往复,不断发展的,中间或许会有歧路,但从宏观整体上把握是呈现螺旋式上升趋势的。
二、原子结构
1.原子的组成
(1)原子
原子核
质子:带 个单位正电荷
中子:不带电
核外电子:带 个单位负电荷
1
1
(2)质量数:将原子核内所有的 和 的相对质量取整数加起来所得的数值,用 表示。
(3)构成原子的微粒间的两个关系
①质量数(A)=_____________________
②质子数=核外电子数= =原子序数。
质子
中子
A
质子数(Z)+中子数(N)
核电荷数
(4)原子组成的表示方法
质量数
质子数
_______
_______
元素符号
12
6
天然存在的 同位素相互间保持一定的比率。如12C为98.892%,13C为1.108%,14C为1.2×10—10%。12C、13C为稳定同位素,14C为放射性同位素,半衰期为5730年,常被用来研究生物过程、生物化学过程等反应途径的指示剂。
俗称 - 重氢 超重氢
符号 ___ ___ ___
质子数 1 1 1
中子数 __ __ ___
氢元素的三种核素
H
D
T
0
1
2
2.元素、核素、同位素(课本96-97)
(1)概念辨析
质子数
质子数
中子数
质子
质量
(2)同位素的应用
①____在考古工作中用于测定文物的年代;
② 用于制造原子弹、核发电;
③ 用于制造氢弹;
④放射性同位素释放的射线可用于育种、治疗恶性肿瘤等。
14C
核外电子排布决定原子的化学性质,在多电子原子中,电子是如何排布的呢?
三、核外电子排布
1.核外电子的分层排布
在多电子的原子里,电子的能量并不相同。能量低的,通常在离核 的区域运动;能量高的,通常在离核 的区域运动。核外电子的分层运动,又叫核外电子的分层排布。其关系如下:
电子层 层数(n) 1 2 3 4 5 6 7
符号 ___ ___ ___ N O P Q
离核远近 由___到___ 能量高低 由___到___ 近
远
K
L
M
近
远
高
低
原子中电子处在原子核的引力场中,电子一般总是先从内层排起,一层充满后再填充下一层。每个电子层最多可以排布多少电子呢?
2
8
2
8
8
2
+2
+10
+18
2
8
18
8
+36
+54
2
8
18
8
18
+86
2
8
18
32
8
18
KLMNOP
2n2
8
2
18
2.原子核外电子排布的一般规律
3.核外电子排布的表示方法——原子结构示意图
(1)钠原子的结构示意图如下,请注明其意义:
电子层
电子数
原子核
核电荷数
(2)离子结构示意图:
①阳离子:元素的原子失去最外层所有电子变为离子时,电子层数减少一层,形成与上一周期稀有气体元素原子相同的电子层结构,其核外电子数= 。
如
质子数-所带电荷数
②阴离子:元素的原子得到电子变成简单阴离子时,形成和同周期稀有气体元素原子相同的电子层结构,其核外电子数= 。
如
质子数+所带电荷数
在练习本上依次画出1~18号元素的原子结构示意图,分析总结它们的核外电子排布特点(填元素符号):
(1)最外层电子数为1的原子有____________;最外层电子数为2的原子有________________。
(2)最外层电子数与次外层电子数相等的原子有________________。
(3)最外层电子数是次外层电子数2倍的原子有_____________,3倍的原子有_____________。
(4)次外层电子数是最外层电子数2倍的原子有________________。
(5)电子层数与最外层电子数相等的原子有________________。
(6)最外层电子数是电子层数2倍的原子有________________。
元素周期表 核素
现在发现和合成的元素一共有118种,如果每种元素都去仔细研究,耗费的人力、物力相当大。
如何做?
——分门别类去研究
如何分类?
找到规律,找到元素内在的联系。
(2)元素周期表的演变
①演变:随着科学发展,为__________留下的空位先后被填满。
②编排依据:由相对原子质量改为原子的_________。
(1)第一张元素周期表
①诞生:1869年,俄国化学家_________绘制出
②绘制依据:将元素按照_____________由小到大的顺序排列,将_______________的元素放在一个纵行。
门捷列夫
相对原子质量
化学性质相似
未知元素
核电荷数
元素周期表的发展历程
[思考与交流] (观察元素周期表)
按照元素在周期表中的顺序给元素编号,
得到原子序数。
结合1-20号元素原子的结构示意图和元素周期表中1-20号元素的排列,分析一下我们现在使用的元素周期表的排列规律。
原子序数=核电荷数=质子数=核外电子数
钾(K) 钙(Ca)
+19 2 8 8 1
⑴ 把电子层数相同的元素,按原子序数递增的顺序从左到右排列
⑵ 把最外层电子数相同的元素按电子层数递增的顺序从上到下排列
元素周期表排列的规律
周期(横行)
第一周期:2 种元素
第二周期:8 种元素
第三周期:8 种元素
第四周期:18 种元素
第五周期:18 种元素
第六周期:32 种元素
第七周期:32种元素
(镧系元素)
(锕系元素)
周期序数 = 电子层数
短周期
长周期
族
纵行
主族:
副族:
ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA
第Ⅷ族:
稀有气体元素
0族:
共七个主族
ⅠB , ⅡB , ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB
共七个副族
三个纵行(8、9、10),位于Ⅶ B 与ⅠB中间
主族序数=最外层电子数
①周期
a.个数:元素周期表中有____个周期。
b.特点:每一周期中元素的_________相同
c.分类:
短周期:包括_______________________。
长周期:包括_____________________。
元素周期表的结构
7
电子层数
第一、二、三周期
第四、五、六、七周期
②族
a.个数:元素周期表有___个纵行,但只有__ 个族。
b.特点:元素周期表中主族元素的族序数等于其____________________。
c.分类:
主族:在族序数后标A,如周期表中第14纵行表示为第________族。
18
16
原子的最外层电子数
ⅣA
副族:在族序数后标B,如周期表中第6纵行表示为
第________族。
0族:最外层电子数___(He为___),其化合价定为__。
Ⅷ族:周期表中第__________纵行。
ⅥB
8
2
0
8、9、10
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
ⅠA ⅡA ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB ⅢA ⅣA ⅤA ⅥA ⅦA 0
族的别称
第ⅠA族称为 元素 ,
第ⅡA族称为 元素
第ⅣA族称为 元素,
第ⅤA族称为 元素
第ⅥA族称为 元素
第ⅦA族称为 元素
零族称为 元素
碱金属
碱土金属
碳族
氮族
氧族
卤族
稀有气体
思考:Cl的位置的描述:
第七主族
VII族
VIIA族
第III周期
第三周期
第3周期
第三周期第VIIA族
1、氦元素原子最外层有两个电子,
为什么不把它排在ⅡA族?
2、哪周期元素种类最多?族呢?
第ⅢB
第六周期、第七周期
元素规律性的总结
预测新元素,为未知元素预留了“房间”。
元素周期表的应用
原子结构与元素性质
门捷列夫曾预言有这样一种元素,性质上和铝相似,称其为“类铝”,密度为5.9—6克/立方厘米。
1875年,法国化学家布瓦博德兰从闪锌矿中发现了镓元素,元素符号定为Ga,中文名为“镓”。镓元素,大部分数据和性质都和门捷列夫预言的类铝相近,只是测定的密度为4.7克/立方厘米,与预测值相距较大。
1876年5月,法国科学院在院刊上公布了布瓦博德兰关于镓的新发现。不久,布瓦博德兰就收到了门捷列夫写来的信件,信中说让他重新测定一下镓的比重。于是,布瓦博德朗把镓提纯之后重新进行了测量,镓的比重实测值为5.96,与门捷列夫的预测十分吻合!此事在欧洲的震动很大。而若干年之后,发现钪和锗的喜讯也相继传来,并且,钪和锗的理化性质都与门捷列夫的预测相一致,从而为门捷列夫周期律的科学性提供了有力的证据。
科学史话
元素的化学性质与原子结构的关系
(1)活泼金属元素的原子最外层电子数 ,容易 电子;具有金属性
(2)活泼非金属元素的原子最外层电子数 ,容易 电子;具有非金属性
较少
失去
较多
得到
碱金属元素
1. 位置
ⅠA 族(除氢外)的元素称为碱金属,它们的原子结构有何异同?
元素名称 元素符号 核电荷数 原子结构示意图 最外层电子数 电子层数 原子半径(nm)
碱 金 属 元 素 锂 0.152
钠 0.186
钾 0.227
铷 0.248
铯 0.265
Li
Na
K
Rb
Cs
3
11
19
37
55
1
1
1
1
1
2
3
4
5
6
2、原子结构
2、原子结构
①相似性:
原子结构的 相同, 都为 。
最外层电子数
1个
②递变性:
从Li到Cs:
核电荷数依次 ;
电子层数逐渐 ;
原子半径逐渐 ;
增大
增多
增大
结构决定性质
从碱金属原子的结构角度推测其化学性质
易失去1个电子
形成+1价阳离子
表现出还原性
可与非金属、水等反应
Li
Na
K
Rb
Cs
3、碱金属单质的化学性质
复习回顾:
Na有哪些化学性质?
与非金属单质(如O2反应)
与水反应
常温下:4Na+O2=== 2Na2O
加热条件下:2Na+O2 === Na2O2
2Na + 2H2O = 2NaOH + H2↑
(1)与水反应
3、碱金属单质的化学性质
钠和钾与水反应的比较
物理性质:质软、银白色、密度比水小
(1)与水反应
钠
与水反应
反应方程式
浮、熔、游、响、红
浮、熔、游、响、红,有微弱爆炸
2Na + 2H2O 2NaOH + H2↑
2K + 2H2O 2KOH + H2↑
钾
2 M + 2 H2O === 2 MOH + H2↑
( M = Li, Na, K, Rb, Cs )
3、碱金属单质的化学性质
反应剧烈程度↑,产物碱性↑
3、碱金属单质的化学性质
(2)与非金属的反应(以O2为例)
3、碱金属单质的化学性质
(2)与非金属的反应(以O2为例)
钠、钾化学性质比较
钠 钾
与氧气 反应 剧烈燃烧, 火焰 色,生成 色的固体 燃烧更剧烈,火焰呈 色 (透过蓝色钴玻璃观察)
黄
淡黄
紫
碱金属 化学反应方程式 反应剧烈程度 产物复杂程度 活
泼
性
Li 逐 渐 逐 渐
逐
渐
Na K Rb Cs 增大
增大
4Li+O2===2Li2O
2Na+O2===Na2O2
K+O2===KO2
为什么碱金属单质化学性质具有相似性和递变性?
结构 性质
相 似 性 最外层都只有__________ 单质都具有较强的 _____ ;
都能与_________反应。
递 变 性 从Li→Cs:电子层数逐渐_____;原子半径逐渐____:原子核对最外层电子的引力逐渐 ___ 。 失电子能力逐渐_____;与O2、H2O反应剧烈程度逐渐____;
碱性逐渐_____,如LiOH< ____ < ____ < ____
1个电子
增多
增大
减弱
还原性
O2、H2O
增强
增大
增强
NaOH
KOH
RbOH
增强
金属元素的金属性强弱判断依据:
1、根据金属单质与水或者与酸反应置换出氢的难易程度。
置换出氢越容易,则金属性越强。
2、根据金属元素最高价氧化物对应水化物碱性强弱。
碱性越强,则原金属元素的金属性越强。
锂 Li
铷 Rb
钠 Na
略带金属光泽
4、碱金属单质的物理性质
阅读课本P101 表4-2,
试着归纳碱金属物理性质的相似性和递变性
碱金属单质 颜色和状态 密度 (g.cm3) 熔点 (℃) 沸点(℃)
Li 银白色,柔软 0.534 180.5 1347
Na 银白色,柔软 0.97 97.81 882.9
K 银白色,柔软 0.86 63.65 774
Rb 银白色,柔软 1.532 38.89 688
Cs 略带金属光泽,柔软 1.879 28.40 678.4
表4-2 碱金属单质的主要物理性质
熔沸点
逐渐降低
最轻的金属
密度反常
4、碱金属单质的物理性质
总结:碱金属元素的递变规律
碱金属元素 原子结构 化学性质 物理性质 核电荷数 电子层数 原子半径 核对最外层电子的吸引力 金 属 性 对应碱的碱性 密度
熔沸点
Li Na K Rb Cs
增
加
增
加
增
加
减
弱
增
强
增
大
(K
除
外)
降
低
增
强
1.锂电池是一种高能电池。
4.铷铯主要用于制备光电管、真空管。铯原子钟是目前最准确的计时仪器。
3.钾的化合物最大用途是做钾肥。硝酸钾还用于做火药。
碱金属元素的用途:
2.钠钾合金可以作核反应堆的传热剂
5、碱金属单质规律的应用
锂电池
电池原材料Li2CO3价格飞涨
→钠电池
二者工作原理几乎一致,研发成本低
卤族元素
1. 位置
氯气
液溴
碘
氟气
2、卤素单质的物理性质
卤素单质 颜色和状态 密度 熔点 (℃) 沸点(℃) 水溶性
F2 淡黄绿色,气体 1.69 g L-1 -219.6 -188.1 反应
Cl2 黄绿色,气体 3.214 g L-1 -101 -34.6 溶解
Br2 深红棕色,液体 3.119 g cm-3 -7.2 58.78 溶解
I2 紫黑色,固体 4.93g cm-3 113.5 184.4 微溶
表4—3 卤素单质的主要物理性质
常温下,唯一的液态非金属单质
2、卤素单质的物理性质
颜色
逐渐加深
气液固,密度逐渐增大
熔沸点
逐渐增大
逐渐减小
递变性
相似性
都有颜色,不易溶于水(氟除外),易溶于苯、四氯化碳等有机溶剂(萃取原理)。
结合下表,推测卤族元素的原子结构和性质有什么相似性和递变性?
元素名称 元素符号 核电荷数 原子结构 示意图 最外层电子数 电子层数 原子半径(nm)
氟 0.071
氯 0.099
溴 0.114
碘 0.133
F
Cl
Br
I
9
17
35
53
7
7
7
7
2
3
4
5
3、原子结构
①相同点:最外层上都有____个电子;
②递变性:从F→I,核电荷数逐渐________,电子层数逐渐_____,原子半径逐渐_____。
7
增多
增多
增大
3、原子结构
具有氧化性
易得1个电子
(1)都能与金属反应生成金属卤化物
(2)都能与氢气反应生成卤化氢(HX)
(3)都能与水反应
(4)都能与碱反应
4、卤素单质的化学性质
(1)卤素单质与氢气反应
卤素 单质 反应 条件 剧烈程度 化学方程式 产物稳
定性
F2 暗处 剧烈,发生爆炸 ________________ 很稳定
Cl2 光照或点燃 剧烈 _______________________ 较稳定
Br2 加热 不剧烈 __________________ 不如氯
化氢稳定
I2 不断 加热 不剧烈 _____________ 不稳定
H2+F2===2HF
通式 H2+X2===2HX
条件
4、卤素单质的化学性质
从卤素单质与氢气反应的条件及产物稳定性来看,请你判断Cl、Br、I单质的氧化性强弱,并用简单的实验验证你的想法。
提供药品:新制氯水、溴水、KCl溶液、KBr溶液、KI溶液
实 验 现 象 反应方程式
(2)卤素单质间的置换反应
实 验 现 象 反应方程式
溶液由无色变为橙黄色
溶液由无色变为褐色
溶液由无色变为褐色
Cl2+2KBr === 2KCl+Br2
2KI+Br2 === 2KBr+I2
2KI+Cl2 === 2KCl+I2
实验①②③结论:Cl2→I2氧化性逐渐减弱,相应卤素离子还原性逐渐增强。
① ② ③
4、卤素单质的化学性质
归纳:卤族元素原子结构和性质的相似性和递变性
1.卤族元素原子结构和性质的相似性:
(1)最外层均有7个电子;
(2)最高正价除F外均显+7价,最低负价为-1价;
最高价氧化物对应水化物的通式为HXO4(F除外)。
2.卤族元素原子结构和性质的递变性:
结构及性质 规 律
原子半径
单质的氧化性
阴离子的还原性
与H2化合的难易程度
氢化物的稳定性
卤素的非金属性强弱
最高价氧化物对 应水化物的酸性
F、Cl、Br、I:原子半径逐渐增大
F-、Cl-、Br-、I-:还原性逐渐增强
F2、Cl2、Br2、I2与H2化合:越来越难
F2、Cl2、Br2、I2的氧化性:越来越弱
HF、HCl、HBr、HI稳定性:逐渐减弱
HClO4、HBrO4、HIO4酸性:逐渐减弱
F2、Cl2、Br2、I2非金属性:逐渐减弱
一般情况下,元素的非金属性强弱可以从以下两个方面判断:
①单质与氢气生成气态氢化物的难易程度及氢化物的稳定性;
②最高价氧化物对应水化物的酸性强弱。
最外层电子数相同
结构
电子层数增加
原子半径增加
性质
失电子能力增强,金属性增强
得电子能力减弱,非金属减弱
决定
总结归纳
反映
