化学人教版(2019)必修第一册2.1钠及其化合物 课件(共50张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.1钠及其化合物 课件(共50张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 5.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-16 12:30:21 | ||
图片预览








文档简介
(共50张PPT)
及其化合物
学习、生活中接触过哪些含钠的物质?
这些物质中钠元素都以什么样的微粒形式存在?
NaCl
Na+
NaHCO3
NaOH
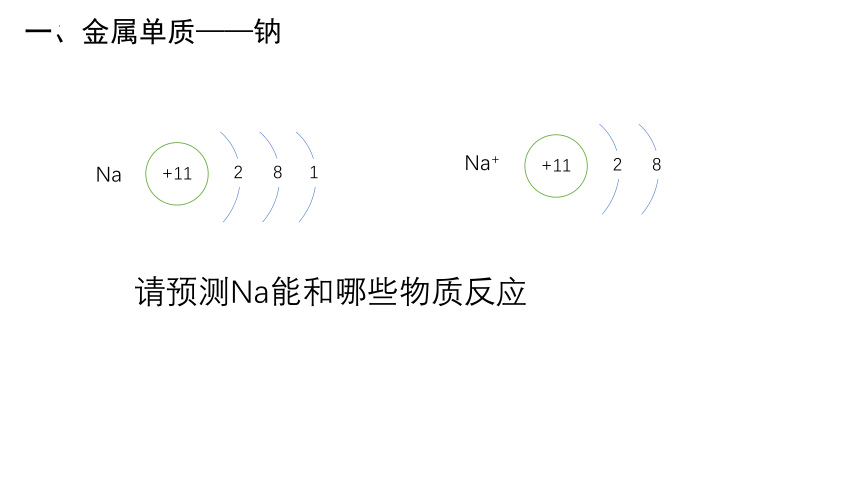
Na
+11
2
8
1
Na+
+11
2
8
一、金属单质——钠
请预测Na能和哪些物质反应
实验探究钠的性质
(1)钠与氧气的反应
实验内容 实验现象 化学反应方程式
1. 取一小钠,用滤纸吸干表面的煤油,切去外皮,观察截面的变化
截面呈银白色,后逐渐氧化变暗
4Na+O2===2Na2O
2Na+O2 === Na2O2
钠熔成小球,剧烈燃烧,发出黄色火焰,生成淡黄色固体物质
结论:钠易被空气中的O2氧化
结论:点燃条件下,Na与空气中的O2剧烈反应。
2. 取一小块钠迅速投放到热坩埚中,继续加热
钠能否保存在水中?
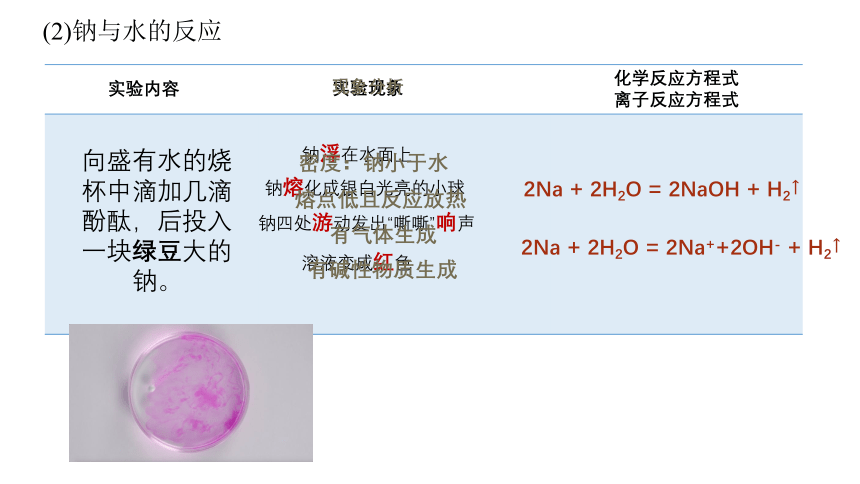
(2)钠与水的反应
化学反应方程式
离子反应方程式
钠浮在水面上
钠熔化成银白光亮的小球
溶液变成红色
钠四处游动发出“嘶嘶”响声
实验内容
实验现象
现象分析
密度:钠小于水
熔点低且反应放热
有碱性物质生成
有气体生成
2Na + 2H2O = 2NaOH + H2↑
2Na + 2H2O = 2Na++2OH- + H2↑
向盛有水的烧杯中滴加几滴酚酞,后投入一块绿豆大的钠。
(3)钠与酸反应
2Na + 2HCl === 2NaCl + H2↑
钠与盐酸反应
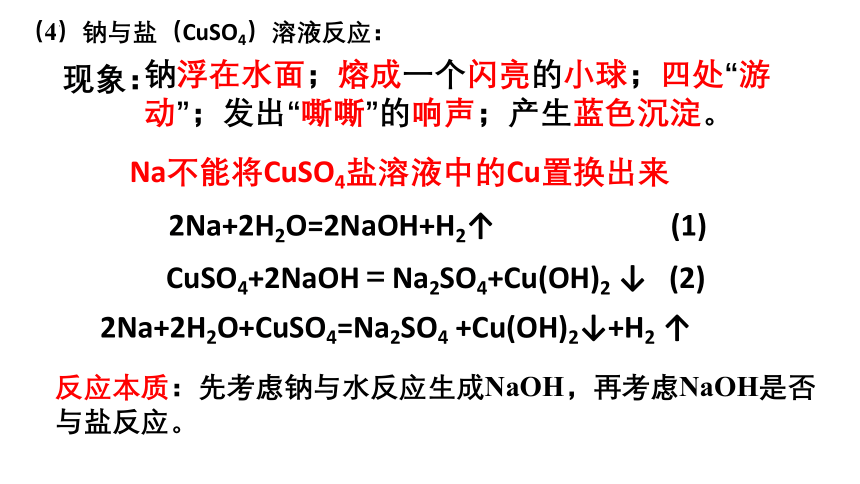
(4)钠与盐(CuSO4)溶液反应:
2Na+2H2O=2NaOH+H2↑ (1)
CuSO4+2NaOH=Na2SO4+Cu(OH)2 ↓ (2)
2Na+2H2O+CuSO4=Na2SO4 +Cu(OH)2↓+H2 ↑
Na不能将CuSO4盐溶液中的Cu置换出来
反应本质:先考虑钠与水反应生成NaOH,再考虑NaOH是否与盐反应。
现象:
钠浮在水面;熔成一个闪亮的小球;四处“游动”;发出“嘶嘶”的响声;产生蓝色沉淀。
预测现象:将一小块钠投入盛有5 mL饱和澄清石灰水的试管中,可能观察到的现象是_____(填字母)。
a.钠熔化成闪亮的小球
b.钠在液面上四处游动
c.溶液底部有银白色物质生成
d.溶液变浑浊
abd
钠的物理性质
钠是 的金属,质 ,熔点低( 于100 ℃),密度比水的 ,但比煤油的 。通常保存在 或石蜡油中。
银白色
软
小
小
大
煤油
钠的化学性质
钠是活泼的 ,能与非金属、水、酸等反应,在反应中均失去一个电子表现强 。
金属
还原性
小结:
存在
钠的性质非常活泼,所以钠在自然界中只能以化合态存在,不存在游离态(单质形态),在海水中储藏极为丰富。主要以氯化钠、碳酸钠和硫酸钠形式存在。
钠的化学性质
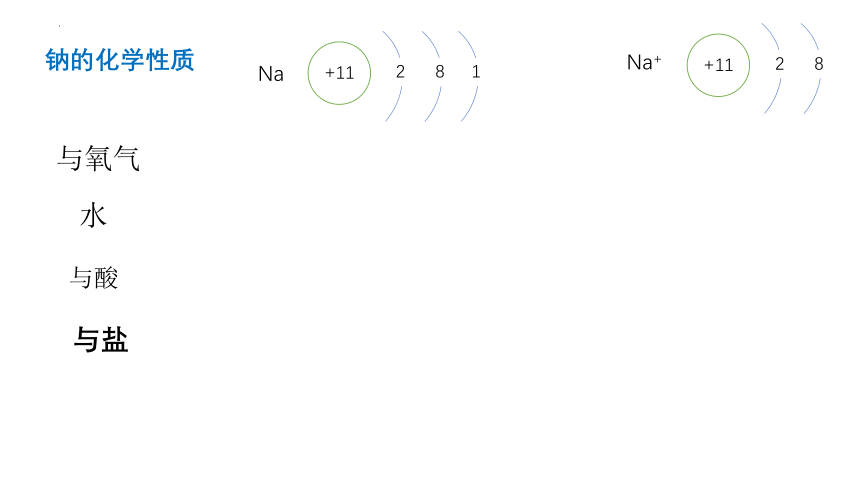
Na
+11
2
8
1
Na+
+11
2
8
与氧气
水
与酸
与盐
若金属钠着火如何灭火?能不能用水?
金属钠着火一般用砂土盖灭,不能用水灭,因为水与钠反应放热且生成易燃物H2火烧得更旺。
思考题:
在水溶液中Cu2+为水合离子,所以Na先和H2O反应
考虑极端条件下,没有水,此时就是Na和熔融CuSO4反应,即金属冶炼。
深度思考
某实验小组在学习了钠与水的反应后,做了以下几个实验。
(1)将两块绿豆粒大小的钠分别同时投入到甲、乙两个小烧杯中,甲烧杯盛有10 mL水,乙烧杯盛有10 mL稀盐酸,观察到的现象:乙烧杯中钠反应更剧烈。结论:乙烧杯中发生反应的化学方程式:___________
。
2Na+2HCl
===2NaCl+H2↑
(2)将一块绿豆粒大小的钠投入到丙烧杯中,观察到的现象是:浮、熔、游、响、生成 。请根据现象写出丙烧杯中发生反应的化学方程式:________________________________________________________
。
蓝色沉淀
2Na+2H2O===2NaOH+H2↑、CuSO4+2NaOH===Cu(OH)2↓+
Na2SO4[或2Na+2H2O+CuSO4===Na2SO4+Cu(OH)2↓+H2↑]
(1)钠与氧气反应时,条件不同,产物也不同( )
(2)等质量的钠无论生成氧化钠、过氧化钠还是它们的混合物,转移的电子数均相同( )
(3)钠失火时不能用水扑灭,应该用沙土盖灭( )
(4)实验中取出的药品都不能再放回原瓶( )
(5)钠投入到NaOH溶液中,无明显现象( )
判断正误
√
×
√
√
×
(1)工业上可以用电解饱和NaCl溶液来制备金属钠( )
(2)钠可以从硫酸铜溶液中置换出铜,因为钠比铜活泼( )
(3)钠与TiCl4反应,冶炼钛要求TiCl4必须是熔融状态( )
(4)高压钠灯常用于照明,利用的是钠的物理性质( )
判断正误
×
×
√
√
返回
归纳总结
(1)钠与水溶液反应的规律
遇水记五点,浮熔游响红,遇酸酸优先,遇盐水在前。
(2)解答钠与水溶液反应问题的思维模型
钠的几种化合物
氧化钠和过氧化钠
氧化钠和过氧化钠
常温下:4Na+O2=== 2Na2O
加热条件下:2Na+O2 === Na2O2
1.Na2O的性质
(1)物理性质: 色固体。
(2)化学性质:碱性氧化物,能与水、酸、酸性氧化物等发生化学反应。
写出下列反应的化学方程式:
氧化钠与盐酸反应: 。
氧化钠与水反应: 。
氧化钠与酸性氧化物(二氧化碳)反应: 。
白
Na2O+H2O===2NaOH
Na2O+2HCl===2NaCl+H2O
Na2O+CO2===Na2CO3
一、氧化钠和过氧化钠
2.Na2O2的性质及应用
(1)物理性质: 色固体。
(2)化学性质:
淡黄
请预测过氧化钠可能具有的化学性质
方向:已知→未知
Na2O
H2O2
实验内容
将1-2ml水滴入盛有1-2g过氧化钠固体的试管中,立即把带火星的木条伸入试管中,检验生成的气体。用手轻轻接触试管外壁,有什么感觉?用指示剂检验溶液的酸碱性?
实验现象:
带火星的木条复燃
实验结论:
实验探究过氧化钠的性质
过氧化钠与水的反应
其中氧化剂是 ,还原剂是 。
过氧化钠
过氧化钠
2Na2O2+2H2O===4NaOH+O2↑
Na2O2+2HCl===2NaCl+H2O2
氧化钠与盐酸反应:
2H2O2 ===H2O+O2↑
2Na2O2+4HCl=4NaCl+2H2O+O2↑
过氧化钠与二氧化碳反应: 。
2Na2O2+2CO2===2Na2CO3+O2
气体成分 吸入气体(%) 呼出气体(%)
氮气 78 78
氧气 21 16
二氧化碳 0.03 4
水 0.07 1.1
其他气体 0.9 0.9
已知:Na2O2 在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。
资料:Na2O2与干燥二氧化碳不反应,请你推测可能的反应过程
化学式 Na2O Na2O2
属类
色、态
化学性质 与水
与酸
碱性氧化物 过氧化物
白、固 淡黄色、固
Na2O+H2O=2NaOH 2Na2O2+2H2O=4NaOH+O2↑
Na2O+2HCl=2NaCl+H2O 2Na2O2+4HCl=4NaCl+2H2O+O2↑
Na2O和Na2O2
Na2O2: 可用作漂白剂和呼吸面具中的供氧剂。
2Na2O2+2CO2
2Na2CO3+O2
小结
钠的氧化物的主要性质
离子 Na+ O2- 2:1 Na+ O22- 2:1
氧的价态 -2 -1
热稳定性 不稳定(加热时被空气氧化) 稳定
与水反应 Na2O+H2O == 2NaOH 2Na2O2+2H2O == 4NaOH+O2↑
与CO2反应 Na2O+CO2 == Na2CO3 2Na2O2+2CO2 == 2Na2CO3+O2
与酸反应 Na2O+2HCl == 2NaCl+H2O 2Na2O2+4HCl == 4NaCl+2H2O+O2↑
主要用途 用于制取少量Na2O2 强氧化剂、漂白剂、供氧剂
组成、结构 性质 用途
决定
决定
推测
反映
1.类比Na与H2O反应的分析方法及Na2O2与H2O反应的化学方程式,试着分析以下问题。
(1)将适量过氧化钠投入盐酸中,有什么现象?写出化学方程式。
深度思考
提示 有气泡产生;2Na2O2+4HCl===4NaCl+O2↑+2H2O。
(2)将适量过氧化钠投入硫酸铜溶液中,有什么现象?写出相关反应的化学方程式。
提示 有气泡放出,溶液颜色变浅,同时有蓝色沉淀生成;2Na2O2+2H2O===4NaOH+O2↑,2NaOH+CuSO4===Cu(OH)2↓+Na2SO4。
归纳总结
氧化钠与过氧化钠的比较
名称 氧化钠 过氧化钠
化学式 Na2O Na2O2
氧的价态 -2价 -1价
颜色状态 白色固体 淡黄色固体
是否为碱性氧化物 是 不是
化学性质 相同点 都能与水反应生成氢氧化钠,都能与CO2反应生成Na2CO3 不同点 过氧化钠与水、二氧化碳反应有氧气产生,具有强氧化性,而Na2O不具有强氧化性
钠的几种化合物
碳酸钠和碳酸氢钠
二、碳酸钠和碳酸氢钠
纯碱,又称苏打、碱灰。在生活中用途广泛
如可用于食品工业,作中和剂、膨松剂,如制造氨基酸、酱油和面制食品如馒头、面包等。还可配成碱水加入面食中,增加弹性和延展性。碳酸钠还可以用于生产味精。碳酸钠溶液可以作为洗涤剂除油污。
小苏打,食品工业中一种应用最广泛的疏松剂,用于生产饼干、糕点、馒头、面包等,是汽水饮料中二氧化碳的发生剂;还可用于治疗胃酸过多。
从什么角度预测性质?
【实验2-4】
在两支试管中分别加入少量碳酸钠和
碳酸氢钠并完成下列表格
白色粉末
白色细小粉末
温度计温度升高
温度计温度无明显变化
温度计温度升高,震荡后可溶解
温度计温度降低,
固体量有所减少
溶液变红色(较深)
溶液微红
溶液呈碱性
溶液呈碱性
1. 比较Na2CO3和NaHCO3溶解性的差异
实验设计:
分别取等质量碳酸钠和碳酸氢钠于试管中,滴加2-3滴水,观察现象;插入温度计观察示数变化
继续往试管中加入5 mL水,观察现象
实验现象:
物质 20 ℃时溶解度
碳酸钠 21.5 g
碳酸氢钠 9.60 g
结论:二者均能溶解,碳酸钠溶解性更好。
2. 比较Na2CO3和NaHCO3溶液的碱性
实验设计:测同样浓度溶液的碱性,滴加酚酞或者用PH试纸
实验现象:
结论:二者均显碱性,碳酸钠碱性更强。
酚酞变色程度 Na2CO3>NaHCO3
某相同浓度溶液,PH Na2CO3>NaHCO3
3. 比较Na2CO3和NaHCO3溶液与盐酸反应
实验设计:
取同样浓度、体积的碳酸钠、碳酸氢钠溶液于试管中,滴加少量盐酸
取同样浓度、体积的碳酸钠、碳酸氢钠溶液于试管中,滴加足量盐酸
实验现象:
结论:二者均能与盐酸反应
NaHCO3固体受热分解
结论: Na2CO3受热稳定, NaHCO3不稳定,加热分解生成Na2CO3、CO2和H2O。
【实验2-5】
在两支试管中分别加入少量碳酸钠和碳酸氢钠并完成下列表格
4. 比较Na2CO3和NaHCO3的热稳定性
性质差异-组成相似但又不同
碳酸钠 碳酸氢钠
分子组成 Na2CO3 NaHCO3
类别 钠盐、碳酸盐 钠盐、碳酸氢盐
构成微粒 Na+ CO32- Na+ HCO3-
Na2CO3→NaHCO3
NaHCO3→Na2CO3
1.加碱
2.加热 2NaHCO3====== Na2CO3+H2O+CO2↑
加酸 Na2CO3+H2O+CO2 ====== 2NaHCO3
如何转化?
混合物(括号内为杂质) 除杂方法或试剂
Na2CO3固体(NaHCO3)
NaHCO3溶液(Na2CO3)
Na2CO3溶液(NaHCO3)
利用性质差异进行除杂
加热至恒重
通入足量CO2气体
加入适量NaOH溶液
鉴别不同物质方法好坏衡量的标准是:
一、现象差异明显;
二、操作方法简便;
三、所选用的试剂为常用廉价药品。
养成科学的态度:
合理的假设、细心地求证
将二氧化碳通入饱和Na2CO3会有什么现象?
侯氏制碱法
纯碱 Na2CO3
NH3+H2O+CO2=NH4HCO3
NH4HCO3+NaCl=NH4Cl+NaHCO3↓
为什么先通入NH3
反应能够发生:溶解度差异
科学史话
侯德榜——中国著名的制碱专家。
侯德榜,1890年生于福建省一个农民家庭。1921年10月,在美国刚刚获得博士学位的侯德榜,满怀报国之志回国创业,1926年生产出纯度为99%的“红三角”牌纯碱,并于当年获得美国费城万国博览会金奖。其产品不但畅销国内,而且远销日本和东南亚,为中国民族化学工业产品赢得了市场和声誉,结束了当时由美、德、英、法等国垄断世界纯碱市场的时代。在抗日战争期间,研究条件十分艰苦,侯德榜在索尔维法的基础上创造出了制碱新法——“联合制碱法”,大大提高了原料的利用率,降低了成本,被人们称为“侯氏联合制碱法”,又称为“侯氏制碱法”。
“侯氏制碱法”的生产流程如图1所示,原料是食盐、氨气和二氧化碳
如何区分碳酸钠溶液与碳酸钾溶液?
1.定义
很多___________________在灼烧时都会使火焰呈现出特征颜色。根据火焰呈现的特征颜色,可以判断试样所含的金属元素,化学上把这样的定性分析操作称为焰色试验。
五、焰色试验
金属或它们的化合物
2.操作
盐酸
原火焰颜色相同
试样
火焰的颜色
及其化合物
学习、生活中接触过哪些含钠的物质?
这些物质中钠元素都以什么样的微粒形式存在?
NaCl
Na+
NaHCO3
NaOH
Na
+11
2
8
1
Na+
+11
2
8
一、金属单质——钠
请预测Na能和哪些物质反应
实验探究钠的性质
(1)钠与氧气的反应
实验内容 实验现象 化学反应方程式
1. 取一小钠,用滤纸吸干表面的煤油,切去外皮,观察截面的变化
截面呈银白色,后逐渐氧化变暗
4Na+O2===2Na2O
2Na+O2 === Na2O2
钠熔成小球,剧烈燃烧,发出黄色火焰,生成淡黄色固体物质
结论:钠易被空气中的O2氧化
结论:点燃条件下,Na与空气中的O2剧烈反应。
2. 取一小块钠迅速投放到热坩埚中,继续加热
钠能否保存在水中?
(2)钠与水的反应
化学反应方程式
离子反应方程式
钠浮在水面上
钠熔化成银白光亮的小球
溶液变成红色
钠四处游动发出“嘶嘶”响声
实验内容
实验现象
现象分析
密度:钠小于水
熔点低且反应放热
有碱性物质生成
有气体生成
2Na + 2H2O = 2NaOH + H2↑
2Na + 2H2O = 2Na++2OH- + H2↑
向盛有水的烧杯中滴加几滴酚酞,后投入一块绿豆大的钠。
(3)钠与酸反应
2Na + 2HCl === 2NaCl + H2↑
钠与盐酸反应
(4)钠与盐(CuSO4)溶液反应:
2Na+2H2O=2NaOH+H2↑ (1)
CuSO4+2NaOH=Na2SO4+Cu(OH)2 ↓ (2)
2Na+2H2O+CuSO4=Na2SO4 +Cu(OH)2↓+H2 ↑
Na不能将CuSO4盐溶液中的Cu置换出来
反应本质:先考虑钠与水反应生成NaOH,再考虑NaOH是否与盐反应。
现象:
钠浮在水面;熔成一个闪亮的小球;四处“游动”;发出“嘶嘶”的响声;产生蓝色沉淀。
预测现象:将一小块钠投入盛有5 mL饱和澄清石灰水的试管中,可能观察到的现象是_____(填字母)。
a.钠熔化成闪亮的小球
b.钠在液面上四处游动
c.溶液底部有银白色物质生成
d.溶液变浑浊
abd
钠的物理性质
钠是 的金属,质 ,熔点低( 于100 ℃),密度比水的 ,但比煤油的 。通常保存在 或石蜡油中。
银白色
软
小
小
大
煤油
钠的化学性质
钠是活泼的 ,能与非金属、水、酸等反应,在反应中均失去一个电子表现强 。
金属
还原性
小结:
存在
钠的性质非常活泼,所以钠在自然界中只能以化合态存在,不存在游离态(单质形态),在海水中储藏极为丰富。主要以氯化钠、碳酸钠和硫酸钠形式存在。
钠的化学性质
Na
+11
2
8
1
Na+
+11
2
8
与氧气
水
与酸
与盐
若金属钠着火如何灭火?能不能用水?
金属钠着火一般用砂土盖灭,不能用水灭,因为水与钠反应放热且生成易燃物H2火烧得更旺。
思考题:
在水溶液中Cu2+为水合离子,所以Na先和H2O反应
考虑极端条件下,没有水,此时就是Na和熔融CuSO4反应,即金属冶炼。
深度思考
某实验小组在学习了钠与水的反应后,做了以下几个实验。
(1)将两块绿豆粒大小的钠分别同时投入到甲、乙两个小烧杯中,甲烧杯盛有10 mL水,乙烧杯盛有10 mL稀盐酸,观察到的现象:乙烧杯中钠反应更剧烈。结论:乙烧杯中发生反应的化学方程式:___________
。
2Na+2HCl
===2NaCl+H2↑
(2)将一块绿豆粒大小的钠投入到丙烧杯中,观察到的现象是:浮、熔、游、响、生成 。请根据现象写出丙烧杯中发生反应的化学方程式:________________________________________________________
。
蓝色沉淀
2Na+2H2O===2NaOH+H2↑、CuSO4+2NaOH===Cu(OH)2↓+
Na2SO4[或2Na+2H2O+CuSO4===Na2SO4+Cu(OH)2↓+H2↑]
(1)钠与氧气反应时,条件不同,产物也不同( )
(2)等质量的钠无论生成氧化钠、过氧化钠还是它们的混合物,转移的电子数均相同( )
(3)钠失火时不能用水扑灭,应该用沙土盖灭( )
(4)实验中取出的药品都不能再放回原瓶( )
(5)钠投入到NaOH溶液中,无明显现象( )
判断正误
√
×
√
√
×
(1)工业上可以用电解饱和NaCl溶液来制备金属钠( )
(2)钠可以从硫酸铜溶液中置换出铜,因为钠比铜活泼( )
(3)钠与TiCl4反应,冶炼钛要求TiCl4必须是熔融状态( )
(4)高压钠灯常用于照明,利用的是钠的物理性质( )
判断正误
×
×
√
√
返回
归纳总结
(1)钠与水溶液反应的规律
遇水记五点,浮熔游响红,遇酸酸优先,遇盐水在前。
(2)解答钠与水溶液反应问题的思维模型
钠的几种化合物
氧化钠和过氧化钠
氧化钠和过氧化钠
常温下:4Na+O2=== 2Na2O
加热条件下:2Na+O2 === Na2O2
1.Na2O的性质
(1)物理性质: 色固体。
(2)化学性质:碱性氧化物,能与水、酸、酸性氧化物等发生化学反应。
写出下列反应的化学方程式:
氧化钠与盐酸反应: 。
氧化钠与水反应: 。
氧化钠与酸性氧化物(二氧化碳)反应: 。
白
Na2O+H2O===2NaOH
Na2O+2HCl===2NaCl+H2O
Na2O+CO2===Na2CO3
一、氧化钠和过氧化钠
2.Na2O2的性质及应用
(1)物理性质: 色固体。
(2)化学性质:
淡黄
请预测过氧化钠可能具有的化学性质
方向:已知→未知
Na2O
H2O2
实验内容
将1-2ml水滴入盛有1-2g过氧化钠固体的试管中,立即把带火星的木条伸入试管中,检验生成的气体。用手轻轻接触试管外壁,有什么感觉?用指示剂检验溶液的酸碱性?
实验现象:
带火星的木条复燃
实验结论:
实验探究过氧化钠的性质
过氧化钠与水的反应
其中氧化剂是 ,还原剂是 。
过氧化钠
过氧化钠
2Na2O2+2H2O===4NaOH+O2↑
Na2O2+2HCl===2NaCl+H2O2
氧化钠与盐酸反应:
2H2O2 ===H2O+O2↑
2Na2O2+4HCl=4NaCl+2H2O+O2↑
过氧化钠与二氧化碳反应: 。
2Na2O2+2CO2===2Na2CO3+O2
气体成分 吸入气体(%) 呼出气体(%)
氮气 78 78
氧气 21 16
二氧化碳 0.03 4
水 0.07 1.1
其他气体 0.9 0.9
已知:Na2O2 在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。
资料:Na2O2与干燥二氧化碳不反应,请你推测可能的反应过程
化学式 Na2O Na2O2
属类
色、态
化学性质 与水
与酸
碱性氧化物 过氧化物
白、固 淡黄色、固
Na2O+H2O=2NaOH 2Na2O2+2H2O=4NaOH+O2↑
Na2O+2HCl=2NaCl+H2O 2Na2O2+4HCl=4NaCl+2H2O+O2↑
Na2O和Na2O2
Na2O2: 可用作漂白剂和呼吸面具中的供氧剂。
2Na2O2+2CO2
2Na2CO3+O2
小结
钠的氧化物的主要性质
离子 Na+ O2- 2:1 Na+ O22- 2:1
氧的价态 -2 -1
热稳定性 不稳定(加热时被空气氧化) 稳定
与水反应 Na2O+H2O == 2NaOH 2Na2O2+2H2O == 4NaOH+O2↑
与CO2反应 Na2O+CO2 == Na2CO3 2Na2O2+2CO2 == 2Na2CO3+O2
与酸反应 Na2O+2HCl == 2NaCl+H2O 2Na2O2+4HCl == 4NaCl+2H2O+O2↑
主要用途 用于制取少量Na2O2 强氧化剂、漂白剂、供氧剂
组成、结构 性质 用途
决定
决定
推测
反映
1.类比Na与H2O反应的分析方法及Na2O2与H2O反应的化学方程式,试着分析以下问题。
(1)将适量过氧化钠投入盐酸中,有什么现象?写出化学方程式。
深度思考
提示 有气泡产生;2Na2O2+4HCl===4NaCl+O2↑+2H2O。
(2)将适量过氧化钠投入硫酸铜溶液中,有什么现象?写出相关反应的化学方程式。
提示 有气泡放出,溶液颜色变浅,同时有蓝色沉淀生成;2Na2O2+2H2O===4NaOH+O2↑,2NaOH+CuSO4===Cu(OH)2↓+Na2SO4。
归纳总结
氧化钠与过氧化钠的比较
名称 氧化钠 过氧化钠
化学式 Na2O Na2O2
氧的价态 -2价 -1价
颜色状态 白色固体 淡黄色固体
是否为碱性氧化物 是 不是
化学性质 相同点 都能与水反应生成氢氧化钠,都能与CO2反应生成Na2CO3 不同点 过氧化钠与水、二氧化碳反应有氧气产生,具有强氧化性,而Na2O不具有强氧化性
钠的几种化合物
碳酸钠和碳酸氢钠
二、碳酸钠和碳酸氢钠
纯碱,又称苏打、碱灰。在生活中用途广泛
如可用于食品工业,作中和剂、膨松剂,如制造氨基酸、酱油和面制食品如馒头、面包等。还可配成碱水加入面食中,增加弹性和延展性。碳酸钠还可以用于生产味精。碳酸钠溶液可以作为洗涤剂除油污。
小苏打,食品工业中一种应用最广泛的疏松剂,用于生产饼干、糕点、馒头、面包等,是汽水饮料中二氧化碳的发生剂;还可用于治疗胃酸过多。
从什么角度预测性质?
【实验2-4】
在两支试管中分别加入少量碳酸钠和
碳酸氢钠并完成下列表格
白色粉末
白色细小粉末
温度计温度升高
温度计温度无明显变化
温度计温度升高,震荡后可溶解
温度计温度降低,
固体量有所减少
溶液变红色(较深)
溶液微红
溶液呈碱性
溶液呈碱性
1. 比较Na2CO3和NaHCO3溶解性的差异
实验设计:
分别取等质量碳酸钠和碳酸氢钠于试管中,滴加2-3滴水,观察现象;插入温度计观察示数变化
继续往试管中加入5 mL水,观察现象
实验现象:
物质 20 ℃时溶解度
碳酸钠 21.5 g
碳酸氢钠 9.60 g
结论:二者均能溶解,碳酸钠溶解性更好。
2. 比较Na2CO3和NaHCO3溶液的碱性
实验设计:测同样浓度溶液的碱性,滴加酚酞或者用PH试纸
实验现象:
结论:二者均显碱性,碳酸钠碱性更强。
酚酞变色程度 Na2CO3>NaHCO3
某相同浓度溶液,PH Na2CO3>NaHCO3
3. 比较Na2CO3和NaHCO3溶液与盐酸反应
实验设计:
取同样浓度、体积的碳酸钠、碳酸氢钠溶液于试管中,滴加少量盐酸
取同样浓度、体积的碳酸钠、碳酸氢钠溶液于试管中,滴加足量盐酸
实验现象:
结论:二者均能与盐酸反应
NaHCO3固体受热分解
结论: Na2CO3受热稳定, NaHCO3不稳定,加热分解生成Na2CO3、CO2和H2O。
【实验2-5】
在两支试管中分别加入少量碳酸钠和碳酸氢钠并完成下列表格
4. 比较Na2CO3和NaHCO3的热稳定性
性质差异-组成相似但又不同
碳酸钠 碳酸氢钠
分子组成 Na2CO3 NaHCO3
类别 钠盐、碳酸盐 钠盐、碳酸氢盐
构成微粒 Na+ CO32- Na+ HCO3-
Na2CO3→NaHCO3
NaHCO3→Na2CO3
1.加碱
2.加热 2NaHCO3====== Na2CO3+H2O+CO2↑
加酸 Na2CO3+H2O+CO2 ====== 2NaHCO3
如何转化?
混合物(括号内为杂质) 除杂方法或试剂
Na2CO3固体(NaHCO3)
NaHCO3溶液(Na2CO3)
Na2CO3溶液(NaHCO3)
利用性质差异进行除杂
加热至恒重
通入足量CO2气体
加入适量NaOH溶液
鉴别不同物质方法好坏衡量的标准是:
一、现象差异明显;
二、操作方法简便;
三、所选用的试剂为常用廉价药品。
养成科学的态度:
合理的假设、细心地求证
将二氧化碳通入饱和Na2CO3会有什么现象?
侯氏制碱法
纯碱 Na2CO3
NH3+H2O+CO2=NH4HCO3
NH4HCO3+NaCl=NH4Cl+NaHCO3↓
为什么先通入NH3
反应能够发生:溶解度差异
科学史话
侯德榜——中国著名的制碱专家。
侯德榜,1890年生于福建省一个农民家庭。1921年10月,在美国刚刚获得博士学位的侯德榜,满怀报国之志回国创业,1926年生产出纯度为99%的“红三角”牌纯碱,并于当年获得美国费城万国博览会金奖。其产品不但畅销国内,而且远销日本和东南亚,为中国民族化学工业产品赢得了市场和声誉,结束了当时由美、德、英、法等国垄断世界纯碱市场的时代。在抗日战争期间,研究条件十分艰苦,侯德榜在索尔维法的基础上创造出了制碱新法——“联合制碱法”,大大提高了原料的利用率,降低了成本,被人们称为“侯氏联合制碱法”,又称为“侯氏制碱法”。
“侯氏制碱法”的生产流程如图1所示,原料是食盐、氨气和二氧化碳
如何区分碳酸钠溶液与碳酸钾溶液?
1.定义
很多___________________在灼烧时都会使火焰呈现出特征颜色。根据火焰呈现的特征颜色,可以判断试样所含的金属元素,化学上把这样的定性分析操作称为焰色试验。
五、焰色试验
金属或它们的化合物
2.操作
盐酸
原火焰颜色相同
试样
火焰的颜色
