化学人教版(2019)必修第一册3.1铁及其化合物 课件(共31张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册3.1铁及其化合物 课件(共31张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-16 12:35:31 | ||
图片预览







文档简介
(共31张PPT)
铁及其化合物
地壳中元素相对含量
(以质量分数计)
铁元素的分布
赤铁矿(Fe2O3)
磁铁矿(Fe3O4)
陨铁(Fe)
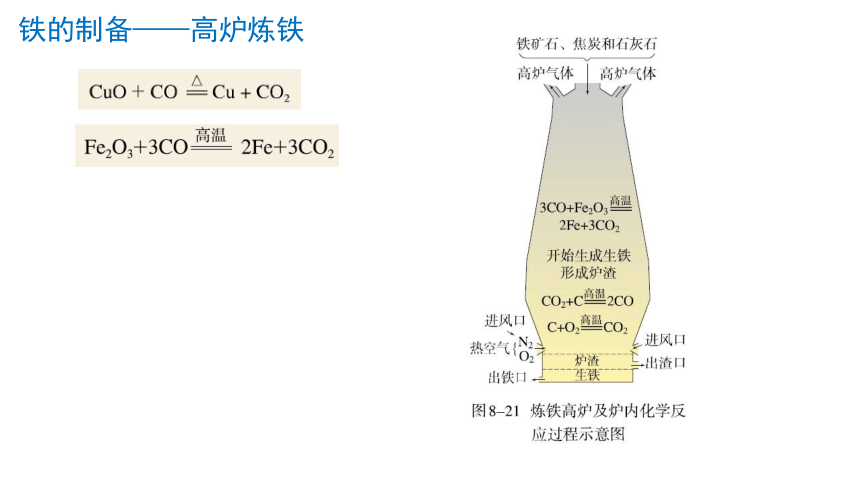
铁的制备——高炉炼铁
铁的单质
铁的物理性质:
特性:能被磁铁吸引,熔沸点较高
熔点:1 535 ℃、沸点:2 750 ℃,密度:7.86 g·cm-3。
铁粉:黑色
铁片:银白色
铁的化学性质:
1. 与非金属单质反应
2. 与酸反应(离子方程式)
3. 与盐反应(离子方程式)
Fe + 2H+ = Fe2+ +H2↑
Fe + Cu2+ = Fe2+ +Cu
为什么铁的价态升高会有+2、+3的区别?
Fe与水是否会发生反应?
在钢铁厂的生产过程中,炽热的铁水或者是钢水注入模具之前,模具必须进行充分的干燥,不得留有水。
铁:熔点 1535 ℃
熔融状态的铁温度高于1500 ℃
铁与沸水,几乎不反应
常温下没有氧气参与,
铁与冷水不反应
与水反应产物探究
Fe + H2O(g) Fe? + H2
铁粉和水蒸气能发生反应,
反应生成什么?
水蒸气发生装置
铁粉(加热)
气体检验
回顾:2Na + 2H2O =2NaOH + H2↑
实验操作:
搭好装置,先加热湿棉花再点燃酒精灯加热铁粉
现象:
加热时铁粉红热,刚开始导管插入蒸发皿的肥皂水中出现很多气泡。大约两分钟后,用小木棒点燃肥皂泡,可听到明显的爆鸣声。停止加热后,粉末仍为黑色。
3Fe + 4H2O(g) Fe3O4 + 4H2
物质 颜色状态 分解温度
Fe(OH)2 白色固体 不稳定,受热易分解
Fe(OH)3 红褐色固体 500 ℃
铁的氧化物
物质 化学式 颜色 俗名 价态
氧化亚铁 FeO 黑色 +2
氧化铁 Fe2O3 红棕色 铁红 +3
四氧化三铁 Fe3O4 黑色 磁性氧化铁 +2,+3
化学性质
(1)FeO不稳定,在空气中受热易被氧化成_________。
(2)FeO和Fe2O3属于______氧化物,与盐酸反应的离子方程式分别为:_______________________、______________________。
(3) Fe3O4不属于碱性氧化物,与盐酸反应的离子方程式为:Fe3O4+8H+==== Fe2++2Fe3++4H2O
Fe3O4
碱性
FeO+2H+===Fe2++H2O
Fe2O3+6H+===2Fe3++3H2O
下列性质与应用没有对应关系的是:
选项 性质 应用
A Fe2O3性质稳定,呈现红棕色 Fe2O3可用作外墙涂料
B Fe3O4具有磁性 可用作指南针
C Fe硬度大 可铸造铁锅
D Fe能导电 可做电极材料
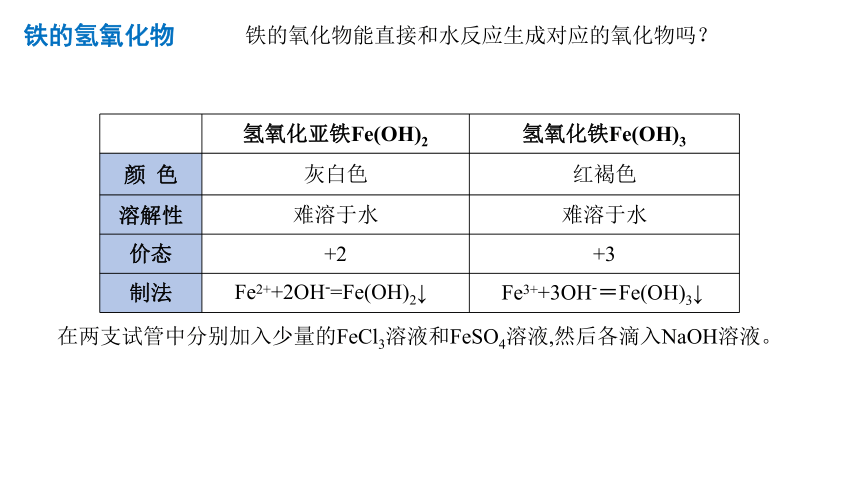
铁的氢氧化物
氢氧化亚铁Fe(OH)2 氢氧化铁Fe(OH)3
颜 色 灰白色 红褐色
溶解性 难溶于水 难溶于水
价态 +2 +3
制法
Fe2++2OH-=Fe(OH)2↓
Fe3++3OH-=Fe(OH)3↓
在两支试管中分别加入少量的FeCl3溶液和FeSO4溶液,然后各滴入NaOH溶液。
铁的氧化物能直接和水反应生成对应的氧化物吗?
现象 氢氧化亚铁Fe(OH)2 氢氧化铁Fe(OH)3
在FeSO4溶液中滴入NaOH溶液
生成白色絮状沉淀,原因是___________________,
沉淀迅速变成灰绿色,最后会有红褐色沉淀生成,原因是___________________
Fe2++2OH-====Fe(OH)2↓
4Fe(OH)2+O2+2H2O ==== 4Fe(OH)3
预测 白色沉淀 红褐色沉淀
实际 先生成白色絮状沉淀,迅速变成灰绿色并有红褐色物质生成。 红褐色沉淀
已知:氢氧化亚铁在空气中易被氧化,如何制备氢氧化亚铁?
关键:排除氧气干扰
反应前:
(1)将配制溶液的蒸馏水煮沸,除去其中的氧气。
反应中:
(1)在亚铁盐溶液上面充入保护气,如H2、N2、稀有气体等。
(2)在亚铁盐溶液上面加保护层,如苯、植物油等。
(3)将盛有NaOH溶液的胶头滴管尖端插入试管内的亚铁盐溶液底部,并慢慢挤出NaOH溶液。
铁的氢氧化物的化学性质
(1)碱的通性——与酸反应
(2) Fe(OH)3 不稳定,受热易分解
(3) ) Fe(OH)2 不稳定,易被氧化
2Fe(OH)3==== Fe2O3+3H2O
氢氧化亚铁Fe(OH)2 氢氧化铁Fe(OH)3
制 法
颜 色
溶解性
稳定性
与酸反应
Fe2++2OH-=Fe(OH)2↓
(隔绝氧气)
Fe3++3OH-=Fe(OH)3↓
灰白色
红褐色
难溶于水
难溶于水
受热易分解
极易被空气中氧气氧化
成氢氧化铁
4Fe(OH)2+2H2O+O2
=4Fe(OH)3
Fe(OH)2+2H+=Fe2++2H2O
Fe(OH)3+3H+=Fe3++3H2O
铁盐和亚铁盐
常见的铁盐有Fe2(SO4)3、FeCl3等,常见的亚铁盐有FeSO4、FeCl2等。
铁是人体必需的微量元素中含量最多的一种,缺铁性贫血已成为仅次于结核病的全球患病率最高、耗资最大的公共卫生问题。那铁元素在人体中又是以什么形式存在呢?
食补
药补
都是亚铁!
如何检验?
是不是可以采用向溶液中加入氢氧化钠的方法检验?
铁盐和亚铁盐
(1)观察法:浅绿色溶液中含有______;棕黄色溶液中含有______。
(2)加碱法:若产生的白色沉淀迅速变为灰绿色,最后变为红褐色的为______;若直接产生红褐色沉淀的为______。
Fe2+
Fe3+
Fe2+
Fe3+
Fe2+、Fe3+的检验方法
单一离子检验
若浓度很小,颜色差异不明显
加碱后沉淀很少,颜色观察困难,若同时有其他氢氧化物沉淀,会干扰检验
Fe3+的检验
在两支试管中分别加入少量的FeCl3溶液和FeCl2溶液,各滴入几滴KSCN溶液。观察并记录现象。
滴入KSCN溶液
FeCl3溶液
FeCl2溶液
溶液呈红色
溶液颜色无明显变化
Fe3+ +3SCN- =Fe(SCN)3 (血红色,易溶难电离)
Fe2++2SCN-=Fe(SCN)2 (无色)
结论:可利用此KSCN(硫氰化钾)来检验Fe3+ 的存在
如何检验Fe2+?(提示:从物质的价态考虑)
① 加KMnO4(H+)溶液(利用Fe2+的还原性)
(注:如是未知溶液则不能用此方法)
现象预测:溶液紫红色褪去
②先加KSCN溶液,再加氯水。(利用Fe2+的还原性)
现象预测:开始溶液不变红色,加几滴氯水
后溶液变红色。
Fe2+、Fe3+、Fe的相互转化
【思考】Fe、FeSO4和Fe2(SO4)3三种物质中,哪种物质可做氧化剂,哪种可做还原剂,哪种既可做氧化剂又可做还原剂
举例写出相应反应的化学方程式,并加以说明。
Fe可做还原剂;
Fe2(SO4)3做氧化剂;
FeSO4既可做氧化剂又可做还原剂
氧化性: Fe3+>Cu2+>Fe2+>Zn2+
在盛有2 mL FeCl3溶液的试管中滴入几滴KSCN溶液,充分反应后,加入少量铁粉,振荡试管观察并记录现象。把上层清液倒入另一支试管中,再滴入几滴氯水(如图右),又发生了什么变化
Fe2+、Fe3+的转化
【现象】
FeCl3溶液的试管中加入少量铁粉后,溶液有棕黄色变浅绿色,滴入KSCN溶液,溶液无明显变化。
2. 把上层清液倒入另一支试管中,再滴入几滴氯水,溶液变红色。
现象解释:在上述实验中,FeCl3溶液中的Fe3+被铁粉还原成Fe2+,Fe2+又被Cl2氧化成Fe3+ ,Fe3+与SCN-反应生成红色Fe(SCN)3 。
2Fe3++Fe===3Fe2+
离子方程式 ____________________、__________________________
结论 Fe3+遇到较强的还原剂时,会被还原成_________;
Fe2+在较强的氧化剂的作用下会被氧化成_________
2Fe2++Cl2===2Fe3++2Cl-
Fe2+
Fe3+
Fe
Fe2+
Fe3+
“铁三角”
H+、Cu2+、S、I2等
Br2、Cl2、HNO3、浓H2SO4等
Br2、Cl2、HNO3、浓H2SO4等
Al、Mn、Zn等
Al、Mn、Zn等
Fe2+、Fe3+、Fe的相互转化
1、氢氧化铁:红褐色沉淀,与酸反应,受热分解
小结:
2、氢氧化亚铁:白色沉淀,易被氧化,迅速变为灰绿色,最终为红褐色
3、Fe3+:黄色,可以被还原为Fe2+
2Fe(OH)3 Fe2O3 + 3H2O
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
Fe + 2Fe3+ = 3Fe2+
检验:滴加KSCN溶液,显红色
Fe3+ + 3SCN- = Fe(SCN)3
4、Fe2+:浅绿色,可以被氧化为Fe3+
Cl2 + 2Fe2+ = 2Fe3+ + 2Cl-
学以致用
了解FeCl3制作印刷电路板
制作过程:
先在塑料板上镀上一层铜,然后在设计好的铜线路上涂上一层石蜡,把板浸到氯化铁溶液中,没有在线路上的铜即没有被石蜡覆盖住,这样铜就被反应掉。
Cu + 2Fe3+ = 2Fe2+ + Cu2+
从生活走进化学
1.FeCl3溶液(FeCl2溶液):
2.FeCl2溶液(FeCl3溶液):
3.FeSO4溶液(CuSO4):
如何分析下列除杂问题?(括号内物质为杂质)
通入足量Cl2;也可加适量双氧水。
加足量铁粉,充分反应后过滤。
加足量铁粉,充分反应后过滤。
铁盐和铁单质
+3价铁离子只具有氧化性,遇较强还原剂时会被还原成亚铁化合物。
① 2Fe3++2I-=2Fe2++I2
② 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
③2Fe3++Cu=2Fe2++Cu2+
+2价铁离子既具有氧化性又具有还原性
氧化性:遇强还原剂时被还原成单质铁
还原性:遇较强氧化剂时被氧化成
三价铁的化合物
*选做强化题 用FeCl3溶液腐蚀印刷电路板上的铜,所得溶液中加入铁粉。对加入铁粉充分反应后的溶液分析合理的是 ( )
A.若无固体剩余,则溶液中一定有Fe3+
B.若有固体存在,则溶液中一定有Fe2+
C.若溶液中有Cu2+,则一定没有固体析出
D.若溶液中有Fe2+,则一定有Cu析出
B
铁及其化合物
地壳中元素相对含量
(以质量分数计)
铁元素的分布
赤铁矿(Fe2O3)
磁铁矿(Fe3O4)
陨铁(Fe)
铁的制备——高炉炼铁
铁的单质
铁的物理性质:
特性:能被磁铁吸引,熔沸点较高
熔点:1 535 ℃、沸点:2 750 ℃,密度:7.86 g·cm-3。
铁粉:黑色
铁片:银白色
铁的化学性质:
1. 与非金属单质反应
2. 与酸反应(离子方程式)
3. 与盐反应(离子方程式)
Fe + 2H+ = Fe2+ +H2↑
Fe + Cu2+ = Fe2+ +Cu
为什么铁的价态升高会有+2、+3的区别?
Fe与水是否会发生反应?
在钢铁厂的生产过程中,炽热的铁水或者是钢水注入模具之前,模具必须进行充分的干燥,不得留有水。
铁:熔点 1535 ℃
熔融状态的铁温度高于1500 ℃
铁与沸水,几乎不反应
常温下没有氧气参与,
铁与冷水不反应
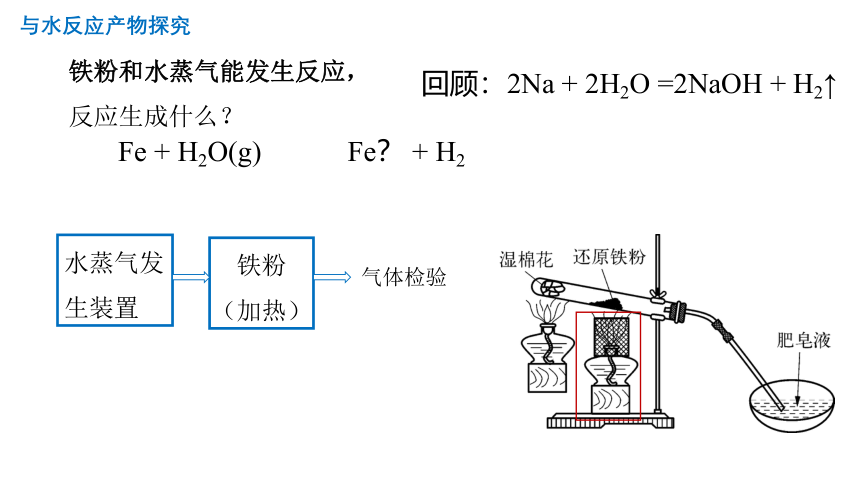
与水反应产物探究
Fe + H2O(g) Fe? + H2
铁粉和水蒸气能发生反应,
反应生成什么?
水蒸气发生装置
铁粉(加热)
气体检验
回顾:2Na + 2H2O =2NaOH + H2↑
实验操作:
搭好装置,先加热湿棉花再点燃酒精灯加热铁粉
现象:
加热时铁粉红热,刚开始导管插入蒸发皿的肥皂水中出现很多气泡。大约两分钟后,用小木棒点燃肥皂泡,可听到明显的爆鸣声。停止加热后,粉末仍为黑色。
3Fe + 4H2O(g) Fe3O4 + 4H2
物质 颜色状态 分解温度
Fe(OH)2 白色固体 不稳定,受热易分解
Fe(OH)3 红褐色固体 500 ℃
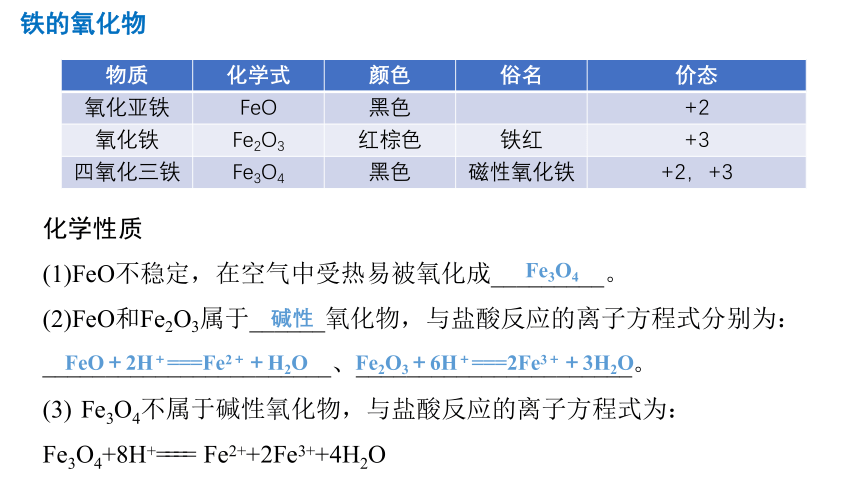
铁的氧化物
物质 化学式 颜色 俗名 价态
氧化亚铁 FeO 黑色 +2
氧化铁 Fe2O3 红棕色 铁红 +3
四氧化三铁 Fe3O4 黑色 磁性氧化铁 +2,+3
化学性质
(1)FeO不稳定,在空气中受热易被氧化成_________。
(2)FeO和Fe2O3属于______氧化物,与盐酸反应的离子方程式分别为:_______________________、______________________。
(3) Fe3O4不属于碱性氧化物,与盐酸反应的离子方程式为:Fe3O4+8H+==== Fe2++2Fe3++4H2O
Fe3O4
碱性
FeO+2H+===Fe2++H2O
Fe2O3+6H+===2Fe3++3H2O
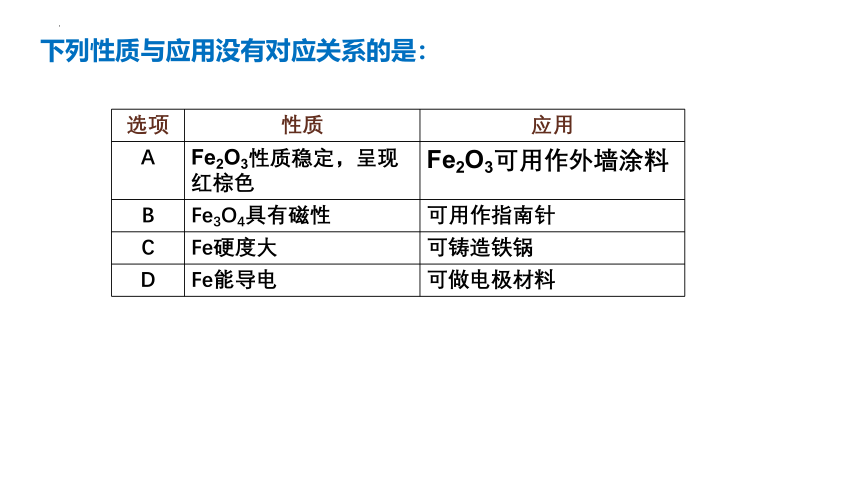
下列性质与应用没有对应关系的是:
选项 性质 应用
A Fe2O3性质稳定,呈现红棕色 Fe2O3可用作外墙涂料
B Fe3O4具有磁性 可用作指南针
C Fe硬度大 可铸造铁锅
D Fe能导电 可做电极材料
铁的氢氧化物
氢氧化亚铁Fe(OH)2 氢氧化铁Fe(OH)3
颜 色 灰白色 红褐色
溶解性 难溶于水 难溶于水
价态 +2 +3
制法
Fe2++2OH-=Fe(OH)2↓
Fe3++3OH-=Fe(OH)3↓
在两支试管中分别加入少量的FeCl3溶液和FeSO4溶液,然后各滴入NaOH溶液。
铁的氧化物能直接和水反应生成对应的氧化物吗?
现象 氢氧化亚铁Fe(OH)2 氢氧化铁Fe(OH)3
在FeSO4溶液中滴入NaOH溶液
生成白色絮状沉淀,原因是___________________,
沉淀迅速变成灰绿色,最后会有红褐色沉淀生成,原因是___________________
Fe2++2OH-====Fe(OH)2↓
4Fe(OH)2+O2+2H2O ==== 4Fe(OH)3
预测 白色沉淀 红褐色沉淀
实际 先生成白色絮状沉淀,迅速变成灰绿色并有红褐色物质生成。 红褐色沉淀
已知:氢氧化亚铁在空气中易被氧化,如何制备氢氧化亚铁?
关键:排除氧气干扰
反应前:
(1)将配制溶液的蒸馏水煮沸,除去其中的氧气。
反应中:
(1)在亚铁盐溶液上面充入保护气,如H2、N2、稀有气体等。
(2)在亚铁盐溶液上面加保护层,如苯、植物油等。
(3)将盛有NaOH溶液的胶头滴管尖端插入试管内的亚铁盐溶液底部,并慢慢挤出NaOH溶液。
铁的氢氧化物的化学性质
(1)碱的通性——与酸反应
(2) Fe(OH)3 不稳定,受热易分解
(3) ) Fe(OH)2 不稳定,易被氧化
2Fe(OH)3==== Fe2O3+3H2O
氢氧化亚铁Fe(OH)2 氢氧化铁Fe(OH)3
制 法
颜 色
溶解性
稳定性
与酸反应
Fe2++2OH-=Fe(OH)2↓
(隔绝氧气)
Fe3++3OH-=Fe(OH)3↓
灰白色
红褐色
难溶于水
难溶于水
受热易分解
极易被空气中氧气氧化
成氢氧化铁
4Fe(OH)2+2H2O+O2
=4Fe(OH)3
Fe(OH)2+2H+=Fe2++2H2O
Fe(OH)3+3H+=Fe3++3H2O
铁盐和亚铁盐
常见的铁盐有Fe2(SO4)3、FeCl3等,常见的亚铁盐有FeSO4、FeCl2等。
铁是人体必需的微量元素中含量最多的一种,缺铁性贫血已成为仅次于结核病的全球患病率最高、耗资最大的公共卫生问题。那铁元素在人体中又是以什么形式存在呢?
食补
药补
都是亚铁!
如何检验?
是不是可以采用向溶液中加入氢氧化钠的方法检验?
铁盐和亚铁盐
(1)观察法:浅绿色溶液中含有______;棕黄色溶液中含有______。
(2)加碱法:若产生的白色沉淀迅速变为灰绿色,最后变为红褐色的为______;若直接产生红褐色沉淀的为______。
Fe2+
Fe3+
Fe2+
Fe3+
Fe2+、Fe3+的检验方法
单一离子检验
若浓度很小,颜色差异不明显
加碱后沉淀很少,颜色观察困难,若同时有其他氢氧化物沉淀,会干扰检验
Fe3+的检验
在两支试管中分别加入少量的FeCl3溶液和FeCl2溶液,各滴入几滴KSCN溶液。观察并记录现象。
滴入KSCN溶液
FeCl3溶液
FeCl2溶液
溶液呈红色
溶液颜色无明显变化
Fe3+ +3SCN- =Fe(SCN)3 (血红色,易溶难电离)
Fe2++2SCN-=Fe(SCN)2 (无色)
结论:可利用此KSCN(硫氰化钾)来检验Fe3+ 的存在
如何检验Fe2+?(提示:从物质的价态考虑)
① 加KMnO4(H+)溶液(利用Fe2+的还原性)
(注:如是未知溶液则不能用此方法)
现象预测:溶液紫红色褪去
②先加KSCN溶液,再加氯水。(利用Fe2+的还原性)
现象预测:开始溶液不变红色,加几滴氯水
后溶液变红色。
Fe2+、Fe3+、Fe的相互转化
【思考】Fe、FeSO4和Fe2(SO4)3三种物质中,哪种物质可做氧化剂,哪种可做还原剂,哪种既可做氧化剂又可做还原剂
举例写出相应反应的化学方程式,并加以说明。
Fe可做还原剂;
Fe2(SO4)3做氧化剂;
FeSO4既可做氧化剂又可做还原剂
氧化性: Fe3+>Cu2+>Fe2+>Zn2+
在盛有2 mL FeCl3溶液的试管中滴入几滴KSCN溶液,充分反应后,加入少量铁粉,振荡试管观察并记录现象。把上层清液倒入另一支试管中,再滴入几滴氯水(如图右),又发生了什么变化
Fe2+、Fe3+的转化
【现象】
FeCl3溶液的试管中加入少量铁粉后,溶液有棕黄色变浅绿色,滴入KSCN溶液,溶液无明显变化。
2. 把上层清液倒入另一支试管中,再滴入几滴氯水,溶液变红色。
现象解释:在上述实验中,FeCl3溶液中的Fe3+被铁粉还原成Fe2+,Fe2+又被Cl2氧化成Fe3+ ,Fe3+与SCN-反应生成红色Fe(SCN)3 。
2Fe3++Fe===3Fe2+
离子方程式 ____________________、__________________________
结论 Fe3+遇到较强的还原剂时,会被还原成_________;
Fe2+在较强的氧化剂的作用下会被氧化成_________
2Fe2++Cl2===2Fe3++2Cl-
Fe2+
Fe3+
Fe
Fe2+
Fe3+
“铁三角”
H+、Cu2+、S、I2等
Br2、Cl2、HNO3、浓H2SO4等
Br2、Cl2、HNO3、浓H2SO4等
Al、Mn、Zn等
Al、Mn、Zn等
Fe2+、Fe3+、Fe的相互转化
1、氢氧化铁:红褐色沉淀,与酸反应,受热分解
小结:
2、氢氧化亚铁:白色沉淀,易被氧化,迅速变为灰绿色,最终为红褐色
3、Fe3+:黄色,可以被还原为Fe2+
2Fe(OH)3 Fe2O3 + 3H2O
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
Fe + 2Fe3+ = 3Fe2+
检验:滴加KSCN溶液,显红色
Fe3+ + 3SCN- = Fe(SCN)3
4、Fe2+:浅绿色,可以被氧化为Fe3+
Cl2 + 2Fe2+ = 2Fe3+ + 2Cl-
学以致用
了解FeCl3制作印刷电路板
制作过程:
先在塑料板上镀上一层铜,然后在设计好的铜线路上涂上一层石蜡,把板浸到氯化铁溶液中,没有在线路上的铜即没有被石蜡覆盖住,这样铜就被反应掉。
Cu + 2Fe3+ = 2Fe2+ + Cu2+
从生活走进化学
1.FeCl3溶液(FeCl2溶液):
2.FeCl2溶液(FeCl3溶液):
3.FeSO4溶液(CuSO4):
如何分析下列除杂问题?(括号内物质为杂质)
通入足量Cl2;也可加适量双氧水。
加足量铁粉,充分反应后过滤。
加足量铁粉,充分反应后过滤。
铁盐和铁单质
+3价铁离子只具有氧化性,遇较强还原剂时会被还原成亚铁化合物。
① 2Fe3++2I-=2Fe2++I2
② 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
③2Fe3++Cu=2Fe2++Cu2+
+2价铁离子既具有氧化性又具有还原性
氧化性:遇强还原剂时被还原成单质铁
还原性:遇较强氧化剂时被氧化成
三价铁的化合物
*选做强化题 用FeCl3溶液腐蚀印刷电路板上的铜,所得溶液中加入铁粉。对加入铁粉充分反应后的溶液分析合理的是 ( )
A.若无固体剩余,则溶液中一定有Fe3+
B.若有固体存在,则溶液中一定有Fe2+
C.若溶液中有Cu2+,则一定没有固体析出
D.若溶液中有Fe2+,则一定有Cu析出
B
