化学人教版(2019)必修第一册2.3.2气体摩尔体积(共21张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.3.2气体摩尔体积(共21张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-16 21:53:20 | ||
图片预览




文档简介
(共21张PPT)
第二章
海水中的重要元素
第三节 物质的量
课时 2 气体摩尔体积
学习目标
1. 了解气体摩尔体积的概念;
2. 能从宏观和微观两个方面了解影响气体体积的因素;
3. 能进行气体摩尔体积的简单判断和计算。。
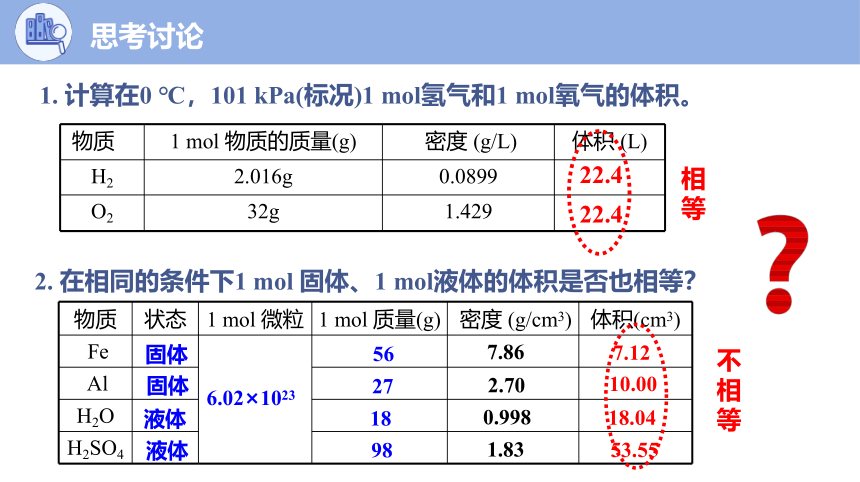
2. 在相同的条件下1 mol 固体、1 mol液体的体积是否也相等?
1. 计算在0 ℃,101 kPa(标况)1 mol氢气和1 mol氧气的体积。
物质 1 mol 物质的质量(g) 密度 (g/L) 体积 (L)
H2 2.016g 0.0899
O2 32g 1.429
22.4
22.4
物质 状态 1 mol 微粒 1 mol 质量(g) 密度 (g/cm3) 体积(cm3)
Fe
Al
H2O
H2SO4
固体
固体
液体
液体
56
27
18
98
7.86
2.70
1.83
7.12
10.00
18.04
53.55
6.02×1023
0.998
不相等
相等
思考讨论
1mol 任何气体 的体积相同
1mol 固体和液体 的体积不相同
同温同压下
【思考与讨论】
为什么呢?
影响物质体积的因素有哪些?
1、所占的体积哪个大?
粒子的大小
2、1个 和 N个 小黄人所占的体积哪个大?
粒子的数目
3、紧密和松散排列所占的体积哪个大?
粒子的间距
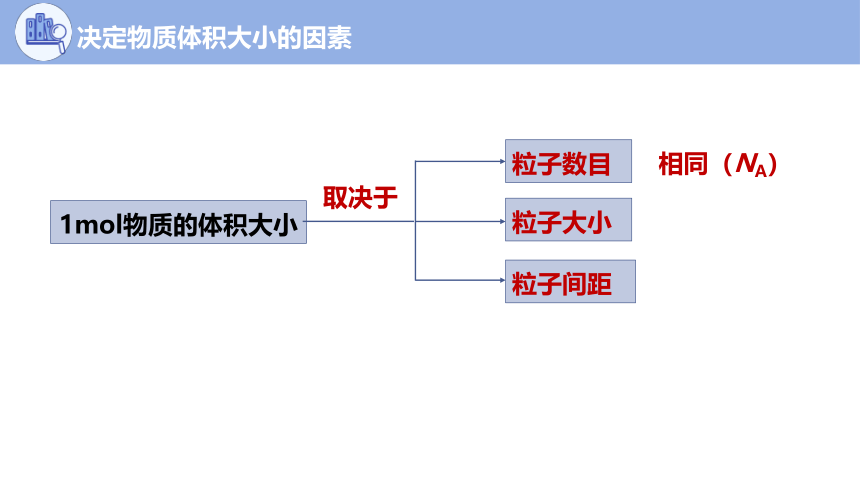
决定物质体积大小的因素
决定物质体积大小的因素
1mol物质的体积大小
粒子数目
粒子大小
粒子间距
相同(NA)
取决于
粒子数目
粒子大小
粒子间距
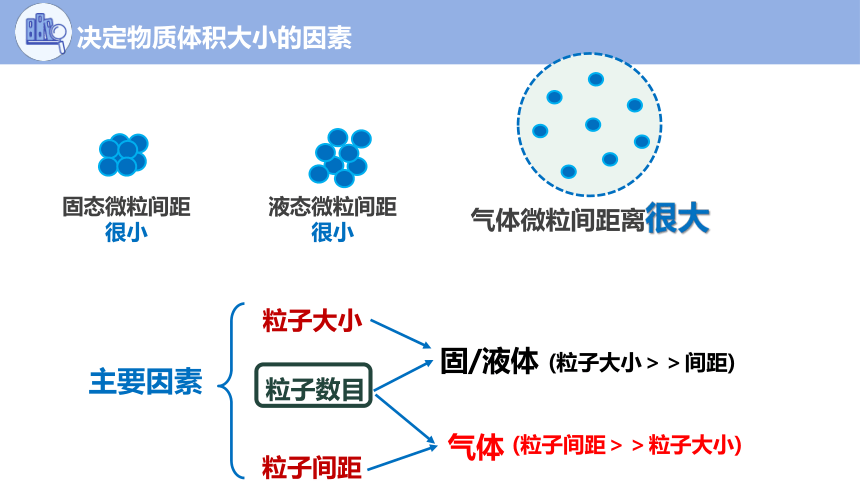
固/液体
主要因素
气体
(粒子大小>>间距)
(粒子间距>>粒子大小)
决定物质体积大小的因素
气体微粒间距离很大
固态微粒间距很小
液态微粒间距很小
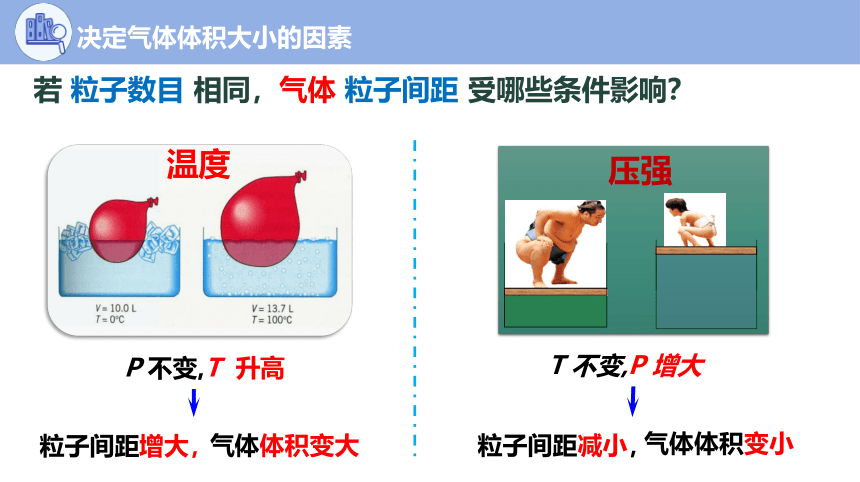
若 粒子数目 相同,气体 粒子间距 受哪些条件影响?
P 不变,T 升高
粒子间距增大,
气体体积变大
T 不变,P 增大
粒子间距减小,
气体体积变小
压强
温度
决定气体体积大小的因素
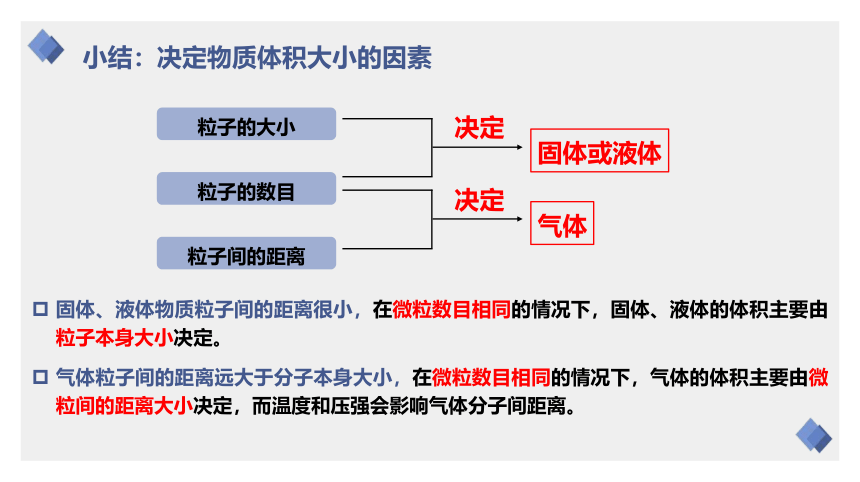
小结:决定物质体积大小的因素
固体、液体物质粒子间的距离很小,在微粒数目相同的情况下,固体、液体的体积主要由粒子本身大小决定。
粒子的数目
粒子的大小
粒子间的距离
决定
固体或液体
气体粒子间的距离远大于分子本身大小,在微粒数目相同的情况下,气体的体积主要由微粒间的距离大小决定,而温度和压强会影响气体分子间距离。
决定
气体
气体 0℃,101KPa时的体积
1mol H2 22.4 L
1mol O2 22.4 L
【思考】
根据以上分析,为什么1mol 不同气体体积相同?
同温同压下,气体分子的间距相同
同温同压下, 1mol 任何气体 的体积相同
单位物质的量的气体所占的体积。
Vm
定义:
符号:
0℃ 101kPa 下, Vm≈22.4 L/mol
数值:
标准状况(标况)
1mol任何气体的体积都约为22.4L
L·mol-1 或 m3·mol-1
单位:
表达式:
Vm
=
V
n
气体摩尔体积
影响因素
温度越高,Vm越大
压强越高,Vm越小
特例
标准状况 (0℃,101KPa) Vm≈ 22.4 L/mol
1、只适用于气态物质,可以是单一气体也可以是混合气体
2、标况下,HF、H2O、NO2、SO3、CCl4、溴、酒精、苯等不属于气态
3、Vm≈ 22.4 L/mol 的状态不一定是标准状况
气体摩尔体积
标准状况下气体体积的计算
计算关系
气体的摩尔体积
(1)1mol任何气体的体积都约为22.4L。
(2)1molH2O在标况下的体积约为22.4L。
(3)标准状况下,0.4molN2和0.6molO2的混合气体的
体积约为22.4 L。
(4)标准状况下,任何气体的体积都约为22.4L。
(5)只有在标准状况时气体摩尔体积才约为22.4L·mol-1
(6)22.4L气体所含分子数一定大于11.2L气体所含分子数
×
√
×
×
×
×
判断下列说法是否正确?并说明原因。
练习:列步骤计算下列问题(标准状况下)
(1)0.5 mol HCl占有的体积是多少?
(2)33.6 L H2的物质的量是多少?
(3)16 g O2的体积是多少?
(4)44.8 L N2中含有的N2分子数是多少?
(11.2L)
(1.5mol)
(11.2L)
(1.204×1024个)
阿伏加德罗定律
阿伏伽德罗定律
具有相同的分子数
同温同压下,
同体积的任何气体,
【思考】
同T同P下,物质的量相同的气体,体积大小如何?
体积相同
阿伏伽德罗定律的推论
思考:气体体积与温度及压强有怎样的具体的数量关系呢?
理想气体状态方程——pV=nRT
R为常数,R≈8.314
相同条件 结论 公式 语言叙述
T、p相同 同温同压下,体积之比等于物质的量之比,等于分子数之比
T、V相同 同温同体积下,压强之比等于物质的量之比,等于分子数之比
n、T相同 物质的量相等,温度相同的气体,其压强与体积成反比
T、p相同 同温同压下,密度之比等于摩尔质量之比
T、p、V相同 同温同压下,体积相同的气体,其质量与摩尔质量成正比
1. 同温同压下等质量的SO2气体和CO2气体,下列有关比较的叙述中,正确的是( )
①密度比为16∶11 ②密度比为11∶16 ③体积比为16∶11 ④体积比为11∶16
A.①③ B.①④ C.②③ D.②④
B
2. 同温、同压下,向两密闭容器中分别充满等质量的O2和O3气体,则
①两容器的体积比为______。
②两种气体的密度比为______。
3∶2
2∶3
A
B
小结
m n N
÷M
×M
÷NA
×NA
÷Vm
×Vm
v
第二章
海水中的重要元素
第三节 物质的量
课时 2 气体摩尔体积
学习目标
1. 了解气体摩尔体积的概念;
2. 能从宏观和微观两个方面了解影响气体体积的因素;
3. 能进行气体摩尔体积的简单判断和计算。。
2. 在相同的条件下1 mol 固体、1 mol液体的体积是否也相等?
1. 计算在0 ℃,101 kPa(标况)1 mol氢气和1 mol氧气的体积。
物质 1 mol 物质的质量(g) 密度 (g/L) 体积 (L)
H2 2.016g 0.0899
O2 32g 1.429
22.4
22.4
物质 状态 1 mol 微粒 1 mol 质量(g) 密度 (g/cm3) 体积(cm3)
Fe
Al
H2O
H2SO4
固体
固体
液体
液体
56
27
18
98
7.86
2.70
1.83
7.12
10.00
18.04
53.55
6.02×1023
0.998
不相等
相等
思考讨论
1mol 任何气体 的体积相同
1mol 固体和液体 的体积不相同
同温同压下
【思考与讨论】
为什么呢?
影响物质体积的因素有哪些?
1、所占的体积哪个大?
粒子的大小
2、1个 和 N个 小黄人所占的体积哪个大?
粒子的数目
3、紧密和松散排列所占的体积哪个大?
粒子的间距
决定物质体积大小的因素
决定物质体积大小的因素
1mol物质的体积大小
粒子数目
粒子大小
粒子间距
相同(NA)
取决于
粒子数目
粒子大小
粒子间距
固/液体
主要因素
气体
(粒子大小>>间距)
(粒子间距>>粒子大小)
决定物质体积大小的因素
气体微粒间距离很大
固态微粒间距很小
液态微粒间距很小
若 粒子数目 相同,气体 粒子间距 受哪些条件影响?
P 不变,T 升高
粒子间距增大,
气体体积变大
T 不变,P 增大
粒子间距减小,
气体体积变小
压强
温度
决定气体体积大小的因素
小结:决定物质体积大小的因素
固体、液体物质粒子间的距离很小,在微粒数目相同的情况下,固体、液体的体积主要由粒子本身大小决定。
粒子的数目
粒子的大小
粒子间的距离
决定
固体或液体
气体粒子间的距离远大于分子本身大小,在微粒数目相同的情况下,气体的体积主要由微粒间的距离大小决定,而温度和压强会影响气体分子间距离。
决定
气体
气体 0℃,101KPa时的体积
1mol H2 22.4 L
1mol O2 22.4 L
【思考】
根据以上分析,为什么1mol 不同气体体积相同?
同温同压下,气体分子的间距相同
同温同压下, 1mol 任何气体 的体积相同
单位物质的量的气体所占的体积。
Vm
定义:
符号:
0℃ 101kPa 下, Vm≈22.4 L/mol
数值:
标准状况(标况)
1mol任何气体的体积都约为22.4L
L·mol-1 或 m3·mol-1
单位:
表达式:
Vm
=
V
n
气体摩尔体积
影响因素
温度越高,Vm越大
压强越高,Vm越小
特例
标准状况 (0℃,101KPa) Vm≈ 22.4 L/mol
1、只适用于气态物质,可以是单一气体也可以是混合气体
2、标况下,HF、H2O、NO2、SO3、CCl4、溴、酒精、苯等不属于气态
3、Vm≈ 22.4 L/mol 的状态不一定是标准状况
气体摩尔体积
标准状况下气体体积的计算
计算关系
气体的摩尔体积
(1)1mol任何气体的体积都约为22.4L。
(2)1molH2O在标况下的体积约为22.4L。
(3)标准状况下,0.4molN2和0.6molO2的混合气体的
体积约为22.4 L。
(4)标准状况下,任何气体的体积都约为22.4L。
(5)只有在标准状况时气体摩尔体积才约为22.4L·mol-1
(6)22.4L气体所含分子数一定大于11.2L气体所含分子数
×
√
×
×
×
×
判断下列说法是否正确?并说明原因。
练习:列步骤计算下列问题(标准状况下)
(1)0.5 mol HCl占有的体积是多少?
(2)33.6 L H2的物质的量是多少?
(3)16 g O2的体积是多少?
(4)44.8 L N2中含有的N2分子数是多少?
(11.2L)
(1.5mol)
(11.2L)
(1.204×1024个)
阿伏加德罗定律
阿伏伽德罗定律
具有相同的分子数
同温同压下,
同体积的任何气体,
【思考】
同T同P下,物质的量相同的气体,体积大小如何?
体积相同
阿伏伽德罗定律的推论
思考:气体体积与温度及压强有怎样的具体的数量关系呢?
理想气体状态方程——pV=nRT
R为常数,R≈8.314
相同条件 结论 公式 语言叙述
T、p相同 同温同压下,体积之比等于物质的量之比,等于分子数之比
T、V相同 同温同体积下,压强之比等于物质的量之比,等于分子数之比
n、T相同 物质的量相等,温度相同的气体,其压强与体积成反比
T、p相同 同温同压下,密度之比等于摩尔质量之比
T、p、V相同 同温同压下,体积相同的气体,其质量与摩尔质量成正比
1. 同温同压下等质量的SO2气体和CO2气体,下列有关比较的叙述中,正确的是( )
①密度比为16∶11 ②密度比为11∶16 ③体积比为16∶11 ④体积比为11∶16
A.①③ B.①④ C.②③ D.②④
B
2. 同温、同压下,向两密闭容器中分别充满等质量的O2和O3气体,则
①两容器的体积比为______。
②两种气体的密度比为______。
3∶2
2∶3
A
B
小结
m n N
÷M
×M
÷NA
×NA
÷Vm
×Vm
v
