化学人教版(2019)必修第一册2.3.3物质的量浓度 课件(共27张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.3.3物质的量浓度 课件(共27张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-16 22:22:11 | ||
图片预览








文档简介
(共27张PPT)
第二章
海水中的重要元素
第三节 物质的量
课时 3 物质的量浓度
?
生活中的化学
生理盐水的溶质质量分数是0.9%,太浓或者太稀都会带来生命危险。
表示浓度的方法有哪些
溶液的量
溶质的量
m(溶质)
m(溶液)
=ω
n(溶质)
V(溶液)
c=
讨论:
根据这个关系式,并类比质量分数的定义给物质的量浓度下个定义。
质量分数:单位质量溶液中所含溶质的质量
思考:
取一定量溶液时,是称质量方便还是量体积方便?
物质的量浓度
1. 定义:单位体积溶液里所含溶质B的物质的量,叫做溶质B的物质的量浓度,符号为CB
3.单位:mol/L 或 mol/m3。
注意(1) B 表示溶液中所含溶质(物质或离子)
V液---溶液体积,不是溶剂体积。
(3)均一性:同一溶液,溶质的物质的量浓度与所取溶液体积无关。
cB =
nB
V液
2.表达式:
nB = cB V液
V液= nB / cB
←溶液的体积(L)
←溶质的物质的量(mol)
一、物质的量浓度
(2)V溶液 ≠ V溶质 + V溶剂 [除题目特殊说明]
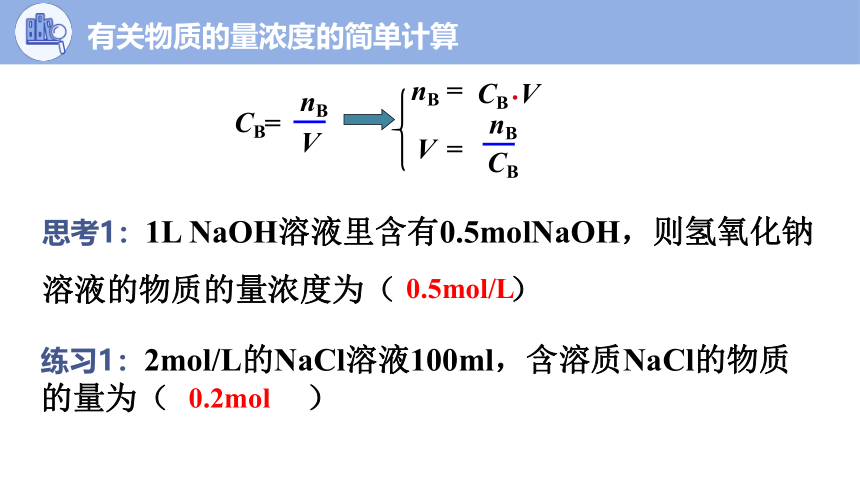
思考1:1L NaOH溶液里含有0.5molNaOH,则氢氧化钠溶液的物质的量浓度为( )
练习1:2mol/L的NaCl溶液100ml,含溶质NaCl的物质的量为( )
0.5mol/L
0.2mol
CB
=
V
nB
CB
V
=
nB
=
V
CB
nB
·
有关物质的量浓度的简单计算
判断下列说法是否正确
1)将1g NaCl溶于水制成1L溶液 ,则cNaCl=1mol·L-1
2)将1mol NaCl溶于1L水中,则cNaCl=1mol·L-1
3)若从1L 1 mol·L-1的NaOH溶液中取出20mL,则取出的NaOH溶液c=1mol·L-1
√
×
×
物质的量浓度为0.5 mol·L-1 的MgCl2溶液含有的Cl-数为NA
溶质不是1mol
溶液不是1L
×
没告诉体积,无法计算
思考如何配制100mL1.00 mol/L的NaCl溶液?【实验2-10】配制100mL1.00 mol/L的NaCl溶液。思考:1、若要精确配制100mL1.00 mol/L的NaCl溶液。需要哪些仪器? 2、实验步骤如何进行?3、有哪些误差的?一种容积精确的仪器, 用于配制溶液
容量瓶上标有:
专用瓶塞
只一个刻度
容积
平底
常用规格: 50 mL、 100 mL、250 mL、 500 mL、1000 mL等。
容量瓶
【注意】
填空题中,若需用到容量瓶,要
指明规格:**mL的容量瓶。
温度
温度、容积、刻度线
配制的溶液温度应在20℃左右
使用容量瓶时的注意事项
使用前要检漏;
(加水-塞瓶塞-倒立-检漏-正置,瓶塞旋转180℃-倒立-检漏)
“五不能”:
不能在瓶内溶解固体;
不能在瓶内稀释浓液体;
不能做反应容器;
不能久存溶液;
不能加热
容量瓶规格的选择依据:“大且近”原则
不能配制任意体积的溶液,只能配制容量瓶规定容积
配制过程及操作
5.85
托盘天平
烧杯
冷却
至室温
100
以配制100 mL 1.0 mol·L-1 NaCl溶液为例:
5.9g
2~3
1~2
凹
液面与刻度线相切
配制一定物质的量浓度的溶液全过程
计算、称量
溶解
移液、洗涤
定容
摇匀
装瓶,贴标签
称量误差 nB V CB
砝码锈蚀增重
砝码、药品放反 5.9g 10.0g
称(易潮解)NaOH固体时间过长
量筒量取液体时俯视读数
量筒量取液体时仰视读数
↑
减小/
不变
↓
偏低/
不变
↑
↑
—
—
—
—
—
↑
↓
↓
↓
依据:
C(B)=
n(B)
V
误差分析的思维流程
操作误差 nB V CB
搅拌或转移时,有液体溅出
未洗涤烧杯
未冷却至室温就转移溶液
转移时玻璃棒靠壁在刻度线上
容量瓶中原有少量蒸馏水,未干燥
定容摇匀后液面下降
定容时,水加多了,用滴管吸出
俯视刻度线定容
仰视刻度线定容
↓
—
—
↓
↓
↓
—
↓
↓
依据:
C(B)=
n(B)
V
无影响
无影响
—
↑
↓
↓
—
↓
俯视
仰视
平视
容量瓶俯视或仰视刻度线对溶液浓度的影响
真实值
真实值
溶液体积偏小
溶液体积偏大
C(B) 增大
C(B) 减小
“虎大羊小”
溶质微粒浓度的计算
思考1:4 L 0.5 mol/L 的Al2(SO4 )3溶液中,
Al3+ 的物质的量浓度为________ mol/L,
SO4 2- 的物质的量浓度为_____ mol/L
有关物质的量浓度的简单计算
1.5
1
思考2:把49克H2SO4配成2L稀H2SO4,其物质的量浓度为?
c(H2SO4)=
n(H2SO4)
V(溶液)
=
M(H2SO4)
m(H2SO4)
V(溶液)
=0.25mol/L
=
0.5mol
2L
有关物质的量浓度的简单计算
物质的量浓度与固体溶质质量的计算
c(NH3)=
n(NH3)
V(溶液)
Vm
V(NH3)
=
V(溶液)
=
0.5mol
0.4L
=1.25mol/L
思考3: 在标准状况下,11.2LNH3溶于水,配成400mL溶液,此氨水物质的量浓度为多少?
有关物质的量浓度的简单计算
物质的量浓度与气体溶质体积的计算
物质的量浓度与溶液中某种粒子数目的计算
思考4:0.5LCaCl2溶液中含有6.02x1023个Cl-,该溶液中CaCl2的物质的量浓度为________。
有关物质的量浓度的简单计算
c(CaCl2)=
n(CaCl2)
V(溶液)
2NA
N(Cl—)
=
V(溶液)
=
0.5mol
0.5L
=1 mol/L
练习:下列各溶液中,Na+ 浓度最大的是 ( )
(A)4L 0.5 mol/L 的NaCl 溶液
(B)1L 0.3 mol/L 的Na2SO4 溶液
(C) 0.8L 0.4 mol/L 的NaOH 溶液
(D) 2L 0.15 mol/L 的Na3PO4 溶液
c (Na+) = 0. 5 mol/L×1 = 0. 5 mol/L
c (Na+) = 0. 3 mol/L×2 = 0. 6 mol/L
c (Na+) = 0. 4 mol/L×1 = 0. 4 mol/L
C (Na+) = 0. 15 mol/L×3 = 0. 45 mol/L
B
物质的量最多
A
思考5:市售浓硫酸18.4 mol·L-1的,现需配制500 mL 1.50 mol/L的硫酸溶液,应需浓硫酸多少毫升?
稀释定律:
m(溶质)=m(浓溶液)·ω(浓溶液)=m(稀溶液)·ω(稀溶液)
n(溶质)= c(浓溶液)·V(浓溶液)=c(稀溶液)·V(稀溶液)
40.8 mL
溶液稀释过程物质的量浓度的计算
有关物质的量浓度的简单计算
溶液的密度(g/mL或g/cm3)×溶液的体积(mL)×溶质的质量分数
物质的量浓度(mol/L)×溶液的体积(L)×溶质的摩尔质量(g/mol)
有关物质的量浓度的简单计算——质量分数
溶质的质量相等
如何用质量分数为98%,密度为1.84g·cm-3的浓硫酸配制250mL 2mol·L-1的稀硫酸?
溶质的质量相等
1.某学生计划用12 mol·L-1的浓盐酸配制0.10 mol·L-1的稀盐酸450 mL,回答下列问题:(1)实验过程中,不必使用的是(填字母)。A.托盘天平B.量筒C.容量瓶D.250 mL烧杯E.胶头滴管F.500 mL试剂瓶(2)除上述仪器可使用外,还缺少的仪器是。(3)量取浓盐酸的体积为mL,应选用的量筒规格为。(4)配制时应选用的容量瓶规格为。A玻璃棒4.210 mL500 mL练习1:n(溶质)=V(浓)×c(浓)=V(稀)×c(稀) 1.判断正误(正确的打“√”,错误的打“×”)
(1)容量瓶在使用前要检查是否漏水( )
(2)配制一定物质的量浓度的溶液,在摇匀后,液面位于刻度线以下,应加水至刻度线( )
(3)配制950 mL一定物质的量浓度溶液时,要选用950 mL容量瓶( )
(4)为了配制方便,可将固体或浓溶液直接在容量瓶(或量筒)中进行溶解(或稀释)( )
(5)将28.6 g Na2CO3·10H2O溶于水配成1 L溶液,所得溶液的物质的量浓度为0.1 mol·L-1 ( )
√
×
×
×
√
(2)从改变溶液体积角度分析产生的误差(用“偏大”“偏小”或“无影响”填空)。
①配制NaOH溶液时,将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容:______。
偏大
NaOH溶于水放热,溶液的体积比室温时大,应恢复至室温后再移液、定容。
(1)从改变溶质物质的量角度分析产生的误差(用“偏大”“偏小”或“无影响”填空)。
①配制450 mL 0.1 mol·L-1的NaOH溶液,用托盘天平称取NaOH固体1.8 g:______。
②配制500 mL 0.1 mol·L-1的硫酸铜溶液,用托盘天平称取胆矾8.0 g:______。
偏小
偏小
所需胆矾质量为0.5 L×0.1 mol·L-1×250 g·mol-1=12.5 g。
3.下图所示是配制一定物质的量浓度溶液的过程中的几步,回答下列问题:
(1)图示几个步骤正确的先后顺序应是_____(填字母)。
A.①②③④ B.③④②①
C.③②④① D.③④①②
B
(2)其中①对应的操作方法为________________________________________________
_______________________________________________________。
将蒸馏水注入容量瓶,当液面离容量瓶颈部的刻度线1~2 cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切
1
2
3
第二章
海水中的重要元素
第三节 物质的量
课时 3 物质的量浓度
?
生活中的化学
生理盐水的溶质质量分数是0.9%,太浓或者太稀都会带来生命危险。
表示浓度的方法有哪些
溶液的量
溶质的量
m(溶质)
m(溶液)
=ω
n(溶质)
V(溶液)
c=
讨论:
根据这个关系式,并类比质量分数的定义给物质的量浓度下个定义。
质量分数:单位质量溶液中所含溶质的质量
思考:
取一定量溶液时,是称质量方便还是量体积方便?
物质的量浓度
1. 定义:单位体积溶液里所含溶质B的物质的量,叫做溶质B的物质的量浓度,符号为CB
3.单位:mol/L 或 mol/m3。
注意(1) B 表示溶液中所含溶质(物质或离子)
V液---溶液体积,不是溶剂体积。
(3)均一性:同一溶液,溶质的物质的量浓度与所取溶液体积无关。
cB =
nB
V液
2.表达式:
nB = cB V液
V液= nB / cB
←溶液的体积(L)
←溶质的物质的量(mol)
一、物质的量浓度
(2)V溶液 ≠ V溶质 + V溶剂 [除题目特殊说明]
思考1:1L NaOH溶液里含有0.5molNaOH,则氢氧化钠溶液的物质的量浓度为( )
练习1:2mol/L的NaCl溶液100ml,含溶质NaCl的物质的量为( )
0.5mol/L
0.2mol
CB
=
V
nB
CB
V
=
nB
=
V
CB
nB
·
有关物质的量浓度的简单计算
判断下列说法是否正确
1)将1g NaCl溶于水制成1L溶液 ,则cNaCl=1mol·L-1
2)将1mol NaCl溶于1L水中,则cNaCl=1mol·L-1
3)若从1L 1 mol·L-1的NaOH溶液中取出20mL,则取出的NaOH溶液c=1mol·L-1
√
×
×
物质的量浓度为0.5 mol·L-1 的MgCl2溶液含有的Cl-数为NA
溶质不是1mol
溶液不是1L
×
没告诉体积,无法计算
思考如何配制100mL1.00 mol/L的NaCl溶液?【实验2-10】配制100mL1.00 mol/L的NaCl溶液。思考:1、若要精确配制100mL1.00 mol/L的NaCl溶液。需要哪些仪器? 2、实验步骤如何进行?3、有哪些误差的?一种容积精确的仪器, 用于配制溶液
容量瓶上标有:
专用瓶塞
只一个刻度
容积
平底
常用规格: 50 mL、 100 mL、250 mL、 500 mL、1000 mL等。
容量瓶
【注意】
填空题中,若需用到容量瓶,要
指明规格:**mL的容量瓶。
温度
温度、容积、刻度线
配制的溶液温度应在20℃左右
使用容量瓶时的注意事项
使用前要检漏;
(加水-塞瓶塞-倒立-检漏-正置,瓶塞旋转180℃-倒立-检漏)
“五不能”:
不能在瓶内溶解固体;
不能在瓶内稀释浓液体;
不能做反应容器;
不能久存溶液;
不能加热
容量瓶规格的选择依据:“大且近”原则
不能配制任意体积的溶液,只能配制容量瓶规定容积
配制过程及操作
5.85
托盘天平
烧杯
冷却
至室温
100
以配制100 mL 1.0 mol·L-1 NaCl溶液为例:
5.9g
2~3
1~2
凹
液面与刻度线相切
配制一定物质的量浓度的溶液全过程
计算、称量
溶解
移液、洗涤
定容
摇匀
装瓶,贴标签
称量误差 nB V CB
砝码锈蚀增重
砝码、药品放反 5.9g 10.0g
称(易潮解)NaOH固体时间过长
量筒量取液体时俯视读数
量筒量取液体时仰视读数
↑
减小/
不变
↓
偏低/
不变
↑
↑
—
—
—
—
—
↑
↓
↓
↓
依据:
C(B)=
n(B)
V
误差分析的思维流程
操作误差 nB V CB
搅拌或转移时,有液体溅出
未洗涤烧杯
未冷却至室温就转移溶液
转移时玻璃棒靠壁在刻度线上
容量瓶中原有少量蒸馏水,未干燥
定容摇匀后液面下降
定容时,水加多了,用滴管吸出
俯视刻度线定容
仰视刻度线定容
↓
—
—
↓
↓
↓
—
↓
↓
依据:
C(B)=
n(B)
V
无影响
无影响
—
↑
↓
↓
—
↓
俯视
仰视
平视
容量瓶俯视或仰视刻度线对溶液浓度的影响
真实值
真实值
溶液体积偏小
溶液体积偏大
C(B) 增大
C(B) 减小
“虎大羊小”
溶质微粒浓度的计算
思考1:4 L 0.5 mol/L 的Al2(SO4 )3溶液中,
Al3+ 的物质的量浓度为________ mol/L,
SO4 2- 的物质的量浓度为_____ mol/L
有关物质的量浓度的简单计算
1.5
1
思考2:把49克H2SO4配成2L稀H2SO4,其物质的量浓度为?
c(H2SO4)=
n(H2SO4)
V(溶液)
=
M(H2SO4)
m(H2SO4)
V(溶液)
=0.25mol/L
=
0.5mol
2L
有关物质的量浓度的简单计算
物质的量浓度与固体溶质质量的计算
c(NH3)=
n(NH3)
V(溶液)
Vm
V(NH3)
=
V(溶液)
=
0.5mol
0.4L
=1.25mol/L
思考3: 在标准状况下,11.2LNH3溶于水,配成400mL溶液,此氨水物质的量浓度为多少?
有关物质的量浓度的简单计算
物质的量浓度与气体溶质体积的计算
物质的量浓度与溶液中某种粒子数目的计算
思考4:0.5LCaCl2溶液中含有6.02x1023个Cl-,该溶液中CaCl2的物质的量浓度为________。
有关物质的量浓度的简单计算
c(CaCl2)=
n(CaCl2)
V(溶液)
2NA
N(Cl—)
=
V(溶液)
=
0.5mol
0.5L
=1 mol/L
练习:下列各溶液中,Na+ 浓度最大的是 ( )
(A)4L 0.5 mol/L 的NaCl 溶液
(B)1L 0.3 mol/L 的Na2SO4 溶液
(C) 0.8L 0.4 mol/L 的NaOH 溶液
(D) 2L 0.15 mol/L 的Na3PO4 溶液
c (Na+) = 0. 5 mol/L×1 = 0. 5 mol/L
c (Na+) = 0. 3 mol/L×2 = 0. 6 mol/L
c (Na+) = 0. 4 mol/L×1 = 0. 4 mol/L
C (Na+) = 0. 15 mol/L×3 = 0. 45 mol/L
B
物质的量最多
A
思考5:市售浓硫酸18.4 mol·L-1的,现需配制500 mL 1.50 mol/L的硫酸溶液,应需浓硫酸多少毫升?
稀释定律:
m(溶质)=m(浓溶液)·ω(浓溶液)=m(稀溶液)·ω(稀溶液)
n(溶质)= c(浓溶液)·V(浓溶液)=c(稀溶液)·V(稀溶液)
40.8 mL
溶液稀释过程物质的量浓度的计算
有关物质的量浓度的简单计算
溶液的密度(g/mL或g/cm3)×溶液的体积(mL)×溶质的质量分数
物质的量浓度(mol/L)×溶液的体积(L)×溶质的摩尔质量(g/mol)
有关物质的量浓度的简单计算——质量分数
溶质的质量相等
如何用质量分数为98%,密度为1.84g·cm-3的浓硫酸配制250mL 2mol·L-1的稀硫酸?
溶质的质量相等
1.某学生计划用12 mol·L-1的浓盐酸配制0.10 mol·L-1的稀盐酸450 mL,回答下列问题:(1)实验过程中,不必使用的是(填字母)。A.托盘天平B.量筒C.容量瓶D.250 mL烧杯E.胶头滴管F.500 mL试剂瓶(2)除上述仪器可使用外,还缺少的仪器是。(3)量取浓盐酸的体积为mL,应选用的量筒规格为。(4)配制时应选用的容量瓶规格为。A玻璃棒4.210 mL500 mL练习1:n(溶质)=V(浓)×c(浓)=V(稀)×c(稀) 1.判断正误(正确的打“√”,错误的打“×”)
(1)容量瓶在使用前要检查是否漏水( )
(2)配制一定物质的量浓度的溶液,在摇匀后,液面位于刻度线以下,应加水至刻度线( )
(3)配制950 mL一定物质的量浓度溶液时,要选用950 mL容量瓶( )
(4)为了配制方便,可将固体或浓溶液直接在容量瓶(或量筒)中进行溶解(或稀释)( )
(5)将28.6 g Na2CO3·10H2O溶于水配成1 L溶液,所得溶液的物质的量浓度为0.1 mol·L-1 ( )
√
×
×
×
√
(2)从改变溶液体积角度分析产生的误差(用“偏大”“偏小”或“无影响”填空)。
①配制NaOH溶液时,将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容:______。
偏大
NaOH溶于水放热,溶液的体积比室温时大,应恢复至室温后再移液、定容。
(1)从改变溶质物质的量角度分析产生的误差(用“偏大”“偏小”或“无影响”填空)。
①配制450 mL 0.1 mol·L-1的NaOH溶液,用托盘天平称取NaOH固体1.8 g:______。
②配制500 mL 0.1 mol·L-1的硫酸铜溶液,用托盘天平称取胆矾8.0 g:______。
偏小
偏小
所需胆矾质量为0.5 L×0.1 mol·L-1×250 g·mol-1=12.5 g。
3.下图所示是配制一定物质的量浓度溶液的过程中的几步,回答下列问题:
(1)图示几个步骤正确的先后顺序应是_____(填字母)。
A.①②③④ B.③④②①
C.③②④① D.③④①②
B
(2)其中①对应的操作方法为________________________________________________
_______________________________________________________。
将蒸馏水注入容量瓶,当液面离容量瓶颈部的刻度线1~2 cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切
1
2
3
