1.1.1 反应热 焓变 课件(共32张PPT)2023—2024学年上学期高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 1.1.1 反应热 焓变 课件(共32张PPT)2023—2024学年上学期高二化学人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-16 22:23:58 | ||
图片预览










文档简介
(共32张PPT)
第一章第一节 反应热
人教版(2019)高中化学选择性必修1课件
学习目标 素养目标
1.通过定量分析化学变化的热效应的教学,掌握反应热、内能、焓的概念,知道吸热反应、放热反应与焓变的关系。 2.通过宏观与微观、定性与定量等角度对物质变化中的能量转化进行分析和表征,理解反应热与键能的关系,能利用键能计算化学反应的反应热,能用热化学方程式表示反应中的能量变化。 【变化观念与平衡思想】 认识化学反应的本质是有新物质生成,并伴有能量的转化;能多角度、动态地分析热化学方程式,运用热化学反应原理解决实际问题。
【证据推理与模型认知】 在合作完成中和反应反应热测定的基础上,能正确搜集实验证据,建立中和反应反应热计算模型。
学习目标 素养目标
3.通过中和反应反应热测定的实验教学,能利用实验数据计算中和反应反应热,能对实验中的“异常”现象作出合理解释 【科学态度与社会责任】 能根据燃料的品质,提出物质在生产、生活和科学技术等方面应用的建议和意见;尊重科学伦理道德,能依据“绿色化学”思想和科学伦理对某一个化学过程进行分析,权衡利弊,作出合理的决策
1. 体系与环境
研究反应热时,首先需要明确体系和环境。如盐酸和NaOH溶液之间的反应,可将试管中的盐酸、NaOH溶液及发生的反应等看作一个反应体系,简称
(又称系统);与体系相互影响的其他部分,如盛溶液的试管和溶液之外的空气等看作 。
2.反应热
在 条件下,化学反应体系向环境 或从环境 的热量,称为化学反应的热效应,简称反应热。
学习任务一 反应热及其测定
体系
环境
等温
释放
吸收
3.中和反应反应热的测定
(1)仪器: 。
(2)原理:根据体系的 和有关物质的 等来计算反应热。
(3)实验装置及作用(如图所示)
简易量热计
温度变化
比热容
(4)实验测量数据
①反应前体系温度(t1)的测量
用一个量筒量取50 mL 0.50 mol·L-1盐酸,打开杯盖,倒入量热计的内筒,盖上杯盖,插入温度计,测量并记录盐酸的温度。用水把温度计上的酸冲洗干净,擦干备用;用另一个量筒量取50 mL 0.55 mol·L-1 NaOH溶液,用温度计测量并记录NaOH溶液的温度,取两温度平均值为t1。
②反应后体系温度(t2)的测量
打开杯盖,将量筒中的NaOH溶液迅速倒入量热计的内筒,立即盖上杯盖,插入温度计,用搅拌器匀速搅拌。准确读取混合溶液的 ,记录为t2。
最高温度
③重复实验操作,记录每次的实验数据,取测量所得温度差(t2-t1)的平均值作为计算依据。
④实验数据处理
盐酸、氢氧化钠溶液为稀溶液,其密度近似地认为都是1 g·cm-3,反应后生成溶液的比热容c=4.18 J·(g· ℃)-1。
该实验中盐酸和NaOH溶液反应放出的热量是 。生成1 mol
H2O时放出的热量为 。
0.418(t2-t1) kJ
kJ
[问题思考]
(1)若用0.55 mol·L-1 KOH溶液代替0.55 mol·L-1 NaOH 溶液,会对结果产生影响吗 为什么
[答案] 提示:无影响。因为强酸、强碱的稀溶液反应生成1 mol H2O(l)时放出的热量是相同的,与用KOH溶液还是NaOH 溶液以及酸碱的用量无关。
(2)用浓硫酸代替盐酸会对结果产生什么影响 用醋酸代替盐酸会对结果产生什么影响 若用稀硫酸和稀Ba(OH)2溶液测定中和反应反应热,会对结果产生什么影响
[答案] 提示:浓硫酸溶于水时放热,则生成1 mol H2O时放出的热量偏大;弱酸、弱碱电离吸热,则生成1 mol H2O时放出的热量偏小;若用稀硫酸和稀Ba(OH)2溶液测定中和反应反应热,生成BaSO4沉淀还会多放出一部分热量,则生成1 mol H2O时放出的热量偏大。
例1 [2023·重庆江津中学阶段考] 利用如图所示装置测定中和反
应反应热的实验步骤如下:
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入量热计的内筒,测出盐
酸温度,用水将温度计上的酸冲洗干净,擦干备用;
②用另一个量筒量取50 mL 0.55 mol·L-1 NaOH溶液,用温度计测出其温度;
③将NaOH溶液分多次缓慢倒入量热计的内筒中,搅拌使之混合均匀,测得混合液的最高温度;
④重复测量2~3次,准确记录数据。 回答下列问题:
(1)上述步骤中有一处错误: 。
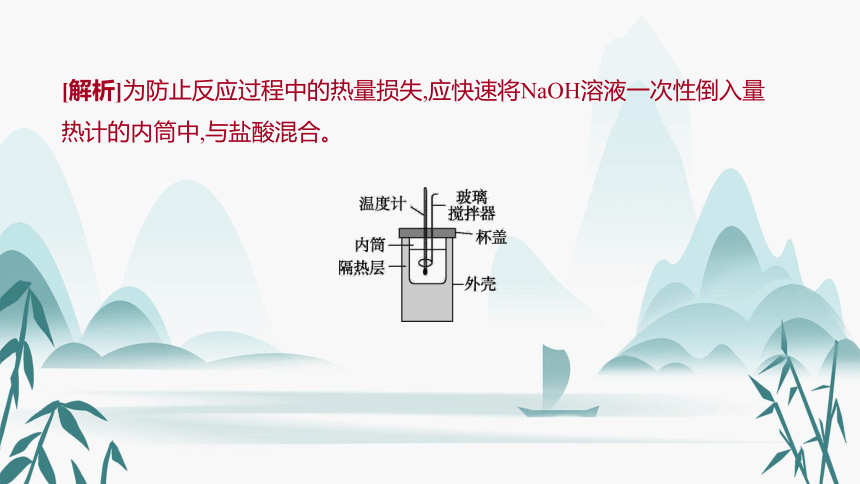
NaOH溶液分多次缓慢倒入量热计的内筒中
[解析]为防止反应过程中的热量损失,应快速将NaOH溶液一次性倒入量热计的内筒中,与盐酸混合。
(2) (填“能”或“不能”)用相同形状的细铁丝代替玻璃搅拌
器,理由是 。
(3)现将一定量的稀氢氧化钾溶液、稀氢氧化钙溶液、稀氨
水分别和1 L 1 mol·L-1稀盐酸恰好完全反应,其放出的热量分
别为Q1、Q2、Q3,则Q1、Q2、Q3的大小关系为 。
不能
[解析] (2)因为铁与盐酸反应且铁丝导热快,影响测量结果,因此不能用相同形状的细铁丝代替玻璃搅拌器。
(3)氢氧化钾与氢氧化钙均是强碱,完全电离,一水合氨为弱碱,反应过程中还会继续电离,电离过程吸热,因此稀氨水与稀盐酸反应放出的热量少,故可得出Q1=Q2>Q3。
Q1=Q2>Q3
铁与盐酸反应且铁丝导热快,影响测量结果
(4)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和反应反应热,某学生的实验记录数据如下表:
依据实验数据,生成1 mol H2O(l)时,该实验测得的中和反应放出的热量为
kJ。
实验序号 起始温度/℃ 终止温度/℃
盐酸 氢氧化钠溶液 混合溶液
1 20.0 20.1 23.2
2 20.2 20.4 23.4
52.25
[解析]实验1的温度差为23.2 ℃-=3.15 ℃,实验2的温度差为23.4 ℃-=3.1 ℃,故平均温度差值为3.125 ℃,生成1 mol H2O(l)时,放出的热量为=52.25 kJ。
实验序号 起始温度/℃ 终止温度/℃
盐酸 氢氧化钠溶液 混合溶液
1 20.0 20.1 23.2
2 20.2 20.4 23.4
(5)上述实验结果与57.3 kJ有偏差,产生偏差的原因不可能为 (填序号)。
①实验装置保温、隔热效果差
②用量筒量取盐酸体积时仰视读数
③分多次把NaOH溶液倒入内筒中
④测量稀盐酸的温度计未洗净直接测定NaOH溶液的温度
[解析]题述实验中测定生成1 mol H2O(l)时放出的热量为52.25 kJ,比理论数值57.3 kJ小。
①实验装置保温、隔热效果差,造成热量损失,故不符合题意;
②用量筒量取盐酸体积时仰视读数,造成量取的盐酸体积偏大,反应生成的水偏多,放出的热量偏多,故符合题意;
②
(5)上述实验结果与57.3 kJ有偏差,产生偏差的原因不可能为 (填序号)。
①实验装置保温、隔热效果差
②用量筒量取盐酸体积时仰视读数
③分多次把NaOH溶液倒入内筒中
④测量稀盐酸的温度计未洗净直接测定NaOH溶液的温度
③分多次把NaOH溶液倒入内筒中,造成热量损失,故不符合题意;
④测量稀盐酸的温度计未洗净直接测定NaOH溶液的温度,造成反应前体系的温度偏大,温度差偏小,则测定生成1 mol H2O(l)时放出的热量偏小,故不符合题意。
②
[归纳小结]测定中和反应反应热的实验中需要注意的问题
(1)所用装置要尽可能做到保温、隔热;实验操作时动作要快,尽量减少热量的损失。
(2)所用溶液的配制必须准确,且浓度要小;为保证盐酸完全被中和,采用稍过量的NaOH溶液。
(3)实验中所用的盐酸和氢氧化钠溶液配好后要充分冷却至室温,才能使用。
(4)要使用同一支温度计,温度计读数要尽可能准确;水银球部位一定要完全浸没在溶液中,且要读取混合后的最高温度。
(5)可采用多次测量取平均值的方法,减小实验误差。
1.焓与化学反应产生反应热的原因
化学反应前后体系的 发生了变化。内能受 、 和物质的 等影响。
2.焓变
在 条件下进行的化学反应,其反应热等于反应的焓变。符号为 ,单位是 。
学习任务二 反应热与焓变
内能
温度
压强
聚集状态
等压
ΔH
kJ·mol-1
3.ΔH的正、负规定
(1)当反应体系放热时其焓 ,ΔH为 ,即ΔH 0。
(2)当反应体系吸热时其焓 ,ΔH为 ,即ΔH 0。
减小
负值
<
增大
正值
>
4. 微观角度认识反应热实质
(1)实例:以H2(g)+Cl2(g) =2HCl(g)(25 ℃、101 kPa下)的能量变化为例,填写下表中的空白。
化学键 反应中能量变化
1 mol A—B化学键 反应中能量变化
H—H 吸收 kJ 共吸收 kJ
Cl—Cl 吸收 kJ
H—Cl 放出 kJ 共放出 kJ
结论 H2(g)+Cl2(g) =2HCl(g)的反应热ΔH=
436
243
679
431
862
-183 kJ·mol-1
(2)结论: 时的能
量变化是化学反应中能量变化的主要
原因。
化学键断裂和形成
【核心知识讲解】
1.从两个角度理解吸热反应和放热反应
(1)从反应物和生成物焓(H)的变化角度理解
(2)从化学键角度理解
键能是指气态分子中1 mol化学键解离成气态原子所吸收的能量。ΔH=反应物的键能总和-生成物的键能总和。
[注意] ①化学键的断裂和形成是化学反应中能量变化的主要原因。
②物质具有的能量越低,该物质越稳定,断开物质内部的化学键就越难,其键能就越大。
2.常见的吸热反应和放热反应
(1)常见的吸热反应:大多数的分解反应、Ba(OH)2·8H2O与NH4Cl的反应、盐酸与碳酸氢钠的反应、C与CO2的反应等。
(2)常见的放热反应:大多数的化合反应、酸碱中和反应、活泼金属与水的反应、较活泼金属与酸的反应、所有的燃烧反应、铝热反应、物质的缓慢氧化等。
例2 [2022·河南名校联盟阶段测试] 合成氨是放热反应,H2与N2发生反应的过程用简化模型图表示如下(“—”表示化学键)。下列说法正确的是 ( )
A.过程Ⅰ是吸热反应
B.该反应中断裂旧化学键放出的能量比形成新化学键吸收的能量高
C.过程Ⅲ为放热过程
D.因该反应过程中的共价键数目增多,故是放热反应
C
[解析] 过程Ⅰ中分子的化学键断裂形成原子,要吸收能量,因此该过程属于吸热过程,但没有化学键的形成,因此不是吸热反应,A错误;
合成氨是放热反应,故反应过程断裂旧化学键吸收的能量比形成新化学键放出的能量低,B错误;
过程Ⅲ为原子结合形成新化学键的过程,是放热过程,C正确;
不同共价键断裂时吸收的能量不同,故不能用共价键数目的增多来判断反应是放热反应还是吸热反应,D错误。
例3 (1)如图是1 mol NO2(g)和1 mol CO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,该反应的焓变ΔH= kJ·mol-1。
-234
[解析]由题图可知,1 mol NO2(g)和1 mol
CO(g)反应生成CO2(g)和NO(g)放出的热
量为368 kJ-134 kJ=234 kJ,则该反应的焓
变ΔH=-234 kJ·mol-1。
(2)下表是部分化学键的键能数据:
已知1 mol P4(g)完全燃烧生成P4O10(g)放出的热量为d kJ,P4和P4O10的结构如图所示,则上表中x= (用含有a、b、c、d的代数式表示)。
(d+6a+5c-12b)
[解析] P4燃烧的化学方程式为P4(g)+5O2(g) =P4O10(g),1 mol P4完全燃烧需拆开6 mol P—P、5 mol O =O,形成12 mol P—O、4 mol P =O,所以(6 mol×a kJ·mol-1+5 mol×c kJ·mol-1)-12 mol×b kJ·mol-1-4 mol×x kJ·mol-1=-d kJ·mol-1,则x=(d+6a+5c-12b)。
化学键 P—P P—O O =O P =O
键能/ (kJ·mol-1) a b c x
1. 判断正误(正确的打“√”,错误的打“×”)。
(1)所有的化学反应都伴有能量的变化 ( )
(2)在一个化学反应中,当反应物总焓大于生成物的总焓时,反应放热, ΔH为负值 ( )
(3)中和反应反应热的测定实验中,应将50 mL 0.55 mol·L-1 NaOH溶液分多次倒入量热计的内筒( )
(4)石墨转化为金刚石需要吸收能量,所以石墨更稳定 ( )
(5)浓硫酸与NaOH溶液反应生成1 mol H2O(l),放出的热量为57.3 kJ ( )
(6)中和反应反应热的测定实验中,测定盐酸后的温度计没有冲洗干净,立即测NaOH溶液的温度 ( )
√
√
×
√
×
×
2.某同学设计如图所示实验,探究反应中的能量变化。
下列判断正确的是 ( )
A.由实验可知,甲、乙、丙所涉及的反应都是放热反应
B.将实验甲中的铝片更换为等质量的铝粉后释放出的热量有所增加
C.实验丙中将玻璃搅拌器改为铁质搅拌器对实验结果没有影响
D.若用NaOH固体测定中和反应反应热,则生成1 mol H2O时放出的热量偏高
D
[解析] Ba(OH)2·8H2O与NH4Cl的反应属于吸热反应,铝片与盐酸、NaOH溶液与盐酸的反应属于放热反应,A错误;
铝粉和铝片都是固体,更换为等质量的铝粉后放出的热量不变,但铝粉与盐酸反应速率加快,B错误;
铁是热的良导体,改为铁质搅拌器,造成热量损失增大,误差大,C错误;
氢氧化钠固体溶解放出热量,因此生成1 mol H2O时,放出热量偏多,D正确。
3.化学反应N2(g)+3H2(g) 2NH3(g)的
能量变化如图所示:
已知断裂1 mol N≡N、1 mol N—H分
别需吸收946 kJ、391 kJ的能量,
试回答下列问题:
(1)该反应为 (填“吸热”或“放热”)反应。
(2)拆开1 mol H2中化学键所需能量为 kJ。
(3)该反应的反应热ΔH= 。
放热
436
-92 kJ·mol-1
第一章第一节 反应热
人教版(2019)高中化学选择性必修1课件
学习目标 素养目标
1.通过定量分析化学变化的热效应的教学,掌握反应热、内能、焓的概念,知道吸热反应、放热反应与焓变的关系。 2.通过宏观与微观、定性与定量等角度对物质变化中的能量转化进行分析和表征,理解反应热与键能的关系,能利用键能计算化学反应的反应热,能用热化学方程式表示反应中的能量变化。 【变化观念与平衡思想】 认识化学反应的本质是有新物质生成,并伴有能量的转化;能多角度、动态地分析热化学方程式,运用热化学反应原理解决实际问题。
【证据推理与模型认知】 在合作完成中和反应反应热测定的基础上,能正确搜集实验证据,建立中和反应反应热计算模型。
学习目标 素养目标
3.通过中和反应反应热测定的实验教学,能利用实验数据计算中和反应反应热,能对实验中的“异常”现象作出合理解释 【科学态度与社会责任】 能根据燃料的品质,提出物质在生产、生活和科学技术等方面应用的建议和意见;尊重科学伦理道德,能依据“绿色化学”思想和科学伦理对某一个化学过程进行分析,权衡利弊,作出合理的决策
1. 体系与环境
研究反应热时,首先需要明确体系和环境。如盐酸和NaOH溶液之间的反应,可将试管中的盐酸、NaOH溶液及发生的反应等看作一个反应体系,简称
(又称系统);与体系相互影响的其他部分,如盛溶液的试管和溶液之外的空气等看作 。
2.反应热
在 条件下,化学反应体系向环境 或从环境 的热量,称为化学反应的热效应,简称反应热。
学习任务一 反应热及其测定
体系
环境
等温
释放
吸收
3.中和反应反应热的测定
(1)仪器: 。
(2)原理:根据体系的 和有关物质的 等来计算反应热。
(3)实验装置及作用(如图所示)
简易量热计
温度变化
比热容
(4)实验测量数据
①反应前体系温度(t1)的测量
用一个量筒量取50 mL 0.50 mol·L-1盐酸,打开杯盖,倒入量热计的内筒,盖上杯盖,插入温度计,测量并记录盐酸的温度。用水把温度计上的酸冲洗干净,擦干备用;用另一个量筒量取50 mL 0.55 mol·L-1 NaOH溶液,用温度计测量并记录NaOH溶液的温度,取两温度平均值为t1。
②反应后体系温度(t2)的测量
打开杯盖,将量筒中的NaOH溶液迅速倒入量热计的内筒,立即盖上杯盖,插入温度计,用搅拌器匀速搅拌。准确读取混合溶液的 ,记录为t2。
最高温度
③重复实验操作,记录每次的实验数据,取测量所得温度差(t2-t1)的平均值作为计算依据。
④实验数据处理
盐酸、氢氧化钠溶液为稀溶液,其密度近似地认为都是1 g·cm-3,反应后生成溶液的比热容c=4.18 J·(g· ℃)-1。
该实验中盐酸和NaOH溶液反应放出的热量是 。生成1 mol
H2O时放出的热量为 。
0.418(t2-t1) kJ
kJ
[问题思考]
(1)若用0.55 mol·L-1 KOH溶液代替0.55 mol·L-1 NaOH 溶液,会对结果产生影响吗 为什么
[答案] 提示:无影响。因为强酸、强碱的稀溶液反应生成1 mol H2O(l)时放出的热量是相同的,与用KOH溶液还是NaOH 溶液以及酸碱的用量无关。
(2)用浓硫酸代替盐酸会对结果产生什么影响 用醋酸代替盐酸会对结果产生什么影响 若用稀硫酸和稀Ba(OH)2溶液测定中和反应反应热,会对结果产生什么影响
[答案] 提示:浓硫酸溶于水时放热,则生成1 mol H2O时放出的热量偏大;弱酸、弱碱电离吸热,则生成1 mol H2O时放出的热量偏小;若用稀硫酸和稀Ba(OH)2溶液测定中和反应反应热,生成BaSO4沉淀还会多放出一部分热量,则生成1 mol H2O时放出的热量偏大。
例1 [2023·重庆江津中学阶段考] 利用如图所示装置测定中和反
应反应热的实验步骤如下:
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入量热计的内筒,测出盐
酸温度,用水将温度计上的酸冲洗干净,擦干备用;
②用另一个量筒量取50 mL 0.55 mol·L-1 NaOH溶液,用温度计测出其温度;
③将NaOH溶液分多次缓慢倒入量热计的内筒中,搅拌使之混合均匀,测得混合液的最高温度;
④重复测量2~3次,准确记录数据。 回答下列问题:
(1)上述步骤中有一处错误: 。
NaOH溶液分多次缓慢倒入量热计的内筒中
[解析]为防止反应过程中的热量损失,应快速将NaOH溶液一次性倒入量热计的内筒中,与盐酸混合。
(2) (填“能”或“不能”)用相同形状的细铁丝代替玻璃搅拌
器,理由是 。
(3)现将一定量的稀氢氧化钾溶液、稀氢氧化钙溶液、稀氨
水分别和1 L 1 mol·L-1稀盐酸恰好完全反应,其放出的热量分
别为Q1、Q2、Q3,则Q1、Q2、Q3的大小关系为 。
不能
[解析] (2)因为铁与盐酸反应且铁丝导热快,影响测量结果,因此不能用相同形状的细铁丝代替玻璃搅拌器。
(3)氢氧化钾与氢氧化钙均是强碱,完全电离,一水合氨为弱碱,反应过程中还会继续电离,电离过程吸热,因此稀氨水与稀盐酸反应放出的热量少,故可得出Q1=Q2>Q3。
Q1=Q2>Q3
铁与盐酸反应且铁丝导热快,影响测量结果
(4)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和反应反应热,某学生的实验记录数据如下表:
依据实验数据,生成1 mol H2O(l)时,该实验测得的中和反应放出的热量为
kJ。
实验序号 起始温度/℃ 终止温度/℃
盐酸 氢氧化钠溶液 混合溶液
1 20.0 20.1 23.2
2 20.2 20.4 23.4
52.25
[解析]实验1的温度差为23.2 ℃-=3.15 ℃,实验2的温度差为23.4 ℃-=3.1 ℃,故平均温度差值为3.125 ℃,生成1 mol H2O(l)时,放出的热量为=52.25 kJ。
实验序号 起始温度/℃ 终止温度/℃
盐酸 氢氧化钠溶液 混合溶液
1 20.0 20.1 23.2
2 20.2 20.4 23.4
(5)上述实验结果与57.3 kJ有偏差,产生偏差的原因不可能为 (填序号)。
①实验装置保温、隔热效果差
②用量筒量取盐酸体积时仰视读数
③分多次把NaOH溶液倒入内筒中
④测量稀盐酸的温度计未洗净直接测定NaOH溶液的温度
[解析]题述实验中测定生成1 mol H2O(l)时放出的热量为52.25 kJ,比理论数值57.3 kJ小。
①实验装置保温、隔热效果差,造成热量损失,故不符合题意;
②用量筒量取盐酸体积时仰视读数,造成量取的盐酸体积偏大,反应生成的水偏多,放出的热量偏多,故符合题意;
②
(5)上述实验结果与57.3 kJ有偏差,产生偏差的原因不可能为 (填序号)。
①实验装置保温、隔热效果差
②用量筒量取盐酸体积时仰视读数
③分多次把NaOH溶液倒入内筒中
④测量稀盐酸的温度计未洗净直接测定NaOH溶液的温度
③分多次把NaOH溶液倒入内筒中,造成热量损失,故不符合题意;
④测量稀盐酸的温度计未洗净直接测定NaOH溶液的温度,造成反应前体系的温度偏大,温度差偏小,则测定生成1 mol H2O(l)时放出的热量偏小,故不符合题意。
②
[归纳小结]测定中和反应反应热的实验中需要注意的问题
(1)所用装置要尽可能做到保温、隔热;实验操作时动作要快,尽量减少热量的损失。
(2)所用溶液的配制必须准确,且浓度要小;为保证盐酸完全被中和,采用稍过量的NaOH溶液。
(3)实验中所用的盐酸和氢氧化钠溶液配好后要充分冷却至室温,才能使用。
(4)要使用同一支温度计,温度计读数要尽可能准确;水银球部位一定要完全浸没在溶液中,且要读取混合后的最高温度。
(5)可采用多次测量取平均值的方法,减小实验误差。
1.焓与化学反应产生反应热的原因
化学反应前后体系的 发生了变化。内能受 、 和物质的 等影响。
2.焓变
在 条件下进行的化学反应,其反应热等于反应的焓变。符号为 ,单位是 。
学习任务二 反应热与焓变
内能
温度
压强
聚集状态
等压
ΔH
kJ·mol-1
3.ΔH的正、负规定
(1)当反应体系放热时其焓 ,ΔH为 ,即ΔH 0。
(2)当反应体系吸热时其焓 ,ΔH为 ,即ΔH 0。
减小
负值
<
增大
正值
>
4. 微观角度认识反应热实质
(1)实例:以H2(g)+Cl2(g) =2HCl(g)(25 ℃、101 kPa下)的能量变化为例,填写下表中的空白。
化学键 反应中能量变化
1 mol A—B化学键 反应中能量变化
H—H 吸收 kJ 共吸收 kJ
Cl—Cl 吸收 kJ
H—Cl 放出 kJ 共放出 kJ
结论 H2(g)+Cl2(g) =2HCl(g)的反应热ΔH=
436
243
679
431
862
-183 kJ·mol-1
(2)结论: 时的能
量变化是化学反应中能量变化的主要
原因。
化学键断裂和形成
【核心知识讲解】
1.从两个角度理解吸热反应和放热反应
(1)从反应物和生成物焓(H)的变化角度理解
(2)从化学键角度理解
键能是指气态分子中1 mol化学键解离成气态原子所吸收的能量。ΔH=反应物的键能总和-生成物的键能总和。
[注意] ①化学键的断裂和形成是化学反应中能量变化的主要原因。
②物质具有的能量越低,该物质越稳定,断开物质内部的化学键就越难,其键能就越大。
2.常见的吸热反应和放热反应
(1)常见的吸热反应:大多数的分解反应、Ba(OH)2·8H2O与NH4Cl的反应、盐酸与碳酸氢钠的反应、C与CO2的反应等。
(2)常见的放热反应:大多数的化合反应、酸碱中和反应、活泼金属与水的反应、较活泼金属与酸的反应、所有的燃烧反应、铝热反应、物质的缓慢氧化等。
例2 [2022·河南名校联盟阶段测试] 合成氨是放热反应,H2与N2发生反应的过程用简化模型图表示如下(“—”表示化学键)。下列说法正确的是 ( )
A.过程Ⅰ是吸热反应
B.该反应中断裂旧化学键放出的能量比形成新化学键吸收的能量高
C.过程Ⅲ为放热过程
D.因该反应过程中的共价键数目增多,故是放热反应
C
[解析] 过程Ⅰ中分子的化学键断裂形成原子,要吸收能量,因此该过程属于吸热过程,但没有化学键的形成,因此不是吸热反应,A错误;
合成氨是放热反应,故反应过程断裂旧化学键吸收的能量比形成新化学键放出的能量低,B错误;
过程Ⅲ为原子结合形成新化学键的过程,是放热过程,C正确;
不同共价键断裂时吸收的能量不同,故不能用共价键数目的增多来判断反应是放热反应还是吸热反应,D错误。
例3 (1)如图是1 mol NO2(g)和1 mol CO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,该反应的焓变ΔH= kJ·mol-1。
-234
[解析]由题图可知,1 mol NO2(g)和1 mol
CO(g)反应生成CO2(g)和NO(g)放出的热
量为368 kJ-134 kJ=234 kJ,则该反应的焓
变ΔH=-234 kJ·mol-1。
(2)下表是部分化学键的键能数据:
已知1 mol P4(g)完全燃烧生成P4O10(g)放出的热量为d kJ,P4和P4O10的结构如图所示,则上表中x= (用含有a、b、c、d的代数式表示)。
(d+6a+5c-12b)
[解析] P4燃烧的化学方程式为P4(g)+5O2(g) =P4O10(g),1 mol P4完全燃烧需拆开6 mol P—P、5 mol O =O,形成12 mol P—O、4 mol P =O,所以(6 mol×a kJ·mol-1+5 mol×c kJ·mol-1)-12 mol×b kJ·mol-1-4 mol×x kJ·mol-1=-d kJ·mol-1,则x=(d+6a+5c-12b)。
化学键 P—P P—O O =O P =O
键能/ (kJ·mol-1) a b c x
1. 判断正误(正确的打“√”,错误的打“×”)。
(1)所有的化学反应都伴有能量的变化 ( )
(2)在一个化学反应中,当反应物总焓大于生成物的总焓时,反应放热, ΔH为负值 ( )
(3)中和反应反应热的测定实验中,应将50 mL 0.55 mol·L-1 NaOH溶液分多次倒入量热计的内筒( )
(4)石墨转化为金刚石需要吸收能量,所以石墨更稳定 ( )
(5)浓硫酸与NaOH溶液反应生成1 mol H2O(l),放出的热量为57.3 kJ ( )
(6)中和反应反应热的测定实验中,测定盐酸后的温度计没有冲洗干净,立即测NaOH溶液的温度 ( )
√
√
×
√
×
×
2.某同学设计如图所示实验,探究反应中的能量变化。
下列判断正确的是 ( )
A.由实验可知,甲、乙、丙所涉及的反应都是放热反应
B.将实验甲中的铝片更换为等质量的铝粉后释放出的热量有所增加
C.实验丙中将玻璃搅拌器改为铁质搅拌器对实验结果没有影响
D.若用NaOH固体测定中和反应反应热,则生成1 mol H2O时放出的热量偏高
D
[解析] Ba(OH)2·8H2O与NH4Cl的反应属于吸热反应,铝片与盐酸、NaOH溶液与盐酸的反应属于放热反应,A错误;
铝粉和铝片都是固体,更换为等质量的铝粉后放出的热量不变,但铝粉与盐酸反应速率加快,B错误;
铁是热的良导体,改为铁质搅拌器,造成热量损失增大,误差大,C错误;
氢氧化钠固体溶解放出热量,因此生成1 mol H2O时,放出热量偏多,D正确。
3.化学反应N2(g)+3H2(g) 2NH3(g)的
能量变化如图所示:
已知断裂1 mol N≡N、1 mol N—H分
别需吸收946 kJ、391 kJ的能量,
试回答下列问题:
(1)该反应为 (填“吸热”或“放热”)反应。
(2)拆开1 mol H2中化学键所需能量为 kJ。
(3)该反应的反应热ΔH= 。
放热
436
-92 kJ·mol-1
