1.1.2热化学方程式 燃烧热 课件(共24张PPT)2023—2024学年上学期高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 1.1.2热化学方程式 燃烧热 课件(共24张PPT)2023—2024学年上学期高二化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-16 22:32:33 | ||
图片预览








文档简介
(共24张PPT)
第一章第一节 反应热
人教版(2019)高中化学选择性必修1课件
第2课时 热化学方程式 燃烧热
1. 概念
表明反应所 的化学方程式。
2.意义
不仅表明了化学反应中的 变化,也表明了化学反应中的 变化。
如:2H2(g)+O2(g) =2H2O(l) ΔH=-571.6 kJ·mol-1,表示在25 ℃和101 kPa下,
气态H2和 气态O2反应生成 时放出
的热量。
学习任务一 热化学方程式
释放或吸收的热量
物质
能量
2 mol
1 mol
2 mol 液态 H2O
571.6 kJ
[问题思考]
比较①②两个方程式:
①H2+Cl2 2HCl
②25 ℃,101 kPa:H2(g)+Cl2(g) =2HCl(g) ΔH=-184.6 kJ·mol-1
(1)属于热化学方程式的是 (填序号)。
(2)热化学方程式与化学方程式相比较,不同之处为_______________________
__________________________________________________________________________________________________________________________________。
(3)热化学方程式中注明物质聚集状态的原因是__________________________
_____________________________。
②
①指明了反应时的温度和压强;②在化学方程式右边注明ΔH的“+”“-”及数值和单位;③所有反应物和生成物都在括号里注明它们在反应时的聚集状态
物质的聚集状态不同时,它们所具有的内能、焓也不同
1. 热化学方程式的书写要求及步骤
[注意]
①热化学方程式的右边不用标注“↑”“↓”。
②热化学方程式能反映该反应已完成的量。由于ΔH与反应物质的量有关,所以热化学方程式中物质的化学计量数必须与ΔH相对应,如果化学计量数加倍,则ΔH也要加倍。当反应向逆反应方向进行时,其反应热与正反应的反应热的数值相等,符号相反。
例1 根据所给信息完成下列热化学方程式,并回答有关问题:
(1)已知1 mol C(石墨,s)与适量H2O(g)完全反应生成CO(g)和H2(g),吸收131.3 kJ热量,请写出该反应的热化学方程式:
__________________________________________________ 。
C(石墨,s)+H2O(g) =CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
[解析]化学式相同的同素异形体除需标明聚集状态外还需标明其名称(因为结构不同,具有的能量不同),如金刚石应表示为“C(金刚石,s)”。
(2)1.7 g NH3(g)发生催化氧化反应生成气态产物,放出22.67 kJ的热量,其热化学方程式为____________________________________________________。
(3)25 ℃、101 kPa下,强酸、强碱的稀溶液发生中和反应生成1 mol H2O(l)时,放出57.3 kJ的热量,其热化学方程式可表示为
_________________________________________________。
NH3(g)+O2(g) = NO(g)+H2O(g) ΔH=-226.7 kJ·mol-1
[解析]1.7 g NH3的物质的量为0.1 mol,则1 mol NH3完全反应放出的热量为226.7 kJ。那么相应的热化学方程式为NH3(g)+O2(g) = NO(g)+H2O(g) ΔH=-226.7 kJ·mol-1。
H+(aq)+OH-(aq) =H2O(l) ΔH=-57.3 kJ·mol-1
[解析]该题注意正、逆反应焓变符号及化学计量数与ΔH的对应。可逆反应中的“ΔH”表示的是完全反应时对应的焓变值。若1 mol N2和3 mol H2在一定条件下反应,由于该反应是可逆反应,不能进行完全,放出的热量小于92 kJ。
(4)已知:N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ·mol-1,请写出1 mol NH3(g)分解对应的热化学方程式: _________________________________________。
若1 mol N2(g)和3 mol H2(g)在一定条件下发生反应,放出的热量________
(填“大于”“小于”或“等于”)92 kJ,理由是_______________________
___________________________________________。
NH3(g) N2(g)+ H2(g) ΔH=+46 kJ·mol-1
小于
该反应是可逆反应,不能进行完全,所以放出的热量小于92 kJ
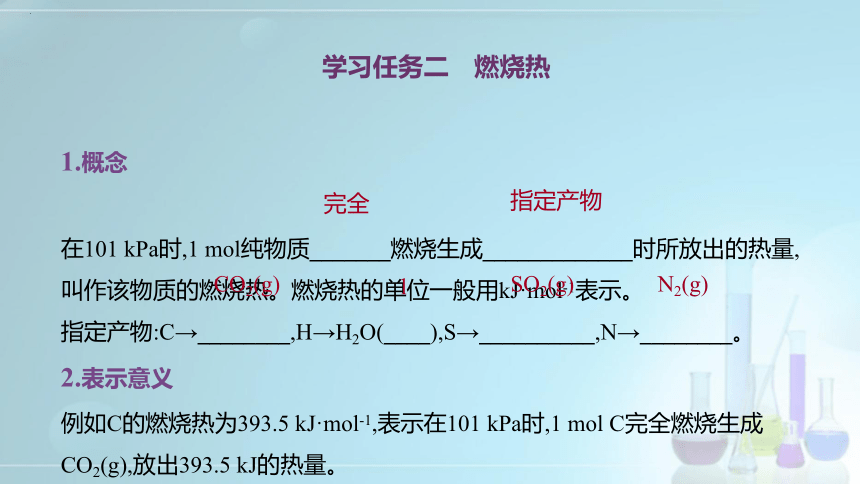
1.概念
在101 kPa时,1 mol纯物质_______燃烧生成_____________时所放出的热量,叫作该物质的燃烧热。燃烧热的单位一般用kJ·mol-1表示。
指定产物:C→________,H→H2O(____),S→__________,N→________。
2.表示意义
例如C的燃烧热为393.5 kJ·mol-1,表示在101 kPa时,1 mol C完全燃烧生成CO2(g),放出393.5 kJ的热量。
学习任务二 燃烧热
完全
指定产物
CO2(g)
l
SO2(g)
N2(g)
[问题思考]
已知H2(g)+O2(g)= H2O(g) ΔH=-241.8 kJ·mol-1,则氢气的燃烧热为
241.8 kJ·mol-1。这种说法是否正确
[答案]提示:不正确。因为H2O的状态为气态,不是指定产物。
1. 反应热与燃烧热的比较
反应热 燃烧热
概念 在等温条件下,化学反应体系向环境释放或从环境吸收的热量 101 kPa时,1 mol纯物质完全燃烧生成指定产物时所放出的热量
能量变化 放热或吸热 放热
ΔH 的大小 放热时,ΔH<0 吸热时,ΔH>0 ΔH<0
反应条件 等温 101 kPa
反应物的量 不限 1 mol纯物质
生成物的量 不限 不限
2. 燃烧热的表示
燃烧热是以1 mol物质完全燃烧生成指定产物所放出的热量来定义的,因此在书写燃烧热的热化学方程式时,应以1 mol物质为标准来配平其余物质的化学计量数。
如:C2H2(g)+O2(g) =2CO2(g)+H2O(l) ΔH=-1 299.6 kJ·mol-1,即C2H2 (g)的燃烧热为1 299.6 kJ·mol-1。
3.燃烧热的计算
可燃物完全燃烧放出的热量的计算方法为Q放=n(可燃物)×|ΔH|。
式中:Q放为可燃物燃烧反应放出的热量;
n为可燃物的物质的量;
ΔH为可燃物的燃烧热。
例2 已知碳的燃烧热为393.5 kJ·mol-1,氢气的燃烧热为285.8 kJ·mol-1,
一氧化碳的燃烧热为283.0 kJ·mol-1。某同学发现在灼热的煤炭上洒少量水,煤炉中会产生淡蓝色火焰,煤炭燃烧更旺。下列有关说法正确的是 ( )
A.氢气燃烧热的热化学方程式为H2(g)+ O2(g)= H2O(g) ΔH=+285.8kJ·mol-1
B.反应C(s)+ O2(g)= CO(g)的ΔH<-393.5 kJ·mol-1
C.“煤炭燃烧更旺”是因为少量固体碳与水反应生成了可燃性气体
D.C(s)+H2O(g)= CO(g)+H2(g) ΔH=+175.3 kJ·mol-1
C
[解析]氢气的燃烧热为285.8 kJ·mol-1,氢气燃烧热的热化学方程式为H2(g)+
O2(g) =H2O(l) ΔH=-285.8 kJ·mol-1,故A错误;
碳的燃烧热为393.5 kJ·mol-1,则C(s)+O2(g)= CO2(g) ΔH=-393.5 kJ·mol-1,
由于CO(g)燃烧生成CO2(g)放热,则反应C(s)+O2(g)= CO(g)的ΔH>
-393.5 kJ·mol-1,故B错误;
“煤炭燃烧更旺”是因为少量固体碳在高温下与水反应生成了可燃性气体H2和CO,故C正确;
由于反应H2(g)+O2(g) =H2O(g)的焓变未知,所以无法计算C(s)+H2O(g) =
CO(g)+H2(g)的焓变,故D错误。
例3 在25 ℃和101 kPa下,一定量的C2H2(g)在O2(g)中完全燃烧生成CO2(g)和H2O(l)时,放出热量a kJ,将产生的CO2全部通入足量澄清石灰水,所得沉淀
经过滤、洗涤、干燥后,称得其质量为10 g,则反应C2H2(g)+O2(g)= 2CO2(g)+H2O(l)的ΔH为 ( )
A.-20a kJ·mol-1 B.+20a kJ·mol-1 C.-10a kJ·mol-1 D.+10a kJ·mol-1
A
[解析]将产生的CO2全部通入足量澄清石灰水,所得沉淀经过滤、洗涤、干燥后,所得产物为碳酸钙固体,称得其质量为10 g,根据CO2~CaCO3,可知C2H2(g)完全燃烧生成二氧化碳的物质的量为0.1 mol,放出热量a kJ,由碳原子守恒可知有0.05 mol C2H2(g)参加反应,则1 mol C2H2(g)放出20a kJ热量,因此题中热化学方程式的ΔH为-20a kJ·mol-1。
[易错提醒] 燃烧热理解中的易错点
(1)反应条件:25 ℃和101 kPa(书中给出的燃烧热数值均为此条件下测得)。
(2)物质的燃烧热要求的是纯物质。
(3)特别注意:C→CO不是完全燃烧;S→SO3,SO3不是指定的燃烧产物;
H→H2O,生成的水是液态不能是气态。
(4)文字叙述燃烧热时,用正值或ΔH表示,例如,CH4的燃烧热为890.3 kJ·mol-1或ΔH=-890. 3 kJ·mol-1。
1. 判断正误(正确的打“√”,错误的打“×”)。
(1)热化学方程式中,化学计量数只代表物质的量,不代表分子数 ( )
(2)比较ΔH大小,只需比较数值,不用考虑正负号 ( )
(3)1 mol可燃物完全燃烧放出的热量就是该物质的燃烧热 ( )
(4)25 ℃、101 kPa下,1 mol氢气完全燃烧生成水蒸气时,放出241.8 kJ的热量,则氢气的燃烧热为241.8 kJ·mol-1 ( )
√
×
×
×
[解析]反应焓变的比较需要考虑正负号。
[解析]101 kPa时,1 mol可燃物完全燃烧生成指定产物所放出的热量才是该物质的燃烧热。
[解析]1 mol氢气完全燃烧生成液态水时,放出的热量为氢气的燃烧热。
随堂训练
(5)已知甲烷的燃烧热为890.3 kJ·mol-1,则表示甲烷燃烧热的热化学方程式为CH4(g)+2O2(g) =CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1( )
(6)对于可逆反应,热化学方程式后的ΔH代表前面的化学计量数对应物质的量的物质完全反应时的热效应( )
(7)若H2(g)+Cl2(g) =2HCl(g) ΔH=-184.6 kJ·mol-1,则2HCl(g) =H2(g)+Cl2(g) ΔH=+184.6 kJ·mol-1 ( )
√
√
√
2.下列说法正确的是 ( )
A.H+(aq)+OH-(aq)= H2O(l) ΔH=-57.3 kJ·mol-1,CH3COOH(aq)+OH-(aq)= H2O(l)+CH3COO-(aq) ΔH<-57.3 kJ·mol-1
B.甲烷燃烧热的热化学方程式为CH4(g)+2O2(g) =CO2(g)+2H2O(g) ΔH=
-890 kJ·mol-1
C.已知H2(g)+Br2(l)= 2HBr(g) ΔH=-72.8 kJ·mol-1,则H2(g)+Br2(g) =2HBr(g) ΔH<-72.8 kJ·mol-1
D.已知2C(s)+2O2(g) =2CO2(g) ΔH=a kJ·mol-1,2C(s)+O2(g) =2CO(g) ΔH=
b kJ·mol-1,则a>b
C
[解析]乙酸是弱酸,电离吸热,中和反应放出热量减少,ΔH>-57.3 kJ·mol-1,
A错误;
表示燃烧热的热化学方程式,应该生成液态水,B错误;
气态溴能量更高,反应放热更多,ΔH<-72.8 kJ·mol-1,C正确;
碳完全燃烧生成二氧化碳放出热量更多,ΔH为负值,放热越多,ΔH越小,
a3.能源是人类赖以生存和发展的重要物质基础,常规能源的合理利用和新能源的合理开发是当今社会面临的严峻课题,回答下列问题:
(1)我国是世界上少数以煤为主要燃料的国家,下列关于煤作燃料的论点正确的是_________(填字母)。
A.煤是重要的化工原料,把煤作燃料简单燃烧掉太可惜,应该综合利用
B.煤是发热量很高的固体燃料,我国煤炭资源相对集中,开采成本低,用煤作燃料实惠
C.煤燃烧时产生大量二氧化硫和烟尘,对环境污染严重
D.通过洁净煤技术,如煤的气化和液化,以及烟气脱硫,不仅减轻了燃煤污染,还能提高煤燃烧的热利用率
ACD
[解析]煤是一种化石燃料,也是重要的化工原料,属于不可再生能源,把煤作燃料简单燃烧掉是一种浪费,并且煤中所含的硫在燃烧时生成SO2,会对环境造成污染,通过洁净煤技术,如煤的气化和液化,以及烟气脱硫,不仅减轻了燃煤污染,还能提高煤燃烧的热利用率。
(2)某国科学家将铜和铁混合熔化制成多孔金属,用于制作太空火箭上使用的煤油燃料雾化器,该雾化器的作用是___________________________________
______________________。
(3)乙醇是未来内燃机的首选环保型液体燃料。2.0 g乙醇完全燃烧生成液态水放出59.42 kJ的热量,则乙醇完全燃烧的热化学方程式为
________________________________________________________________。
使煤油雾化,增大煤油与助燃剂的接触面积,提高燃烧效率
C2H5OH(l)+3O2(g) =2CO2(g)+3H2O(l) ΔH=-1 366.66 kJ·mol-1
[解析] 煤油雾化后可使煤油与助燃剂充分接触,提高燃烧效率。
[解析] 根据已知条件,1 mol乙醇完全燃烧放出的热量为59.42 kJ× =
1 366.66 kJ。
第一章第一节 反应热
人教版(2019)高中化学选择性必修1课件
第2课时 热化学方程式 燃烧热
1. 概念
表明反应所 的化学方程式。
2.意义
不仅表明了化学反应中的 变化,也表明了化学反应中的 变化。
如:2H2(g)+O2(g) =2H2O(l) ΔH=-571.6 kJ·mol-1,表示在25 ℃和101 kPa下,
气态H2和 气态O2反应生成 时放出
的热量。
学习任务一 热化学方程式
释放或吸收的热量
物质
能量
2 mol
1 mol
2 mol 液态 H2O
571.6 kJ
[问题思考]
比较①②两个方程式:
①H2+Cl2 2HCl
②25 ℃,101 kPa:H2(g)+Cl2(g) =2HCl(g) ΔH=-184.6 kJ·mol-1
(1)属于热化学方程式的是 (填序号)。
(2)热化学方程式与化学方程式相比较,不同之处为_______________________
__________________________________________________________________________________________________________________________________。
(3)热化学方程式中注明物质聚集状态的原因是__________________________
_____________________________。
②
①指明了反应时的温度和压强;②在化学方程式右边注明ΔH的“+”“-”及数值和单位;③所有反应物和生成物都在括号里注明它们在反应时的聚集状态
物质的聚集状态不同时,它们所具有的内能、焓也不同
1. 热化学方程式的书写要求及步骤
[注意]
①热化学方程式的右边不用标注“↑”“↓”。
②热化学方程式能反映该反应已完成的量。由于ΔH与反应物质的量有关,所以热化学方程式中物质的化学计量数必须与ΔH相对应,如果化学计量数加倍,则ΔH也要加倍。当反应向逆反应方向进行时,其反应热与正反应的反应热的数值相等,符号相反。
例1 根据所给信息完成下列热化学方程式,并回答有关问题:
(1)已知1 mol C(石墨,s)与适量H2O(g)完全反应生成CO(g)和H2(g),吸收131.3 kJ热量,请写出该反应的热化学方程式:
__________________________________________________ 。
C(石墨,s)+H2O(g) =CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
[解析]化学式相同的同素异形体除需标明聚集状态外还需标明其名称(因为结构不同,具有的能量不同),如金刚石应表示为“C(金刚石,s)”。
(2)1.7 g NH3(g)发生催化氧化反应生成气态产物,放出22.67 kJ的热量,其热化学方程式为____________________________________________________。
(3)25 ℃、101 kPa下,强酸、强碱的稀溶液发生中和反应生成1 mol H2O(l)时,放出57.3 kJ的热量,其热化学方程式可表示为
_________________________________________________。
NH3(g)+O2(g) = NO(g)+H2O(g) ΔH=-226.7 kJ·mol-1
[解析]1.7 g NH3的物质的量为0.1 mol,则1 mol NH3完全反应放出的热量为226.7 kJ。那么相应的热化学方程式为NH3(g)+O2(g) = NO(g)+H2O(g) ΔH=-226.7 kJ·mol-1。
H+(aq)+OH-(aq) =H2O(l) ΔH=-57.3 kJ·mol-1
[解析]该题注意正、逆反应焓变符号及化学计量数与ΔH的对应。可逆反应中的“ΔH”表示的是完全反应时对应的焓变值。若1 mol N2和3 mol H2在一定条件下反应,由于该反应是可逆反应,不能进行完全,放出的热量小于92 kJ。
(4)已知:N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ·mol-1,请写出1 mol NH3(g)分解对应的热化学方程式: _________________________________________。
若1 mol N2(g)和3 mol H2(g)在一定条件下发生反应,放出的热量________
(填“大于”“小于”或“等于”)92 kJ,理由是_______________________
___________________________________________。
NH3(g) N2(g)+ H2(g) ΔH=+46 kJ·mol-1
小于
该反应是可逆反应,不能进行完全,所以放出的热量小于92 kJ
1.概念
在101 kPa时,1 mol纯物质_______燃烧生成_____________时所放出的热量,叫作该物质的燃烧热。燃烧热的单位一般用kJ·mol-1表示。
指定产物:C→________,H→H2O(____),S→__________,N→________。
2.表示意义
例如C的燃烧热为393.5 kJ·mol-1,表示在101 kPa时,1 mol C完全燃烧生成CO2(g),放出393.5 kJ的热量。
学习任务二 燃烧热
完全
指定产物
CO2(g)
l
SO2(g)
N2(g)
[问题思考]
已知H2(g)+O2(g)= H2O(g) ΔH=-241.8 kJ·mol-1,则氢气的燃烧热为
241.8 kJ·mol-1。这种说法是否正确
[答案]提示:不正确。因为H2O的状态为气态,不是指定产物。
1. 反应热与燃烧热的比较
反应热 燃烧热
概念 在等温条件下,化学反应体系向环境释放或从环境吸收的热量 101 kPa时,1 mol纯物质完全燃烧生成指定产物时所放出的热量
能量变化 放热或吸热 放热
ΔH 的大小 放热时,ΔH<0 吸热时,ΔH>0 ΔH<0
反应条件 等温 101 kPa
反应物的量 不限 1 mol纯物质
生成物的量 不限 不限
2. 燃烧热的表示
燃烧热是以1 mol物质完全燃烧生成指定产物所放出的热量来定义的,因此在书写燃烧热的热化学方程式时,应以1 mol物质为标准来配平其余物质的化学计量数。
如:C2H2(g)+O2(g) =2CO2(g)+H2O(l) ΔH=-1 299.6 kJ·mol-1,即C2H2 (g)的燃烧热为1 299.6 kJ·mol-1。
3.燃烧热的计算
可燃物完全燃烧放出的热量的计算方法为Q放=n(可燃物)×|ΔH|。
式中:Q放为可燃物燃烧反应放出的热量;
n为可燃物的物质的量;
ΔH为可燃物的燃烧热。
例2 已知碳的燃烧热为393.5 kJ·mol-1,氢气的燃烧热为285.8 kJ·mol-1,
一氧化碳的燃烧热为283.0 kJ·mol-1。某同学发现在灼热的煤炭上洒少量水,煤炉中会产生淡蓝色火焰,煤炭燃烧更旺。下列有关说法正确的是 ( )
A.氢气燃烧热的热化学方程式为H2(g)+ O2(g)= H2O(g) ΔH=+285.8kJ·mol-1
B.反应C(s)+ O2(g)= CO(g)的ΔH<-393.5 kJ·mol-1
C.“煤炭燃烧更旺”是因为少量固体碳与水反应生成了可燃性气体
D.C(s)+H2O(g)= CO(g)+H2(g) ΔH=+175.3 kJ·mol-1
C
[解析]氢气的燃烧热为285.8 kJ·mol-1,氢气燃烧热的热化学方程式为H2(g)+
O2(g) =H2O(l) ΔH=-285.8 kJ·mol-1,故A错误;
碳的燃烧热为393.5 kJ·mol-1,则C(s)+O2(g)= CO2(g) ΔH=-393.5 kJ·mol-1,
由于CO(g)燃烧生成CO2(g)放热,则反应C(s)+O2(g)= CO(g)的ΔH>
-393.5 kJ·mol-1,故B错误;
“煤炭燃烧更旺”是因为少量固体碳在高温下与水反应生成了可燃性气体H2和CO,故C正确;
由于反应H2(g)+O2(g) =H2O(g)的焓变未知,所以无法计算C(s)+H2O(g) =
CO(g)+H2(g)的焓变,故D错误。
例3 在25 ℃和101 kPa下,一定量的C2H2(g)在O2(g)中完全燃烧生成CO2(g)和H2O(l)时,放出热量a kJ,将产生的CO2全部通入足量澄清石灰水,所得沉淀
经过滤、洗涤、干燥后,称得其质量为10 g,则反应C2H2(g)+O2(g)= 2CO2(g)+H2O(l)的ΔH为 ( )
A.-20a kJ·mol-1 B.+20a kJ·mol-1 C.-10a kJ·mol-1 D.+10a kJ·mol-1
A
[解析]将产生的CO2全部通入足量澄清石灰水,所得沉淀经过滤、洗涤、干燥后,所得产物为碳酸钙固体,称得其质量为10 g,根据CO2~CaCO3,可知C2H2(g)完全燃烧生成二氧化碳的物质的量为0.1 mol,放出热量a kJ,由碳原子守恒可知有0.05 mol C2H2(g)参加反应,则1 mol C2H2(g)放出20a kJ热量,因此题中热化学方程式的ΔH为-20a kJ·mol-1。
[易错提醒] 燃烧热理解中的易错点
(1)反应条件:25 ℃和101 kPa(书中给出的燃烧热数值均为此条件下测得)。
(2)物质的燃烧热要求的是纯物质。
(3)特别注意:C→CO不是完全燃烧;S→SO3,SO3不是指定的燃烧产物;
H→H2O,生成的水是液态不能是气态。
(4)文字叙述燃烧热时,用正值或ΔH表示,例如,CH4的燃烧热为890.3 kJ·mol-1或ΔH=-890. 3 kJ·mol-1。
1. 判断正误(正确的打“√”,错误的打“×”)。
(1)热化学方程式中,化学计量数只代表物质的量,不代表分子数 ( )
(2)比较ΔH大小,只需比较数值,不用考虑正负号 ( )
(3)1 mol可燃物完全燃烧放出的热量就是该物质的燃烧热 ( )
(4)25 ℃、101 kPa下,1 mol氢气完全燃烧生成水蒸气时,放出241.8 kJ的热量,则氢气的燃烧热为241.8 kJ·mol-1 ( )
√
×
×
×
[解析]反应焓变的比较需要考虑正负号。
[解析]101 kPa时,1 mol可燃物完全燃烧生成指定产物所放出的热量才是该物质的燃烧热。
[解析]1 mol氢气完全燃烧生成液态水时,放出的热量为氢气的燃烧热。
随堂训练
(5)已知甲烷的燃烧热为890.3 kJ·mol-1,则表示甲烷燃烧热的热化学方程式为CH4(g)+2O2(g) =CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1( )
(6)对于可逆反应,热化学方程式后的ΔH代表前面的化学计量数对应物质的量的物质完全反应时的热效应( )
(7)若H2(g)+Cl2(g) =2HCl(g) ΔH=-184.6 kJ·mol-1,则2HCl(g) =H2(g)+Cl2(g) ΔH=+184.6 kJ·mol-1 ( )
√
√
√
2.下列说法正确的是 ( )
A.H+(aq)+OH-(aq)= H2O(l) ΔH=-57.3 kJ·mol-1,CH3COOH(aq)+OH-(aq)= H2O(l)+CH3COO-(aq) ΔH<-57.3 kJ·mol-1
B.甲烷燃烧热的热化学方程式为CH4(g)+2O2(g) =CO2(g)+2H2O(g) ΔH=
-890 kJ·mol-1
C.已知H2(g)+Br2(l)= 2HBr(g) ΔH=-72.8 kJ·mol-1,则H2(g)+Br2(g) =2HBr(g) ΔH<-72.8 kJ·mol-1
D.已知2C(s)+2O2(g) =2CO2(g) ΔH=a kJ·mol-1,2C(s)+O2(g) =2CO(g) ΔH=
b kJ·mol-1,则a>b
C
[解析]乙酸是弱酸,电离吸热,中和反应放出热量减少,ΔH>-57.3 kJ·mol-1,
A错误;
表示燃烧热的热化学方程式,应该生成液态水,B错误;
气态溴能量更高,反应放热更多,ΔH<-72.8 kJ·mol-1,C正确;
碳完全燃烧生成二氧化碳放出热量更多,ΔH为负值,放热越多,ΔH越小,
a
(1)我国是世界上少数以煤为主要燃料的国家,下列关于煤作燃料的论点正确的是_________(填字母)。
A.煤是重要的化工原料,把煤作燃料简单燃烧掉太可惜,应该综合利用
B.煤是发热量很高的固体燃料,我国煤炭资源相对集中,开采成本低,用煤作燃料实惠
C.煤燃烧时产生大量二氧化硫和烟尘,对环境污染严重
D.通过洁净煤技术,如煤的气化和液化,以及烟气脱硫,不仅减轻了燃煤污染,还能提高煤燃烧的热利用率
ACD
[解析]煤是一种化石燃料,也是重要的化工原料,属于不可再生能源,把煤作燃料简单燃烧掉是一种浪费,并且煤中所含的硫在燃烧时生成SO2,会对环境造成污染,通过洁净煤技术,如煤的气化和液化,以及烟气脱硫,不仅减轻了燃煤污染,还能提高煤燃烧的热利用率。
(2)某国科学家将铜和铁混合熔化制成多孔金属,用于制作太空火箭上使用的煤油燃料雾化器,该雾化器的作用是___________________________________
______________________。
(3)乙醇是未来内燃机的首选环保型液体燃料。2.0 g乙醇完全燃烧生成液态水放出59.42 kJ的热量,则乙醇完全燃烧的热化学方程式为
________________________________________________________________。
使煤油雾化,增大煤油与助燃剂的接触面积,提高燃烧效率
C2H5OH(l)+3O2(g) =2CO2(g)+3H2O(l) ΔH=-1 366.66 kJ·mol-1
[解析] 煤油雾化后可使煤油与助燃剂充分接触,提高燃烧效率。
[解析] 根据已知条件,1 mol乙醇完全燃烧放出的热量为59.42 kJ× =
1 366.66 kJ。
