2023-2024学年人教版高中化学选择性必修一 4.2.1化学反应与电能——电解池 课件(共16张PPT)
文档属性
| 名称 | 2023-2024学年人教版高中化学选择性必修一 4.2.1化学反应与电能——电解池 课件(共16张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 875.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-17 10:18:35 | ||
图片预览






文档简介
(共16张PPT)
第四章 化学反应与电能
第二节 电解池
第1课时 电解原理
电解
2 H2O ==2 H2 ↑+ O2↑
_
+
学习目标:
1.通过对氯化铜溶液电解过程的分析,了解电解、电解池的概念,认识电解是电能转化为化学能的一种重要形式。
2.形成系统分析电解池的一般思路和方法,能初步设计简单的电解池。
3.初步了解在电解过程中,粒子的放电顺序与其氧化性、还原性的关系,能解释或推测电解反应的产物,并能用电极反应和总反应进行表征。
重点:电解原理电极反应的分析与表征。
难点:电解池思维模型的建构。
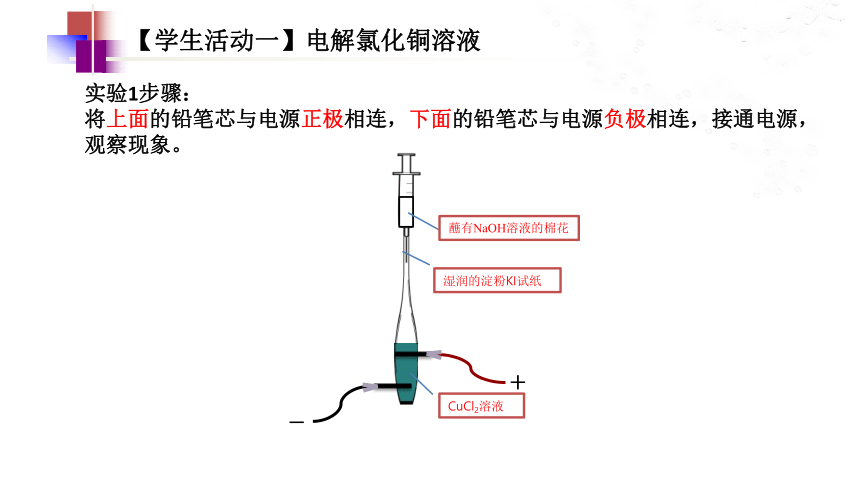
【学生活动一】电解氯化铜溶液
实验1步骤:
将上面的铅笔芯与电源正极相连,下面的铅笔芯与电源负极相连,接通电源,观察现象。
湿润的淀粉KI试纸
+
_
蘸有NaOH溶液的棉花
CuCl2溶液
【学生活动一】电解氯化铜溶液
实验现象及产物判断:
1.与负极相连的铅笔芯上有什么现象?说明生成了什么产物?
2.与正极相连的铅笔芯上和湿润的淀粉碘化钾试纸分别有什么现象?说明生成了什么产物?
1.根据反应产物写出两个电极上的反应式、判断反应类型(氧化反应或还原反应)、根据反应类型判断电极名称。
2.CuCl2溶液中的离子有哪些?通电后哪些离子移向阳极?哪些离子移向阴极?
评价活动1
3.根据电极反应式判断这些离子的氧化性或还原性强弱。
评价活动1
4.在电解CuCl2溶液的实验结束后,将两电极的连接相互交换,接通电源, 观察记录阳极上的现象。
请同学们依据以上所学完成电解池工作原理的示意图,并与同学交流。示意图要求包括以下内容:
(1)注明电解池的组成;
(2)标明氧化反应和还原反应发生的区域;
(3)标明电子的运动方向和阴离子、阳离子的迁移方向。
【学生活动二】绘制电解池工作原理示意图
1.若把电解质溶液改成熔融的NaCl,将其设计成电解池,试分析:
(1)熔融NaCl中含有哪几种离子?
(2)哪种离子可以在阴极得到电子发生还原反应?哪种离子可以在阳极失去电子发生氧化反应?
评价活动2
(3)分别写出两极的电极反应式和总反应式。
阴极:
阳极:
总反应式:
2.构成电解池的条件有哪些?
评价活动2
对比原电池和电解池的异同:
装置 电解池 原电池
电极名称 极 (与电源正极相连) 极 (与电源负极相连) 极 (电子流出的一极)
极
(电子流入的
一极)
反应类型
能量转化
反应本质
总结
阳
阴
化学能→电能
电能→化学能
氧化反应
还原反应
氧化反应
还原反应
负
正
自发的氧化还原反应
非自发的氧化还原反应
原电池
电解池
自发的氧化还原反应
非自发的氧化还原反应
区别
【当堂检测】
欲将下列两个反应设计成原电池或电解池(1)Zn+H2SO4= ZnSO4+H2↑,
(2)Cu+H2SO4= CuSO4+H2↑,试分别画出装置图,标出电子转移的方向和电极名称,指明是原电池还是电解池。
课后作业
1.查阅资料,了解电解池原理在工业上和生活中有哪些应用?
2.请用电解、电解池、化学能、电能、阴极、阳极、氧化反应、还原反应、氧化还原反应等概念名词绘制本节课的思维导图。
谢谢大家
再见
第四章 化学反应与电能
第二节 电解池
第1课时 电解原理
电解
2 H2O ==2 H2 ↑+ O2↑
_
+
学习目标:
1.通过对氯化铜溶液电解过程的分析,了解电解、电解池的概念,认识电解是电能转化为化学能的一种重要形式。
2.形成系统分析电解池的一般思路和方法,能初步设计简单的电解池。
3.初步了解在电解过程中,粒子的放电顺序与其氧化性、还原性的关系,能解释或推测电解反应的产物,并能用电极反应和总反应进行表征。
重点:电解原理电极反应的分析与表征。
难点:电解池思维模型的建构。
【学生活动一】电解氯化铜溶液
实验1步骤:
将上面的铅笔芯与电源正极相连,下面的铅笔芯与电源负极相连,接通电源,观察现象。
湿润的淀粉KI试纸
+
_
蘸有NaOH溶液的棉花
CuCl2溶液
【学生活动一】电解氯化铜溶液
实验现象及产物判断:
1.与负极相连的铅笔芯上有什么现象?说明生成了什么产物?
2.与正极相连的铅笔芯上和湿润的淀粉碘化钾试纸分别有什么现象?说明生成了什么产物?
1.根据反应产物写出两个电极上的反应式、判断反应类型(氧化反应或还原反应)、根据反应类型判断电极名称。
2.CuCl2溶液中的离子有哪些?通电后哪些离子移向阳极?哪些离子移向阴极?
评价活动1
3.根据电极反应式判断这些离子的氧化性或还原性强弱。
评价活动1
4.在电解CuCl2溶液的实验结束后,将两电极的连接相互交换,接通电源, 观察记录阳极上的现象。
请同学们依据以上所学完成电解池工作原理的示意图,并与同学交流。示意图要求包括以下内容:
(1)注明电解池的组成;
(2)标明氧化反应和还原反应发生的区域;
(3)标明电子的运动方向和阴离子、阳离子的迁移方向。
【学生活动二】绘制电解池工作原理示意图
1.若把电解质溶液改成熔融的NaCl,将其设计成电解池,试分析:
(1)熔融NaCl中含有哪几种离子?
(2)哪种离子可以在阴极得到电子发生还原反应?哪种离子可以在阳极失去电子发生氧化反应?
评价活动2
(3)分别写出两极的电极反应式和总反应式。
阴极:
阳极:
总反应式:
2.构成电解池的条件有哪些?
评价活动2
对比原电池和电解池的异同:
装置 电解池 原电池
电极名称 极 (与电源正极相连) 极 (与电源负极相连) 极 (电子流出的一极)
极
(电子流入的
一极)
反应类型
能量转化
反应本质
总结
阳
阴
化学能→电能
电能→化学能
氧化反应
还原反应
氧化反应
还原反应
负
正
自发的氧化还原反应
非自发的氧化还原反应
原电池
电解池
自发的氧化还原反应
非自发的氧化还原反应
区别
【当堂检测】
欲将下列两个反应设计成原电池或电解池(1)Zn+H2SO4= ZnSO4+H2↑,
(2)Cu+H2SO4= CuSO4+H2↑,试分别画出装置图,标出电子转移的方向和电极名称,指明是原电池还是电解池。
课后作业
1.查阅资料,了解电解池原理在工业上和生活中有哪些应用?
2.请用电解、电解池、化学能、电能、阴极、阳极、氧化反应、还原反应、氧化还原反应等概念名词绘制本节课的思维导图。
谢谢大家
再见
