2.2.2.氯气的实验室制法 氯离子的检验 课件(共35张PPT)2023-2024学年上学期高一化学人教版(2019)必修第一册
文档属性
| 名称 | 2.2.2.氯气的实验室制法 氯离子的检验 课件(共35张PPT)2023-2024学年上学期高一化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 15.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-17 12:11:15 | ||
图片预览






文档简介
(共35张PPT)
第二节 氯及其化合物
第2课时 氯气的实验室制法 氯离子的检验
君行一舟
新高考
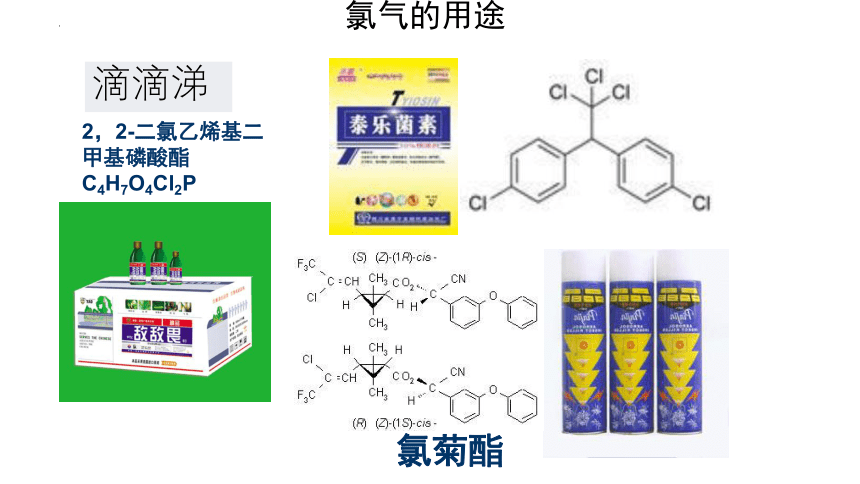
滴滴涕
氯菊酯
2,2-二氯乙烯基二甲基磷酸酯 C4H7O4Cl2P
氯气的用途
1、氯元素在自然界中以_________存在。
2、氯气由________发现的,由__________
确认的。此反应是实验室制取氯气的主
要方法之一,药品是______________ ,
反应原理为
__________________________________。
化合态
自然界中有没有游离态的氯 如果
没有,人们是怎样制得氯气的呢?
舍勒
戴维
软锰矿和浓盐酸
MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
△
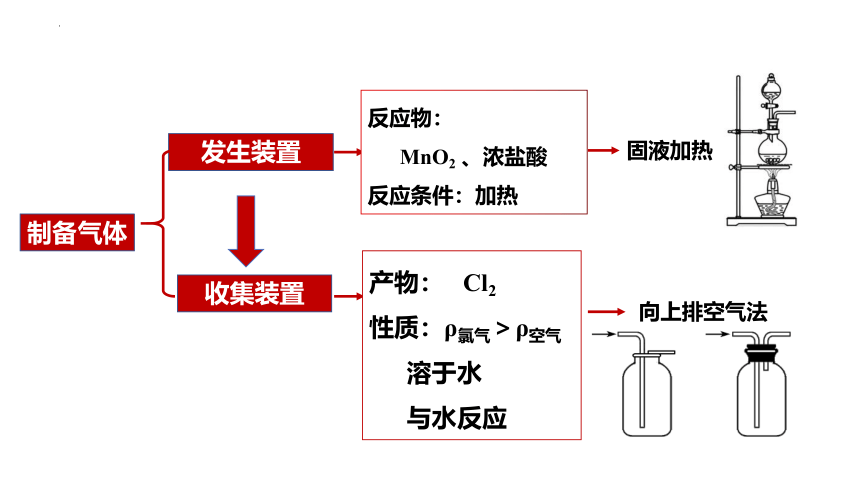
发生装置
收集装置
反应物:
MnO2 、浓盐酸
反应条件:加热
固液加热
产物: Cl2
性质:ρ氯气>ρ空气
溶于水
与水反应
向上排空气法
制备气体
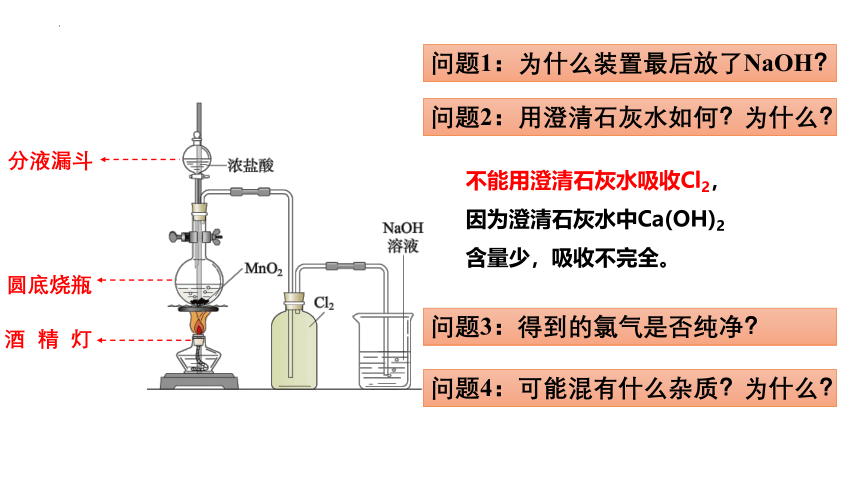
问题1:为什么装置最后放了NaOH?
问题3:得到的氯气是否纯净?
问题4:可能混有什么杂质?为什么?
问题2:用澄清石灰水如何?为什么?
不能用澄清石灰水吸收Cl2,
因为澄清石灰水中Ca(OH)2
含量少,吸收不完全。
分液漏斗
圆底烧瓶
酒 精 灯
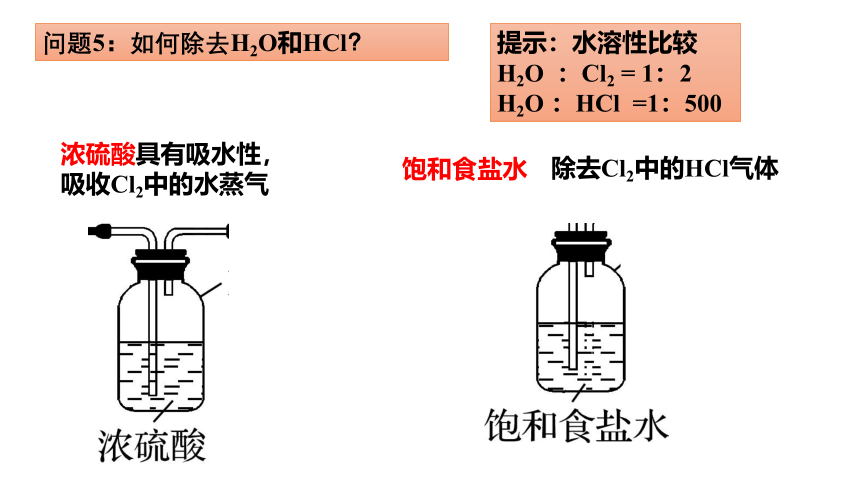
问题5:如何除去H2O和HCl?
提示:水溶性比较
H2O :Cl2 = 1:2
H2O :HCl =1:500
饱和食盐水
除去Cl2中的HCl气体
浓硫酸具有吸水性,吸收Cl2中的水蒸气
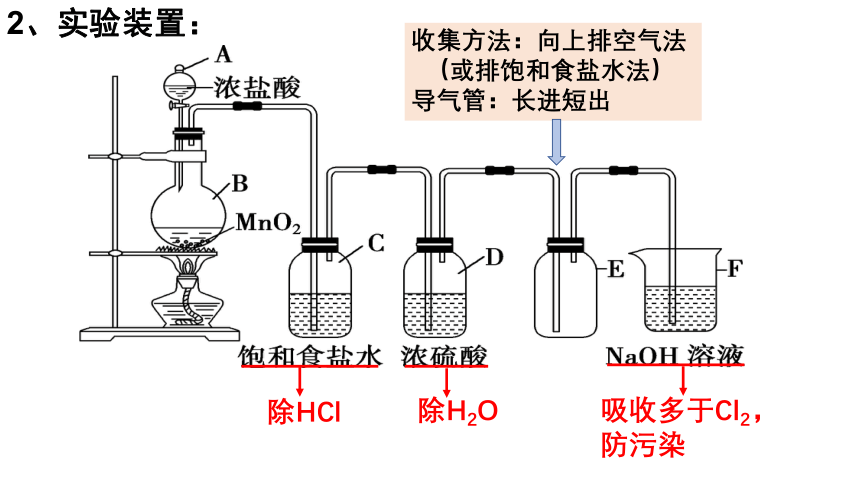
2、实验装置:
除HCl
除H2O
吸收多于Cl2,防污染
收集方法:向上排空气法
(或排饱和食盐水法)
导气管:长进短出
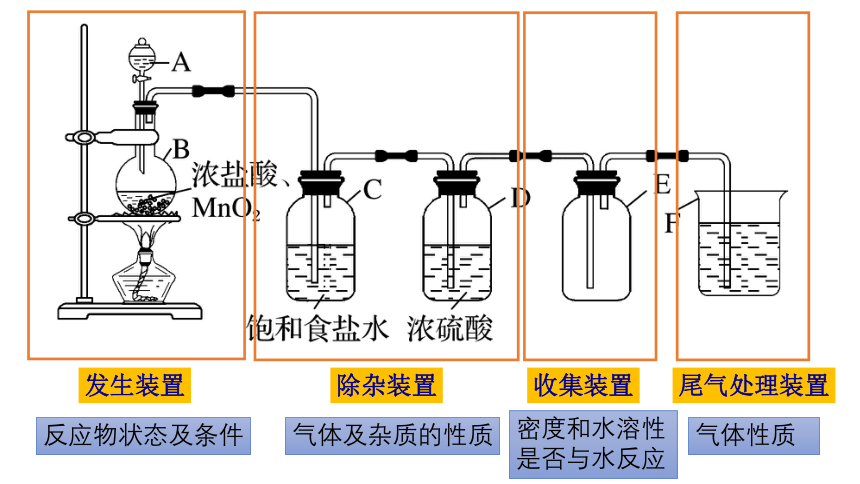
发生装置
除杂装置
收集装置
尾气处理装置
反应物状态及条件
气体及杂质的性质
密度和水溶性
是否与水反应
气体性质
验满方法
根据集气瓶内是否充满黄绿色气体来检验是否收集满。
将湿润的淀粉碘化钾试纸靠近盛Cl2的瓶口,观察到试纸立即变蓝,则证明已集满
Cl2+2KI=I2+2KCl
(3)将湿润的蓝色石蕊试纸靠近盛氯气的瓶口,观察到试纸立即发生先变红后褪色的变化, 则证明已集满。
注意事项:
①必须用浓盐酸,MnO2与稀盐酸不反应。
②加热温度不宜过高,减少HCl的挥发,得到更加纯净的Cl2。
③尾气吸收时,不能用澄清石灰水代替NaOH,因为澄清石灰水中的Ca(OH)2浓度小,吸收不完全。
④实验结束后,先使反应停止并排出残留的Cl2,再拆卸装置,避免污染空气。
其他氧化还原法制取氯气
1、高锰酸钾氧化浓盐酸(不需加热)
2、氯酸钾氧化浓盐酸(不需加热)
KClO3+ 6HCl(浓)===KCl + 3Cl2 + 3H2O
2KMnO4 + 16HCl(浓)===2KCl + 2MnCl2 + 5Cl2 + 8H2O
练习:某学生设计如下实验装置用于制备纯净的氯气。
装置中有六处错误,请指出。
1、烧瓶下面缺石棉网 2、铁圈下面缺酒精灯
3、原料使用了稀盐酸 4、不应使用长颈漏斗
5、盛浓硫酸的洗气瓶和盛饱和食盐水的洗气瓶位置颠倒了
6、洗气瓶D的气体入口导管应深插在液面下,而出口导管应靠近瓶塞
1、除去Cl2中少量的HCl气体,最好选用的试剂是( )
A.蒸馏水 B.二氧化锰
C.饱和食盐水 D.氢氧化钠溶液
C
C
1.下列关于实验室制氯气的说法中错误的是( )
A.该反应是一个氧化还原反应,其中二氧化锰是氧化剂
B.HCl表现还原性和酸性
C.该反应的离子方程式为MnO2+4H++4Cl- MnCl2+2H2O+Cl2↑
D.该方法是瑞典化学家舍勒最先发现的
课堂练习
C
2.在实验室利用浓盐酸和二氧化锰制氯气,制备装置中应使用分液漏斗而不能使用长颈漏斗,下列有关理由叙述错误的是( )
A.防止氯气扩散到空气中造成污染 B.便于控制加入盐酸的量
C.长颈漏斗便于添加液体 D.尽量避免氯化氢挥发到空气中
C
课堂练习
3. 某同学制备并检验Cl2的性质。下列说法正确的是( )
D
Ⅰ图中:如果MnO2过量,盐酸就可全部消耗
Ⅱ图中:如果倒置的量筒充满了氯气,水槽内装满水,经足够长的时间光照, 量筒内最后剩余气体为HCl和氧气
Ⅲ图中:生成蓝色的烟
Ⅳ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中至溶液呈酸性,结果有Cl2生成
4. 某化学小组用图示装置制取氯气,下列说法不正确的是( )
A.该装置图中至少存在两处明显错误
B.为了防止氯气污染空气,必须进行尾气处理
C.在集气瓶的导管口处放一片湿润的淀粉碘化钾
试纸,可以证明是否有氯气逸出
D.该实验中收集氯气的方法不正确
课堂练习
D
5. 在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。下列收集Cl2的正确装置是( )
C
课堂练习
6.下列关于氯气的实验装置能达到实验目的或实验效果的是( )
①可用于氯气的收集
②可用于除去氯气中
少量的氯化氢气体
③可证明氯气具有漂白性
④可用于实验室氯气的尾气吸收
A.①② B.①③ C.②③ D.①④
D
7. 实验室用下列两种方法制氯气:①用含HCl 146 g的浓盐酸与足量的MnO2反应;②用87 g MnO2与足量浓盐酸反应。所得的氯气( )
A.①比②多 B.②比①多 C.一样多 D.无法比较
B
氯气的实验室制法
拓展:氯气的工业制法
富集、分离提纯、转化
原料:海水
产品:氯气
氯碱工业:
电解熔融氯化钠:
2 NaCl + 2 H2O == Cl2 ↑ + H2 ↑ +2 NaOH
通电
2 NaCl (熔融)== Cl2 ↑ + 2 Na
通电
氯气的性质很活泼,能与很多金属反应生成盐,其中大多数盐能溶于水并电离出氯离子。
思考·讨论
有没有什么办法能检验物质中是否存在氯离子呢?
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
在三只试管中分别加入2~3mL稀盐酸、NaCl溶液、Na2CO3溶液,然后各滴入几滴AgNO3溶液,观察现象。再分别加入少量稀硝酸,观察现象。
实验
稀盐酸
NaCl溶液
Na2CO3溶液
AgNO3溶液
实验·探究
三、Cl-的检验
HCl
NaCl
Na2CO3
AgNO3溶液
AgNO3溶液
HNO3溶液
Cl- + Ag+ = AgCl↓
CO32- + 2Ag+ = Ag2CO3↓
Ag2CO3 + 2H+ = 2Ag+ + CO2↑ + H2O
都产生白色沉淀
HNO3溶液
AgNO3溶液
HNO3溶液
沉淀不溶解
沉淀溶解
思考:
(1)若在某无色溶液中加入AgNO3溶液,产生白色沉淀,则溶液中一定含有Cl-吗 为什么
不一定含Cl-, CO32- 与Ag+反应也生成白色沉淀。
(2)检验Cl-时为何要加入稀硝酸
防止 CO32- 等离子的干扰。
氯离子检验方法
方法1:先在待测液中加入稀HNO3酸化,排除CO32-的干扰,再滴入AgNO3溶液,若产生白色沉淀,则被测液中含有Cl-。
方法2:先在待测液中加入AgNO3,产生白色沉淀,再加入稀HNO3,沉淀不溶解,则被测液中含有Cl-。
化学与职业
水质检验员是指对天然水、工业用水、生活用水等的物理性质、化学性质及生物性质进行检验和评定的专业技术人员。水质检验的目的是考察和研究环境质量、水的污染性或水受污染的程度、水质是否适宜使用。以及水处理过程的效率等。自来水厂,污水处理厂,玻璃加工、制药、食品和化工企业等都需要进行水质检验。例如,自来水厂水质检验员的工作就是在自来水出厂前,利用
化学分析仪器等对水中的一些物质,如硫酸根离子、氯离子、放射性物质、微生物和有机物等进行检测,并对检测数据进行分析,以确保百姓家中的自来水达到国家《生活饮用水卫生标准》。
水质检验员
C
课堂练习
8. 检验某溶液中是否含有Cl-,正确的操作是( )
A.取样,滴加AgNO3溶液,看是否有白色沉淀生成
B.取样,先加盐酸酸化,再加AgNO3溶液,看是否有白色沉淀生成
C.取样,先加稀硝酸酸化,再加入AgNO3溶液,看是否有白色沉淀生成
D.取样,加少量AgNO3溶液,有白色沉淀生成,再加稀盐酸,看白色沉淀是否消失
C
9. 为确定某溶液中的离子组成,进行如下实验:
①取少量溶液加入稀盐酸至溶液呈酸性,产生使澄清石灰水变浑浊的无色无味气体
②在①溶液中再滴加Ba(NO3)2溶液,产生白色沉淀
③取②上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀根据实验现象,下列推断正确的是( )
A.一定有CO32- B.一定有Cl- C.一定有SO42- D.一定有HCO3-
C
金属氯的性质
黄绿色气体,气味大,有毒
易溶于水,熔点:-101℃,沸点:-34.6℃
课堂小结
物理性质
与金属的反应
化学性质
与水的反应
与非金属的反应
与碱的反应
氯气的实验室制法: MnO2 + 4HCl(浓) ==== MnCl2 + Cl2 + 2H2O
氯离子的检验:取少量待检液于一洁净试管中,向试管中加入稀硝酸酸化,再滴入 AgNO3溶液,若产生白色沉淀,则被检液中含有Cl-。
Cl2 + H2O = HCl + HClO
2Na+Cl2 2NaCl
2Fe+3Cl2 2FeCl3
Cu+Cl2 CuCl2
H2 + Cl2 2HCl
Cl2+2NaOH = NaCl+NaClO+H2O 漂白液
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 漂白粉 漂粉精
四、卤素的性质及应用
1、卤素的相似性(X为F、Cl、Br、I)
与大多数金属反应:2Na + X2 === 2NaX
点燃
与H2反应:H2 + X2 === 2HX(F2最剧烈)
光照
与H2O反应:2F2+2H2O===4HF+O2
X2+ H2O === HX + HXO(剧烈程度:F2 > Cl2 > Br2 >I2)
与碱反应: X2 + 2NaOH === NaX + NaXO + H2O(F2例外)
2、卤素的递变性
F2 Cl2 Br2 I2
颜色、状态 淡黄绿色气体 黄绿色气体 深红棕色液体 紫黑色固体
熔、沸点 逐渐升高 密度 逐渐增大 溶解性 逐渐减小 单质氧化性 F2 > Cl2 > Br2 > I2 Cl2 + 2Br- === Br2 + 2Cl- Br2 + 2I- === I2 + 2Br- 离子还原性 F - < Cl - < Br - < I- 3、卤素离子的检验
原理:X- + Ag+ ==== AgX(X为Cl-、Br-、I-)
无色溶液
加入AgNO3溶液
白色沉淀,可能为Cl-
淡黄色沉淀,可能为Br-
黄色沉淀,可能为 I-
加入稀HNO3
白色沉淀不溶解,含Cl-
淡黄色沉淀不溶解,含Br-
黄色沉淀不溶解,含 I-
A
4、氯气能使湿润的蓝色石蕊试纸( )
A、褪色 B、变成红色
C、先褪色后变红 D、先变红后褪色
B
D
第二节 氯及其化合物
第2课时 氯气的实验室制法 氯离子的检验
君行一舟
新高考
滴滴涕
氯菊酯
2,2-二氯乙烯基二甲基磷酸酯 C4H7O4Cl2P
氯气的用途
1、氯元素在自然界中以_________存在。
2、氯气由________发现的,由__________
确认的。此反应是实验室制取氯气的主
要方法之一,药品是______________ ,
反应原理为
__________________________________。
化合态
自然界中有没有游离态的氯 如果
没有,人们是怎样制得氯气的呢?
舍勒
戴维
软锰矿和浓盐酸
MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
△
发生装置
收集装置
反应物:
MnO2 、浓盐酸
反应条件:加热
固液加热
产物: Cl2
性质:ρ氯气>ρ空气
溶于水
与水反应
向上排空气法
制备气体
问题1:为什么装置最后放了NaOH?
问题3:得到的氯气是否纯净?
问题4:可能混有什么杂质?为什么?
问题2:用澄清石灰水如何?为什么?
不能用澄清石灰水吸收Cl2,
因为澄清石灰水中Ca(OH)2
含量少,吸收不完全。
分液漏斗
圆底烧瓶
酒 精 灯
问题5:如何除去H2O和HCl?
提示:水溶性比较
H2O :Cl2 = 1:2
H2O :HCl =1:500
饱和食盐水
除去Cl2中的HCl气体
浓硫酸具有吸水性,吸收Cl2中的水蒸气
2、实验装置:
除HCl
除H2O
吸收多于Cl2,防污染
收集方法:向上排空气法
(或排饱和食盐水法)
导气管:长进短出
发生装置
除杂装置
收集装置
尾气处理装置
反应物状态及条件
气体及杂质的性质
密度和水溶性
是否与水反应
气体性质
验满方法
根据集气瓶内是否充满黄绿色气体来检验是否收集满。
将湿润的淀粉碘化钾试纸靠近盛Cl2的瓶口,观察到试纸立即变蓝,则证明已集满
Cl2+2KI=I2+2KCl
(3)将湿润的蓝色石蕊试纸靠近盛氯气的瓶口,观察到试纸立即发生先变红后褪色的变化, 则证明已集满。
注意事项:
①必须用浓盐酸,MnO2与稀盐酸不反应。
②加热温度不宜过高,减少HCl的挥发,得到更加纯净的Cl2。
③尾气吸收时,不能用澄清石灰水代替NaOH,因为澄清石灰水中的Ca(OH)2浓度小,吸收不完全。
④实验结束后,先使反应停止并排出残留的Cl2,再拆卸装置,避免污染空气。
其他氧化还原法制取氯气
1、高锰酸钾氧化浓盐酸(不需加热)
2、氯酸钾氧化浓盐酸(不需加热)
KClO3+ 6HCl(浓)===KCl + 3Cl2 + 3H2O
2KMnO4 + 16HCl(浓)===2KCl + 2MnCl2 + 5Cl2 + 8H2O
练习:某学生设计如下实验装置用于制备纯净的氯气。
装置中有六处错误,请指出。
1、烧瓶下面缺石棉网 2、铁圈下面缺酒精灯
3、原料使用了稀盐酸 4、不应使用长颈漏斗
5、盛浓硫酸的洗气瓶和盛饱和食盐水的洗气瓶位置颠倒了
6、洗气瓶D的气体入口导管应深插在液面下,而出口导管应靠近瓶塞
1、除去Cl2中少量的HCl气体,最好选用的试剂是( )
A.蒸馏水 B.二氧化锰
C.饱和食盐水 D.氢氧化钠溶液
C
C
1.下列关于实验室制氯气的说法中错误的是( )
A.该反应是一个氧化还原反应,其中二氧化锰是氧化剂
B.HCl表现还原性和酸性
C.该反应的离子方程式为MnO2+4H++4Cl- MnCl2+2H2O+Cl2↑
D.该方法是瑞典化学家舍勒最先发现的
课堂练习
C
2.在实验室利用浓盐酸和二氧化锰制氯气,制备装置中应使用分液漏斗而不能使用长颈漏斗,下列有关理由叙述错误的是( )
A.防止氯气扩散到空气中造成污染 B.便于控制加入盐酸的量
C.长颈漏斗便于添加液体 D.尽量避免氯化氢挥发到空气中
C
课堂练习
3. 某同学制备并检验Cl2的性质。下列说法正确的是( )
D
Ⅰ图中:如果MnO2过量,盐酸就可全部消耗
Ⅱ图中:如果倒置的量筒充满了氯气,水槽内装满水,经足够长的时间光照, 量筒内最后剩余气体为HCl和氧气
Ⅲ图中:生成蓝色的烟
Ⅳ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中至溶液呈酸性,结果有Cl2生成
4. 某化学小组用图示装置制取氯气,下列说法不正确的是( )
A.该装置图中至少存在两处明显错误
B.为了防止氯气污染空气,必须进行尾气处理
C.在集气瓶的导管口处放一片湿润的淀粉碘化钾
试纸,可以证明是否有氯气逸出
D.该实验中收集氯气的方法不正确
课堂练习
D
5. 在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。下列收集Cl2的正确装置是( )
C
课堂练习
6.下列关于氯气的实验装置能达到实验目的或实验效果的是( )
①可用于氯气的收集
②可用于除去氯气中
少量的氯化氢气体
③可证明氯气具有漂白性
④可用于实验室氯气的尾气吸收
A.①② B.①③ C.②③ D.①④
D
7. 实验室用下列两种方法制氯气:①用含HCl 146 g的浓盐酸与足量的MnO2反应;②用87 g MnO2与足量浓盐酸反应。所得的氯气( )
A.①比②多 B.②比①多 C.一样多 D.无法比较
B
氯气的实验室制法
拓展:氯气的工业制法
富集、分离提纯、转化
原料:海水
产品:氯气
氯碱工业:
电解熔融氯化钠:
2 NaCl + 2 H2O == Cl2 ↑ + H2 ↑ +2 NaOH
通电
2 NaCl (熔融)== Cl2 ↑ + 2 Na
通电
氯气的性质很活泼,能与很多金属反应生成盐,其中大多数盐能溶于水并电离出氯离子。
思考·讨论
有没有什么办法能检验物质中是否存在氯离子呢?
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
在三只试管中分别加入2~3mL稀盐酸、NaCl溶液、Na2CO3溶液,然后各滴入几滴AgNO3溶液,观察现象。再分别加入少量稀硝酸,观察现象。
实验
稀盐酸
NaCl溶液
Na2CO3溶液
AgNO3溶液
实验·探究
三、Cl-的检验
HCl
NaCl
Na2CO3
AgNO3溶液
AgNO3溶液
HNO3溶液
Cl- + Ag+ = AgCl↓
CO32- + 2Ag+ = Ag2CO3↓
Ag2CO3 + 2H+ = 2Ag+ + CO2↑ + H2O
都产生白色沉淀
HNO3溶液
AgNO3溶液
HNO3溶液
沉淀不溶解
沉淀溶解
思考:
(1)若在某无色溶液中加入AgNO3溶液,产生白色沉淀,则溶液中一定含有Cl-吗 为什么
不一定含Cl-, CO32- 与Ag+反应也生成白色沉淀。
(2)检验Cl-时为何要加入稀硝酸
防止 CO32- 等离子的干扰。
氯离子检验方法
方法1:先在待测液中加入稀HNO3酸化,排除CO32-的干扰,再滴入AgNO3溶液,若产生白色沉淀,则被测液中含有Cl-。
方法2:先在待测液中加入AgNO3,产生白色沉淀,再加入稀HNO3,沉淀不溶解,则被测液中含有Cl-。
化学与职业
水质检验员是指对天然水、工业用水、生活用水等的物理性质、化学性质及生物性质进行检验和评定的专业技术人员。水质检验的目的是考察和研究环境质量、水的污染性或水受污染的程度、水质是否适宜使用。以及水处理过程的效率等。自来水厂,污水处理厂,玻璃加工、制药、食品和化工企业等都需要进行水质检验。例如,自来水厂水质检验员的工作就是在自来水出厂前,利用
化学分析仪器等对水中的一些物质,如硫酸根离子、氯离子、放射性物质、微生物和有机物等进行检测,并对检测数据进行分析,以确保百姓家中的自来水达到国家《生活饮用水卫生标准》。
水质检验员
C
课堂练习
8. 检验某溶液中是否含有Cl-,正确的操作是( )
A.取样,滴加AgNO3溶液,看是否有白色沉淀生成
B.取样,先加盐酸酸化,再加AgNO3溶液,看是否有白色沉淀生成
C.取样,先加稀硝酸酸化,再加入AgNO3溶液,看是否有白色沉淀生成
D.取样,加少量AgNO3溶液,有白色沉淀生成,再加稀盐酸,看白色沉淀是否消失
C
9. 为确定某溶液中的离子组成,进行如下实验:
①取少量溶液加入稀盐酸至溶液呈酸性,产生使澄清石灰水变浑浊的无色无味气体
②在①溶液中再滴加Ba(NO3)2溶液,产生白色沉淀
③取②上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀根据实验现象,下列推断正确的是( )
A.一定有CO32- B.一定有Cl- C.一定有SO42- D.一定有HCO3-
C
金属氯的性质
黄绿色气体,气味大,有毒
易溶于水,熔点:-101℃,沸点:-34.6℃
课堂小结
物理性质
与金属的反应
化学性质
与水的反应
与非金属的反应
与碱的反应
氯气的实验室制法: MnO2 + 4HCl(浓) ==== MnCl2 + Cl2 + 2H2O
氯离子的检验:取少量待检液于一洁净试管中,向试管中加入稀硝酸酸化,再滴入 AgNO3溶液,若产生白色沉淀,则被检液中含有Cl-。
Cl2 + H2O = HCl + HClO
2Na+Cl2 2NaCl
2Fe+3Cl2 2FeCl3
Cu+Cl2 CuCl2
H2 + Cl2 2HCl
Cl2+2NaOH = NaCl+NaClO+H2O 漂白液
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 漂白粉 漂粉精
四、卤素的性质及应用
1、卤素的相似性(X为F、Cl、Br、I)
与大多数金属反应:2Na + X2 === 2NaX
点燃
与H2反应:H2 + X2 === 2HX(F2最剧烈)
光照
与H2O反应:2F2+2H2O===4HF+O2
X2+ H2O === HX + HXO(剧烈程度:F2 > Cl2 > Br2 >I2)
与碱反应: X2 + 2NaOH === NaX + NaXO + H2O(F2例外)
2、卤素的递变性
F2 Cl2 Br2 I2
颜色、状态 淡黄绿色气体 黄绿色气体 深红棕色液体 紫黑色固体
熔、沸点 逐渐升高 密度 逐渐增大 溶解性 逐渐减小 单质氧化性 F2 > Cl2 > Br2 > I2 Cl2 + 2Br- === Br2 + 2Cl- Br2 + 2I- === I2 + 2Br- 离子还原性 F - < Cl - < Br - < I- 3、卤素离子的检验
原理:X- + Ag+ ==== AgX(X为Cl-、Br-、I-)
无色溶液
加入AgNO3溶液
白色沉淀,可能为Cl-
淡黄色沉淀,可能为Br-
黄色沉淀,可能为 I-
加入稀HNO3
白色沉淀不溶解,含Cl-
淡黄色沉淀不溶解,含Br-
黄色沉淀不溶解,含 I-
A
4、氯气能使湿润的蓝色石蕊试纸( )
A、褪色 B、变成红色
C、先褪色后变红 D、先变红后褪色
B
D
