第二章 第三节 第2课时 气体摩尔体积(75张PPT)
文档属性
| 名称 | 第二章 第三节 第2课时 气体摩尔体积(75张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-17 17:16:14 | ||
图片预览








文档简介
(共75张PPT)
第二章 第三节
第2课时 气体摩尔体积
1.能从宏观和微观相结合的角度理解影响物质体积大小的因素,知道气体摩尔
体积的含义,能叙述阿伏加德罗定律的内容。
2.能基于物质的量认识物质的组成及变化,建立n、m、Vm之间计算的模型,熟
悉阿伏加德罗定律的应用。
核心素养
发展目标
一、气体摩尔体积
二、阿伏加德罗定律及推论
课时对点练
内容索引
随堂演练 知识落实
气体摩尔体积
一
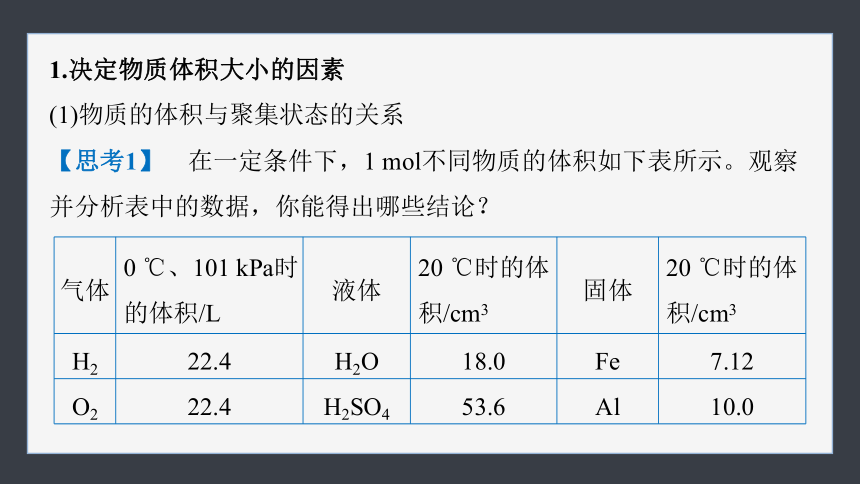
1.决定物质体积大小的因素
(1)物质的体积与聚集状态的关系
【思考1】 在一定条件下,1 mol不同物质的体积如下表所示。观察并分析表中的数据,你能得出哪些结论?
气体 0 ℃、101 kPa时的体积/L 液体 20 ℃时的体积/cm3 固体 20 ℃时的体积/cm3
H2 22.4 H2O 18.0 Fe 7.12
O2 22.4 H2SO4 53.6 Al 10.0
结论:同温同压下,1 mol不同的固态物质或液态物质的体积差别
。
同温同压下,1 mol气体的体积 。
较大
近似相等
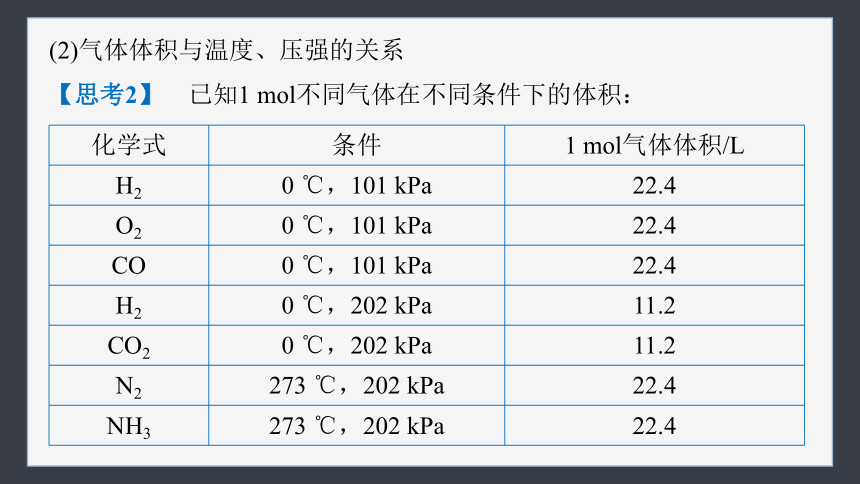
(2)气体体积与温度、压强的关系
【思考2】 已知1 mol不同气体在不同条件下的体积:
化学式 条件 1 mol气体体积/L
H2 0 ℃,101 kPa 22.4
O2 0 ℃,101 kPa 22.4
CO 0 ℃,101 kPa 22.4
H2 0 ℃,202 kPa 11.2
CO2 0 ℃,202 kPa 11.2
N2 273 ℃,202 kPa 22.4
NH3 273 ℃,202 kPa 22.4
Ⅰ.从上表分析得出结论:
①1 mol任何气体,在标准状况下的体积都约为________。
②1 mol不同的气体,在不同的条件下,体积__________(填“一定”“一定不”或“不一定”)相等。
Ⅱ.理论依据:相同温度和压强下,1 mol任何气体的体积几乎相等,原因是①_________________,②_________________,③_________
______________________________________。
22.4 L
不一定
气体的粒子数相同
粒子间的距离相同
气体粒子
的大小相对于气体粒子间的距离可以忽略
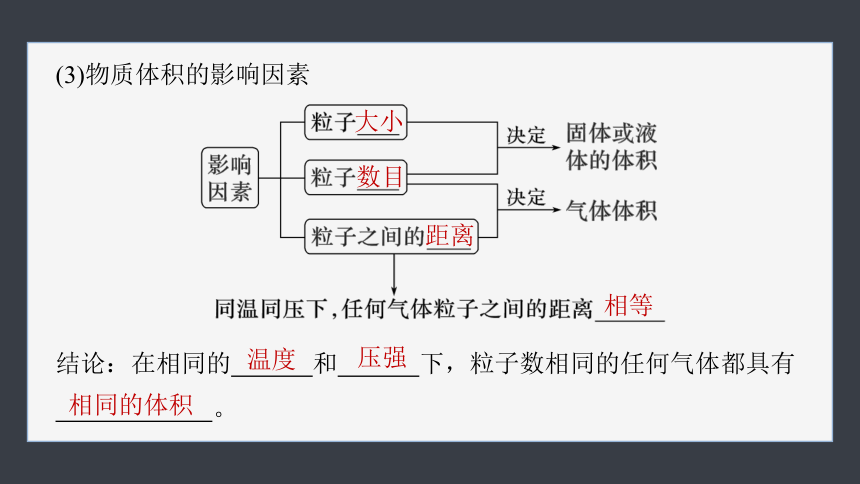
(3)物质体积的影响因素
结论:在相同的 和 下,粒子数相同的任何气体都具有
。
大小
数目
距离
温度
相等
压强
相同的体积
2.气体摩尔体积
(1)气体摩尔体积
单位物质的量的气体
Vm
L·mol-1
m3·mol-1
温度
压强
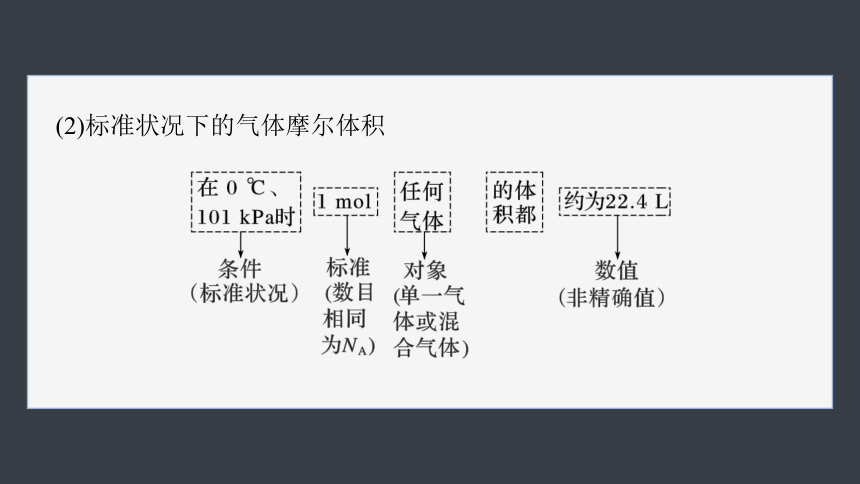
(2)标准状况下的气体摩尔体积
特别提醒 ①n= ,只适用于气态物质(单一或者混合气体),对于固态和液态物质(如水、酒精、碳、三氧化硫等)均不适用。②标准状况下的气体摩尔体积Vm=22.4 L·mol-1,Vm与温度、压强有关,但质量、物质的量不受温度、压强的影响。
【思考3】 完成下列问题。
(1)标准状况下,某气体的密度为1.43 g·L-1,则该气体的摩尔质量约为_____________。
32.03 g·mol-1
气体的摩尔质量M=Vm·ρ,代入数据求得M≈32.03 g·mol-1。
(2)标准状况下,0.51 g某气体的体积为672 mL,则该气体的摩尔质量为___________。
17 g·mol-1
(3)在标准状况下,CO和CO2的混合气体共39.2 L,质量为61 g,则混合气体的平均摩尔质量约为____________。
34.9 g·mol-1
(4)在标准状况下,H2和HCl的混合气体密度为1.25 g·L-1,则该混合气体的平均摩尔质量为____________。
28 g·mol-1
归纳总结
标准状况下,气体摩尔体积的有关计算
(2)气体的摩尔质量M=Vm·ρ=22.4ρ g·mol-1;
归纳总结
应用体验
1.判断正误
(1)一定温度、压强下,气体体积由其分子的大小和数目决定
(2)在常温常压下,11.2 L Cl2含有的分子数为0.5NA
(3)标准状况下,2 mol CO2的气体摩尔体积为44.8 L·mol-1
(4)标准状况下的Vm=22.4 L·mol-1,那么Vm=22.4 L·mol-1时也一定是标准状况
×
×
×
×
应用体验
2.(1)标准状况下,33.6 L Cl2的物质的量是________,16 g O2所占体积约是_______。
(2)标准状况下,含有1.5 mol H2和0.5 mol O2的混合气体所占体积约是________。
(3)标准状况下,11.2 L二氧化碳和氧气的混合气体中含有的氧原子数是_____。
返回
1.5 mol
11.2 L
44.8 L
NA
阿伏加德罗定律及推论
二
1.阿伏加德罗定律的内容
在相同的温度和压强下,相同体积的任何气体都含有相同数目的粒子。
特别提醒 ①阿伏加德罗定律适用于任何气体,包括混合气体,不适用于非气体;②同温、同压、同体积、同分子数,“四同”,相互制约,即“三同定一同”。
2.阿伏加德罗定律的推论
【思考】 在同温同压(以0 ℃,101 kPa即标准状况为例)下,完成下列问题。
(1)1 mol O2的体积是 ,2 mol H2的体积是 ,由此可推知:同温同压下,气体的体积之比等于其 之比。
22.4 L
44.8 L
物质的量
(2)1 mol O2的质量是 ,体积是 ,ρ(O2)= =______ g·L-1
(列式不化简,下同)。1 mol H2的质量是 ,体积是 ,ρ(H2)
= =______ g·L-1。由此可推知:
①同温同压下,气体的密度之比等于其 之比。
②在标准状况下,气体的密度为_____ g·L-1。
32 g
22.4 L
2 g
22.4 L
摩尔质量
阿伏加德罗定律的推论:
语言叙述 公式
同温同压下,气体体积之比等于物质的量之比,等于分子数之比
同温同体积下,气体压强之比等于物质的量之比,等于分子数之比
同温同压下,气体密度之比等于摩尔质量之比
应用体验
1.判断正误
(1)同温同压下,同体积的物质所含的分子数一定相等
(2)同温同压下,相同体积的任何气体都含有相同数目的原子
(3)同温同压下,相同体积的氧气和氨气,前者质量小于后者
(4)同温同体积下,1 mol氢气与1 mol氧气,它们的压强相同
(5)同温同压下,氧气的密度是氢气的16倍
×
×
×
√
√
应用体验
2.质量相同的CH4和NH3比较,下列结论错误的是
A.分子个数之比为17∶16
B.同温同压下两种气体的体积之比为17∶16
C.氢原子个数之比为17∶12
D.原子个数之比为17∶16
√
返回
同温同压下两种气体的体积之比等于物质的量之比,为17∶16,故B正确;
随堂演练 知识落实
1
2
3
4
1.下列关于决定物质体积的因素,说法错误的是
A.物质的体积取决于微粒数目、微粒大小和微粒间距
B.同温同压下,相同体积的任何气体具有相同数目的分子
C.同温同压下,1 mol任何物质所占有的体积均相同
D.等质量的H2,压强越小、温度越高,气体所占体积越大
√
随堂演练
1
2
3
4
随堂演练
相同条件下,粒子数相同的任何气体,微粒平均距离相同,所以都具有相同体积,故B正确;
固体中微粒之间的距离很小,决定固体体积大小的因素是粒子数和粒子的大小,同温同压下,1 mol任何气体所占有的体积均相同,故C错误。
2.如图表示某条件下H2S气体的体积与质量的关系,则该条件下的气体摩尔体积为
A.22.0 L·mol-1 B.22.4 L·mol-1
C.22.8 L·mol-1 D.23.2 L·mol-1
√
随堂演练
1
2
3
4
3.(2022·云南曲靖市马龙区第一中学高一月考)在下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计),其中能表示等质量的氢气与氦气的是
随堂演练
1
2
3
4
√
随堂演练
1
2
3
4
H2的摩尔质量为2 g·mol-1,He的摩尔质量为4 g·mol-1。根据n= ,等质量的氢气和氦气的物质的量和摩尔质量成反比,所以物质的量之比为4∶2=2∶1,根据n= ,物质的量和粒子个数成正比,所以氢气和氦气的分子个数比为2∶1。
根据阿伏加德罗定律,同温同压下,气体体积和物质的量成正比,所以V(H2)∶V(He)=2∶1。
氢气是双原子分子,氦气是单原子分子。
4.同温同压下,将1体积的CO2和2体积的CO进行比较,则CO2与CO的:
(1)物质的量之比为______。
(2)分子数之比为______。
(3)原子数之比为______。
(4)质量之比为________。
(5)摩尔质量之比为_______。
(6)密度之比为______。
随堂演练
1
2
3
4
1∶2
1∶2
3∶4
11∶7
返回
11∶14
11∶7
课时对点练
1
2
3
4
5
6
7
8
9
题组一 决定物质体积大小的因素
1.下列有关气体的叙述错误的是
A.不同的气体,若体积不同,则它们所含的分子数肯定不同
B.在标准状况下,气体的摩尔体积约为22.4 L·mol-1
C.当分子数目相同时,气体体积的大小主要取决于气体分子之间的距离
D.气态物质没有固定的形状,且容易被压缩
√
10
11
12
13
14
15
对点训练
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
气体的体积受温度、压强、分子数多少的影响,若未说明气体体积的条件,则无法知道它们所含有的分子数的多少,A错误;
气态物质由于分子之间的间隔较大,可以压缩或扩大,因而没有固定的形状,且容易被压缩,D正确。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2.(2022·张家界高一月考)决定气体体积的主要因素有
①气体的分子个数 ②气体分子的大小 ③气体分子间的平均距离 ④气体的相对分子质量
A.①② B.①③ C.②③ D.②④
√
2
由于气体的分子间距离远大于分子本身的大小,则决定气体体积的因素主要是气体的分子数目以及分子间距离,故①③正确。
题组二 气体摩尔体积
3.下列关于气体摩尔体积的说法中正确的是
A.标准状况下,1 mol H2O的体积是22.4 L
B.22 g CO2的物质的量是0.5 mol,其体积为11.2 L
C.只有标准状况下的气体摩尔体积是22.4 L·mol-1,其他条件下一定不
是该值
D.标准状况下,1摩尔任何气体的体积都约是22.4 L
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
标准状况下,水是非气态,1 mol H2O的体积远远小于22.4 L,A错误;
没有指明气体所处的温度与压强,不能确定CO2的体积,B错误;
在273 ℃、202 kPa时,气体摩尔体积也是22.4 L·mol-1,C错误。
4.(2022·武汉高一月考)设NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,2.24 L 乙醇中含有0.1NA个分子
B.常温常压下,80 g氩气含有的原子数为2NA
C.1 mol Na2O2与足量H2O反应产生11.2 L的O2
D.1 mol Cl2与足量的铁粉反应转移的电子数目是3NA
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
乙醇在标准状况下为液体,2.24 L 乙醇的物质的量大于0.1 mol,含有分子数大于0.1NA,故A错误;
常温常压下,80 g氩气的物质的量为2 mol,氩气是单原子构成的物质,则含有的原子数为2NA,故B正确;
未指明气体所处的温度与压强,不可计算体积,故C错误;
1 mol Cl2与足量的铁粉反应,氯元素从0价降到-1价,两个氯原子发生价态变化,故转移的电子数目是2NA,故D错误。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
5.设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,11.2 L CH4和C2H4中含有的氢原子数目为2NA
B.标准状况下2.24 L H2与足量O2在密闭容器中反应,转移电子数为0.1NA
C.64 g Cu与Cl2完全反应,转移电子数为NA
D.常温常压下,22.4 L SO3的分子个数为NA
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
CH4和C2H4中均含有4个氢原子,标准状况下11.2 L CH4和C2H4的物质的量为0.5 mol,含有的氢原子数为2NA,故A正确;
标准状况下2.24 L H2与O2反应转移电子数为0.2NA,故B错误;
Cu与Cl2反应生成CuCl2,64 g Cu的物质的量为1 mol,与Cl2完全反应,转移电子数为2NA,故C错误;
常温常压下SO3不是气体,不能用气体摩尔体积计算其物质的量,故D错误。
2
6.(2022·沈阳高一期末)设NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,40 g SO3所占的体积为11.2 L
B.1 mol OH-所含的电子数为10NA
C.标准状况下,28 g CO和N2的混合气体的体积为44.8 L
D.1 mol NaHSO4晶体中含H+数目为NA
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
标准状况下,SO3为固体,故40 g SO3即0.5 mol SO3的体积小于11.2 L,A错误;
1个OH-中含10个电子,故1 mol OH-中含10NA个电子,B正确;
CO和氮气的摩尔质量均为28 g·mol-1,故28 g混合物的物质的量为
1 mol,则标准状况下,气体的体积V=nVm=1 mol×22.4 L·mol-1=22.4 L,C错误;
NaHSO4晶体中不含H+,D错误。
题组三 阿伏加德罗定律及推论
7.(2022·湖北华中师大一附中高一期末)在两个容积相同的容器中,一个盛有N2,另一个盛有C2H4和CO的混合气体。在同温同压下,两容器内的气体一定相同的物理量有
①分子数 ②原子数 ③质量 ④中子数 ⑤密度 ⑥气体摩尔体积
A.4项 B.5项
C.6项 D.3项
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
①在同温同压下,相同体积的任何气体含有相同的分子数,则相同体积的N2与C2H4和CO的混合气体的分子数相同,符合题意;
②在同温同压下,相同体积的任何气体含有相同的分子数,物质的量相等,CO、N2是双原子分子、C2H4是6原子分子,则气体的原子数一定不相等,不符合题意;
③CO、N2和C2H4的摩尔质量都是28 g·mol-1,N2的物质的量与C2H4和CO的总物质的量相等时,质量一定相等,符合题意;
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
④CO的中子数为14,N2的中子数为14,C2H4的中子数为12,故两容器内气体的中子数一定不相等,不符合题意;
⑤C2H4和CO的相对分子质量都是28,故混合气体平均相对分子质量为28,N2的相对分子质量为28,同温同压下,气体密度之比等于相对分子质量之比,故两容器内气体的密度相等,符合题意;
⑥在相同温度和压强下,气体的摩尔体积相等,符合题意;综上所述,正确的有4项。
8.将质量均为m g的O2和X气体分别充入相同体积的密闭容器中,二者压强(p)与温度(T)的关系如图所示,则X气体
可能是
A.H2 B.NH3
C.CO D.SO2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
√
9.(2022·黑龙江哈九中高一期末)下列说法不正确的是
A.温度相同、体积相同的氧气和氮气分子数相同
B.等温等压下,二氧化硫气体与二氧化碳气体的密度之比等于16∶11
C.等温等体积下,5 mol氧气和 2 mol氮气的压强之比等于5∶2
D.等温等压下,32 g 氧气和2 g氢气的体积之比等于1∶1
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
根据阿伏加德罗定律推论可知,等温等体积下,压强之比等于物质的量之比,所以5 mol氧气和 2 mol氮气的压强之比等于5∶2,故C正确;
2
综合强化
10.(2022·四川眉山高一期末)已知a g气体XY3含有b个原子,设阿伏加德罗常数的值为NA,气体摩尔体积为c L·mol-1,则该条件下11.2 L该气体的质量为
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
11.在甲、乙两个体积不同的密闭容器中,分别充入质量相等的CO、CO2气体时,两容器的温度和压强均相同,则下列说法正确的是
A.充入的CO分子数比CO2分子数少
B.甲容器的体积比乙容器的体积小
C.CO的摩尔体积比CO2的摩尔体积小
D.若将压强相同改为体积相同,则甲容器的压强比乙容器的压强大
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
由于M(CO)两容器的温度和压强相同,则两容器内气体的体积与气体的总物质的量成正比,由于n(CO)>n(CO2),所以甲容器的体积比乙容器的体积大,B不正确;
温度、压强相同时,气体的摩尔体积相同,C不正确;
根据阿伏加德罗定律及推论可知,同温同体积的条件下,压强与气体的总物质的量成正比,由于n(CO)>n(CO2),所以甲容器的压强比乙容器的压强大,D正确。
12.(2022·山东日照高一月考)三种气体 X、Y、Z 的相对分子质量关系为M(X)A.原子数相等的三种气体,质量最大的是Z
B.若一定条件下,三种气体体积均为2.24 L,则它们的物质的量一定均为
0.1 mol
C.同温同压下,三种气体中密度最小的是X
D.同温下,体积相同的两容器分别充a g Y气体和2a g Z气体,则压强之
比为1∶2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
根据m=nM= ,分子数目相等的三种气体,相对分子质量越大,质量越大;因为不确定X、Y、Z三种气体分子中原子个数和组成,所以由原子数相等的三种气体不能确定三种气体的分子数,故A错误;
气体的物质的量n= ,Vm和气体的状态有关,三种气体体积均为2.24 L,Vm不一定等于22.4 L·mol-1,所以它们的物质的量不一定均为0.1 mol,故B错误;
根据阿伏加德罗定律的推论知,同温同压下,气体的密度和相对分子质量成正比,则三种气体密度最小的是X,故C正确;
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
13.(2022·安徽亳州二中高一期中)回答下列问题:
(1)含有6.02×1023个氧原子的H2SO4的物质的量是______ mol。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
0.25
(2)在一定的温度和压强下,1体积气体X2跟3体积气体Y2化合生成2体积化合物,则该化合物的化学式是_______。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
设该化合物为R,根据信息可得方程式为X2+3Y2===2R,则R为XY3。
XY3
(3)等质量的NH3和N2物质的量之比为________。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
28∶17
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
14.现有16.0 g CO 和 CO2 的混合气体,在标准状况下其体积为 8.96 L。请回答下列问题:
(1)该混合气体的平均摩尔质量为___________。
2
40 g·mol-1
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
16.0 g CO和CO2的混合气体,在标准状况下其体积为8.96 L,则混合气体的总物质的量是 =0.4 mol,设混合气体中CO和CO2的物质的量分别为x mol、y mol,根据C原子守恒可知x+y=0.4,根据质量守恒可得28x+44y=16,联立解得x=0.1、y=0.3。
该混合气体的平均摩尔质量为 =40 g·mol-1。
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
(2)混合气体中碳原子的个数为_______(用NA 表示阿伏加德罗常数的值)。
0.4NA
CO和CO2分子中都只含1个碳原子,混合气体的总物质的量是0.4 mol,所以混合气体中碳原子的个数为0.4NA。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(3)将混合气体依次通过如图所示装置,最后收
集在气球中(体积在标准状况下测定)。
①气球中收集到的气体的质量为______。
2.8 g
2
二氧化碳被氢氧化钠吸收,气球中收集到的气体是CO,CO的摩尔质量为28 g·mol-1,其质量m=0.1 mol×28 g·mol-1=2.8 g。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
②气球中收集到的气体中,电子总数为
________(用NA 表示,假设气体全部进
入气球中)。
1.4NA
2
1个CO分子中有14个电子,气球中收集到的气体是0.1 mol CO,电子总数为1.4NA。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
③气球的体积为______ L(忽略气球弹性的
影响)。
2.24
2
气球中收集到的气体是0.1 mol CO,标准状况下,气球的体积为0.1 mol
×22.4 L·mol-1=2.24 L。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
④若将混合气体通入足量的 Na2O2 中,转移
的电子数为_______(用NA 表示)。
0.3NA
2
若将混合气体通入足量的 Na2O2中,发生反应:2CO2+2Na2O2===
2Na2CO3+O2,该反应为过氧化钠的歧化反应,0.3 mol CO2参与反应,生成0.15 mol氧气,转移0.3NA个电子。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
15.(2023·河北邢台高一期末)我国化学家侯德榜发明的“联合制碱法”为世界制碱工业做出了巨大贡献,该法利用的原理为NaCl+CO2+NH3+H2O===NaHCO3↓+NH4Cl。根据要求回答下列问题:
(1)同温同压下,等物质的量的CO2和NH3,前者与后者的分子数之比为______,原子总数之比为______,密度之比为________。
2
1∶1
3∶4
44∶17
同温同压下,等物质的量的CO2和NH3,分子数之比等于物质的量之比,前者与后者的分子数之比为1∶1,原子总数之比为3∶4,密度之比等于摩尔质量之比为44∶17。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(2)与标准状况下6.72 L CO2中所含的氧原子数相等的H2O的质量为______ g,与该质量的水中所含的氢原子数相等的NH3在标准状况下的体积为______ L。
2
10.8
8.96
标准状况下6.72 L CO2的物质的量是 =0.3 mol,所含的氧原子的物质的量是0.6 mol,则H2O的物质的量是0.6 mol,质量为0.6 mol
×18 g·mol-1=10.8 g,该质量的水中含1.2 mol氢原子,则NH3物质的量为0.4 mol,在标准状况下的体积为0.4 mol×22.4 L·mol-1=8.96 L。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(3)将一定量CO2和NH3混合测得混合气体中碳元素与氮元素的质量之比为3∶7,则该混合气体中CO2与NH3物质的量之比为______,该混合气体的密度是同温同压下氢气密度的_____倍。
2
1∶2
13
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
返回
本课结束
第二章 第三节
第2课时 气体摩尔体积
1.能从宏观和微观相结合的角度理解影响物质体积大小的因素,知道气体摩尔
体积的含义,能叙述阿伏加德罗定律的内容。
2.能基于物质的量认识物质的组成及变化,建立n、m、Vm之间计算的模型,熟
悉阿伏加德罗定律的应用。
核心素养
发展目标
一、气体摩尔体积
二、阿伏加德罗定律及推论
课时对点练
内容索引
随堂演练 知识落实
气体摩尔体积
一
1.决定物质体积大小的因素
(1)物质的体积与聚集状态的关系
【思考1】 在一定条件下,1 mol不同物质的体积如下表所示。观察并分析表中的数据,你能得出哪些结论?
气体 0 ℃、101 kPa时的体积/L 液体 20 ℃时的体积/cm3 固体 20 ℃时的体积/cm3
H2 22.4 H2O 18.0 Fe 7.12
O2 22.4 H2SO4 53.6 Al 10.0
结论:同温同压下,1 mol不同的固态物质或液态物质的体积差别
。
同温同压下,1 mol气体的体积 。
较大
近似相等
(2)气体体积与温度、压强的关系
【思考2】 已知1 mol不同气体在不同条件下的体积:
化学式 条件 1 mol气体体积/L
H2 0 ℃,101 kPa 22.4
O2 0 ℃,101 kPa 22.4
CO 0 ℃,101 kPa 22.4
H2 0 ℃,202 kPa 11.2
CO2 0 ℃,202 kPa 11.2
N2 273 ℃,202 kPa 22.4
NH3 273 ℃,202 kPa 22.4
Ⅰ.从上表分析得出结论:
①1 mol任何气体,在标准状况下的体积都约为________。
②1 mol不同的气体,在不同的条件下,体积__________(填“一定”“一定不”或“不一定”)相等。
Ⅱ.理论依据:相同温度和压强下,1 mol任何气体的体积几乎相等,原因是①_________________,②_________________,③_________
______________________________________。
22.4 L
不一定
气体的粒子数相同
粒子间的距离相同
气体粒子
的大小相对于气体粒子间的距离可以忽略
(3)物质体积的影响因素
结论:在相同的 和 下,粒子数相同的任何气体都具有
。
大小
数目
距离
温度
相等
压强
相同的体积
2.气体摩尔体积
(1)气体摩尔体积
单位物质的量的气体
Vm
L·mol-1
m3·mol-1
温度
压强
(2)标准状况下的气体摩尔体积
特别提醒 ①n= ,只适用于气态物质(单一或者混合气体),对于固态和液态物质(如水、酒精、碳、三氧化硫等)均不适用。②标准状况下的气体摩尔体积Vm=22.4 L·mol-1,Vm与温度、压强有关,但质量、物质的量不受温度、压强的影响。
【思考3】 完成下列问题。
(1)标准状况下,某气体的密度为1.43 g·L-1,则该气体的摩尔质量约为_____________。
32.03 g·mol-1
气体的摩尔质量M=Vm·ρ,代入数据求得M≈32.03 g·mol-1。
(2)标准状况下,0.51 g某气体的体积为672 mL,则该气体的摩尔质量为___________。
17 g·mol-1
(3)在标准状况下,CO和CO2的混合气体共39.2 L,质量为61 g,则混合气体的平均摩尔质量约为____________。
34.9 g·mol-1
(4)在标准状况下,H2和HCl的混合气体密度为1.25 g·L-1,则该混合气体的平均摩尔质量为____________。
28 g·mol-1
归纳总结
标准状况下,气体摩尔体积的有关计算
(2)气体的摩尔质量M=Vm·ρ=22.4ρ g·mol-1;
归纳总结
应用体验
1.判断正误
(1)一定温度、压强下,气体体积由其分子的大小和数目决定
(2)在常温常压下,11.2 L Cl2含有的分子数为0.5NA
(3)标准状况下,2 mol CO2的气体摩尔体积为44.8 L·mol-1
(4)标准状况下的Vm=22.4 L·mol-1,那么Vm=22.4 L·mol-1时也一定是标准状况
×
×
×
×
应用体验
2.(1)标准状况下,33.6 L Cl2的物质的量是________,16 g O2所占体积约是_______。
(2)标准状况下,含有1.5 mol H2和0.5 mol O2的混合气体所占体积约是________。
(3)标准状况下,11.2 L二氧化碳和氧气的混合气体中含有的氧原子数是_____。
返回
1.5 mol
11.2 L
44.8 L
NA
阿伏加德罗定律及推论
二
1.阿伏加德罗定律的内容
在相同的温度和压强下,相同体积的任何气体都含有相同数目的粒子。
特别提醒 ①阿伏加德罗定律适用于任何气体,包括混合气体,不适用于非气体;②同温、同压、同体积、同分子数,“四同”,相互制约,即“三同定一同”。
2.阿伏加德罗定律的推论
【思考】 在同温同压(以0 ℃,101 kPa即标准状况为例)下,完成下列问题。
(1)1 mol O2的体积是 ,2 mol H2的体积是 ,由此可推知:同温同压下,气体的体积之比等于其 之比。
22.4 L
44.8 L
物质的量
(2)1 mol O2的质量是 ,体积是 ,ρ(O2)= =______ g·L-1
(列式不化简,下同)。1 mol H2的质量是 ,体积是 ,ρ(H2)
= =______ g·L-1。由此可推知:
①同温同压下,气体的密度之比等于其 之比。
②在标准状况下,气体的密度为_____ g·L-1。
32 g
22.4 L
2 g
22.4 L
摩尔质量
阿伏加德罗定律的推论:
语言叙述 公式
同温同压下,气体体积之比等于物质的量之比,等于分子数之比
同温同体积下,气体压强之比等于物质的量之比,等于分子数之比
同温同压下,气体密度之比等于摩尔质量之比
应用体验
1.判断正误
(1)同温同压下,同体积的物质所含的分子数一定相等
(2)同温同压下,相同体积的任何气体都含有相同数目的原子
(3)同温同压下,相同体积的氧气和氨气,前者质量小于后者
(4)同温同体积下,1 mol氢气与1 mol氧气,它们的压强相同
(5)同温同压下,氧气的密度是氢气的16倍
×
×
×
√
√
应用体验
2.质量相同的CH4和NH3比较,下列结论错误的是
A.分子个数之比为17∶16
B.同温同压下两种气体的体积之比为17∶16
C.氢原子个数之比为17∶12
D.原子个数之比为17∶16
√
返回
同温同压下两种气体的体积之比等于物质的量之比,为17∶16,故B正确;
随堂演练 知识落实
1
2
3
4
1.下列关于决定物质体积的因素,说法错误的是
A.物质的体积取决于微粒数目、微粒大小和微粒间距
B.同温同压下,相同体积的任何气体具有相同数目的分子
C.同温同压下,1 mol任何物质所占有的体积均相同
D.等质量的H2,压强越小、温度越高,气体所占体积越大
√
随堂演练
1
2
3
4
随堂演练
相同条件下,粒子数相同的任何气体,微粒平均距离相同,所以都具有相同体积,故B正确;
固体中微粒之间的距离很小,决定固体体积大小的因素是粒子数和粒子的大小,同温同压下,1 mol任何气体所占有的体积均相同,故C错误。
2.如图表示某条件下H2S气体的体积与质量的关系,则该条件下的气体摩尔体积为
A.22.0 L·mol-1 B.22.4 L·mol-1
C.22.8 L·mol-1 D.23.2 L·mol-1
√
随堂演练
1
2
3
4
3.(2022·云南曲靖市马龙区第一中学高一月考)在下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计),其中能表示等质量的氢气与氦气的是
随堂演练
1
2
3
4
√
随堂演练
1
2
3
4
H2的摩尔质量为2 g·mol-1,He的摩尔质量为4 g·mol-1。根据n= ,等质量的氢气和氦气的物质的量和摩尔质量成反比,所以物质的量之比为4∶2=2∶1,根据n= ,物质的量和粒子个数成正比,所以氢气和氦气的分子个数比为2∶1。
根据阿伏加德罗定律,同温同压下,气体体积和物质的量成正比,所以V(H2)∶V(He)=2∶1。
氢气是双原子分子,氦气是单原子分子。
4.同温同压下,将1体积的CO2和2体积的CO进行比较,则CO2与CO的:
(1)物质的量之比为______。
(2)分子数之比为______。
(3)原子数之比为______。
(4)质量之比为________。
(5)摩尔质量之比为_______。
(6)密度之比为______。
随堂演练
1
2
3
4
1∶2
1∶2
3∶4
11∶7
返回
11∶14
11∶7
课时对点练
1
2
3
4
5
6
7
8
9
题组一 决定物质体积大小的因素
1.下列有关气体的叙述错误的是
A.不同的气体,若体积不同,则它们所含的分子数肯定不同
B.在标准状况下,气体的摩尔体积约为22.4 L·mol-1
C.当分子数目相同时,气体体积的大小主要取决于气体分子之间的距离
D.气态物质没有固定的形状,且容易被压缩
√
10
11
12
13
14
15
对点训练
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
气体的体积受温度、压强、分子数多少的影响,若未说明气体体积的条件,则无法知道它们所含有的分子数的多少,A错误;
气态物质由于分子之间的间隔较大,可以压缩或扩大,因而没有固定的形状,且容易被压缩,D正确。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2.(2022·张家界高一月考)决定气体体积的主要因素有
①气体的分子个数 ②气体分子的大小 ③气体分子间的平均距离 ④气体的相对分子质量
A.①② B.①③ C.②③ D.②④
√
2
由于气体的分子间距离远大于分子本身的大小,则决定气体体积的因素主要是气体的分子数目以及分子间距离,故①③正确。
题组二 气体摩尔体积
3.下列关于气体摩尔体积的说法中正确的是
A.标准状况下,1 mol H2O的体积是22.4 L
B.22 g CO2的物质的量是0.5 mol,其体积为11.2 L
C.只有标准状况下的气体摩尔体积是22.4 L·mol-1,其他条件下一定不
是该值
D.标准状况下,1摩尔任何气体的体积都约是22.4 L
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
标准状况下,水是非气态,1 mol H2O的体积远远小于22.4 L,A错误;
没有指明气体所处的温度与压强,不能确定CO2的体积,B错误;
在273 ℃、202 kPa时,气体摩尔体积也是22.4 L·mol-1,C错误。
4.(2022·武汉高一月考)设NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,2.24 L 乙醇中含有0.1NA个分子
B.常温常压下,80 g氩气含有的原子数为2NA
C.1 mol Na2O2与足量H2O反应产生11.2 L的O2
D.1 mol Cl2与足量的铁粉反应转移的电子数目是3NA
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
乙醇在标准状况下为液体,2.24 L 乙醇的物质的量大于0.1 mol,含有分子数大于0.1NA,故A错误;
常温常压下,80 g氩气的物质的量为2 mol,氩气是单原子构成的物质,则含有的原子数为2NA,故B正确;
未指明气体所处的温度与压强,不可计算体积,故C错误;
1 mol Cl2与足量的铁粉反应,氯元素从0价降到-1价,两个氯原子发生价态变化,故转移的电子数目是2NA,故D错误。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
5.设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,11.2 L CH4和C2H4中含有的氢原子数目为2NA
B.标准状况下2.24 L H2与足量O2在密闭容器中反应,转移电子数为0.1NA
C.64 g Cu与Cl2完全反应,转移电子数为NA
D.常温常压下,22.4 L SO3的分子个数为NA
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
CH4和C2H4中均含有4个氢原子,标准状况下11.2 L CH4和C2H4的物质的量为0.5 mol,含有的氢原子数为2NA,故A正确;
标准状况下2.24 L H2与O2反应转移电子数为0.2NA,故B错误;
Cu与Cl2反应生成CuCl2,64 g Cu的物质的量为1 mol,与Cl2完全反应,转移电子数为2NA,故C错误;
常温常压下SO3不是气体,不能用气体摩尔体积计算其物质的量,故D错误。
2
6.(2022·沈阳高一期末)设NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,40 g SO3所占的体积为11.2 L
B.1 mol OH-所含的电子数为10NA
C.标准状况下,28 g CO和N2的混合气体的体积为44.8 L
D.1 mol NaHSO4晶体中含H+数目为NA
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
标准状况下,SO3为固体,故40 g SO3即0.5 mol SO3的体积小于11.2 L,A错误;
1个OH-中含10个电子,故1 mol OH-中含10NA个电子,B正确;
CO和氮气的摩尔质量均为28 g·mol-1,故28 g混合物的物质的量为
1 mol,则标准状况下,气体的体积V=nVm=1 mol×22.4 L·mol-1=22.4 L,C错误;
NaHSO4晶体中不含H+,D错误。
题组三 阿伏加德罗定律及推论
7.(2022·湖北华中师大一附中高一期末)在两个容积相同的容器中,一个盛有N2,另一个盛有C2H4和CO的混合气体。在同温同压下,两容器内的气体一定相同的物理量有
①分子数 ②原子数 ③质量 ④中子数 ⑤密度 ⑥气体摩尔体积
A.4项 B.5项
C.6项 D.3项
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
①在同温同压下,相同体积的任何气体含有相同的分子数,则相同体积的N2与C2H4和CO的混合气体的分子数相同,符合题意;
②在同温同压下,相同体积的任何气体含有相同的分子数,物质的量相等,CO、N2是双原子分子、C2H4是6原子分子,则气体的原子数一定不相等,不符合题意;
③CO、N2和C2H4的摩尔质量都是28 g·mol-1,N2的物质的量与C2H4和CO的总物质的量相等时,质量一定相等,符合题意;
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
④CO的中子数为14,N2的中子数为14,C2H4的中子数为12,故两容器内气体的中子数一定不相等,不符合题意;
⑤C2H4和CO的相对分子质量都是28,故混合气体平均相对分子质量为28,N2的相对分子质量为28,同温同压下,气体密度之比等于相对分子质量之比,故两容器内气体的密度相等,符合题意;
⑥在相同温度和压强下,气体的摩尔体积相等,符合题意;综上所述,正确的有4项。
8.将质量均为m g的O2和X气体分别充入相同体积的密闭容器中,二者压强(p)与温度(T)的关系如图所示,则X气体
可能是
A.H2 B.NH3
C.CO D.SO2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
√
9.(2022·黑龙江哈九中高一期末)下列说法不正确的是
A.温度相同、体积相同的氧气和氮气分子数相同
B.等温等压下,二氧化硫气体与二氧化碳气体的密度之比等于16∶11
C.等温等体积下,5 mol氧气和 2 mol氮气的压强之比等于5∶2
D.等温等压下,32 g 氧气和2 g氢气的体积之比等于1∶1
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
根据阿伏加德罗定律推论可知,等温等体积下,压强之比等于物质的量之比,所以5 mol氧气和 2 mol氮气的压强之比等于5∶2,故C正确;
2
综合强化
10.(2022·四川眉山高一期末)已知a g气体XY3含有b个原子,设阿伏加德罗常数的值为NA,气体摩尔体积为c L·mol-1,则该条件下11.2 L该气体的质量为
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
11.在甲、乙两个体积不同的密闭容器中,分别充入质量相等的CO、CO2气体时,两容器的温度和压强均相同,则下列说法正确的是
A.充入的CO分子数比CO2分子数少
B.甲容器的体积比乙容器的体积小
C.CO的摩尔体积比CO2的摩尔体积小
D.若将压强相同改为体积相同,则甲容器的压强比乙容器的压强大
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
由于M(CO)
温度、压强相同时,气体的摩尔体积相同,C不正确;
根据阿伏加德罗定律及推论可知,同温同体积的条件下,压强与气体的总物质的量成正比,由于n(CO)>n(CO2),所以甲容器的压强比乙容器的压强大,D正确。
12.(2022·山东日照高一月考)三种气体 X、Y、Z 的相对分子质量关系为M(X)
B.若一定条件下,三种气体体积均为2.24 L,则它们的物质的量一定均为
0.1 mol
C.同温同压下,三种气体中密度最小的是X
D.同温下,体积相同的两容器分别充a g Y气体和2a g Z气体,则压强之
比为1∶2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
根据m=nM= ,分子数目相等的三种气体,相对分子质量越大,质量越大;因为不确定X、Y、Z三种气体分子中原子个数和组成,所以由原子数相等的三种气体不能确定三种气体的分子数,故A错误;
气体的物质的量n= ,Vm和气体的状态有关,三种气体体积均为2.24 L,Vm不一定等于22.4 L·mol-1,所以它们的物质的量不一定均为0.1 mol,故B错误;
根据阿伏加德罗定律的推论知,同温同压下,气体的密度和相对分子质量成正比,则三种气体密度最小的是X,故C正确;
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
13.(2022·安徽亳州二中高一期中)回答下列问题:
(1)含有6.02×1023个氧原子的H2SO4的物质的量是______ mol。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
0.25
(2)在一定的温度和压强下,1体积气体X2跟3体积气体Y2化合生成2体积化合物,则该化合物的化学式是_______。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
设该化合物为R,根据信息可得方程式为X2+3Y2===2R,则R为XY3。
XY3
(3)等质量的NH3和N2物质的量之比为________。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
28∶17
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
14.现有16.0 g CO 和 CO2 的混合气体,在标准状况下其体积为 8.96 L。请回答下列问题:
(1)该混合气体的平均摩尔质量为___________。
2
40 g·mol-1
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
16.0 g CO和CO2的混合气体,在标准状况下其体积为8.96 L,则混合气体的总物质的量是 =0.4 mol,设混合气体中CO和CO2的物质的量分别为x mol、y mol,根据C原子守恒可知x+y=0.4,根据质量守恒可得28x+44y=16,联立解得x=0.1、y=0.3。
该混合气体的平均摩尔质量为 =40 g·mol-1。
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
(2)混合气体中碳原子的个数为_______(用NA 表示阿伏加德罗常数的值)。
0.4NA
CO和CO2分子中都只含1个碳原子,混合气体的总物质的量是0.4 mol,所以混合气体中碳原子的个数为0.4NA。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(3)将混合气体依次通过如图所示装置,最后收
集在气球中(体积在标准状况下测定)。
①气球中收集到的气体的质量为______。
2.8 g
2
二氧化碳被氢氧化钠吸收,气球中收集到的气体是CO,CO的摩尔质量为28 g·mol-1,其质量m=0.1 mol×28 g·mol-1=2.8 g。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
②气球中收集到的气体中,电子总数为
________(用NA 表示,假设气体全部进
入气球中)。
1.4NA
2
1个CO分子中有14个电子,气球中收集到的气体是0.1 mol CO,电子总数为1.4NA。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
③气球的体积为______ L(忽略气球弹性的
影响)。
2.24
2
气球中收集到的气体是0.1 mol CO,标准状况下,气球的体积为0.1 mol
×22.4 L·mol-1=2.24 L。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
④若将混合气体通入足量的 Na2O2 中,转移
的电子数为_______(用NA 表示)。
0.3NA
2
若将混合气体通入足量的 Na2O2中,发生反应:2CO2+2Na2O2===
2Na2CO3+O2,该反应为过氧化钠的歧化反应,0.3 mol CO2参与反应,生成0.15 mol氧气,转移0.3NA个电子。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
15.(2023·河北邢台高一期末)我国化学家侯德榜发明的“联合制碱法”为世界制碱工业做出了巨大贡献,该法利用的原理为NaCl+CO2+NH3+H2O===NaHCO3↓+NH4Cl。根据要求回答下列问题:
(1)同温同压下,等物质的量的CO2和NH3,前者与后者的分子数之比为______,原子总数之比为______,密度之比为________。
2
1∶1
3∶4
44∶17
同温同压下,等物质的量的CO2和NH3,分子数之比等于物质的量之比,前者与后者的分子数之比为1∶1,原子总数之比为3∶4,密度之比等于摩尔质量之比为44∶17。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(2)与标准状况下6.72 L CO2中所含的氧原子数相等的H2O的质量为______ g,与该质量的水中所含的氢原子数相等的NH3在标准状况下的体积为______ L。
2
10.8
8.96
标准状况下6.72 L CO2的物质的量是 =0.3 mol,所含的氧原子的物质的量是0.6 mol,则H2O的物质的量是0.6 mol,质量为0.6 mol
×18 g·mol-1=10.8 g,该质量的水中含1.2 mol氢原子,则NH3物质的量为0.4 mol,在标准状况下的体积为0.4 mol×22.4 L·mol-1=8.96 L。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(3)将一定量CO2和NH3混合测得混合气体中碳元素与氮元素的质量之比为3∶7,则该混合气体中CO2与NH3物质的量之比为______,该混合气体的密度是同温同压下氢气密度的_____倍。
2
1∶2
13
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
返回
本课结束
