2.1研究与实践1 了解纯碱的生产历史 课件(28张PPT)
文档属性
| 名称 | 2.1研究与实践1 了解纯碱的生产历史 课件(28张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-17 17:21:00 | ||
图片预览






文档简介
(共28张PPT)
研究与实践1 了解纯碱的生产
历史
第二章 第一节
【研究目的】
纯碱是一种重要的化工原料,具有广泛的用途。通过查阅资料,了解纯碱的生产历史,感受化学工业发展过程中技术进步的重要性,以及建设生态文明的意义。
【纯碱的生产历史】
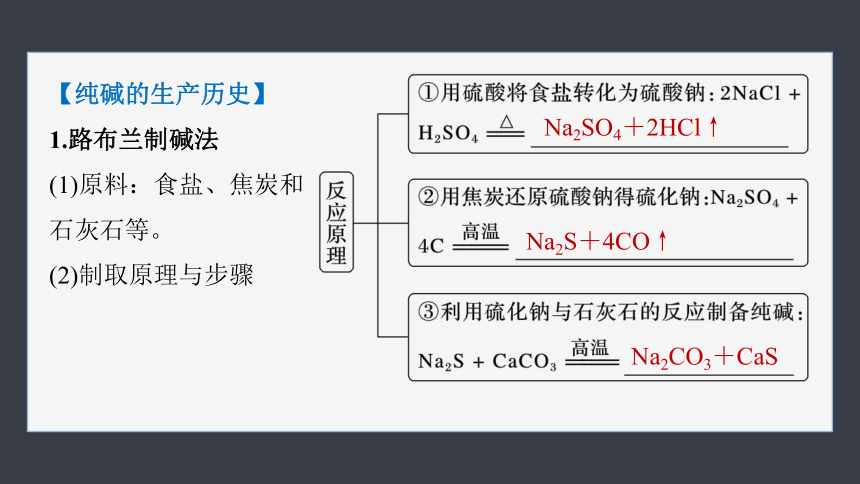
1.路布兰制碱法
(1)原料:食盐、焦炭和
石灰石等。
(2)制取原理与步骤
Na2SO4+2HCl↑
Na2S+4CO↑
Na2CO3+CaS
(3)制取方法评价
路布兰制取纯碱,主要生产过程在固相中进行,难以连续生产,又需硫酸做原料,设备腐蚀严重,产品质量不纯,原料利用不充分,价格较贵,所以在20世纪20年代被淘汰。
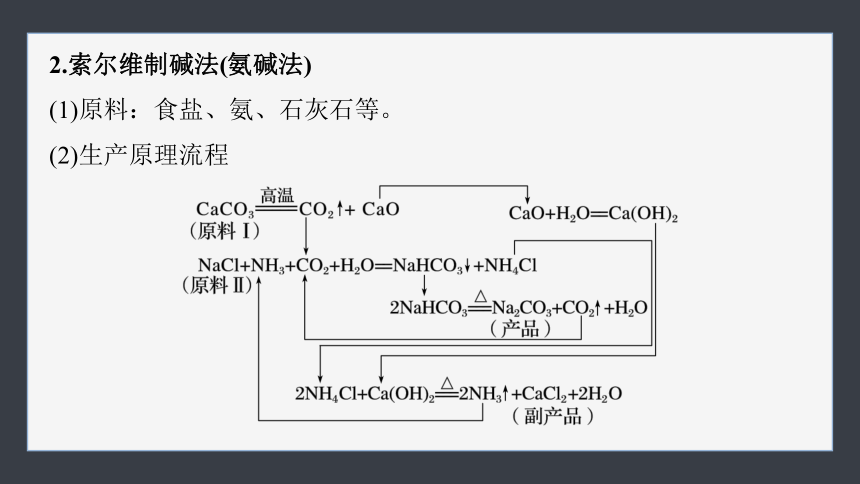
2.索尔维制碱法(氨碱法)
(1)原料:食盐、氨、石灰石等。
(2)生产原理流程
(3)制取方法评价
此法食盐利用率比路布兰制碱法高,产品较纯净,成本低。
缺点:原料中一半成分未能转化为产品。
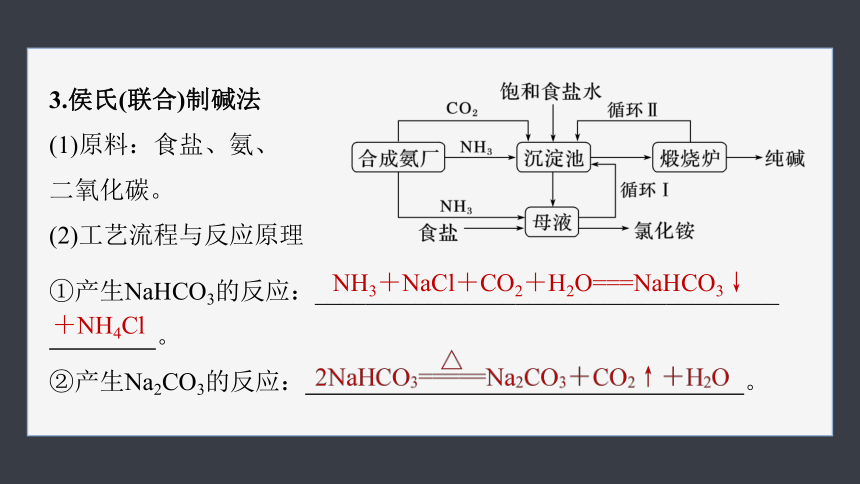
3.侯氏(联合)制碱法
(1)原料:食盐、氨、
二氧化碳。
(2)工艺流程与反应原理
①产生NaHCO3的反应:_____________________________________
。
②产生Na2CO3的反应: 。
NH3+NaCl+CO2+H2O===NaHCO3↓
+NH4Cl
(3)制取方法评价
①符合现在提倡的“绿色化学的要求”,提高了原料(NaCl)的利用率,不产生无用的CaCl2。
②利用了大规模联合生产的优越性,利用一个厂的废料,作为另一个厂的主要原料。如合成氨厂的废料CO2可以作为碱厂的主要原料;碱厂无用的Cl-可以代替价格比较昂贵的硫酸用来固定氨,制成氮肥,降低了成本,提高了综合经济效益。
1.侯氏制碱法中,向饱和食盐水中是先通NH3还是先通CO2?为什么?
深度思考
2.低温下,向母液中通入NH3并加入NaCl细粒,为什么可促使NH4Cl析出?
提示 低温下,NH4Cl的溶解度比NaCl的小,通入NH3并加入NaCl细粒,可生成更多的NH4Cl,促使该物质析出,也提高了NaCl的利用率。
3.侯氏制碱法与索尔维制碱法相比较,有哪些优点?
深度思考
提示 侯氏制碱法与索尔维制碱法相比较,其优点是食盐的利用率大大提高,用等量的食盐可生产更多的纯碱,同时得到氮肥氯化铵,不再产生废渣氯化钙,减少了对环境的污染,并且大大降低了纯碱和氮肥的成本,充分体现了大规模联合生产的优越性。
1
2
3
1.“NaCl+CO2+NH3+H2O===NaHCO3↓+NH4Cl”是著名的“侯氏制碱法”的重要反应。下面是4位同学对该反应涉及的有关知识发表的部分见解。其中不正确的是
跟踪训练
4
5
√
2.(2022·上海高一月考)“索尔维制碱法”与“侯氏制碱法”是常见的纯碱工业制法,下列关于两者说法正确的是
A.两者生产原料来源相同
B.两者均使用了高效催化剂
C.侯氏制碱法将索尔维制碱法与合成氨法两种工艺联合了起来
D.索尔维制碱法食盐利用率更高
1
2
3
跟踪训练
4
5
√
1
2
3
跟踪训练
分析可知两者生产原料来源不相同,故A错误;
过程分析可知,两者均未使用高效催化剂,故B错误;
由原理分析可知,索尔维制碱法食盐利用率低,故D错误。
4
5
1
2
3
跟踪训练
3.如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是
A.a先通入CO2,然后b通入NH3,c中放碱石灰
B.b先通入NH3,然后a通入CO2,c中放碱石灰
C.a先通入NH3,然后b通入CO2,c中放蘸有稀
硫酸的脱脂棉
D.b先通入CO2,然后a通入NH3,c中放蘸有稀硫酸的脱脂棉
4
5
√
1
2
3
跟踪训练
4
5
NH3的溶解度较大,为防止倒吸,b通入CO2,
a通NH3,要在饱和食盐水中先通入NH3然后
再通入CO2,否则CO2通入后会从水中逸出,
得到的产品会很少;尾气主要是CO2和NH3,
其中NH3对环境影响较大,要吸收尾气,而NH3是碱性气体,所以在c装置中要装酸性物质,故A、B、D项错误、C项正确。
1
2
3
跟踪训练
4
5
4.海洋是人类宝贵的自然资源,海水“制碱”体现了化学科学在改造物质中的智慧。某厂生产纯碱的工艺流程如图所示,下列说法错误的是
A.CO2可以循环利用
B.进入流程Ⅱ的滤液必须再经适量稀盐酸
处理
C.试剂2为Na2CO3溶液
D.NH3与CO2的通入顺序不能改变
√
灼烧时会产生二氧化碳和水,故CO2可以在流程Ⅱ循环利用,A正确;
NH3与CO2的通入顺序不能改变,因为碱性溶液更容易吸收二氧化碳,D正确。
1
2
3
跟踪训练
4
5
5.某化学兴趣小组模拟“侯氏制碱法”制纯碱并进行后续实验。
Ⅰ.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用如图所示装置制取NaHCO3,然后再将NaHCO3制
备成Na2CO3。
1
2
3
跟踪训练
4
5
(1)装置甲中反应的离子方程式为
____________________________
_______;装置乙的作用是______________________,反应的化学方程式为___________________________________。
CaCO3+2H+===Ca2++CO2↑
+H2O
除去CO2中的HCl气体
NaHCO3+HCl===NaCl+H2O+CO2↑
装置甲中碳酸钙与稀盐酸反应生成氯化钙、二氧化碳和水,反应的离子方程式是CaCO3+2H+===Ca2++CO2↑+H2O;装置乙的作用是用碳酸氢钠除去二氧化碳中的氯化氢,反应的化学方程式为NaHCO3+HCl===NaCl+H2O+CO2↑。
1
2
3
跟踪训练
4
5
(2)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3。装置丙中可得两种产物,分别是NaHCO3和另一种盐,装置丙中反应的化学方程式为_________________
__________________________。
1
2
3
跟踪训练
4
5
NH3+CO2+H2O+
NaCl===NaHCO3↓+NH4Cl
1
2
3
跟踪训练
4
5
装置丙中氯化钠与二氧化碳、氨气反应可得两种产物,分别是NaHCO3
和另一种盐,根据元素守恒,另一种盐是氯化铵,反应的化学方程式是NH3+CO2+H2O+NaCl===NaHCO3↓+NH4Cl。
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有________、洗涤固体、_________,最后一步发生反应的化学方程式为
__________________________________。
1
2
3
跟踪训练
4
5
过滤
灼烧
1
2
3
跟踪训练
4
5
用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有过滤、洗涤固体、灼烧,灼烧碳酸氢钠发生反应的化学方程式为2NaHCO3
Na2CO3+H2O+CO2↑。
Ⅱ.测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有
NaHCO3,请选择下列装置
设计实验,并完成下表:
1
2
3
跟踪训练
4
5
选择的装置(填编号) 实验现象 实验结论
样品中含NaHCO3
A、B
B中澄清石灰水变浑浊
C中物质变蓝
C中物质变蓝,B中澄清石灰水变浑浊
(或A、C)
(或A、C、B)
1
2
3
跟踪训练
4
5
用装置A加热分解 NaHCO3,用澄清石灰水检验是否有二氧化碳气体放出,选择装置B,若澄清石灰水变浑浊,则含有NaHCO3。
(5)测定该纯碱样品的纯度:称取m1 g样品置于小烧杯中,加水溶解,滴加足量CaCl2溶液,将反应混合物过滤、洗涤、干燥、称量,得到固体
的质量为m2 g,则该纯碱样品的纯度为________。
1
2
3
跟踪训练
4
5
1
2
3
跟踪训练
4
5
设样品中Na2CO3的质量为x g,CaCl2与Na2CO3反应生成碳酸钙和氯化钠:
CaCl2+Na2CO3===CaCO3↓+2NaCl
106 100
x g m2 g
本课结束
研究与实践1 了解纯碱的生产
历史
第二章 第一节
【研究目的】
纯碱是一种重要的化工原料,具有广泛的用途。通过查阅资料,了解纯碱的生产历史,感受化学工业发展过程中技术进步的重要性,以及建设生态文明的意义。
【纯碱的生产历史】
1.路布兰制碱法
(1)原料:食盐、焦炭和
石灰石等。
(2)制取原理与步骤
Na2SO4+2HCl↑
Na2S+4CO↑
Na2CO3+CaS
(3)制取方法评价
路布兰制取纯碱,主要生产过程在固相中进行,难以连续生产,又需硫酸做原料,设备腐蚀严重,产品质量不纯,原料利用不充分,价格较贵,所以在20世纪20年代被淘汰。
2.索尔维制碱法(氨碱法)
(1)原料:食盐、氨、石灰石等。
(2)生产原理流程
(3)制取方法评价
此法食盐利用率比路布兰制碱法高,产品较纯净,成本低。
缺点:原料中一半成分未能转化为产品。
3.侯氏(联合)制碱法
(1)原料:食盐、氨、
二氧化碳。
(2)工艺流程与反应原理
①产生NaHCO3的反应:_____________________________________
。
②产生Na2CO3的反应: 。
NH3+NaCl+CO2+H2O===NaHCO3↓
+NH4Cl
(3)制取方法评价
①符合现在提倡的“绿色化学的要求”,提高了原料(NaCl)的利用率,不产生无用的CaCl2。
②利用了大规模联合生产的优越性,利用一个厂的废料,作为另一个厂的主要原料。如合成氨厂的废料CO2可以作为碱厂的主要原料;碱厂无用的Cl-可以代替价格比较昂贵的硫酸用来固定氨,制成氮肥,降低了成本,提高了综合经济效益。
1.侯氏制碱法中,向饱和食盐水中是先通NH3还是先通CO2?为什么?
深度思考
2.低温下,向母液中通入NH3并加入NaCl细粒,为什么可促使NH4Cl析出?
提示 低温下,NH4Cl的溶解度比NaCl的小,通入NH3并加入NaCl细粒,可生成更多的NH4Cl,促使该物质析出,也提高了NaCl的利用率。
3.侯氏制碱法与索尔维制碱法相比较,有哪些优点?
深度思考
提示 侯氏制碱法与索尔维制碱法相比较,其优点是食盐的利用率大大提高,用等量的食盐可生产更多的纯碱,同时得到氮肥氯化铵,不再产生废渣氯化钙,减少了对环境的污染,并且大大降低了纯碱和氮肥的成本,充分体现了大规模联合生产的优越性。
1
2
3
1.“NaCl+CO2+NH3+H2O===NaHCO3↓+NH4Cl”是著名的“侯氏制碱法”的重要反应。下面是4位同学对该反应涉及的有关知识发表的部分见解。其中不正确的是
跟踪训练
4
5
√
2.(2022·上海高一月考)“索尔维制碱法”与“侯氏制碱法”是常见的纯碱工业制法,下列关于两者说法正确的是
A.两者生产原料来源相同
B.两者均使用了高效催化剂
C.侯氏制碱法将索尔维制碱法与合成氨法两种工艺联合了起来
D.索尔维制碱法食盐利用率更高
1
2
3
跟踪训练
4
5
√
1
2
3
跟踪训练
分析可知两者生产原料来源不相同,故A错误;
过程分析可知,两者均未使用高效催化剂,故B错误;
由原理分析可知,索尔维制碱法食盐利用率低,故D错误。
4
5
1
2
3
跟踪训练
3.如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是
A.a先通入CO2,然后b通入NH3,c中放碱石灰
B.b先通入NH3,然后a通入CO2,c中放碱石灰
C.a先通入NH3,然后b通入CO2,c中放蘸有稀
硫酸的脱脂棉
D.b先通入CO2,然后a通入NH3,c中放蘸有稀硫酸的脱脂棉
4
5
√
1
2
3
跟踪训练
4
5
NH3的溶解度较大,为防止倒吸,b通入CO2,
a通NH3,要在饱和食盐水中先通入NH3然后
再通入CO2,否则CO2通入后会从水中逸出,
得到的产品会很少;尾气主要是CO2和NH3,
其中NH3对环境影响较大,要吸收尾气,而NH3是碱性气体,所以在c装置中要装酸性物质,故A、B、D项错误、C项正确。
1
2
3
跟踪训练
4
5
4.海洋是人类宝贵的自然资源,海水“制碱”体现了化学科学在改造物质中的智慧。某厂生产纯碱的工艺流程如图所示,下列说法错误的是
A.CO2可以循环利用
B.进入流程Ⅱ的滤液必须再经适量稀盐酸
处理
C.试剂2为Na2CO3溶液
D.NH3与CO2的通入顺序不能改变
√
灼烧时会产生二氧化碳和水,故CO2可以在流程Ⅱ循环利用,A正确;
NH3与CO2的通入顺序不能改变,因为碱性溶液更容易吸收二氧化碳,D正确。
1
2
3
跟踪训练
4
5
5.某化学兴趣小组模拟“侯氏制碱法”制纯碱并进行后续实验。
Ⅰ.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用如图所示装置制取NaHCO3,然后再将NaHCO3制
备成Na2CO3。
1
2
3
跟踪训练
4
5
(1)装置甲中反应的离子方程式为
____________________________
_______;装置乙的作用是______________________,反应的化学方程式为___________________________________。
CaCO3+2H+===Ca2++CO2↑
+H2O
除去CO2中的HCl气体
NaHCO3+HCl===NaCl+H2O+CO2↑
装置甲中碳酸钙与稀盐酸反应生成氯化钙、二氧化碳和水,反应的离子方程式是CaCO3+2H+===Ca2++CO2↑+H2O;装置乙的作用是用碳酸氢钠除去二氧化碳中的氯化氢,反应的化学方程式为NaHCO3+HCl===NaCl+H2O+CO2↑。
1
2
3
跟踪训练
4
5
(2)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3。装置丙中可得两种产物,分别是NaHCO3和另一种盐,装置丙中反应的化学方程式为_________________
__________________________。
1
2
3
跟踪训练
4
5
NH3+CO2+H2O+
NaCl===NaHCO3↓+NH4Cl
1
2
3
跟踪训练
4
5
装置丙中氯化钠与二氧化碳、氨气反应可得两种产物,分别是NaHCO3
和另一种盐,根据元素守恒,另一种盐是氯化铵,反应的化学方程式是NH3+CO2+H2O+NaCl===NaHCO3↓+NH4Cl。
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有________、洗涤固体、_________,最后一步发生反应的化学方程式为
__________________________________。
1
2
3
跟踪训练
4
5
过滤
灼烧
1
2
3
跟踪训练
4
5
用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有过滤、洗涤固体、灼烧,灼烧碳酸氢钠发生反应的化学方程式为2NaHCO3
Na2CO3+H2O+CO2↑。
Ⅱ.测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有
NaHCO3,请选择下列装置
设计实验,并完成下表:
1
2
3
跟踪训练
4
5
选择的装置(填编号) 实验现象 实验结论
样品中含NaHCO3
A、B
B中澄清石灰水变浑浊
C中物质变蓝
C中物质变蓝,B中澄清石灰水变浑浊
(或A、C)
(或A、C、B)
1
2
3
跟踪训练
4
5
用装置A加热分解 NaHCO3,用澄清石灰水检验是否有二氧化碳气体放出,选择装置B,若澄清石灰水变浑浊,则含有NaHCO3。
(5)测定该纯碱样品的纯度:称取m1 g样品置于小烧杯中,加水溶解,滴加足量CaCl2溶液,将反应混合物过滤、洗涤、干燥、称量,得到固体
的质量为m2 g,则该纯碱样品的纯度为________。
1
2
3
跟踪训练
4
5
1
2
3
跟踪训练
4
5
设样品中Na2CO3的质量为x g,CaCl2与Na2CO3反应生成碳酸钙和氯化钠:
CaCl2+Na2CO3===CaCO3↓+2NaCl
106 100
x g m2 g
本课结束
