第三章 第二节 第1课时 常见的合金及应用(82张PPT)
文档属性
| 名称 | 第三章 第二节 第1课时 常见的合金及应用(82张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 13.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-17 17:57:07 | ||
图片预览










文档简介
(共82张PPT)
第三章 第二节
第1课时 常见的合金及应用
1.能从合金结构与组成的角度理解合金的特殊性能,培养宏观辨识与微观探析
的能力。
2.能列举常见合金的组成和性能,能科学、合理的选择和使用金属材料,培养
学生的科学态度和社会责任感。
核心素养
发展目标
一、铁合金
二、铝和铝合金、新型合金
课时对点练
内容索引
随堂演练 知识落实
铁合金
一
1.合金
(1)由两种或两种以上的金属(或金属与非金属)熔合而成的具有______
的物质。
(2)合金具有优良的 、 或 性能;一般来说,合金的硬度 各成分金属,熔点 各成分金属。
金属
特性
物理
化学
机械
大于
低于
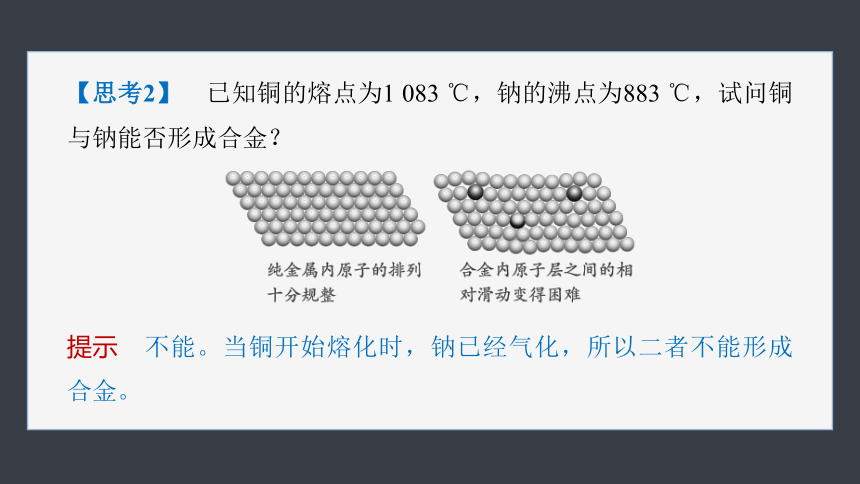
【思考1】 根据纯金属与合金的结构比较,说明合金的硬度比其成分金属大的原因。
提示 纯金属内所有原子的大小和形状相同,原子排列十分规整;加入或大或小的其他元素的原子后,改变了金属原子有规则的层状排列,使原子层之间的相对滑动变得困难,导致合金的硬度变大。
【思考2】 已知铜的熔点为1 083 ℃,钠的沸点为883 ℃,试问铜与钠能否形成合金?
提示 不能。当铜开始熔化时,钠已经气化,所以二者不能形成合金。
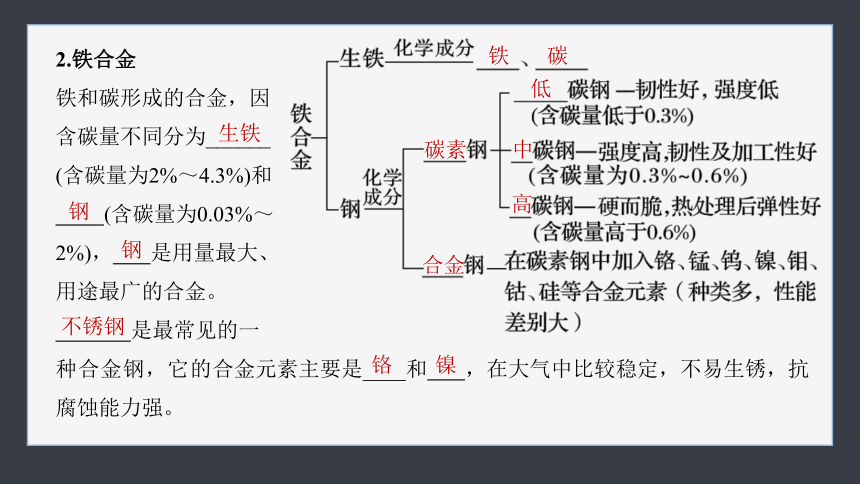
2.铁合金
铁和碳形成的合金,因
含碳量不同分为______
(含碳量为2%~4.3%)和
(含碳量为0.03%~
2%), 是用量最大、
用途最广的合金。
是最常见的一
种合金钢,它的合金元素主要是____和 ,在大气中比较稳定,不易生锈,抗腐蚀能力强。
生铁
钢
钢
不锈钢
铬
镍
铁
碳
低
碳素
中
高
合金
【思考3】 根据以上所述,说明碳素钢含碳量与其性能的关系。
提示 钢的含碳量越低,韧性越好,硬度越低;含碳量越高,韧性越差,硬度越高。
应用体验
1.判断正误
(1)合金一定是不同金属熔合而成的具有金属特性的化合物
(2)生铁的熔点比纯铁低,但机械强度和硬度比纯铁高
(3)生铁中的铁与纯铁的化学性质不同
(4)地震灾区重建要使用大量钢材,钢材是合金
×
×
√
√
应用体验
2.合金是一类用途广泛的金属材料,下列关于合金的说法正确的是
A.铜铝合金的硬度比铜和铝的都大,熔点比铜和铝的都低
B.合金只能由两种或两种以上的金属组成
C.合金的制备过程发生的是化学变化
D.铁合金不能与酸反应
√
合金是一种金属熔合其他金属或非金属形成的具有金属特性的混合物,合金中可以含有非金属元素,如生铁为铁与碳的合金,故B不符合题意;
合金的制备过程没有新物质生成,是物理变化,故C不符合题意;
铁合金中含有铁,能够与盐酸等反应生成盐和氢气,故D不符合题意。
应用体验
3.(2022·沈阳重点高中联合体高一月考)北宋沈括对生铁炼钢有这么一段评价:“世间锻铁所谓钢铁者,用柔铁屈盘之,乃以生铁陷其间,泥封炼之,锻令相入,谓入‘团钢’,亦谓之‘灌钢’。此乃伪钢耳……”,下列说法正确的是
A.生铁和钢都是铁的含碳合金,生铁中碳的含量较低
B.通过炼制和锻打,可以调节铁中元素的组成、元素的含量等来改变
铁的性能
C.高碳钢的韧性较好,低碳钢的硬度较大
D.不锈钢是一种常见的合金钢,它的合金元素主要是钨(W)和硅(Si)
√
生铁中碳的含量高于钢,A错误;
通过炼制和锻打,可以降低生铁中含碳量,除去生铁中有害元素P、S等,调整生铁中Si、Mn等的含量,改变铁的性能,B正确;
高碳钢硬度较大,韧性较差,低碳钢硬度较小,韧性较强,C错误;
不锈钢的合金元素主要是铬(Cr)、镍(Ni),常用来制造医疗器械、餐具等,D错误。
返回
铝和铝合金、新型合金
二
1.铝和铝合金
(1)铝是地壳中含量 的金属元素,常温下就能与空气中的______
发生反应。
【思考1】 常温下,铁和铝都能与氧气反应,为什么铁会因生锈报废,而铝制品却能稳定存在?
提示 铁与氧气反应生成的铁锈比较疏松,不能阻止内部的铁与氧气的进一步反应,所以铁会因生锈而报废;铝和氧气反应表面生成一层致密的氧化铝薄膜,这层膜能防止内部金属进一步被氧化,故铝制品在空气中能稳定存在。
最多
氧气
特别提醒 在常温下形成致密保护膜的金属,如铝、镁等金属;铁在高温下形成致密保护膜,俗称“烤蓝”;铁或铝遇到浓H2SO4或浓HNO3时,迅速反应生成致密氧化膜,称为钝化。
(2)铝合金
铝合金是目前用途广泛的合金之一,硬铝是在铝中添加了一定比例的Cu、Mg、Mn、Si,它的密度 ,强度 ,具有较强的抗腐蚀能力,是制造飞机和宇宙飞船的理想材料。
小
高
2.铝、氧化铝的性质
(1)实验探究
实验操作
实验现象 铝片 ,有无色气泡冒出,将点燃的木条放在试管口有_______ 试管①中一开始无气泡产生,一段时间
后,铝片 ,有无色气泡冒出;试管②中铝片溶解,立即产生无色气泡。将点燃的木条放在试管口,都有_______
逐渐溶解
溶解
爆鸣声
爆鸣声
化学方程式 _____________________ ________、 _____________________ ______ _______________________
____________、
_______________________
____________________
离子方程式 _____________________ ________、 _____________________ ______ _______________________
____________、
_______________________
__________________
Al2O3+6HCl===2AlCl3
+3H2O
2Al+6HCl===2AlCl3+3H2↑
Al2O3+2NaOH+3H2O===
2Na[Al(OH)4]
2Al+2NaOH+6H2O===
2Na[Al(OH)4]+3H2↑
Al2O3+6H+===2Al3++3H2O
2Al+6H+===2Al3++3H2↑
(2)两性氧化物
既能与 反应生成盐和水,又能与 反应生成盐和水的氧化物,如Al2O3等,其与强酸、强碱反应的离子方程式分别为
Al2O3+6H+===2Al3++3H2O,
Al2O3+2OH-+3H2O===2[Al(OH)4]-。
酸
碱
【思考2】 (1)为什么铝制餐具不适宜用来蒸煮或长时间盛放酸性、碱性食物?
提示 由于铝和氧化铝能跟酸、碱反应,因此铝制餐具不宜用来蒸煮或长期存放酸性、碱性食物。
(2)向集满CO2的铝制易拉罐中加入过量NaOH浓溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起。上述实验过程中发生的离子反应有_________________________
__________________________________________________________________________。
向集满CO2的铝制易拉罐中加入过量NaOH浓溶液,易拉罐渐渐凹瘪,是由于CO2被NaOH溶液吸收,气体压强减小;铝制易拉罐表面的Al2O3会与NaOH溶液反应;后NaOH溶液与Al发生反应生成H2,使易拉罐凸起。
Al2O3+2OH-+3H2O ===2[Al(OH)4]-、2Al+2OH-+6H2O===
2[Al(OH)4]-+3H2↑
3.新型合金
(1)储氢合金:一类能够大量吸收H2,并与H2结合成_____________
的材料。如Ti-Fe合金、La-Ni合金等,为氢气作为能源的实际应用起到重要的推动作用。
(2)其他新型合金: 、 和 等新型合金广泛应用于航空航天、生物工程和电子工业等领域。
钛合金
金属氢化物
耐热合金
形状记忆合金
应用体验
1.(2022·广东清远高一月考)铝是地壳中含量最高的金属元素,下列关于铝及其化合物的性质、用途的说法错误的是
A.纯铝的硬度和强度较小,不适合用于制造机器零部件
B.可用NaOH溶液除去Fe2O3粉末中少量的Al2O3
C.铝合金是用来制造飞机和宇宙飞船的理想材料
D.盐酸可以除去镁粉中的铝粉
√
制造机器零部件要求材料硬度高、强度大,而纯铝硬度、强度较小,不适合,A正确;
氧化铁不与氢氧化钠溶液反应,氧化铝为两性氧化物,与氢氧化钠溶液反应生成Na[Al(OH)4],B正确;
铝合金硬度高、质量轻,是用来制造飞机和宇宙飞船的理想材料,C正确;
Mg、Al均与盐酸反应,应用NaOH溶液除去镁粉中的铝粉,D错误。
应用体验
2.下列关于新型合金材料说法不正确的是
A.镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料
B.钛合金生物相容性好,强度大,可作人造骨骼
C.形状记忆合金可在使合金发生形变的作用力消失后恢复原状
D.利用合金的熔点低于成分金属这一特点可制得耐热合金
√
储氢材料是一类能可逆地吸收和释放氢气的材料,镧镍合金能大量吸收H2形成金属氢化物,是目前解决氢气的储存和运输问题的材料,故A正确;
钛合金与人体有很好的相容性,且性质稳定,抗腐蚀性强,所以可用来制造人造骨骼,故B正确;
耐热合金的熔点很高,与合金的特性无关,故D错误。
由2Al+6HCl===2AlCl3+3H2↑、2Al+2NaOH+6H2O===2Na[Al(OH)4] +3H2↑可知,产生氢气的体积比为1∶3,需要盐酸和苛性钠的物质的量之比为1∶1,溶液的体积相同,故盐酸和苛性钠溶液的物质的量浓度之比也为1∶1。
应用体验
3.等体积的盐酸和苛性钠溶液分别与两份足量的铝粉反应,在相同条件下产生氢气的体积比为1∶3,则盐酸和苛性钠溶液的物质的量浓度之比为
A.1∶1 B.2∶1 C.3∶1 D.2∶3
√
返回
随堂演练 知识落实
1
2
3
4
1.(2022·无锡教育科学研究院高一质检)下列关于合金的叙述正确的是
A.铝合金硬度比纯铝小
B.生铁是铁碳合金,钢是纯净的铁单质
C.硬铝密度小、强度高,常用于制造飞机外壳
D.不锈钢和钢都是铁合金,性质完全相同
√
随堂演练
1
2
3
4
随堂演练
合金的硬度比其任一成分金属都大,铝合金硬度比纯铝大,A错误;
生铁是铁碳合金,钢的含碳量比生铁低,也是铁碳合金,B错误;
不锈钢和钢都是铁合金,但其内部结构和组分不同,性质不相同,D错误。
2.下列说法正确的是
A.Al2O3难溶于水,不与水反应,所以它不是Al(OH)3对应的氧化物
B.因为Al2O3是金属氧化物,所以它是碱性氧化物
C.Al2O3能跟所有的酸、碱溶液反应
D.Al2O3能跟强酸、强碱溶液反应
√
随堂演练
1
2
3
4
Al2O3虽然难溶于水,但是2Al(OH)3 Al2O3+3H2O,Al2O3和
Al(OH)3中Al的化合价相同,所以Al2O3是Al(OH)3对应的氧化物;Al2O3是两性氧化物;Al2O3与强酸、强碱反应,与弱碱不反应。
3.向某溶液中加入铝粉能放出H2,下列各组离子一定不能在该溶液中大量共存的是
随堂演练
1
2
3
4
√
随堂演练
1
2
3
4
加入铝粉能放出H2,说明该溶液可能呈酸性,也可能呈碱性。A选项中的4种离子可在酸性溶液中大量共存;
C选项中的离子在碱性溶液中可以大量共存;
D选项中的离子在酸性溶液、碱性溶液中都可以大量共存。
4.铁和铝是科技、生产、生活中应用最广泛的金属材料。现有铁、铝的混合物进行如下实验:
随堂演练
1
2
3
4
(1)操作X的名称是______。
向铁、铝混合物中加入足量NaOH溶液,Al溶解,Fe不溶,操作X为过滤。
过滤
随堂演练
1
2
3
4
(2)气体A是_____。
Al与氢氧化钠溶液反应产生氢气,气体A为H2。
H2
随堂演练
1
2
3
4
(3)A与Cl2混合光照可能发生爆炸,生成______(填化学式),A在该反应中作为________(填“氧化剂”或“还原剂”)。
H2与Cl2反应生成HCl。
HCl
还原剂
随堂演练
1
2
3
4
(4)溶液B中阴离子除OH-外还有____________,溶液D中存在的金属离子为______。
Fe2+
返回
[Al(OH)4]-
溶液B中阴离子有OH-、[Al(OH)4]-,溶液D中金属离子为Fe2+。
课时对点练
1
2
3
4
5
6
7
8
9
题组一 合金及铁合金
1.(2021·广东,1)今年五一假期,人文考古游持续成为热点。很多珍贵文物都记载着中华文明的灿烂成就,具有深邃的文化寓意和极高的学术价值。下列国宝级文物主要由合金材料制成的是
10
11
12
13
14
15
对点训练
选项 A B C D
文物
名称 铸客大铜鼎 河姆渡出土陶灶 兽首玛瑙杯 角形玉杯
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
铸客大铜鼎属于铜的合金,A符合题意;
河姆渡出土陶灶属于陶器,主要成分为硅酸盐,不属于合金,B不符合题意;
兽首玛瑙杯的主要成分为二氧化硅,不属于合金,C不符合题意;
角形玉杯的主要成分为硅酸盐,不属于合金,D不符合题意。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2.下列与合金相关的叙述正确的有
①合金的硬度一般比它的成分金属的硬度都大
②合金的熔点一般比它的成分金属的熔点都低
③改变原料的配比、变更制造合金的工艺,可得到不同性能的合金
④合金的导电性比纯金属的更强
⑤合金的应用范围比纯金属更广
A.①②⑤ B.①②③⑤
C.②③④ D.①②④
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
①合金的硬度一般大于其成分金属的硬度,故正确;
②合金的熔点一般低于其成分金属的熔点,故正确;
③合金的性质与合金的原料配比以及制造工艺有关,所以改变原料的配比、变更制造合金的工艺,可以制得具有不同性能的合金,故正确;
④合金的导电性不一定比纯金属更强,比如铝合金的导电性比纯铝要差,故错误;
⑤合金一般比其成分金属熔点低,硬度大,具有更好的机械加工性能,故应用更广泛,故正确。
2
3.《五金·铁》中记载:“若造熟铁,则生铁流出时,相连数尺内,低下数寸,筑一方塘,短墙抵之。其铁流入塘内,数人执柳木排立墙上……众人柳棍疾搅,即时炒成熟铁。”下列说法不正确的是
A.碳素钢与生铁的组成元素相同
B.生铁比熟铁质地更硬,延展性稍差
C.炒铁是为了提高铁水中的碳含量
D.该法与近代向生铁水中吹空气炼钢异曲同工
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
碳素钢与生铁都是铁碳合金,组成元素相同,故A正确;
炒铁过程中降低了铁水中的碳含量,从而将生铁转化成熟铁,故C错误;
该冶炼方法和近代向生铁水中吹空气炼钢,都是利用空气中氧气氧化C元素,其原理基本相同,故D正确。
题组二 铝和铝合金
4.镁铝合金质优体轻,又不易锈蚀,大量用于航空工业、造船工业、日用化工等领域。下列关于镁铝合金性质的叙述中,不正确的是
A.此合金的熔点比镁和铝的熔点都低
B.此合金能全部溶解于足量稀盐酸中
C.此合金能全部溶解于足量氢氧化钠溶液中
D.此合金的硬度比镁和铝的硬度都大
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
合金的熔点一般比各成分金属的熔点低,A正确;
镁铝合金的主要成分是镁和铝,Mg和Al均能与稀盐酸反应,则合金能全部溶解于足量稀盐酸中,B正确;
铝能与氢氧化钠溶液反应但镁不能,镁铝合金不能全部溶解于足量氢氧化钠溶液中,C错误;
合金的硬度一般比各成分金属的硬度大,D正确。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
5.(2023·大连高一期中)足量下列物质与相同质量的铝反应,放出氢气且消耗溶质物质的量最少的是
A.盐酸 B.稀硫酸
C.氢氧化钠溶液 D.氯化钠溶液
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
氯化钠溶液与铝不反应,盐酸、稀硫酸、氢氧化钠溶液均能与铝反应生成氢气,化学方程式分别为2Al+6HCl===2AlCl3+3H2↑、2Al+3H2SO4===Al2(SO4)3+3H2↑、2Al+2NaOH+6H2O===2Na[Al(OH)4]+3H2↑,故1 mol铝完全反应时,消耗盐酸、稀硫酸和氢氧化钠溶液中溶质的物质的量分别为3 mol、1.5 mol、1 mol,则消耗氢氧化钠的物质的量最少,C正确。
2
6.在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡。然后将两球分别浸没在溶液质量相等的稀烧碱溶液和硫酸铜溶液中一段时间,如图所示。下列说法正确的是
A.铝球表面有气泡产生,且有白色沉淀生成,
杠杆不平衡
B.铝球表面有气泡产生,溶液澄清;铁球表面有红色物质析出,溶液蓝
色变浅,杠杆右边下沉
C.反应后去掉两烧杯,杠杆仍平衡
D.右边球上出现红色,左边溶液的c(OH-)增大
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
左烧杯中的铝球与氢氧化钠溶液反应:2Al+2NaOH+6H2O===
2Na[Al(OH)4]+3H2↑,有一部分铝溶解,
并产生气体,生成Na[Al(OH)4];右烧杯铁球
浸在硫酸铜溶液中发生反应:Fe+CuSO4
===FeSO4+Cu,铁球表面有红色物质析出,铁球质量增加,溶液蓝色变浅,左边消耗OH-,使c(OH-)减小。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
题组三 新型合金
7.储氢合金是一种新型合金。下列关于储氢合金的说法错误的是
A.储氢合金是一类能够大量吸收氢气,并与氢气结合成金属氢化物的新型
合金材料
B.储氢合金具有储氢量大、能耗低、使用方便的特点
C.储氢合金具有很强的捕捉氢的能力,氢分子在合金中先分解成单个的原
子,氢原子进入合金原子的缝隙中,并与合金生成金属氢化物
D.储氢合金形成的金属氢化物性质稳定,高温条件下也不易分解
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
储氢合金形成的金属氢化物既容易形成,加热又容易分解,室温下吸、放氢的速率快,故D错误。
8.将一个预先做好的“ICE”形状的镍钛合金破坏形状后,只要在热水中浸泡,其便会恢复原来形状。下列说法正确的是
A.记忆合金的形状变化属于化学变化
B.合金的熔点一般比各组分金属低,硬度比各组分金属小
C.形状记忆合金在医疗上可用来接断骨等,在日常生活中可制眼镜框
架等
D.钛合金的化学性质与钛单质完全相同
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
记忆合金的形状变化没有生成新物质,属于物理变化,A不正确;
合金的熔点一般比组分金属的低,但硬度要比组分金属的大,B不正确;
钛合金中因为加入了其他金属,化学性质与钛单质不完全相同,D不正确。
2
9.下列变化不可能通过一步反应直接完成的是
A.Al(OH)3→Al2O3 B.Al2O3→Al(OH)3
C.Al→[Al(OH)4]- D.AlCl3→Al(OH)3
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
√
氢氧化铝受热分解生成氧化铝和水,A可以一步完成;
Al2O3难溶于水,应先将Al2O3与酸反应变成Al3+或与强碱溶液反应生成[Al(OH)4]-后,然后加入弱碱或弱酸反应生成Al(OH)3,B不可以一步完成;
Al和NaOH溶液反应生成Na[Al(OH)4]和H2,C可以一步完成;
氯化铝和弱碱反应生成氢氧化铝,D可以一步完成。
10.(2022·张家口高一检测)下列离子方程式正确的是
A.铁与稀硫酸的反应:2Fe+6H+===2Fe3++3H2↑
B.将碳酸氢钠溶液与NaOH溶液混合: +OH-===CO2↑+H2O
C.氧化铝与烧碱溶液反应:Al2O3+2OH-===2Al3++4O2-+H2O
D.铝与NaOH溶液反应:2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
铁与稀硫酸反应生成硫酸亚铁和氢气,反应的离子方程式是Fe+2H+===Fe2++H2↑,故A错误;
氧化铝与烧碱溶液反应生成Na[Al(OH)4],反应的离子方程式是Al2O3+2OH-+3H2O===2[Al(OH)4]-,故C错误。
2
综合强化
11.用除去表面氧化膜的铝箔包装0.1 mol金属钠,用针扎出一些小孔,放入水中,完全反应后,用排水集气法收集反应产生的气体,则收集到的气体为(标准状况)
A.O2和H2的混合气体 B.1.12 L H2
C.大于1.12 L H2 D.小于1.12 L H2
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
首先钠与水反应生成NaOH和H2,铝再与NaOH溶液反应生成Na[Al(OH)4]
和H2,收集到的气体为两者产生的氢气之和,0.1 mol钠与水反应产生标准状况下气体1.12 L,再加上铝与NaOH溶液反应放出的H2,最终收集到的H2大于1.12 L。
12.甲、乙两个烧杯中分别盛有100 mL 4.0 mol·L-1的盐酸和100 mL
4.0 mol·L-1 NaOH溶液,向两个烧杯中均加入5.4 g铝粉,在相同状况下产生气体的体积比为
A.1∶1 B.2∶3 C.3∶2 D.3∶1
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
甲、乙两烧杯中含HCl、NaOH的物质的量都为0.4 mol,根据化学方程式:2Al+6HCl===2AlCl3+3H2↑、2Al+2NaOH+6H2O===2Na[Al(OH)4]
+3H2↑可知,5.4 g(即0.2 mol)Al分别与盐酸和NaOH溶液反应时,盐酸量不足而NaOH过量,故Al与盐酸反应生成0.2 mol H2,与NaOH溶液反应生成0.3 mol H2,相同状况下其体积比为2∶3。
13.合金是重要的金属材料。
(1)下列材料不属于合金的是____(填字母)。
A.铸造下水道井盖的生铁 B.储氢用的La-Ni合金
C.可用于机器人“皮肤”的橡胶 D.可用于军用车辆的超级钢
(2)生铁是常用的合金,生铁属于________(填“纯净物”或“混合物”)。
(3)黄铜是铜锌合金,将纯铜片和黄铜片互相刻划
(如图所示),纯铜片上留下明显的划痕,说明:
__________________________。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
C
混合物
黄铜的硬度比纯铜的硬度大
(4)黄铜渣中约含Zn 7%、ZnO 31%、Cu 50%、CuO 5%,其余为杂质。处理黄铜渣可得到硫酸锌,其主要流程如下(杂质不溶于水、不参与反应):
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
由于锌的活动性排在氢和铜的前面,故锌既可以与硫酸反应,也可以与硫酸铜反应,反应的化学方程式分别为Zn+H2SO4===ZnSO4+H2↑,Zn+CuSO4===ZnSO4+Cu。
①Ⅱ中发生反应的化学方程式为________________________________________
___________。
Zn+H2SO4===ZnSO4+H2↑,Zn+CuSO4===
ZnSO4+Cu
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
由题中流程可知,操作Ⅰ过滤除去铜和杂质,操作Ⅱ过滤是除去锌和置换出的铜。因氧化锌的质量大于氧化铜,且锌也能和硫酸反应生成硫酸锌,而铜和硫酸不反应,故溶液A中硫酸锌的质量大于硫酸铜。
②下列说法正确的是_____(填字母)。
a.Ⅰ、Ⅱ中的操作均包含过滤
b.溶液A中ZnSO4的质量大于CuSO4
ab
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
14.明矾晶体[KAl(SO4)2·12H2O]在生产、生活中有广泛用途,如饮用水的净化、造纸工业的施胶剂、食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、Al2O3及少量SiO2和FeO·xFe2O3)可制备明矾,工艺流程如图:
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
回答下列问题:
(1)“滤渣①”的主要成分是
______(填化学式)。
2
SiO2
二氧化硅不溶于稀硫酸,可知“滤渣①”的主要成分是SiO2。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(2)加入稀硫酸酸化后,再经“一系列操作”可得到明矾晶体[KAl(SO4)2·
12H2O],则“一系列操作”是_________、_________、______、洗涤、干燥。
2
蒸发浓缩
冷却结晶
过滤
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
加入稀硫酸酸化后,再经“一系列操作”可得到明矾晶体[KAl(SO4)2·12H2O],由于明矾来自于无色滤液B,滤液主要是Na[Al(OH)4]溶
液,加入硫酸钾和稀硫酸酸化后经蒸发浓缩,冷却结晶,过滤,洗涤得到明矾晶体。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(3)流程中加入H2O2的作用是_________________,写出反应的离子方程式:__________________________________。
2
将Fe2+氧化为Fe3+
2Fe2++H2O2+2H+===2Fe3++2H2O
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
溶液中含有亚铁离子,由于氢氧化铁更难溶,则流程中加入H2O2的作用是将Fe2+氧化为Fe3+,该反应的离子方程式为2Fe2++
H2O2+2H+===2Fe3++2H2O。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
(4)若将铝灰投入过量的氢氧化钠溶液中,所得溶液的溶质除NaOH和Na2SiO3外,还含有_____________(填化学式)。写出生成气体的反应的化学方程式:_________________________________________。
Na[Al(OH)4]
2Al+2NaOH+6H2O===2Na[Al(OH)4]+3H2↑
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
15.铝镁合金已成为轮船制造、化工生产等行业的重要材料。某研究性学习小组的三位同学为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计下列三种不同实验方案进行探究。填写下列空白:
探究一
实验方案:铝镁合金 测定剩余固体质量。实验中发生反应的化学方程式是__________________________________________。
实验步骤:
(1)称取5.4 g铝镁合金粉末样品,投入体积为V、浓度为2.0 mol·L-1的NaOH溶液中,充分反应。为保证合金充分反应,NaOH溶液的体积V≥________。
2
97 mL
6H2O+2Al+2NaOH===2Na[Al(OH)4]+3H2↑
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
铝镁合金中镁的质量分数为3%时,5.4 g铝镁合金粉末样品中铝的质量为5.4 g×(1-3%)=5.4 g×97%,则:
2Al + 2NaOH+6H2O===2Na[Al(OH)4]+3H2↑
2 2
为保证合金充分反应,NaOH溶液的体积V≥97 mL。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将______(填“偏大”或“偏小”)。
2
偏大
镁上会附着Na[Al(OH)4]等物质,未洗涤固体会导致测定的镁的质量偏大,镁的质量分数将偏大。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
探究二
实验方案:铝镁合金 测定生成气体的
体积(实验装置如图所示)。
(1)某同学提出该实验装置不够完善,应在A、
B之间添加一个除酸雾的装置。你的意见是
________(填“需要”或“不需要”)。
2
不需要
因为氯化氢极易溶于水,挥发的氯化氢不影响氢气体积的测定结果,所以不需要加除酸雾装置。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(2)为使测定结果尽可能精确,实验中应注意的
问题有(写出两点):
①__________________,
②_____________________________。
2
冷却至室温再读数
反应中装置的气密性、合金是否完全溶解、量气装置的使用都会影响测定结果。因此为使测定结果尽可能精确,实验中应注意的问题有:检查装置的气密性,加入足量盐酸,调整量气管C的高度,使C中液面与B中液面相平,待冷却至室温再读取体积等。
读数时,使量气管左右液面相平
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
探究三
实验方案:称量x g铝镁合金粉末,放入装有足量氧气的容器中使其充分灼烧。
(1)欲计算镁的质量分数,该实验中还需要测定的数据是_______________
___________。
2
充分灼烧后固体
Mg、Al均与氧气反应生成金属氧化物,则还需测定生成物的质量,才能计算出Mg的质量分数。
粉末的质量
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(2)若用空气代替O2进行实验,对测定结果是否有影响?_____(填“是”或“否”)。
是
2
返回
本课结束
第三章 第二节
第1课时 常见的合金及应用
1.能从合金结构与组成的角度理解合金的特殊性能,培养宏观辨识与微观探析
的能力。
2.能列举常见合金的组成和性能,能科学、合理的选择和使用金属材料,培养
学生的科学态度和社会责任感。
核心素养
发展目标
一、铁合金
二、铝和铝合金、新型合金
课时对点练
内容索引
随堂演练 知识落实
铁合金
一
1.合金
(1)由两种或两种以上的金属(或金属与非金属)熔合而成的具有______
的物质。
(2)合金具有优良的 、 或 性能;一般来说,合金的硬度 各成分金属,熔点 各成分金属。
金属
特性
物理
化学
机械
大于
低于
【思考1】 根据纯金属与合金的结构比较,说明合金的硬度比其成分金属大的原因。
提示 纯金属内所有原子的大小和形状相同,原子排列十分规整;加入或大或小的其他元素的原子后,改变了金属原子有规则的层状排列,使原子层之间的相对滑动变得困难,导致合金的硬度变大。
【思考2】 已知铜的熔点为1 083 ℃,钠的沸点为883 ℃,试问铜与钠能否形成合金?
提示 不能。当铜开始熔化时,钠已经气化,所以二者不能形成合金。
2.铁合金
铁和碳形成的合金,因
含碳量不同分为______
(含碳量为2%~4.3%)和
(含碳量为0.03%~
2%), 是用量最大、
用途最广的合金。
是最常见的一
种合金钢,它的合金元素主要是____和 ,在大气中比较稳定,不易生锈,抗腐蚀能力强。
生铁
钢
钢
不锈钢
铬
镍
铁
碳
低
碳素
中
高
合金
【思考3】 根据以上所述,说明碳素钢含碳量与其性能的关系。
提示 钢的含碳量越低,韧性越好,硬度越低;含碳量越高,韧性越差,硬度越高。
应用体验
1.判断正误
(1)合金一定是不同金属熔合而成的具有金属特性的化合物
(2)生铁的熔点比纯铁低,但机械强度和硬度比纯铁高
(3)生铁中的铁与纯铁的化学性质不同
(4)地震灾区重建要使用大量钢材,钢材是合金
×
×
√
√
应用体验
2.合金是一类用途广泛的金属材料,下列关于合金的说法正确的是
A.铜铝合金的硬度比铜和铝的都大,熔点比铜和铝的都低
B.合金只能由两种或两种以上的金属组成
C.合金的制备过程发生的是化学变化
D.铁合金不能与酸反应
√
合金是一种金属熔合其他金属或非金属形成的具有金属特性的混合物,合金中可以含有非金属元素,如生铁为铁与碳的合金,故B不符合题意;
合金的制备过程没有新物质生成,是物理变化,故C不符合题意;
铁合金中含有铁,能够与盐酸等反应生成盐和氢气,故D不符合题意。
应用体验
3.(2022·沈阳重点高中联合体高一月考)北宋沈括对生铁炼钢有这么一段评价:“世间锻铁所谓钢铁者,用柔铁屈盘之,乃以生铁陷其间,泥封炼之,锻令相入,谓入‘团钢’,亦谓之‘灌钢’。此乃伪钢耳……”,下列说法正确的是
A.生铁和钢都是铁的含碳合金,生铁中碳的含量较低
B.通过炼制和锻打,可以调节铁中元素的组成、元素的含量等来改变
铁的性能
C.高碳钢的韧性较好,低碳钢的硬度较大
D.不锈钢是一种常见的合金钢,它的合金元素主要是钨(W)和硅(Si)
√
生铁中碳的含量高于钢,A错误;
通过炼制和锻打,可以降低生铁中含碳量,除去生铁中有害元素P、S等,调整生铁中Si、Mn等的含量,改变铁的性能,B正确;
高碳钢硬度较大,韧性较差,低碳钢硬度较小,韧性较强,C错误;
不锈钢的合金元素主要是铬(Cr)、镍(Ni),常用来制造医疗器械、餐具等,D错误。
返回
铝和铝合金、新型合金
二
1.铝和铝合金
(1)铝是地壳中含量 的金属元素,常温下就能与空气中的______
发生反应。
【思考1】 常温下,铁和铝都能与氧气反应,为什么铁会因生锈报废,而铝制品却能稳定存在?
提示 铁与氧气反应生成的铁锈比较疏松,不能阻止内部的铁与氧气的进一步反应,所以铁会因生锈而报废;铝和氧气反应表面生成一层致密的氧化铝薄膜,这层膜能防止内部金属进一步被氧化,故铝制品在空气中能稳定存在。
最多
氧气
特别提醒 在常温下形成致密保护膜的金属,如铝、镁等金属;铁在高温下形成致密保护膜,俗称“烤蓝”;铁或铝遇到浓H2SO4或浓HNO3时,迅速反应生成致密氧化膜,称为钝化。
(2)铝合金
铝合金是目前用途广泛的合金之一,硬铝是在铝中添加了一定比例的Cu、Mg、Mn、Si,它的密度 ,强度 ,具有较强的抗腐蚀能力,是制造飞机和宇宙飞船的理想材料。
小
高
2.铝、氧化铝的性质
(1)实验探究
实验操作
实验现象 铝片 ,有无色气泡冒出,将点燃的木条放在试管口有_______ 试管①中一开始无气泡产生,一段时间
后,铝片 ,有无色气泡冒出;试管②中铝片溶解,立即产生无色气泡。将点燃的木条放在试管口,都有_______
逐渐溶解
溶解
爆鸣声
爆鸣声
化学方程式 _____________________ ________、 _____________________ ______ _______________________
____________、
_______________________
____________________
离子方程式 _____________________ ________、 _____________________ ______ _______________________
____________、
_______________________
__________________
Al2O3+6HCl===2AlCl3
+3H2O
2Al+6HCl===2AlCl3+3H2↑
Al2O3+2NaOH+3H2O===
2Na[Al(OH)4]
2Al+2NaOH+6H2O===
2Na[Al(OH)4]+3H2↑
Al2O3+6H+===2Al3++3H2O
2Al+6H+===2Al3++3H2↑
(2)两性氧化物
既能与 反应生成盐和水,又能与 反应生成盐和水的氧化物,如Al2O3等,其与强酸、强碱反应的离子方程式分别为
Al2O3+6H+===2Al3++3H2O,
Al2O3+2OH-+3H2O===2[Al(OH)4]-。
酸
碱
【思考2】 (1)为什么铝制餐具不适宜用来蒸煮或长时间盛放酸性、碱性食物?
提示 由于铝和氧化铝能跟酸、碱反应,因此铝制餐具不宜用来蒸煮或长期存放酸性、碱性食物。
(2)向集满CO2的铝制易拉罐中加入过量NaOH浓溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起。上述实验过程中发生的离子反应有_________________________
__________________________________________________________________________。
向集满CO2的铝制易拉罐中加入过量NaOH浓溶液,易拉罐渐渐凹瘪,是由于CO2被NaOH溶液吸收,气体压强减小;铝制易拉罐表面的Al2O3会与NaOH溶液反应;后NaOH溶液与Al发生反应生成H2,使易拉罐凸起。
Al2O3+2OH-+3H2O ===2[Al(OH)4]-、2Al+2OH-+6H2O===
2[Al(OH)4]-+3H2↑
3.新型合金
(1)储氢合金:一类能够大量吸收H2,并与H2结合成_____________
的材料。如Ti-Fe合金、La-Ni合金等,为氢气作为能源的实际应用起到重要的推动作用。
(2)其他新型合金: 、 和 等新型合金广泛应用于航空航天、生物工程和电子工业等领域。
钛合金
金属氢化物
耐热合金
形状记忆合金
应用体验
1.(2022·广东清远高一月考)铝是地壳中含量最高的金属元素,下列关于铝及其化合物的性质、用途的说法错误的是
A.纯铝的硬度和强度较小,不适合用于制造机器零部件
B.可用NaOH溶液除去Fe2O3粉末中少量的Al2O3
C.铝合金是用来制造飞机和宇宙飞船的理想材料
D.盐酸可以除去镁粉中的铝粉
√
制造机器零部件要求材料硬度高、强度大,而纯铝硬度、强度较小,不适合,A正确;
氧化铁不与氢氧化钠溶液反应,氧化铝为两性氧化物,与氢氧化钠溶液反应生成Na[Al(OH)4],B正确;
铝合金硬度高、质量轻,是用来制造飞机和宇宙飞船的理想材料,C正确;
Mg、Al均与盐酸反应,应用NaOH溶液除去镁粉中的铝粉,D错误。
应用体验
2.下列关于新型合金材料说法不正确的是
A.镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料
B.钛合金生物相容性好,强度大,可作人造骨骼
C.形状记忆合金可在使合金发生形变的作用力消失后恢复原状
D.利用合金的熔点低于成分金属这一特点可制得耐热合金
√
储氢材料是一类能可逆地吸收和释放氢气的材料,镧镍合金能大量吸收H2形成金属氢化物,是目前解决氢气的储存和运输问题的材料,故A正确;
钛合金与人体有很好的相容性,且性质稳定,抗腐蚀性强,所以可用来制造人造骨骼,故B正确;
耐热合金的熔点很高,与合金的特性无关,故D错误。
由2Al+6HCl===2AlCl3+3H2↑、2Al+2NaOH+6H2O===2Na[Al(OH)4] +3H2↑可知,产生氢气的体积比为1∶3,需要盐酸和苛性钠的物质的量之比为1∶1,溶液的体积相同,故盐酸和苛性钠溶液的物质的量浓度之比也为1∶1。
应用体验
3.等体积的盐酸和苛性钠溶液分别与两份足量的铝粉反应,在相同条件下产生氢气的体积比为1∶3,则盐酸和苛性钠溶液的物质的量浓度之比为
A.1∶1 B.2∶1 C.3∶1 D.2∶3
√
返回
随堂演练 知识落实
1
2
3
4
1.(2022·无锡教育科学研究院高一质检)下列关于合金的叙述正确的是
A.铝合金硬度比纯铝小
B.生铁是铁碳合金,钢是纯净的铁单质
C.硬铝密度小、强度高,常用于制造飞机外壳
D.不锈钢和钢都是铁合金,性质完全相同
√
随堂演练
1
2
3
4
随堂演练
合金的硬度比其任一成分金属都大,铝合金硬度比纯铝大,A错误;
生铁是铁碳合金,钢的含碳量比生铁低,也是铁碳合金,B错误;
不锈钢和钢都是铁合金,但其内部结构和组分不同,性质不相同,D错误。
2.下列说法正确的是
A.Al2O3难溶于水,不与水反应,所以它不是Al(OH)3对应的氧化物
B.因为Al2O3是金属氧化物,所以它是碱性氧化物
C.Al2O3能跟所有的酸、碱溶液反应
D.Al2O3能跟强酸、强碱溶液反应
√
随堂演练
1
2
3
4
Al2O3虽然难溶于水,但是2Al(OH)3 Al2O3+3H2O,Al2O3和
Al(OH)3中Al的化合价相同,所以Al2O3是Al(OH)3对应的氧化物;Al2O3是两性氧化物;Al2O3与强酸、强碱反应,与弱碱不反应。
3.向某溶液中加入铝粉能放出H2,下列各组离子一定不能在该溶液中大量共存的是
随堂演练
1
2
3
4
√
随堂演练
1
2
3
4
加入铝粉能放出H2,说明该溶液可能呈酸性,也可能呈碱性。A选项中的4种离子可在酸性溶液中大量共存;
C选项中的离子在碱性溶液中可以大量共存;
D选项中的离子在酸性溶液、碱性溶液中都可以大量共存。
4.铁和铝是科技、生产、生活中应用最广泛的金属材料。现有铁、铝的混合物进行如下实验:
随堂演练
1
2
3
4
(1)操作X的名称是______。
向铁、铝混合物中加入足量NaOH溶液,Al溶解,Fe不溶,操作X为过滤。
过滤
随堂演练
1
2
3
4
(2)气体A是_____。
Al与氢氧化钠溶液反应产生氢气,气体A为H2。
H2
随堂演练
1
2
3
4
(3)A与Cl2混合光照可能发生爆炸,生成______(填化学式),A在该反应中作为________(填“氧化剂”或“还原剂”)。
H2与Cl2反应生成HCl。
HCl
还原剂
随堂演练
1
2
3
4
(4)溶液B中阴离子除OH-外还有____________,溶液D中存在的金属离子为______。
Fe2+
返回
[Al(OH)4]-
溶液B中阴离子有OH-、[Al(OH)4]-,溶液D中金属离子为Fe2+。
课时对点练
1
2
3
4
5
6
7
8
9
题组一 合金及铁合金
1.(2021·广东,1)今年五一假期,人文考古游持续成为热点。很多珍贵文物都记载着中华文明的灿烂成就,具有深邃的文化寓意和极高的学术价值。下列国宝级文物主要由合金材料制成的是
10
11
12
13
14
15
对点训练
选项 A B C D
文物
名称 铸客大铜鼎 河姆渡出土陶灶 兽首玛瑙杯 角形玉杯
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
铸客大铜鼎属于铜的合金,A符合题意;
河姆渡出土陶灶属于陶器,主要成分为硅酸盐,不属于合金,B不符合题意;
兽首玛瑙杯的主要成分为二氧化硅,不属于合金,C不符合题意;
角形玉杯的主要成分为硅酸盐,不属于合金,D不符合题意。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2.下列与合金相关的叙述正确的有
①合金的硬度一般比它的成分金属的硬度都大
②合金的熔点一般比它的成分金属的熔点都低
③改变原料的配比、变更制造合金的工艺,可得到不同性能的合金
④合金的导电性比纯金属的更强
⑤合金的应用范围比纯金属更广
A.①②⑤ B.①②③⑤
C.②③④ D.①②④
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
①合金的硬度一般大于其成分金属的硬度,故正确;
②合金的熔点一般低于其成分金属的熔点,故正确;
③合金的性质与合金的原料配比以及制造工艺有关,所以改变原料的配比、变更制造合金的工艺,可以制得具有不同性能的合金,故正确;
④合金的导电性不一定比纯金属更强,比如铝合金的导电性比纯铝要差,故错误;
⑤合金一般比其成分金属熔点低,硬度大,具有更好的机械加工性能,故应用更广泛,故正确。
2
3.《五金·铁》中记载:“若造熟铁,则生铁流出时,相连数尺内,低下数寸,筑一方塘,短墙抵之。其铁流入塘内,数人执柳木排立墙上……众人柳棍疾搅,即时炒成熟铁。”下列说法不正确的是
A.碳素钢与生铁的组成元素相同
B.生铁比熟铁质地更硬,延展性稍差
C.炒铁是为了提高铁水中的碳含量
D.该法与近代向生铁水中吹空气炼钢异曲同工
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
碳素钢与生铁都是铁碳合金,组成元素相同,故A正确;
炒铁过程中降低了铁水中的碳含量,从而将生铁转化成熟铁,故C错误;
该冶炼方法和近代向生铁水中吹空气炼钢,都是利用空气中氧气氧化C元素,其原理基本相同,故D正确。
题组二 铝和铝合金
4.镁铝合金质优体轻,又不易锈蚀,大量用于航空工业、造船工业、日用化工等领域。下列关于镁铝合金性质的叙述中,不正确的是
A.此合金的熔点比镁和铝的熔点都低
B.此合金能全部溶解于足量稀盐酸中
C.此合金能全部溶解于足量氢氧化钠溶液中
D.此合金的硬度比镁和铝的硬度都大
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
合金的熔点一般比各成分金属的熔点低,A正确;
镁铝合金的主要成分是镁和铝,Mg和Al均能与稀盐酸反应,则合金能全部溶解于足量稀盐酸中,B正确;
铝能与氢氧化钠溶液反应但镁不能,镁铝合金不能全部溶解于足量氢氧化钠溶液中,C错误;
合金的硬度一般比各成分金属的硬度大,D正确。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
5.(2023·大连高一期中)足量下列物质与相同质量的铝反应,放出氢气且消耗溶质物质的量最少的是
A.盐酸 B.稀硫酸
C.氢氧化钠溶液 D.氯化钠溶液
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
氯化钠溶液与铝不反应,盐酸、稀硫酸、氢氧化钠溶液均能与铝反应生成氢气,化学方程式分别为2Al+6HCl===2AlCl3+3H2↑、2Al+3H2SO4===Al2(SO4)3+3H2↑、2Al+2NaOH+6H2O===2Na[Al(OH)4]+3H2↑,故1 mol铝完全反应时,消耗盐酸、稀硫酸和氢氧化钠溶液中溶质的物质的量分别为3 mol、1.5 mol、1 mol,则消耗氢氧化钠的物质的量最少,C正确。
2
6.在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡。然后将两球分别浸没在溶液质量相等的稀烧碱溶液和硫酸铜溶液中一段时间,如图所示。下列说法正确的是
A.铝球表面有气泡产生,且有白色沉淀生成,
杠杆不平衡
B.铝球表面有气泡产生,溶液澄清;铁球表面有红色物质析出,溶液蓝
色变浅,杠杆右边下沉
C.反应后去掉两烧杯,杠杆仍平衡
D.右边球上出现红色,左边溶液的c(OH-)增大
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
左烧杯中的铝球与氢氧化钠溶液反应:2Al+2NaOH+6H2O===
2Na[Al(OH)4]+3H2↑,有一部分铝溶解,
并产生气体,生成Na[Al(OH)4];右烧杯铁球
浸在硫酸铜溶液中发生反应:Fe+CuSO4
===FeSO4+Cu,铁球表面有红色物质析出,铁球质量增加,溶液蓝色变浅,左边消耗OH-,使c(OH-)减小。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
题组三 新型合金
7.储氢合金是一种新型合金。下列关于储氢合金的说法错误的是
A.储氢合金是一类能够大量吸收氢气,并与氢气结合成金属氢化物的新型
合金材料
B.储氢合金具有储氢量大、能耗低、使用方便的特点
C.储氢合金具有很强的捕捉氢的能力,氢分子在合金中先分解成单个的原
子,氢原子进入合金原子的缝隙中,并与合金生成金属氢化物
D.储氢合金形成的金属氢化物性质稳定,高温条件下也不易分解
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
储氢合金形成的金属氢化物既容易形成,加热又容易分解,室温下吸、放氢的速率快,故D错误。
8.将一个预先做好的“ICE”形状的镍钛合金破坏形状后,只要在热水中浸泡,其便会恢复原来形状。下列说法正确的是
A.记忆合金的形状变化属于化学变化
B.合金的熔点一般比各组分金属低,硬度比各组分金属小
C.形状记忆合金在医疗上可用来接断骨等,在日常生活中可制眼镜框
架等
D.钛合金的化学性质与钛单质完全相同
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
记忆合金的形状变化没有生成新物质,属于物理变化,A不正确;
合金的熔点一般比组分金属的低,但硬度要比组分金属的大,B不正确;
钛合金中因为加入了其他金属,化学性质与钛单质不完全相同,D不正确。
2
9.下列变化不可能通过一步反应直接完成的是
A.Al(OH)3→Al2O3 B.Al2O3→Al(OH)3
C.Al→[Al(OH)4]- D.AlCl3→Al(OH)3
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
√
氢氧化铝受热分解生成氧化铝和水,A可以一步完成;
Al2O3难溶于水,应先将Al2O3与酸反应变成Al3+或与强碱溶液反应生成[Al(OH)4]-后,然后加入弱碱或弱酸反应生成Al(OH)3,B不可以一步完成;
Al和NaOH溶液反应生成Na[Al(OH)4]和H2,C可以一步完成;
氯化铝和弱碱反应生成氢氧化铝,D可以一步完成。
10.(2022·张家口高一检测)下列离子方程式正确的是
A.铁与稀硫酸的反应:2Fe+6H+===2Fe3++3H2↑
B.将碳酸氢钠溶液与NaOH溶液混合: +OH-===CO2↑+H2O
C.氧化铝与烧碱溶液反应:Al2O3+2OH-===2Al3++4O2-+H2O
D.铝与NaOH溶液反应:2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
铁与稀硫酸反应生成硫酸亚铁和氢气,反应的离子方程式是Fe+2H+===Fe2++H2↑,故A错误;
氧化铝与烧碱溶液反应生成Na[Al(OH)4],反应的离子方程式是Al2O3+2OH-+3H2O===2[Al(OH)4]-,故C错误。
2
综合强化
11.用除去表面氧化膜的铝箔包装0.1 mol金属钠,用针扎出一些小孔,放入水中,完全反应后,用排水集气法收集反应产生的气体,则收集到的气体为(标准状况)
A.O2和H2的混合气体 B.1.12 L H2
C.大于1.12 L H2 D.小于1.12 L H2
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
首先钠与水反应生成NaOH和H2,铝再与NaOH溶液反应生成Na[Al(OH)4]
和H2,收集到的气体为两者产生的氢气之和,0.1 mol钠与水反应产生标准状况下气体1.12 L,再加上铝与NaOH溶液反应放出的H2,最终收集到的H2大于1.12 L。
12.甲、乙两个烧杯中分别盛有100 mL 4.0 mol·L-1的盐酸和100 mL
4.0 mol·L-1 NaOH溶液,向两个烧杯中均加入5.4 g铝粉,在相同状况下产生气体的体积比为
A.1∶1 B.2∶3 C.3∶2 D.3∶1
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
甲、乙两烧杯中含HCl、NaOH的物质的量都为0.4 mol,根据化学方程式:2Al+6HCl===2AlCl3+3H2↑、2Al+2NaOH+6H2O===2Na[Al(OH)4]
+3H2↑可知,5.4 g(即0.2 mol)Al分别与盐酸和NaOH溶液反应时,盐酸量不足而NaOH过量,故Al与盐酸反应生成0.2 mol H2,与NaOH溶液反应生成0.3 mol H2,相同状况下其体积比为2∶3。
13.合金是重要的金属材料。
(1)下列材料不属于合金的是____(填字母)。
A.铸造下水道井盖的生铁 B.储氢用的La-Ni合金
C.可用于机器人“皮肤”的橡胶 D.可用于军用车辆的超级钢
(2)生铁是常用的合金,生铁属于________(填“纯净物”或“混合物”)。
(3)黄铜是铜锌合金,将纯铜片和黄铜片互相刻划
(如图所示),纯铜片上留下明显的划痕,说明:
__________________________。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
C
混合物
黄铜的硬度比纯铜的硬度大
(4)黄铜渣中约含Zn 7%、ZnO 31%、Cu 50%、CuO 5%,其余为杂质。处理黄铜渣可得到硫酸锌,其主要流程如下(杂质不溶于水、不参与反应):
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
由于锌的活动性排在氢和铜的前面,故锌既可以与硫酸反应,也可以与硫酸铜反应,反应的化学方程式分别为Zn+H2SO4===ZnSO4+H2↑,Zn+CuSO4===ZnSO4+Cu。
①Ⅱ中发生反应的化学方程式为________________________________________
___________。
Zn+H2SO4===ZnSO4+H2↑,Zn+CuSO4===
ZnSO4+Cu
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
由题中流程可知,操作Ⅰ过滤除去铜和杂质,操作Ⅱ过滤是除去锌和置换出的铜。因氧化锌的质量大于氧化铜,且锌也能和硫酸反应生成硫酸锌,而铜和硫酸不反应,故溶液A中硫酸锌的质量大于硫酸铜。
②下列说法正确的是_____(填字母)。
a.Ⅰ、Ⅱ中的操作均包含过滤
b.溶液A中ZnSO4的质量大于CuSO4
ab
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
14.明矾晶体[KAl(SO4)2·12H2O]在生产、生活中有广泛用途,如饮用水的净化、造纸工业的施胶剂、食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、Al2O3及少量SiO2和FeO·xFe2O3)可制备明矾,工艺流程如图:
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
回答下列问题:
(1)“滤渣①”的主要成分是
______(填化学式)。
2
SiO2
二氧化硅不溶于稀硫酸,可知“滤渣①”的主要成分是SiO2。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(2)加入稀硫酸酸化后,再经“一系列操作”可得到明矾晶体[KAl(SO4)2·
12H2O],则“一系列操作”是_________、_________、______、洗涤、干燥。
2
蒸发浓缩
冷却结晶
过滤
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
加入稀硫酸酸化后,再经“一系列操作”可得到明矾晶体[KAl(SO4)2·12H2O],由于明矾来自于无色滤液B,滤液主要是Na[Al(OH)4]溶
液,加入硫酸钾和稀硫酸酸化后经蒸发浓缩,冷却结晶,过滤,洗涤得到明矾晶体。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(3)流程中加入H2O2的作用是_________________,写出反应的离子方程式:__________________________________。
2
将Fe2+氧化为Fe3+
2Fe2++H2O2+2H+===2Fe3++2H2O
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
溶液中含有亚铁离子,由于氢氧化铁更难溶,则流程中加入H2O2的作用是将Fe2+氧化为Fe3+,该反应的离子方程式为2Fe2++
H2O2+2H+===2Fe3++2H2O。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
(4)若将铝灰投入过量的氢氧化钠溶液中,所得溶液的溶质除NaOH和Na2SiO3外,还含有_____________(填化学式)。写出生成气体的反应的化学方程式:_________________________________________。
Na[Al(OH)4]
2Al+2NaOH+6H2O===2Na[Al(OH)4]+3H2↑
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
15.铝镁合金已成为轮船制造、化工生产等行业的重要材料。某研究性学习小组的三位同学为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计下列三种不同实验方案进行探究。填写下列空白:
探究一
实验方案:铝镁合金 测定剩余固体质量。实验中发生反应的化学方程式是__________________________________________。
实验步骤:
(1)称取5.4 g铝镁合金粉末样品,投入体积为V、浓度为2.0 mol·L-1的NaOH溶液中,充分反应。为保证合金充分反应,NaOH溶液的体积V≥________。
2
97 mL
6H2O+2Al+2NaOH===2Na[Al(OH)4]+3H2↑
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
铝镁合金中镁的质量分数为3%时,5.4 g铝镁合金粉末样品中铝的质量为5.4 g×(1-3%)=5.4 g×97%,则:
2Al + 2NaOH+6H2O===2Na[Al(OH)4]+3H2↑
2 2
为保证合金充分反应,NaOH溶液的体积V≥97 mL。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将______(填“偏大”或“偏小”)。
2
偏大
镁上会附着Na[Al(OH)4]等物质,未洗涤固体会导致测定的镁的质量偏大,镁的质量分数将偏大。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
探究二
实验方案:铝镁合金 测定生成气体的
体积(实验装置如图所示)。
(1)某同学提出该实验装置不够完善,应在A、
B之间添加一个除酸雾的装置。你的意见是
________(填“需要”或“不需要”)。
2
不需要
因为氯化氢极易溶于水,挥发的氯化氢不影响氢气体积的测定结果,所以不需要加除酸雾装置。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(2)为使测定结果尽可能精确,实验中应注意的
问题有(写出两点):
①__________________,
②_____________________________。
2
冷却至室温再读数
反应中装置的气密性、合金是否完全溶解、量气装置的使用都会影响测定结果。因此为使测定结果尽可能精确,实验中应注意的问题有:检查装置的气密性,加入足量盐酸,调整量气管C的高度,使C中液面与B中液面相平,待冷却至室温再读取体积等。
读数时,使量气管左右液面相平
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
探究三
实验方案:称量x g铝镁合金粉末,放入装有足量氧气的容器中使其充分灼烧。
(1)欲计算镁的质量分数,该实验中还需要测定的数据是_______________
___________。
2
充分灼烧后固体
Mg、Al均与氧气反应生成金属氧化物,则还需测定生成物的质量,才能计算出Mg的质量分数。
粉末的质量
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(2)若用空气代替O2进行实验,对测定结果是否有影响?_____(填“是”或“否”)。
是
2
返回
本课结束
