1.1.物质的分类 及转化第1课时课件(共27张PPT)2023-2024学年上学期高一化学人教版(2019)必修第一册
文档属性
| 名称 | 1.1.物质的分类 及转化第1课时课件(共27张PPT)2023-2024学年上学期高一化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 790.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-17 20:27:01 | ||
图片预览



文档简介
(共27张PPT)
第一章 物质的分类及其变化
第一节 物质的分类
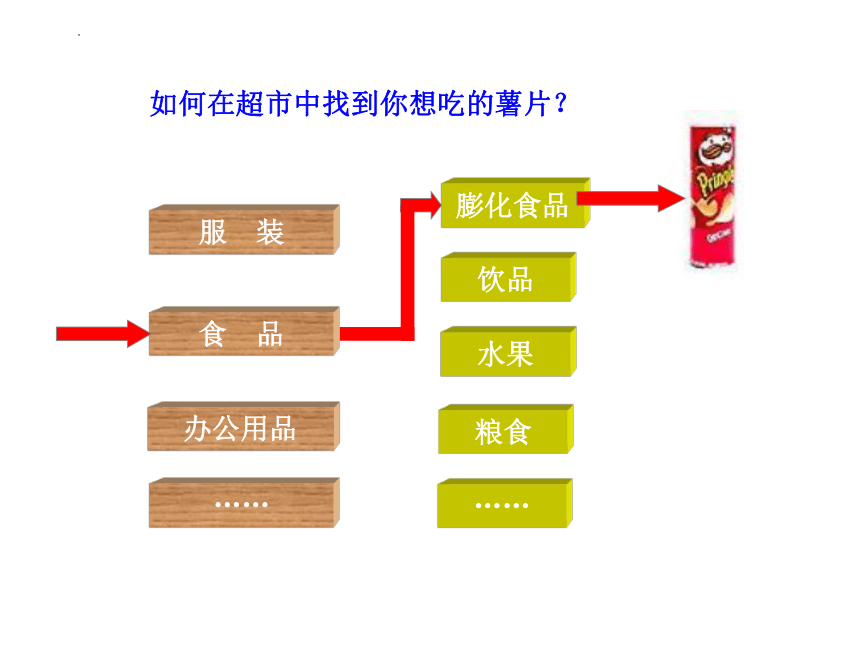
如何在超市中找到你想吃的薯片?
食 品
服 装
办公用品
……
水果
膨化食品
饮品
粮食
……
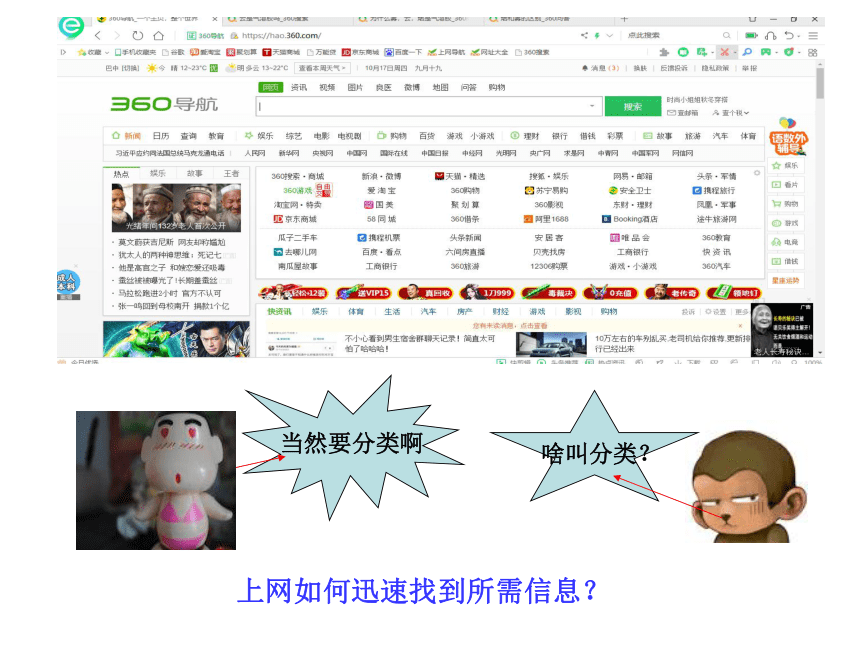
上网如何迅速找到所需信息?
当然要分类啊
啥叫分类?
一、简单分类法及其应用
1、分类:把某些特征相似的事物归类到一起的方法
试想想:没有分类的世界模样会怎样?
分类的目的和意义:分类是一种行之有效、简单易行的科学方法。能够提高人们工作、学习的效率,使人们更快更便捷的达到目的。
第一节 物质的分类
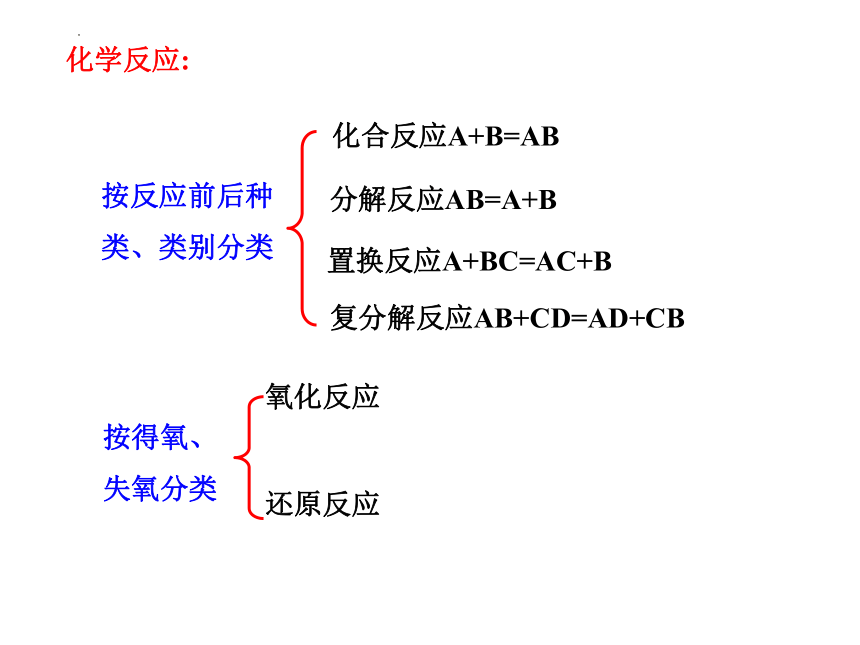
化学反应:
按反应前后种类、类别分类
按得氧、失氧分类
化合反应A+B=AB
分解反应AB=A+B
置换反应A+BC=AC+B
复分解反应AB+CD=AD+CB
氧化反应
还原反应
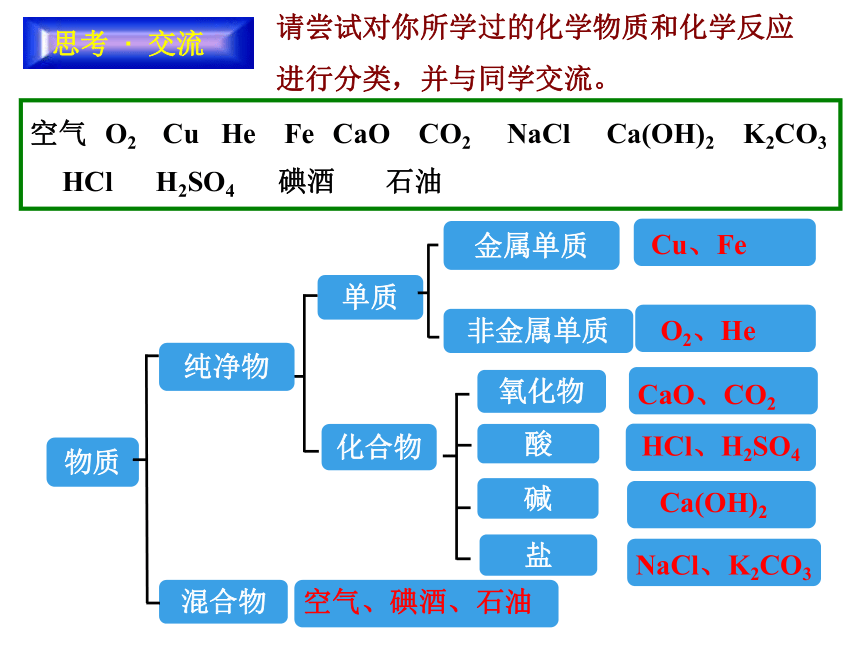
思考 · 交流
请尝试对你所学过的化学物质和化学反应
进行分类,并与同学交流。
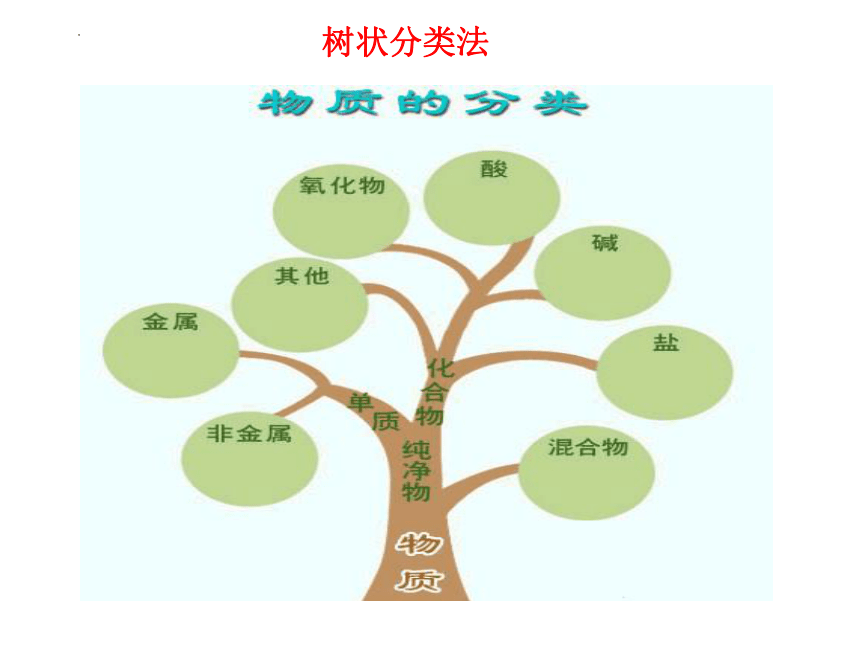
物质
混合物
单质
纯净物
化合物
碱
盐
酸
氧化物
金属单质
非金属单质
Cu、Fe
O2、He
CaO、CO2
HCl、H2SO4
Ca(OH)2
NaCl、K2CO3
空气、碘酒、石油
空气 O2 Cu He Fe CaO CO2 NaCl Ca(OH)2 K2CO3 HCl H2SO4 碘酒 石油
树状分类法
特点:同一层次的物质类别间一般是相互独立、
没有交叉的。
(1)树状分类法—对同类事物进行再分类
2、分类的方法
田亮
罗
纳
尔
多
姚明
你都
认识吧
刘
翔
中国运动员
外国运动员
球类运动员
非球类运动员
请你把他们进行分类连线
Na2CO3
钠 盐
碳 酸 盐
Na2CO3
(2)交叉分类法:
对一种事物以多种标准进行分类
特点:物质所属类别有交叉部分
Na2SO4
K2SO4
K2CO3
碳酸盐
硫酸盐
钾盐
Na2CO3
钠盐
以所含阳
离子不同
进行分类
以所含阴
离子不同
进行分类
分类的标准
交叉分类法举例
1.树状分类法:对同一分类进行再分类,系统性强,
适合层次包含关系
2.交叉分类法:至少同时运用两种分类标准,弥补
单一标准的不足
如何进行分类?
确定分类标准
选择分类方法
得出正确分类
小结
1、请对下列物质进行分类
盐酸 含氧酸
硝酸 无氧酸
氢硫酸 一元酸
硫酸 二元酸
磷酸 三元酸
课堂练习
2、下列几组物质中,每一组中有一种物质从某种分类角度分析与其它三种不同,请找出该物质,并说明区别的理由。
(1) Cu、Hg、Au、Fe
(2)液氧、氨气、金刚石、玻璃
(3) KCl、Na2SO4、K2CO3、NaNO3
(4)NaCl 、KCl 、NaClO3 、MgCl2
3、对下列化学反应进行分类
(1)硫在氧气里燃烧 (2)红磷在氧气里燃烧
(3)铁丝在氧气里燃烧(4)铝箔在氧气里燃烧
(5)甲烷在氧气里燃烧
[分类标准1]:是不是化合反应:
化学反应(1)(2)(3)(4)为一类,都是化合反应;
[分类标准2]: 反应物的特点:
反应(1)(2)为一类,都是非金属与氧气反应,
(3)(4)为一类,都是金属与氧气反应;
[分类标准3]:是不是氧化还原反应:
化学反应(1)(2)(3)(4)(5)为一类,都是氧化还原反应。
酸
从是否含氧分
从酸性强弱分
无氧酸
中强酸
弱酸
强酸
H2SO4、HNO3、H3PO4、H2CO3
HCl、H2S
H2SO4、HNO3、HCl、HBr、HI、HClO4
H3PO4
H2CO3
含氧酸
按电离出的H+数:一元酸、二元酸、三元酸
按酸根有无氧化性:氧化性酸、非氧化性酸
按挥发性:挥发性酸、高沸点酸
按溶解性:可溶性酸、难溶性酸
电解质电离时所生成的阳离子全部是H+的化合物
酸:
物质分类
指含氧酸按化学计量组成脱去若干分子水后所得的对应氧化物。常见无机含氧酸的酸酐多为其对应的酸性氧化物,且含氧酸根的中心元素和酸酐对应元素的化合价是一致的。反之酸酐也多能与水化合成对应的含氧酸(个别二氧化硅等例外)。
酸酐
注:HNO3的酸酐是N2O5 ,可视为两分子HNO3脱去一份子水而得来,即:2HNO3 = N2O5 + H2O
无机酸的酸酐一定是酸性氧化物
碱
从是否溶于水分
从碱性强弱分
难溶碱
弱碱
可溶碱
强碱
NaOH、KOH、Ba(OH)2、
NaOH、KOH、Ca(OH) 2、Ba(OH)2
Cu(OH)2、Mg(OH)2、Fe(OH) 3
NH3·H2O 、Cu(OH)2、Mg(OH)2、Fe(OH) 3
……
电解质在电离时生成的阴离子全部是OH-的化合物。
碱:
微溶碱
Ca(OH) 2
按电离出OH-的数目分
一元碱、二元碱、多元碱
盐
按是否溶于水分
按组成离子分
无氧酸盐
钠盐
钾盐
氨盐
硫酸盐
碳酸盐
硝酸盐
按酸根是否含氧分
含氧酸盐
可溶盐
难溶盐
NaCl、AgNO3、CuSO4
CaCO3、BaSO4、ZnS
KNO3、KMnO4、FeSO4
NaCl、ZnS、CaCl2
……
……
还可以按组成分为:正盐、酸式盐、碱式盐、复盐
由金属阳离子(或阳离子NH4+)和酸根组成的化合物。
盐:
氧化物
酸性氧化物
碱性氧化物
(不成盐氧化物)
CuO、Fe2O3、Na2O
CO、P2O5、H2O
CO2、P2O5、SO3
CaO、CuO、K2O
CO、NO、N2O、NO2、 N2O4、H2O
从组成元素分
非金属氧化物
金属氧化物
从性质分
氧化物:
由两种元素组成其中一种是氧元素的化合物。
两性氧化物
BeO、Al2O3、Cr2O3、ZnO
过氧化物
Na2O2、H2O2
特殊氧化物
Fe3O4
Na2O2是金属氧化物,但不是碱性氧化物
酸性氧化物:与碱反应只生成盐和水的氧化物。
2、碱性氧化物也不一定能与水反应生成碱,如CuO 等。
注意:
1、酸性氧化物不一定能与水反应生成酸,如SiO2、Fe2O3等 。
3、碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性
氧化物(如:Mn2O7、Al2O3、Na2O2)。
4、酸性氧化物不一定是非金属氧化物(如Mn2O7 ),非金属氧
化物也不一定是酸性氧化物(如:CO、NO、NO2)。
碱性氧化物:与酸反应只生成盐和水的氧化物。
化合反应:A+B=AB
分解反应:AB=A+B
置换反应:A+BC=B+AC
复分解反应:AB+CD=AD+CB
按照反应物生成物种类及多少(从形式上)分为
化学反应
按参加反应的微粒是否有离子参与(从本质上)分为
分子反应
离子反应
按照反应中有无电子转移(从本质上)分为
氧化还原反应
非氧化还原反应
待学
化学反应分类
讨论:初中已学化学反应的分类?
⑤碱性氧化物+酸性氧化物→含氧酸盐
常见的化合反应主要包括:
①金属+氧气→金属氧化物
②非金属+氧气→非属氧化物
③酸性氧化物+水→可溶性含氧酸
④碱性氧化物+水→可溶性碱
①不溶性碱 → 碱性氧化物+水
②不稳定的含氧酸→酸性氧化物+水
③某些不稳定含氧酸盐 → 碱性氧化物+酸性氧化物
④高价含氧酸盐受热分解
常见的分解反应主要包括:
常见的置换反应主要包括:
③非水溶液中的置换反应
①金属+酸→盐+氢气
②金属+盐溶液→另一种金属+另一种盐
可溶性碱加热不分解
⑤碱性氧化物+酸→盐+水
常见的复分解反应主要包括:
①酸+碱→盐+水
②盐+碱→新盐+新碱
③盐+酸→新盐+新酸
④盐+盐→两种新盐
溶液中复分解反应的条件是什么?
注意:基本反应类型不能包括所有化学反应,也不能反映化
学反应的实质
⑥酸性氧化物+碱→盐+水
P25实践活动:3题
第一章 物质的分类及其变化
第一节 物质的分类
如何在超市中找到你想吃的薯片?
食 品
服 装
办公用品
……
水果
膨化食品
饮品
粮食
……
上网如何迅速找到所需信息?
当然要分类啊
啥叫分类?
一、简单分类法及其应用
1、分类:把某些特征相似的事物归类到一起的方法
试想想:没有分类的世界模样会怎样?
分类的目的和意义:分类是一种行之有效、简单易行的科学方法。能够提高人们工作、学习的效率,使人们更快更便捷的达到目的。
第一节 物质的分类
化学反应:
按反应前后种类、类别分类
按得氧、失氧分类
化合反应A+B=AB
分解反应AB=A+B
置换反应A+BC=AC+B
复分解反应AB+CD=AD+CB
氧化反应
还原反应
思考 · 交流
请尝试对你所学过的化学物质和化学反应
进行分类,并与同学交流。
物质
混合物
单质
纯净物
化合物
碱
盐
酸
氧化物
金属单质
非金属单质
Cu、Fe
O2、He
CaO、CO2
HCl、H2SO4
Ca(OH)2
NaCl、K2CO3
空气、碘酒、石油
空气 O2 Cu He Fe CaO CO2 NaCl Ca(OH)2 K2CO3 HCl H2SO4 碘酒 石油
树状分类法
特点:同一层次的物质类别间一般是相互独立、
没有交叉的。
(1)树状分类法—对同类事物进行再分类
2、分类的方法
田亮
罗
纳
尔
多
姚明
你都
认识吧
刘
翔
中国运动员
外国运动员
球类运动员
非球类运动员
请你把他们进行分类连线
Na2CO3
钠 盐
碳 酸 盐
Na2CO3
(2)交叉分类法:
对一种事物以多种标准进行分类
特点:物质所属类别有交叉部分
Na2SO4
K2SO4
K2CO3
碳酸盐
硫酸盐
钾盐
Na2CO3
钠盐
以所含阳
离子不同
进行分类
以所含阴
离子不同
进行分类
分类的标准
交叉分类法举例
1.树状分类法:对同一分类进行再分类,系统性强,
适合层次包含关系
2.交叉分类法:至少同时运用两种分类标准,弥补
单一标准的不足
如何进行分类?
确定分类标准
选择分类方法
得出正确分类
小结
1、请对下列物质进行分类
盐酸 含氧酸
硝酸 无氧酸
氢硫酸 一元酸
硫酸 二元酸
磷酸 三元酸
课堂练习
2、下列几组物质中,每一组中有一种物质从某种分类角度分析与其它三种不同,请找出该物质,并说明区别的理由。
(1) Cu、Hg、Au、Fe
(2)液氧、氨气、金刚石、玻璃
(3) KCl、Na2SO4、K2CO3、NaNO3
(4)NaCl 、KCl 、NaClO3 、MgCl2
3、对下列化学反应进行分类
(1)硫在氧气里燃烧 (2)红磷在氧气里燃烧
(3)铁丝在氧气里燃烧(4)铝箔在氧气里燃烧
(5)甲烷在氧气里燃烧
[分类标准1]:是不是化合反应:
化学反应(1)(2)(3)(4)为一类,都是化合反应;
[分类标准2]: 反应物的特点:
反应(1)(2)为一类,都是非金属与氧气反应,
(3)(4)为一类,都是金属与氧气反应;
[分类标准3]:是不是氧化还原反应:
化学反应(1)(2)(3)(4)(5)为一类,都是氧化还原反应。
酸
从是否含氧分
从酸性强弱分
无氧酸
中强酸
弱酸
强酸
H2SO4、HNO3、H3PO4、H2CO3
HCl、H2S
H2SO4、HNO3、HCl、HBr、HI、HClO4
H3PO4
H2CO3
含氧酸
按电离出的H+数:一元酸、二元酸、三元酸
按酸根有无氧化性:氧化性酸、非氧化性酸
按挥发性:挥发性酸、高沸点酸
按溶解性:可溶性酸、难溶性酸
电解质电离时所生成的阳离子全部是H+的化合物
酸:
物质分类
指含氧酸按化学计量组成脱去若干分子水后所得的对应氧化物。常见无机含氧酸的酸酐多为其对应的酸性氧化物,且含氧酸根的中心元素和酸酐对应元素的化合价是一致的。反之酸酐也多能与水化合成对应的含氧酸(个别二氧化硅等例外)。
酸酐
注:HNO3的酸酐是N2O5 ,可视为两分子HNO3脱去一份子水而得来,即:2HNO3 = N2O5 + H2O
无机酸的酸酐一定是酸性氧化物
碱
从是否溶于水分
从碱性强弱分
难溶碱
弱碱
可溶碱
强碱
NaOH、KOH、Ba(OH)2、
NaOH、KOH、Ca(OH) 2、Ba(OH)2
Cu(OH)2、Mg(OH)2、Fe(OH) 3
NH3·H2O 、Cu(OH)2、Mg(OH)2、Fe(OH) 3
……
电解质在电离时生成的阴离子全部是OH-的化合物。
碱:
微溶碱
Ca(OH) 2
按电离出OH-的数目分
一元碱、二元碱、多元碱
盐
按是否溶于水分
按组成离子分
无氧酸盐
钠盐
钾盐
氨盐
硫酸盐
碳酸盐
硝酸盐
按酸根是否含氧分
含氧酸盐
可溶盐
难溶盐
NaCl、AgNO3、CuSO4
CaCO3、BaSO4、ZnS
KNO3、KMnO4、FeSO4
NaCl、ZnS、CaCl2
……
……
还可以按组成分为:正盐、酸式盐、碱式盐、复盐
由金属阳离子(或阳离子NH4+)和酸根组成的化合物。
盐:
氧化物
酸性氧化物
碱性氧化物
(不成盐氧化物)
CuO、Fe2O3、Na2O
CO、P2O5、H2O
CO2、P2O5、SO3
CaO、CuO、K2O
CO、NO、N2O、NO2、 N2O4、H2O
从组成元素分
非金属氧化物
金属氧化物
从性质分
氧化物:
由两种元素组成其中一种是氧元素的化合物。
两性氧化物
BeO、Al2O3、Cr2O3、ZnO
过氧化物
Na2O2、H2O2
特殊氧化物
Fe3O4
Na2O2是金属氧化物,但不是碱性氧化物
酸性氧化物:与碱反应只生成盐和水的氧化物。
2、碱性氧化物也不一定能与水反应生成碱,如CuO 等。
注意:
1、酸性氧化物不一定能与水反应生成酸,如SiO2、Fe2O3等 。
3、碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性
氧化物(如:Mn2O7、Al2O3、Na2O2)。
4、酸性氧化物不一定是非金属氧化物(如Mn2O7 ),非金属氧
化物也不一定是酸性氧化物(如:CO、NO、NO2)。
碱性氧化物:与酸反应只生成盐和水的氧化物。
化合反应:A+B=AB
分解反应:AB=A+B
置换反应:A+BC=B+AC
复分解反应:AB+CD=AD+CB
按照反应物生成物种类及多少(从形式上)分为
化学反应
按参加反应的微粒是否有离子参与(从本质上)分为
分子反应
离子反应
按照反应中有无电子转移(从本质上)分为
氧化还原反应
非氧化还原反应
待学
化学反应分类
讨论:初中已学化学反应的分类?
⑤碱性氧化物+酸性氧化物→含氧酸盐
常见的化合反应主要包括:
①金属+氧气→金属氧化物
②非金属+氧气→非属氧化物
③酸性氧化物+水→可溶性含氧酸
④碱性氧化物+水→可溶性碱
①不溶性碱 → 碱性氧化物+水
②不稳定的含氧酸→酸性氧化物+水
③某些不稳定含氧酸盐 → 碱性氧化物+酸性氧化物
④高价含氧酸盐受热分解
常见的分解反应主要包括:
常见的置换反应主要包括:
③非水溶液中的置换反应
①金属+酸→盐+氢气
②金属+盐溶液→另一种金属+另一种盐
可溶性碱加热不分解
⑤碱性氧化物+酸→盐+水
常见的复分解反应主要包括:
①酸+碱→盐+水
②盐+碱→新盐+新碱
③盐+酸→新盐+新酸
④盐+盐→两种新盐
溶液中复分解反应的条件是什么?
注意:基本反应类型不能包括所有化学反应,也不能反映化
学反应的实质
⑥酸性氧化物+碱→盐+水
P25实践活动:3题
