4.2 微专题5 “位—构—性”与元素的综合推断 课件(23张PPT)
文档属性
| 名称 | 4.2 微专题5 “位—构—性”与元素的综合推断 课件(23张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 724.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-17 21:04:39 | ||
图片预览






文档简介
(共23张PPT)
第四章 第二节
微专题5 “位—构—性”与元素
的综合推断
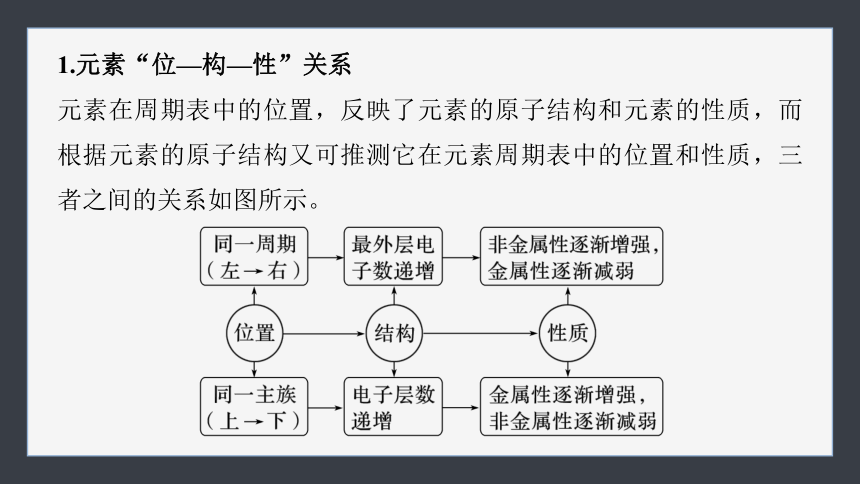
1.元素“位—构—性”关系
元素在周期表中的位置,反映了元素的原子结构和元素的性质,而根据元素的原子结构又可推测它在元素周期表中的位置和性质,三者之间的关系如图所示。
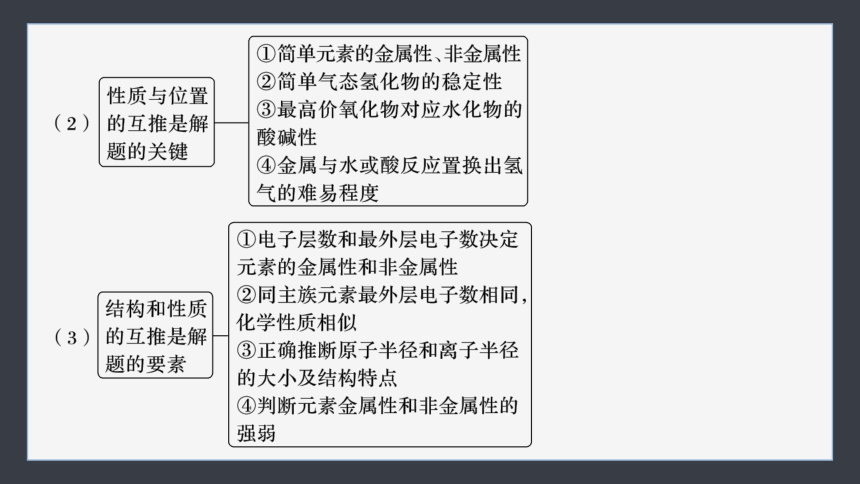
2.元素“位—构—性”关系在解题中的应用
1
2
3
4
5
6
1.(2022·佛山高一质检)短周期主族元素X、Y、Z、W的原子序数依次增大,X和Z位于同一主族,Z与冷水反应生成X的单质,X、Y、Z的原子序数之和为20,W的最外层电子数比次外层少2个。下列说法正确的是
A.Y和X形成的化合物液态时只有水
B.简单气态氢化物的稳定性:W>Y
C.简单离子半径大小:Y>Z
D.X和W形成的化合物中,各原子均为8电子稳定结构
√
跟踪训练
1
2
3
4
5
6
跟踪训练
Z为Na,X为H,Y为O,W为S。根据元素的非金属性越强,其简单气态氢化物越稳定,因此简单气态氢化物的稳定性:Y>W,故B错误;
根据同电子层结构,核多径小原则得到简单离子半径大小:Y>Z,故C正确;
X和W形成的化合物为H2S,H原子是2电子稳定结构,故D错误。
1
3
4
5
6
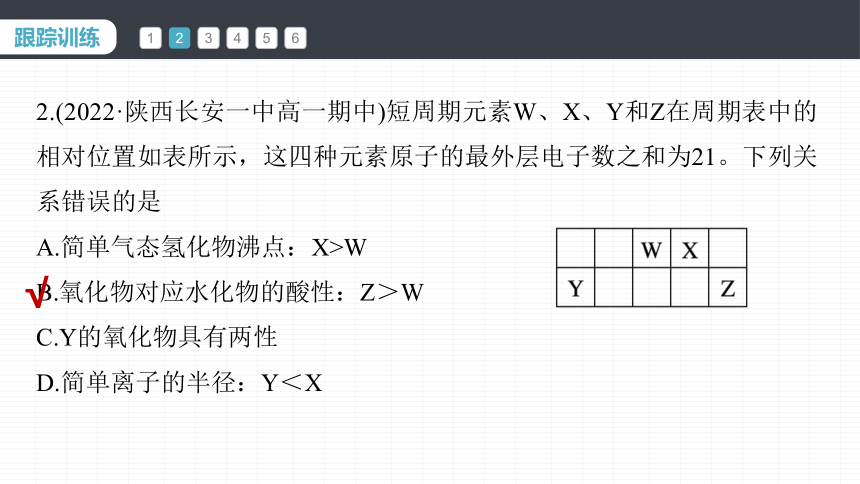
2.(2022·陕西长安一中高一期中)短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。下列关系错误的是
A.简单气态氢化物沸点:X>W
B.氧化物对应水化物的酸性:Z>W
C.Y的氧化物具有两性
D.简单离子的半径:Y<X
√
2
跟踪训练
1
3
4
5
6
2
跟踪训练
设W元素原子的最外层电子数为a,则X元素原子
的最外层电子数为a+1,Y、Z元素原子的最外层
电子数分别为a-2、a+2,从而得出a+a+1+a
-2+a+2=21,a=5。由短周期元素在周期表中的相对位置,可确定W、X、Y、Z分别为N、O、Al、Cl元素。W、X分别为N、O,二者的简单气态氢化物的沸点:H2O>NH3,A正确;
Z、W分别为Cl、N,没有指明氧化物是否为最高价氧化物,若为最高价氧化物对应的水化物,则酸性:HNO3<HClO4,B不正确;
1
3
4
5
6
2
跟踪训练
氧化铝属于两性氧化物,C正确;
Y、X的简单离子分别为Al3+、O2-,二者的
电子层结构相同,但Al的核电荷数大于O,所以简单离子半径:Al3+<O2-,D正确。
3.(2022·天津高一期末)短周期元素a、b、c、d在元素周期表中的位置如图所示。下列叙述错误的是
A.a与c属于同一主族,化学性质相似
B.a的单质可与b的单质剧烈化合
C.原子半径:c>d>b
D.b下一周期的同主族元素的单质分别可与a、c、d的单质发生化合反应
1
3
4
5
6
√
2
跟踪训练
1
3
4
5
6
2
跟踪训练
根据元素在周期表的位置可知a是H,b是F,c是
Na,d是Mg,然后根据元素周期律及物质的性质
分析解答。a是H,c是Na,二者原子核外最外层
电子数都是1个,位于元素周期表第ⅠA族,但H
是非金属元素,在化学反应中能够表现氧化性、还原性,而Na是活泼的金属元素,只有强还原性,不具有氧化性,因此二者的化学性质不相似,A错误;
H2与F2在冷暗处迅速化合形成HF,反应非常剧烈,B正确;
1
3
4
5
6
2
跟踪训练
同一周期元素,原子序数越大原子半径越小,
不同周期元素,一般原子核外电子层数越多,
原子半径就越大,所以原子半径:c(Na)>
d(Mg)>b(F),C正确;
b是F,其下一周期的同主族元素是Cl,Cl2的性质活泼,可与a、c、d的单质发生化合反应,分别生成化合物HCl、NaCl、MgCl2,D正确。
B.X、Y均可形成三氯化物
C.X的原子半径小于Y的
D.Y仅有一种含氧酸
1
3
4
5
6
2
跟踪训练
√
1
3
4
5
6
2
跟踪训练
X与Y最外层电子数之和为8,质子数相差2,且X为金属元素,可推知X为Al元素,Y为P元素,二者都有+3价,都可以形成三氯化物,B项正确;
同一周期主族元素自左向右,原子半径逐渐减小,故Al的原子半径大于P,C项错误;
P元素对应含氧酸不止一种,有磷酸、次磷酸、亚磷酸等,D项错误。
1
3
4
5
6
5.W、X、Y、Z是原子序数依次增大的短周期元素。m、n、p是由这些元素组成的二元化合物,r是元素Y的常见单质,能使带火星的木条复燃,q为一元强碱,q、s的焰色均呈黄色。上述物质的转化关系如图所示。下列说法正确的是
A.原子半径:W<X<Y<Z
B.Y的简单气态氢化物的稳定性比X的弱
C.元素的非金属性:X<Y
D.由W、X、Y、Z四种元素只能组成一种化合物
√
2
跟踪训练
由题意与转化图可推知W、X、Y、Z分别为H、C、O、Na。C、O位于同一周期,C的原子半径大于O,故原子半径:W<Y<X<Z,A错误;
C、O为同周期元素,元素的非金属性:C<
O,其简单气态氢化物的稳定性:H2O>CH4,B错误、C正确;
由W、X、Y、Z四种元素可组成NaHCO3、CH3COONa等多种化合物,D错误。
1
3
4
5
6
2
跟踪训练
6.现有X、Y、Z三种元素,已知:
①X、Y、Z的单质在常温下均为气体。
②X的单质在Z的单质中燃烧,生成XZ,燃烧时火焰为苍白色。
③XZ的水溶液可使紫色石蕊溶液变红。
④两分子X的单质与一分子Y的单质化合,生成两分子X2Y,X2Y常温下为液态。
⑤Z的单质溶于X2Y中,所得溶液具有漂白性。
1
3
4
5
6
2
跟踪训练
据此推断:
(1)3.2 g Y单质的质子数约为_____________________;画出元素Y的离子
结构示意图:_________。
1
3
4
5
6
2
跟踪训练
9.632×1023(或1.6 NA)
1
3
4
5
6
2
跟踪训练
X、Y、Z的单质在常温下均为气体,X的单质在Z的单质中燃烧生成XZ,燃烧时火焰为苍白色,是氢气在氯气中燃烧的现象,XZ的水溶液可使紫色石蕊溶液变红,说明XZ是HCl,则X为H元素,Z为Cl元素。
两分子X的单质与一分子Y的单质化合,生成两分子X2Y,X2Y常温下为液体,Z的单质即Cl2,溶于X2Y中,所得溶液具有漂白性,说明X2Y是H2O,则Y为O元素。
1
3
4
5
6
2
跟踪训练
由上述分析可知,Y为O元素,其单质为O2,一个O2分子中含有的质子数为8×2=16,3.2 g O2的物质的量为 =0.1 mol,则含有的质子数目约为0.1×16×NA=1.6NA;O原子核外有8个电子,得到两个
电子形成O2-,其离子结构示意图为 。
(2)X、Y、Z的原子半径由大到小的顺序为_________(用元素符号表示)。
1
3
4
5
6
2
跟踪训练
Cl>O>H
一般情况下,电子层数越多,原子半径越大,电子层数:Cl>O>H,则原子半径:Cl>O>H。
(3)请列举Z单质的一种用途:_____________________________________
___________________。
(4)写出⑤的化学方程式:_______________________。
1
3
4
5
6
2
跟踪训练
制漂白剂、染料、药物、塑料、氯化物等
(写出其中一种即可)
Cl2+H2O HClO+HCl
本课结束
第四章 第二节
微专题5 “位—构—性”与元素
的综合推断
1.元素“位—构—性”关系
元素在周期表中的位置,反映了元素的原子结构和元素的性质,而根据元素的原子结构又可推测它在元素周期表中的位置和性质,三者之间的关系如图所示。
2.元素“位—构—性”关系在解题中的应用
1
2
3
4
5
6
1.(2022·佛山高一质检)短周期主族元素X、Y、Z、W的原子序数依次增大,X和Z位于同一主族,Z与冷水反应生成X的单质,X、Y、Z的原子序数之和为20,W的最外层电子数比次外层少2个。下列说法正确的是
A.Y和X形成的化合物液态时只有水
B.简单气态氢化物的稳定性:W>Y
C.简单离子半径大小:Y>Z
D.X和W形成的化合物中,各原子均为8电子稳定结构
√
跟踪训练
1
2
3
4
5
6
跟踪训练
Z为Na,X为H,Y为O,W为S。根据元素的非金属性越强,其简单气态氢化物越稳定,因此简单气态氢化物的稳定性:Y>W,故B错误;
根据同电子层结构,核多径小原则得到简单离子半径大小:Y>Z,故C正确;
X和W形成的化合物为H2S,H原子是2电子稳定结构,故D错误。
1
3
4
5
6
2.(2022·陕西长安一中高一期中)短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。下列关系错误的是
A.简单气态氢化物沸点:X>W
B.氧化物对应水化物的酸性:Z>W
C.Y的氧化物具有两性
D.简单离子的半径:Y<X
√
2
跟踪训练
1
3
4
5
6
2
跟踪训练
设W元素原子的最外层电子数为a,则X元素原子
的最外层电子数为a+1,Y、Z元素原子的最外层
电子数分别为a-2、a+2,从而得出a+a+1+a
-2+a+2=21,a=5。由短周期元素在周期表中的相对位置,可确定W、X、Y、Z分别为N、O、Al、Cl元素。W、X分别为N、O,二者的简单气态氢化物的沸点:H2O>NH3,A正确;
Z、W分别为Cl、N,没有指明氧化物是否为最高价氧化物,若为最高价氧化物对应的水化物,则酸性:HNO3<HClO4,B不正确;
1
3
4
5
6
2
跟踪训练
氧化铝属于两性氧化物,C正确;
Y、X的简单离子分别为Al3+、O2-,二者的
电子层结构相同,但Al的核电荷数大于O,所以简单离子半径:Al3+<O2-,D正确。
3.(2022·天津高一期末)短周期元素a、b、c、d在元素周期表中的位置如图所示。下列叙述错误的是
A.a与c属于同一主族,化学性质相似
B.a的单质可与b的单质剧烈化合
C.原子半径:c>d>b
D.b下一周期的同主族元素的单质分别可与a、c、d的单质发生化合反应
1
3
4
5
6
√
2
跟踪训练
1
3
4
5
6
2
跟踪训练
根据元素在周期表的位置可知a是H,b是F,c是
Na,d是Mg,然后根据元素周期律及物质的性质
分析解答。a是H,c是Na,二者原子核外最外层
电子数都是1个,位于元素周期表第ⅠA族,但H
是非金属元素,在化学反应中能够表现氧化性、还原性,而Na是活泼的金属元素,只有强还原性,不具有氧化性,因此二者的化学性质不相似,A错误;
H2与F2在冷暗处迅速化合形成HF,反应非常剧烈,B正确;
1
3
4
5
6
2
跟踪训练
同一周期元素,原子序数越大原子半径越小,
不同周期元素,一般原子核外电子层数越多,
原子半径就越大,所以原子半径:c(Na)>
d(Mg)>b(F),C正确;
b是F,其下一周期的同主族元素是Cl,Cl2的性质活泼,可与a、c、d的单质发生化合反应,分别生成化合物HCl、NaCl、MgCl2,D正确。
B.X、Y均可形成三氯化物
C.X的原子半径小于Y的
D.Y仅有一种含氧酸
1
3
4
5
6
2
跟踪训练
√
1
3
4
5
6
2
跟踪训练
X与Y最外层电子数之和为8,质子数相差2,且X为金属元素,可推知X为Al元素,Y为P元素,二者都有+3价,都可以形成三氯化物,B项正确;
同一周期主族元素自左向右,原子半径逐渐减小,故Al的原子半径大于P,C项错误;
P元素对应含氧酸不止一种,有磷酸、次磷酸、亚磷酸等,D项错误。
1
3
4
5
6
5.W、X、Y、Z是原子序数依次增大的短周期元素。m、n、p是由这些元素组成的二元化合物,r是元素Y的常见单质,能使带火星的木条复燃,q为一元强碱,q、s的焰色均呈黄色。上述物质的转化关系如图所示。下列说法正确的是
A.原子半径:W<X<Y<Z
B.Y的简单气态氢化物的稳定性比X的弱
C.元素的非金属性:X<Y
D.由W、X、Y、Z四种元素只能组成一种化合物
√
2
跟踪训练
由题意与转化图可推知W、X、Y、Z分别为H、C、O、Na。C、O位于同一周期,C的原子半径大于O,故原子半径:W<Y<X<Z,A错误;
C、O为同周期元素,元素的非金属性:C<
O,其简单气态氢化物的稳定性:H2O>CH4,B错误、C正确;
由W、X、Y、Z四种元素可组成NaHCO3、CH3COONa等多种化合物,D错误。
1
3
4
5
6
2
跟踪训练
6.现有X、Y、Z三种元素,已知:
①X、Y、Z的单质在常温下均为气体。
②X的单质在Z的单质中燃烧,生成XZ,燃烧时火焰为苍白色。
③XZ的水溶液可使紫色石蕊溶液变红。
④两分子X的单质与一分子Y的单质化合,生成两分子X2Y,X2Y常温下为液态。
⑤Z的单质溶于X2Y中,所得溶液具有漂白性。
1
3
4
5
6
2
跟踪训练
据此推断:
(1)3.2 g Y单质的质子数约为_____________________;画出元素Y的离子
结构示意图:_________。
1
3
4
5
6
2
跟踪训练
9.632×1023(或1.6 NA)
1
3
4
5
6
2
跟踪训练
X、Y、Z的单质在常温下均为气体,X的单质在Z的单质中燃烧生成XZ,燃烧时火焰为苍白色,是氢气在氯气中燃烧的现象,XZ的水溶液可使紫色石蕊溶液变红,说明XZ是HCl,则X为H元素,Z为Cl元素。
两分子X的单质与一分子Y的单质化合,生成两分子X2Y,X2Y常温下为液体,Z的单质即Cl2,溶于X2Y中,所得溶液具有漂白性,说明X2Y是H2O,则Y为O元素。
1
3
4
5
6
2
跟踪训练
由上述分析可知,Y为O元素,其单质为O2,一个O2分子中含有的质子数为8×2=16,3.2 g O2的物质的量为 =0.1 mol,则含有的质子数目约为0.1×16×NA=1.6NA;O原子核外有8个电子,得到两个
电子形成O2-,其离子结构示意图为 。
(2)X、Y、Z的原子半径由大到小的顺序为_________(用元素符号表示)。
1
3
4
5
6
2
跟踪训练
Cl>O>H
一般情况下,电子层数越多,原子半径越大,电子层数:Cl>O>H,则原子半径:Cl>O>H。
(3)请列举Z单质的一种用途:_____________________________________
___________________。
(4)写出⑤的化学方程式:_______________________。
1
3
4
5
6
2
跟踪训练
制漂白剂、染料、药物、塑料、氯化物等
(写出其中一种即可)
Cl2+H2O HClO+HCl
本课结束
