第四章 第三节 第2课时 共价键 (75张PPT)
文档属性
| 名称 | 第四章 第三节 第2课时 共价键 (75张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-17 21:14:24 | ||
图片预览










文档简介
(共75张PPT)
第四章 第三节
第2课时 共价键
1.了解共价键、极性键、非极性键的概念,会用电子式表示共价键的形成过程。
2.会识别判断共价化合物,熟知分子结构的不同表示方法。
3.理解化学键的概念及化学反应的本质,培养“宏观辨识与微观探析”的核心
素养。
核心素养
发展目标
一、共价键与共价化合物
二、共价分子的表示方法
课时对点练
内容索引
随堂演练 知识落实
三、化学键与分子间作用力
共价键与共价化合物
一
1.微观探析,认识共价键的形成
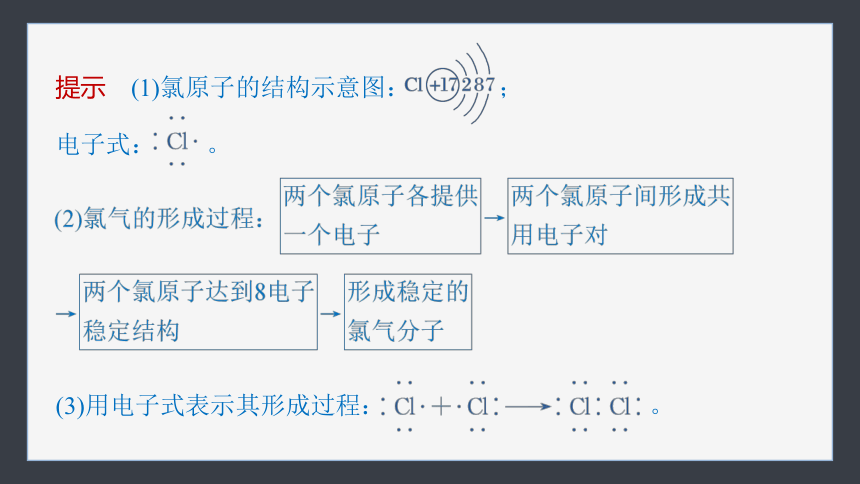
【思考1】 Cl2是怎样形成的?(画出氯原子的结构示意图和电子式)用电子式表示其形成过程。
提示 (1)氯原子的结构示意图: ;
电子式: 。
(3)用电子式表示其形成过程: 。
【思考2】 从原子结构角度分析氢原子和氯原子是怎样形成HCl的?用电子式表示其形成过程。
提示 (1)HCl的形成过程:氢原子和氯原子各提供一个电子,氢原子和氯原子间形成共用电子对,都达到稳定结构。
(2)用电子式表示其形成过程: 。
【思考3】 分析Cl2和HCl共价键的不同之处。
提示 Cl2:由同种原子形成共价键,共用电子对不偏移,成键原子不显电性;
HCl:由不同种原子形成共价键,共用电子对偏向Cl一方,Cl一方显负电性,H一方显正电性。
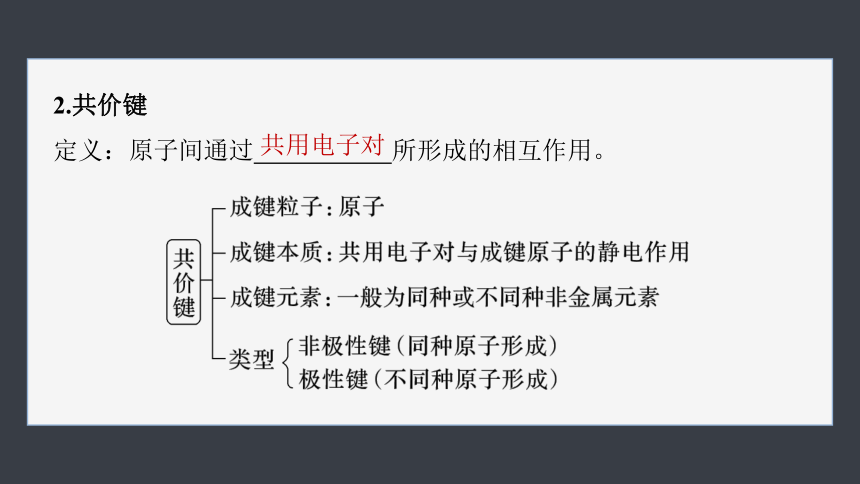
2.共价键
定义:原子间通过 所形成的相互作用。
共用电子对
3.共价化合物
(1)定义:以 形成分子的化合物。
【思考4】 判断下列哪些物质是共价化合物?(填“是”或“不是”)。
①CH4________;②CO2_______;
③HNO3_______;④ C2H5OH_______;
⑤NH4Cl______。
共用电子对
是
是
是
是
不是
(2)与物质类别的关系
应用体验
1.判断正误
(1)共价键与离子键的成键微粒是一样的
(2)非金属元素只能形成共价键
(3)只含共价键的化合物一定是共价化合物
(4)共价化合物中可能含有离子键,离子化合物中也可能含有共价键
(5)稀有气体分子中一定存在共价键
×
×
×
×
√
应用体验
2.下列元素最易形成共价键的是
A.Na B.Mg
C.Al D.Si
√
应用体验
3.(2022·广东肇庆高一期末)研究化学键有助于人们理解物质的某些性质,下列物质既含离子键又含共价键的是
A.CaCl2 B.CO2 C.H2SO4 D.K2O2
√
CaCl2中只含有离子键,CO2与H2SO4中只含有共价键,K2O2中既含有离子键又含有共价键。
返回
共价分子的表示方法
二
1.常见单质的电子式与结构式
在化学上,常用一根短线“—”表示1对共用电子的图示叫做结构式。
分子 H2 N2 Cl2
电子式 _______ ________ _________
结构式 ________ ________ ________
H—H
N≡N
Cl—Cl
2.常见化合物的电子式、结构式和空间结构
分子 H2O CO2 CH4
电子式 __________ _____________
___________
结构式 ___________ ___________
___________
空间结构 ______ ________ ____________
O==C==O
V形
直线形
正四面体形
应用体验
1.判断正误
(1)HCl、BF3和CO2分子中各原子都满足8电子稳定结构
(2)N2和CO2的电子式分别为 和
(3) 的结构式可表示为
×
×
√
应用体验
2.(2022·北京房山区高一期末)下列电子式书写不正确的是
A. B.
C. D.
氯化钠为离子化合物,电子式中需要标出阴、阳离子所带的电荷,氯化钠的电子式为 ,D项错误。
√
应用体验
3.化学用语是学习化学的基础工具,下列有关微粒的描述正确的是
A.CCl4的电子式:
B.HClO分子的结构式:H—Cl—O
C.由NH3的电子式 知,NH3分子中共含8个电子
D.用电子式表示HCl的形成过程:H×+ ―→
√
共价化合物的电子式应把组成化合物的各个原子的最外层电子数均表
示出来,CCl4的电子式为 ,故A错误;
HClO的结构式为 ,故B错误,
1个NH3分子中的电子数应为N和H电子总和,共10个电子,故C错误。
返回
化学键与分子间作用力
三
1.化学键
(1)概念: 的原子之间 的相互作用。
(2)分类
相邻
强烈
离子键
共价键
非极性键
极性键
(3)化学反应的本质
①表象:反应物中的原子重新组合为产物分子。
②本质: 的断裂和 的形成。
③解释H2和Cl2反应过程
旧化学键
新化学键
【思考1】 有化学键断裂的过程一定是化学反应吗?有化学键形成的过程一定有新物质生成吗?
提示 不一定,如NaCl受热熔化断裂离子键,HCl溶于水断裂共价键,但都不是化学变化,NaCl溶液蒸发结晶,有离子键形成,但过程为物理变化,没有新物质生成。
2.分子间作用力
(1)分子间存在一种把 在一起的作用力,叫做分子间作用力,最初又称 。由分子构成的物质,其 等物理性质主要由分子间作用力大小决定。
(2)分类:分子间作用力分为 和 。其中范德华力比化学键弱得多;氢键不是化学键,比化学键 ,比范德华力 。
(3)分子间形成的氢键会使物质的熔点和沸点 ,水分子间的氢键可使其密度在固态时 液态时的密度。
分子聚集
范德华力
熔、沸点
范德华力
氢键
弱
强
升高
低于
【思考2】 “因为H2O分子间存在氢键,故H2O的稳定性强于H2S”这句话对吗?为什么?
提示 不对。氢键属于分子间作用力,只影响物质的熔、沸点等物理性质,而H2O的稳定性是由H—O稳定性决定,是物质的化学性质。
应用体验
1.判断正误
(1)NaHSO4中含有离子键、极性共价键与非极性共价键
(2)化学键既可存在于分子内的原子间,又可存在于分子之间
(3)氢键是一种特殊的化学键
(4)稀有气体中不存在化学键
(5)两原子之间的相互作用叫做化学键
×
×
√
×
×
应用体验
2.下列叙述正确的是
A.共价化合物中一定含有共价键
B.氯气中含离子键
C.离子键、共价键、分子间作用力均属于化学键
D.所有物质一定含有化学键
√
共价化合物中各原子间以共价键相结合,故A正确;
离子键只存在于离子化合物中,氯气是非金属单质,不含离子键,故B错误;
分子间作用力不属于化学键,故C错误;
稀有气体中没有化学键,故D错误。
应用体验
3.关于氢键及范德华力,下列说法正确的是
A.氢键比范德华力强,所以它属于化学键
B.分子间形成的氢键使物质的熔、沸点升高
C.沸点:HI>HBr>HCl>HF
D.H2O是一种稳定的化合物,这是由H2O之间形成氢键所致
√
氢键属于分子间作用力,不属于化学键,A错误;
若分子间含有氢键,则固体熔化或液体汽化时除克服范德华力外,还需要破坏氢键,所以分子间形成的氢键会使物质的熔、沸点都升高,B正确;
第ⅦA族元素的简单气态氢化物中,氟化氢分子间存在氢键,沸点较高,其他元素氢化物分子间只有范德华力,一般相对分子质量越大,范德华力越大,物质的熔、沸点越高,因此沸点:HF>HI>HBr>HCl,C错误;
H2O的化学性质稳定是因为分子内的氢氧键比较稳定,与分子间形成氢键无关,D错误。
返回
随堂演练 知识落实
1
2
3
4
1.下列含有共价键的物质是
A.NaCl B.MgCl2
C.H2O D.KI
√
随堂演练
2.(2023·徐州高一期末)下列说法正确的是
A.CaO和SiO2都是离子化合物
B.次氯酸的电子式是
C.H2O比H2S的沸点高是因为水分子间存在氢键
D.含金属元素的化合物一定是离子化合物
√
随堂演练
1
2
3
4
随堂演练
1
2
3
4
以离子键结合形成的化合物属于离子化合物,CaO属于离子化合物,SiO2属于共价化合物,故A错误;
次氯酸中心原子是O,O原子分别与H、Cl原子共用1对电子,O、Cl原子外围达到8电子稳定结构,次氯酸的电子式为 ,故B错误;
H2O比H2S的沸点高是因为水分子间存在氢键,分子间作用力较强,沸点较高,故C正确;
含金属元素的化合物不一定是离子化合物,如氯化铝为共价化合物,故D错误。
3.(2022·苏州高一月考)下列各组物质熔化或升华时,所克服的粒子间作用属于同种类型的是
A.MgO和SiC B.NaCl和冰
C.CO2和SiO2 D.碘和冰升华
√
随堂演练
1
2
3
4
随堂演练
1
2
3
4
MgO熔化克服离子键,SiC熔化克服共价键,类型不同,故A不选;
冰熔化克服氢键及范德华力,NaCl熔化克服离子键,类型不同,故B不选;
CO2熔化或升华克服分子间作用力,SiO2熔化克服共价键,类型不同,故C不选;
碘和冰升华均克服分子间作用力,类型相同,故D选。
4.根据给出的化学反应或化学方程式写出反应过程中断裂的键和形成的键。
(1)电解水的反应:断裂的键为______,形成的键为_____________。
(2)P4+10Cl2 4PCl5[白磷(P4)的空间结构如图所示]:断裂的键为_____________,形成的键为_______。
随堂演练
1
2
3
4
H—O
H—H、O==O
P—P、Cl—Cl
P—Cl
返回
课时对点练
1
2
3
4
5
6
7
8
9
题组一 共价键与共价化合物
1.下列分子中共用电子对数目最多的是
A.CH4 B.NH3 C.HCl D.N2
√
10
11
12
13
14
15
对点训练
CH4分子中存在4个C—H,所以存在4对共用电子对,NH3分子中存在3个N—H,所以存在3对共用电子对;HCl分子中存在1个H—Cl,存在1对共用电子对;
N2分子中存在1个N≡N,存在3对共用电子对;
所以共用电子对数目最多的是甲烷。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2.(2022·余姚市校级高一月考)含有极性共价键的盐是
A.KCl B.H2O2 C.NH4Cl D.Cu2S
√
2
KCl只存子离子键,故A错误;
H2O2属于氧化物,不是盐,故B错误;
NH4Cl中铵根离子和氯离子之间存在离子键、铵根离子内存在N—H极性键,属于盐,故C正确;
Cu2S只存在离子键,故D错误。
3.下列关于共价键与共价化合物的叙述正确的是
①含金属元素的化合物一定不是共价化合物
②共价化合物中一定只含有共价键
③共价化合物中一定不含离子键
④含有共价键的化合物一定是共价化合物
⑤离子化合物中可能含有共价键
A.②③⑤ B.②③④⑤
C.②③④ D.①②③⑤
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
含金属元素的化合物可能是共价化合物,如氯化铝,①错误;
共价化合物中只含有共价键,一定不含离子键,②、③正确;
离子化合物中可能含有共价键,如氢氧化钠含有离子键和共价键,⑤正确。
A.甲烷的结构式 B.氨气的电子式 C.氯化钠的电子式 D.F-的结构示意图
CH4
题组二 共价分子结构的表示方法
4.下列物质结构与对应的用语表达正确的是
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
甲烷的结构式为 ,故A错误;
氨气的电子式为 ,故B错误;
氯化钠的电子式为 ,故C错误;
氟离子核外10个电子,核内9个质子,最外层8个电子,离子结构示意
图为 ,故D正确。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
5.(2022·佛山高一期末)中国科学院首次用CO2人工合成淀粉,该过程需要H2和H2O的参与。下列说法错误的是
A.C的原子结构示意图为
B.H2的电子式为H—H
C.CO2的结构式为O==C==O
D.H2O的分子结构模型为
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
C原子核外电子数为6,电子层数为2,最外层电子数为4,原子结构示
意图为 ,故A正确;
氢气分子是两个氢原子间形成一对共用电子对,电子式为 ,故B
错误;
CO2是共价化合物,C原子与O原子之间以双键结合,其结构式为O==C==O,故C正确;
水分子结构模型为 ,故D正确。
2
6.(2023·西安高一期末)下列关于电子式的相关描述正确的是
A.CS2的电子式:
B.N2的电子式:N N
C.Na2O2的电子式:
D.用电子式表示HCl的形成过程:
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
二硫化碳是共价化合物,C原子最外层4个电子,S原子最外层6个电子,所以二硫化碳的电子式为 ,故A错误;
氮气中N原子之间以三键结合,电子式为 ,故B错误;
Na2O2是离子化合物,由Na+和 构成, 中O原子间共用一对电子,其电子式为 ,故C错误。
题组三 构成物质微粒间的相互作用
7.(2022·浦东新区校级高一期中)下列各组物质中,含有的化学键类型完全相同的是
A.HI和NaI B.NaF和KOH
C.CO2和HCl D.F2和NaBr
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
NaI是离子化合物,存在的化学键是离子键,HI是共价化合物,只存在共价键,化学键类型不相同,故A错误;
NaF和KOH均是离子化合物,存在离子键,KOH中还存在共价键,化学键类型不全相同,故B错误;
CO2和HCl都是共价化合物,存在的化学键都是极性共价键,故C正确;
F2是共价化合物,存在的化学键是共价键,NaBr是离子化合物,只存在离子键,化学键类型不同,故D错误。
2
8.(2022·江苏盐城高一期中)从化学键的角度看,化学反应的实质是“旧化学键的断裂,新化学键的形成”,下列过程中既有旧化学键的断裂,又有新化学键的形成的是
A.Cl2溶于水
B.碘升华
C.氯化钠受热熔化
D.硝酸铵溶于水
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
氯气溶于水发生了化学反应,氯气和水反应生成HCl和次氯酸,既有旧化学键的断裂,又有新化学键的形成,A正确;
碘升华是物理变化,只是物质的状态发生了变化,只破坏了分子间作用力,没有发生化学反应,所以没有旧化学键的断裂和新化学键的形成,B错误;
氯化钠受热熔化是物理变化,只是物质的状态发生了变化,破坏了离子键,没有新化学键的形成,C错误;
硝酸铵溶于水没有发生化学反应,只是破坏离子键,没有新化学键的形成,D错误。
2
9.(2022·重庆缙云教育联盟高一期末)下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是
A.Cl2+H2O HClO+HCl
B.2Na2O2+2H2O===4NaOH+O2↑
C.NH4Cl+NaOH NaCl+NH3↑+H2O
D.2FeCl2+H2O2+2HCl===2FeCl3+2H2O
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
反应Cl2+H2O HClO+HCl中,无离子键的断裂和形成,无非极性键的形成,A不符合题意;
反应2Na2O2+2H2O===4NaOH+O2↑中,钠离子和过氧根离子之间的离子键断裂,过氧根离子中两个O之间的非极性键断裂,H2O分子中H和O之间的极性键断裂,有钠离子和氢氧根离子之间的离子键、OH-中H和O之间的极性键、O2分子中O和O之间的非极性键形成,B符合题意;
2
综合强化
1
3
4
5
6
7
8
9
10
11
12
13
14
15
反应NH4Cl+NaOH NaCl+NH3↑+H2O中,无非极性键的断裂和形成,C不符合题意;
反应2FeCl2+H2O2+2HCl===2FeCl3+2H2O中,无非极性键的形成,D不符合题意。
2
综合强化
10.下列说法正确的是
A.HCl溶于水能电离出H+、Cl-,所以HCl是离子化合物
B.NaHCO3受热分解的过程中既破坏了离子键,也破坏了共价键
C.CO2分子内存在非极性共价键
D.非极性键只能存在于非金属单质或共价化合物中
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
HCl分子中只存在H—Cl共价键,HCl属于共价化合物,故A错误;
CO2分子内只存在极性共价键,故C错误;
非极性键可能存在于离子化合物中,如Na2O2中含有非极性键,故D错误。
11.化合物M(结构式如图所示)可用于口腔清洁。已知W、X、Y、Z是原子序数依次增大的前20号主族元素,W与Z、X与Y分别同主族,Y、Z对应的简单离子核外电子排布相同。下列说法不正确的是
A.简单离子的半径:Y>Z>W
B.简单氢化物的沸点:X>Y
C.化合物M中X的化合价均为-2
D.ZW可与H2O反应生成W的单质
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
已知W、X、Y、Z是原子序数依次增大
的前20号主族元素,由X可以形成2个共
价键、Y形成6个共价键,X与Y同主族可
知,X为O、Y为S;Y、Z对应的简单离子核外电子排布相同,Z可以形成带1个单位正电荷的阳离子,Z为第ⅠA族元素,为K;W与Z同主族,W为H。电子层数越多半径越大,电子层数相同时,核电荷数越大,半径越小,简单离子的半径:Y>Z>W,A正确;
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
水分子可以形成分子间氢键,导致水的沸
点高于硫化氢,B正确;
由图可知,化合物M中存在过氧根,故O的
化合价存在-1价,C错误;
KH为金属氢化物,可与水反应生成氢气,D正确。
12.(2022·河南驻马店高一期末)在抗击某病毒的“战斗”中“84消毒液”
(有效成分是NaClO)发挥了重要作用。工业上,制备“84消毒液”的原理
为NaCl+H2O NaClO+H2↑。下列说法正确的是
A.NaClO的消毒原理是利用了其强氧化性
B.NaClO的电子式为
C.该反应每转移1 mol电子生成74.5 g的NaClO
D.上述反应过程中只有离子键、非极性共价键的断裂和形成
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
NaClO中Cl元素的化合价为+1价,具有强氧化性,可用于杀菌消毒,A正确;
NaClO的电子式为 ,B错误;
根据化学方程式可知,Cl的化合价从-1价升高为+1价,每转移2 mol电子生成74.5 g的NaClO,故该反应每转移1 mol电子生成37.25 g的NaClO,C错误;
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
NaCl中钠离子和氯离子之间是离子键,水分子中含有极性共价键,NaClO中含有离子键和极性共价键,H2中存在非极性共价键,故上述反应过程中有离子键、极性共价键的断裂,有离子键、极性共价键、非极性共价键的形成,D错误。
13.(1)有下列物质:①O2 ②金刚石 ③NaBr ④H2SO4 ⑤Na2CO3
⑥NH4Cl ⑦NaHSO4 ⑧Ne ⑨Na2O2 ⑩NaOH
其中,只含有离子键的是______(填序号,下同);只含有极性键的是______;只含有非极性键的是______;既含有离子键又含有极性键的是__________;既含有离子键又含有非极性键的是______;没有离子键和共价键的是______。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
③
④
①②
⑤⑥⑦⑩
⑨
⑧
(2)NaHSO4溶于水时,断开的化学键的类型:___________________。
(3)NaHCO3受热分解时,断开的化学键的类型:__________________,形成的化学键类型:___________________。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
离子键、极性共价键
离子键、极性共价键
离子键、极性共价键
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
14.为了清理路面积雪,人们常使用一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol电子。
(1)该融雪剂的化学式是________,该物质中的化学键类型是________,
电子式是___________________。
2
CaCl2
离子键
融雪剂XY2中阳离子和阴离子的电子层结构相同且1 mol XY2含有54 mol
电子,则1 mol X2+和1 mol Y-中均含有18 mol电子,故X是Ca元素,Y是Cl元素,XY2是CaCl2。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻。
①D的离子结构示意图是__________。
②D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到8e-稳定结构,化学键类型为____________(填“离子键”“非极性共价键”或“极性共价键”)。
2
极性共价键
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D是S元素,E是C元素。
D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到8e-稳定结构,该化合物是CS2,含有极性共价键。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质在W的常见单质中反应时有两种产物,不加热时生成______,其化学键类型为________;加热时生成_______,其化学键类型为_________
______________。
Na2O
离子键
W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,则W是O元素,Z是Na元素。Na和O2在不加热时生成Na2O,含有离子键;在加热时生成Na2O2,含有离子键和非极性共价键。
Na2O2
离子键和
非极性共价键
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
15.现有A、B、C、D四种元素,前三种元素的离子都和氖原子具有相同的核外电子排布。A元素没有正化合价;B的氢化物的分子式为H2B,0.2 mol的C单质能从酸中置换出2.24 L H2(标准状况下)。D的原子核中没有中子。
(1)根据以上条件,推断A、B、C、D的元素名称:
A_____,B_____,C_____,D_____。
2
氟
氧
钠
氢
化合物 电子式 化合物类型 化学键类型
C+A
C+B
B+D
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(2)用电子式表示C与A、C与B、B与D相互结合成的一种化合物,并指出其化合物的类型及化学键类型:
2
离子化合物
离子键
离子化合物
共价化合物
离子键(或 离子化合物 离子键和非极性共价键)
极性共价键(或 共价化合物 极性共价键和非极性共价键)
题给信息中A、B、C的离子与氖原子的核外电子排布相同,说明A、B、C是第二周期的非金属元素或第三周期的金属元素;
B的氢化物的分子式为H2B,说明B一定是氧元素;
A是没有正价态的元素,说明A很活泼且只能得电子,为活泼的非金属元素氟;
C与酸反应能产生H2,说明C为金属元素且在第三周期,再由0.2 mol C可产生0.1 mol H2,则C为钠元素;
D的原子核中没有中子,说明D为氢元素。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(3)写出C与B所形成的化合物和D与B所形成的化合物反应的离子方程式:
________________________________________________________________。
2
Na2O+H2O===2Na++2OH-(或2Na2O2+2H2O===4Na++4OH-+O2↑)
返回
本课结束
第四章 第三节
第2课时 共价键
1.了解共价键、极性键、非极性键的概念,会用电子式表示共价键的形成过程。
2.会识别判断共价化合物,熟知分子结构的不同表示方法。
3.理解化学键的概念及化学反应的本质,培养“宏观辨识与微观探析”的核心
素养。
核心素养
发展目标
一、共价键与共价化合物
二、共价分子的表示方法
课时对点练
内容索引
随堂演练 知识落实
三、化学键与分子间作用力
共价键与共价化合物
一
1.微观探析,认识共价键的形成
【思考1】 Cl2是怎样形成的?(画出氯原子的结构示意图和电子式)用电子式表示其形成过程。
提示 (1)氯原子的结构示意图: ;
电子式: 。
(3)用电子式表示其形成过程: 。
【思考2】 从原子结构角度分析氢原子和氯原子是怎样形成HCl的?用电子式表示其形成过程。
提示 (1)HCl的形成过程:氢原子和氯原子各提供一个电子,氢原子和氯原子间形成共用电子对,都达到稳定结构。
(2)用电子式表示其形成过程: 。
【思考3】 分析Cl2和HCl共价键的不同之处。
提示 Cl2:由同种原子形成共价键,共用电子对不偏移,成键原子不显电性;
HCl:由不同种原子形成共价键,共用电子对偏向Cl一方,Cl一方显负电性,H一方显正电性。
2.共价键
定义:原子间通过 所形成的相互作用。
共用电子对
3.共价化合物
(1)定义:以 形成分子的化合物。
【思考4】 判断下列哪些物质是共价化合物?(填“是”或“不是”)。
①CH4________;②CO2_______;
③HNO3_______;④ C2H5OH_______;
⑤NH4Cl______。
共用电子对
是
是
是
是
不是
(2)与物质类别的关系
应用体验
1.判断正误
(1)共价键与离子键的成键微粒是一样的
(2)非金属元素只能形成共价键
(3)只含共价键的化合物一定是共价化合物
(4)共价化合物中可能含有离子键,离子化合物中也可能含有共价键
(5)稀有气体分子中一定存在共价键
×
×
×
×
√
应用体验
2.下列元素最易形成共价键的是
A.Na B.Mg
C.Al D.Si
√
应用体验
3.(2022·广东肇庆高一期末)研究化学键有助于人们理解物质的某些性质,下列物质既含离子键又含共价键的是
A.CaCl2 B.CO2 C.H2SO4 D.K2O2
√
CaCl2中只含有离子键,CO2与H2SO4中只含有共价键,K2O2中既含有离子键又含有共价键。
返回
共价分子的表示方法
二
1.常见单质的电子式与结构式
在化学上,常用一根短线“—”表示1对共用电子的图示叫做结构式。
分子 H2 N2 Cl2
电子式 _______ ________ _________
结构式 ________ ________ ________
H—H
N≡N
Cl—Cl
2.常见化合物的电子式、结构式和空间结构
分子 H2O CO2 CH4
电子式 __________ _____________
___________
结构式 ___________ ___________
___________
空间结构 ______ ________ ____________
O==C==O
V形
直线形
正四面体形
应用体验
1.判断正误
(1)HCl、BF3和CO2分子中各原子都满足8电子稳定结构
(2)N2和CO2的电子式分别为 和
(3) 的结构式可表示为
×
×
√
应用体验
2.(2022·北京房山区高一期末)下列电子式书写不正确的是
A. B.
C. D.
氯化钠为离子化合物,电子式中需要标出阴、阳离子所带的电荷,氯化钠的电子式为 ,D项错误。
√
应用体验
3.化学用语是学习化学的基础工具,下列有关微粒的描述正确的是
A.CCl4的电子式:
B.HClO分子的结构式:H—Cl—O
C.由NH3的电子式 知,NH3分子中共含8个电子
D.用电子式表示HCl的形成过程:H×+ ―→
√
共价化合物的电子式应把组成化合物的各个原子的最外层电子数均表
示出来,CCl4的电子式为 ,故A错误;
HClO的结构式为 ,故B错误,
1个NH3分子中的电子数应为N和H电子总和,共10个电子,故C错误。
返回
化学键与分子间作用力
三
1.化学键
(1)概念: 的原子之间 的相互作用。
(2)分类
相邻
强烈
离子键
共价键
非极性键
极性键
(3)化学反应的本质
①表象:反应物中的原子重新组合为产物分子。
②本质: 的断裂和 的形成。
③解释H2和Cl2反应过程
旧化学键
新化学键
【思考1】 有化学键断裂的过程一定是化学反应吗?有化学键形成的过程一定有新物质生成吗?
提示 不一定,如NaCl受热熔化断裂离子键,HCl溶于水断裂共价键,但都不是化学变化,NaCl溶液蒸发结晶,有离子键形成,但过程为物理变化,没有新物质生成。
2.分子间作用力
(1)分子间存在一种把 在一起的作用力,叫做分子间作用力,最初又称 。由分子构成的物质,其 等物理性质主要由分子间作用力大小决定。
(2)分类:分子间作用力分为 和 。其中范德华力比化学键弱得多;氢键不是化学键,比化学键 ,比范德华力 。
(3)分子间形成的氢键会使物质的熔点和沸点 ,水分子间的氢键可使其密度在固态时 液态时的密度。
分子聚集
范德华力
熔、沸点
范德华力
氢键
弱
强
升高
低于
【思考2】 “因为H2O分子间存在氢键,故H2O的稳定性强于H2S”这句话对吗?为什么?
提示 不对。氢键属于分子间作用力,只影响物质的熔、沸点等物理性质,而H2O的稳定性是由H—O稳定性决定,是物质的化学性质。
应用体验
1.判断正误
(1)NaHSO4中含有离子键、极性共价键与非极性共价键
(2)化学键既可存在于分子内的原子间,又可存在于分子之间
(3)氢键是一种特殊的化学键
(4)稀有气体中不存在化学键
(5)两原子之间的相互作用叫做化学键
×
×
√
×
×
应用体验
2.下列叙述正确的是
A.共价化合物中一定含有共价键
B.氯气中含离子键
C.离子键、共价键、分子间作用力均属于化学键
D.所有物质一定含有化学键
√
共价化合物中各原子间以共价键相结合,故A正确;
离子键只存在于离子化合物中,氯气是非金属单质,不含离子键,故B错误;
分子间作用力不属于化学键,故C错误;
稀有气体中没有化学键,故D错误。
应用体验
3.关于氢键及范德华力,下列说法正确的是
A.氢键比范德华力强,所以它属于化学键
B.分子间形成的氢键使物质的熔、沸点升高
C.沸点:HI>HBr>HCl>HF
D.H2O是一种稳定的化合物,这是由H2O之间形成氢键所致
√
氢键属于分子间作用力,不属于化学键,A错误;
若分子间含有氢键,则固体熔化或液体汽化时除克服范德华力外,还需要破坏氢键,所以分子间形成的氢键会使物质的熔、沸点都升高,B正确;
第ⅦA族元素的简单气态氢化物中,氟化氢分子间存在氢键,沸点较高,其他元素氢化物分子间只有范德华力,一般相对分子质量越大,范德华力越大,物质的熔、沸点越高,因此沸点:HF>HI>HBr>HCl,C错误;
H2O的化学性质稳定是因为分子内的氢氧键比较稳定,与分子间形成氢键无关,D错误。
返回
随堂演练 知识落实
1
2
3
4
1.下列含有共价键的物质是
A.NaCl B.MgCl2
C.H2O D.KI
√
随堂演练
2.(2023·徐州高一期末)下列说法正确的是
A.CaO和SiO2都是离子化合物
B.次氯酸的电子式是
C.H2O比H2S的沸点高是因为水分子间存在氢键
D.含金属元素的化合物一定是离子化合物
√
随堂演练
1
2
3
4
随堂演练
1
2
3
4
以离子键结合形成的化合物属于离子化合物,CaO属于离子化合物,SiO2属于共价化合物,故A错误;
次氯酸中心原子是O,O原子分别与H、Cl原子共用1对电子,O、Cl原子外围达到8电子稳定结构,次氯酸的电子式为 ,故B错误;
H2O比H2S的沸点高是因为水分子间存在氢键,分子间作用力较强,沸点较高,故C正确;
含金属元素的化合物不一定是离子化合物,如氯化铝为共价化合物,故D错误。
3.(2022·苏州高一月考)下列各组物质熔化或升华时,所克服的粒子间作用属于同种类型的是
A.MgO和SiC B.NaCl和冰
C.CO2和SiO2 D.碘和冰升华
√
随堂演练
1
2
3
4
随堂演练
1
2
3
4
MgO熔化克服离子键,SiC熔化克服共价键,类型不同,故A不选;
冰熔化克服氢键及范德华力,NaCl熔化克服离子键,类型不同,故B不选;
CO2熔化或升华克服分子间作用力,SiO2熔化克服共价键,类型不同,故C不选;
碘和冰升华均克服分子间作用力,类型相同,故D选。
4.根据给出的化学反应或化学方程式写出反应过程中断裂的键和形成的键。
(1)电解水的反应:断裂的键为______,形成的键为_____________。
(2)P4+10Cl2 4PCl5[白磷(P4)的空间结构如图所示]:断裂的键为_____________,形成的键为_______。
随堂演练
1
2
3
4
H—O
H—H、O==O
P—P、Cl—Cl
P—Cl
返回
课时对点练
1
2
3
4
5
6
7
8
9
题组一 共价键与共价化合物
1.下列分子中共用电子对数目最多的是
A.CH4 B.NH3 C.HCl D.N2
√
10
11
12
13
14
15
对点训练
CH4分子中存在4个C—H,所以存在4对共用电子对,NH3分子中存在3个N—H,所以存在3对共用电子对;HCl分子中存在1个H—Cl,存在1对共用电子对;
N2分子中存在1个N≡N,存在3对共用电子对;
所以共用电子对数目最多的是甲烷。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2.(2022·余姚市校级高一月考)含有极性共价键的盐是
A.KCl B.H2O2 C.NH4Cl D.Cu2S
√
2
KCl只存子离子键,故A错误;
H2O2属于氧化物,不是盐,故B错误;
NH4Cl中铵根离子和氯离子之间存在离子键、铵根离子内存在N—H极性键,属于盐,故C正确;
Cu2S只存在离子键,故D错误。
3.下列关于共价键与共价化合物的叙述正确的是
①含金属元素的化合物一定不是共价化合物
②共价化合物中一定只含有共价键
③共价化合物中一定不含离子键
④含有共价键的化合物一定是共价化合物
⑤离子化合物中可能含有共价键
A.②③⑤ B.②③④⑤
C.②③④ D.①②③⑤
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
含金属元素的化合物可能是共价化合物,如氯化铝,①错误;
共价化合物中只含有共价键,一定不含离子键,②、③正确;
离子化合物中可能含有共价键,如氢氧化钠含有离子键和共价键,⑤正确。
A.甲烷的结构式 B.氨气的电子式 C.氯化钠的电子式 D.F-的结构示意图
CH4
题组二 共价分子结构的表示方法
4.下列物质结构与对应的用语表达正确的是
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
甲烷的结构式为 ,故A错误;
氨气的电子式为 ,故B错误;
氯化钠的电子式为 ,故C错误;
氟离子核外10个电子,核内9个质子,最外层8个电子,离子结构示意
图为 ,故D正确。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
5.(2022·佛山高一期末)中国科学院首次用CO2人工合成淀粉,该过程需要H2和H2O的参与。下列说法错误的是
A.C的原子结构示意图为
B.H2的电子式为H—H
C.CO2的结构式为O==C==O
D.H2O的分子结构模型为
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
C原子核外电子数为6,电子层数为2,最外层电子数为4,原子结构示
意图为 ,故A正确;
氢气分子是两个氢原子间形成一对共用电子对,电子式为 ,故B
错误;
CO2是共价化合物,C原子与O原子之间以双键结合,其结构式为O==C==O,故C正确;
水分子结构模型为 ,故D正确。
2
6.(2023·西安高一期末)下列关于电子式的相关描述正确的是
A.CS2的电子式:
B.N2的电子式:N N
C.Na2O2的电子式:
D.用电子式表示HCl的形成过程:
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
二硫化碳是共价化合物,C原子最外层4个电子,S原子最外层6个电子,所以二硫化碳的电子式为 ,故A错误;
氮气中N原子之间以三键结合,电子式为 ,故B错误;
Na2O2是离子化合物,由Na+和 构成, 中O原子间共用一对电子,其电子式为 ,故C错误。
题组三 构成物质微粒间的相互作用
7.(2022·浦东新区校级高一期中)下列各组物质中,含有的化学键类型完全相同的是
A.HI和NaI B.NaF和KOH
C.CO2和HCl D.F2和NaBr
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
NaI是离子化合物,存在的化学键是离子键,HI是共价化合物,只存在共价键,化学键类型不相同,故A错误;
NaF和KOH均是离子化合物,存在离子键,KOH中还存在共价键,化学键类型不全相同,故B错误;
CO2和HCl都是共价化合物,存在的化学键都是极性共价键,故C正确;
F2是共价化合物,存在的化学键是共价键,NaBr是离子化合物,只存在离子键,化学键类型不同,故D错误。
2
8.(2022·江苏盐城高一期中)从化学键的角度看,化学反应的实质是“旧化学键的断裂,新化学键的形成”,下列过程中既有旧化学键的断裂,又有新化学键的形成的是
A.Cl2溶于水
B.碘升华
C.氯化钠受热熔化
D.硝酸铵溶于水
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
氯气溶于水发生了化学反应,氯气和水反应生成HCl和次氯酸,既有旧化学键的断裂,又有新化学键的形成,A正确;
碘升华是物理变化,只是物质的状态发生了变化,只破坏了分子间作用力,没有发生化学反应,所以没有旧化学键的断裂和新化学键的形成,B错误;
氯化钠受热熔化是物理变化,只是物质的状态发生了变化,破坏了离子键,没有新化学键的形成,C错误;
硝酸铵溶于水没有发生化学反应,只是破坏离子键,没有新化学键的形成,D错误。
2
9.(2022·重庆缙云教育联盟高一期末)下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是
A.Cl2+H2O HClO+HCl
B.2Na2O2+2H2O===4NaOH+O2↑
C.NH4Cl+NaOH NaCl+NH3↑+H2O
D.2FeCl2+H2O2+2HCl===2FeCl3+2H2O
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
反应Cl2+H2O HClO+HCl中,无离子键的断裂和形成,无非极性键的形成,A不符合题意;
反应2Na2O2+2H2O===4NaOH+O2↑中,钠离子和过氧根离子之间的离子键断裂,过氧根离子中两个O之间的非极性键断裂,H2O分子中H和O之间的极性键断裂,有钠离子和氢氧根离子之间的离子键、OH-中H和O之间的极性键、O2分子中O和O之间的非极性键形成,B符合题意;
2
综合强化
1
3
4
5
6
7
8
9
10
11
12
13
14
15
反应NH4Cl+NaOH NaCl+NH3↑+H2O中,无非极性键的断裂和形成,C不符合题意;
反应2FeCl2+H2O2+2HCl===2FeCl3+2H2O中,无非极性键的形成,D不符合题意。
2
综合强化
10.下列说法正确的是
A.HCl溶于水能电离出H+、Cl-,所以HCl是离子化合物
B.NaHCO3受热分解的过程中既破坏了离子键,也破坏了共价键
C.CO2分子内存在非极性共价键
D.非极性键只能存在于非金属单质或共价化合物中
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
HCl分子中只存在H—Cl共价键,HCl属于共价化合物,故A错误;
CO2分子内只存在极性共价键,故C错误;
非极性键可能存在于离子化合物中,如Na2O2中含有非极性键,故D错误。
11.化合物M(结构式如图所示)可用于口腔清洁。已知W、X、Y、Z是原子序数依次增大的前20号主族元素,W与Z、X与Y分别同主族,Y、Z对应的简单离子核外电子排布相同。下列说法不正确的是
A.简单离子的半径:Y>Z>W
B.简单氢化物的沸点:X>Y
C.化合物M中X的化合价均为-2
D.ZW可与H2O反应生成W的单质
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
已知W、X、Y、Z是原子序数依次增大
的前20号主族元素,由X可以形成2个共
价键、Y形成6个共价键,X与Y同主族可
知,X为O、Y为S;Y、Z对应的简单离子核外电子排布相同,Z可以形成带1个单位正电荷的阳离子,Z为第ⅠA族元素,为K;W与Z同主族,W为H。电子层数越多半径越大,电子层数相同时,核电荷数越大,半径越小,简单离子的半径:Y>Z>W,A正确;
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
水分子可以形成分子间氢键,导致水的沸
点高于硫化氢,B正确;
由图可知,化合物M中存在过氧根,故O的
化合价存在-1价,C错误;
KH为金属氢化物,可与水反应生成氢气,D正确。
12.(2022·河南驻马店高一期末)在抗击某病毒的“战斗”中“84消毒液”
(有效成分是NaClO)发挥了重要作用。工业上,制备“84消毒液”的原理
为NaCl+H2O NaClO+H2↑。下列说法正确的是
A.NaClO的消毒原理是利用了其强氧化性
B.NaClO的电子式为
C.该反应每转移1 mol电子生成74.5 g的NaClO
D.上述反应过程中只有离子键、非极性共价键的断裂和形成
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
NaClO中Cl元素的化合价为+1价,具有强氧化性,可用于杀菌消毒,A正确;
NaClO的电子式为 ,B错误;
根据化学方程式可知,Cl的化合价从-1价升高为+1价,每转移2 mol电子生成74.5 g的NaClO,故该反应每转移1 mol电子生成37.25 g的NaClO,C错误;
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
NaCl中钠离子和氯离子之间是离子键,水分子中含有极性共价键,NaClO中含有离子键和极性共价键,H2中存在非极性共价键,故上述反应过程中有离子键、极性共价键的断裂,有离子键、极性共价键、非极性共价键的形成,D错误。
13.(1)有下列物质:①O2 ②金刚石 ③NaBr ④H2SO4 ⑤Na2CO3
⑥NH4Cl ⑦NaHSO4 ⑧Ne ⑨Na2O2 ⑩NaOH
其中,只含有离子键的是______(填序号,下同);只含有极性键的是______;只含有非极性键的是______;既含有离子键又含有极性键的是__________;既含有离子键又含有非极性键的是______;没有离子键和共价键的是______。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
③
④
①②
⑤⑥⑦⑩
⑨
⑧
(2)NaHSO4溶于水时,断开的化学键的类型:___________________。
(3)NaHCO3受热分解时,断开的化学键的类型:__________________,形成的化学键类型:___________________。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
离子键、极性共价键
离子键、极性共价键
离子键、极性共价键
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
14.为了清理路面积雪,人们常使用一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol电子。
(1)该融雪剂的化学式是________,该物质中的化学键类型是________,
电子式是___________________。
2
CaCl2
离子键
融雪剂XY2中阳离子和阴离子的电子层结构相同且1 mol XY2含有54 mol
电子,则1 mol X2+和1 mol Y-中均含有18 mol电子,故X是Ca元素,Y是Cl元素,XY2是CaCl2。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻。
①D的离子结构示意图是__________。
②D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到8e-稳定结构,化学键类型为____________(填“离子键”“非极性共价键”或“极性共价键”)。
2
极性共价键
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D是S元素,E是C元素。
D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到8e-稳定结构,该化合物是CS2,含有极性共价键。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质在W的常见单质中反应时有两种产物,不加热时生成______,其化学键类型为________;加热时生成_______,其化学键类型为_________
______________。
Na2O
离子键
W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,则W是O元素,Z是Na元素。Na和O2在不加热时生成Na2O,含有离子键;在加热时生成Na2O2,含有离子键和非极性共价键。
Na2O2
离子键和
非极性共价键
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
15.现有A、B、C、D四种元素,前三种元素的离子都和氖原子具有相同的核外电子排布。A元素没有正化合价;B的氢化物的分子式为H2B,0.2 mol的C单质能从酸中置换出2.24 L H2(标准状况下)。D的原子核中没有中子。
(1)根据以上条件,推断A、B、C、D的元素名称:
A_____,B_____,C_____,D_____。
2
氟
氧
钠
氢
化合物 电子式 化合物类型 化学键类型
C+A
C+B
B+D
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(2)用电子式表示C与A、C与B、B与D相互结合成的一种化合物,并指出其化合物的类型及化学键类型:
2
离子化合物
离子键
离子化合物
共价化合物
离子键(或 离子化合物 离子键和非极性共价键)
极性共价键(或 共价化合物 极性共价键和非极性共价键)
题给信息中A、B、C的离子与氖原子的核外电子排布相同,说明A、B、C是第二周期的非金属元素或第三周期的金属元素;
B的氢化物的分子式为H2B,说明B一定是氧元素;
A是没有正价态的元素,说明A很活泼且只能得电子,为活泼的非金属元素氟;
C与酸反应能产生H2,说明C为金属元素且在第三周期,再由0.2 mol C可产生0.1 mol H2,则C为钠元素;
D的原子核中没有中子,说明D为氢元素。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(3)写出C与B所形成的化合物和D与B所形成的化合物反应的离子方程式:
________________________________________________________________。
2
Na2O+H2O===2Na++2OH-(或2Na2O2+2H2O===4Na++4OH-+O2↑)
返回
本课结束
