4.1 微专题4 元素金属性、非金属性强弱的比较 课件(23张PPT)
文档属性
| 名称 | 4.1 微专题4 元素金属性、非金属性强弱的比较 课件(23张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 255.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-17 21:16:10 | ||
图片预览








文档简介
(共23张PPT)
第四章 第一节
微专题4 元素金属性、非金属性
强弱的比较
1.金属性强弱的判断方法
金属性是指金属元素原子在化学反应中失电子的能力,通常用如下两种方法判断其强弱:
(1)根据金属单质与水或非氧化性酸反应置换出氢气的难易程度判断,置换出氢气越容易,则元素的金属性越强。
(2)根据金属元素最高价氧化物对应的水化物的碱性强弱判断,碱性越强,则元素的金属性越强。
2.非金属性强弱的判断方法
非金属性是指非金属元素原子得电子的能力,通常用如下两种方法判断:
(1)根据非金属单质与H2化合的难易程度、生成气态氢化物的稳定性判断,越易化合,生成的气态氢化物越稳定,则元素的非金属性越强。
(2)根据非金属元素最高价氧化物对应的水化物的酸性强弱判断,酸性越强,则元素的非金属性越强。
提示 不一定,如HClO为弱酸,H2SO4为强酸,但非金属性:Cl>S。比较元素的非金属性强弱,应比较元素对应的最高价含氧酸的酸性强弱,酸性越强,则非金属性越强。
【思考】 元素的非金属性越强,其含氧酸的酸性越强吗?为什么?
3.其他判断方法
(1)根据置换反应,金属性较强的金属单质可以置换金属性较弱的金属单质;非金属性较强的非金属单质可以置换非金属性较弱的非金属单质。
(2)根据离子的氧化性或还原性强弱,金属单质的还原性越强,则简单阳离子的氧化性越弱;非金属单质的氧化性越强,对应简单阴离子的还原性越弱。
1
2
3
4
5
1.下列关于元素金属性、非金属性的说法不正确的是
A.将碳酸钠加入稀硫酸中,能产生CO2气体,说明S的非金属性强于C
B.H2SO4的酸性强于HClO,则非金属性:S>Cl
C.Si与H2化合所需温度远高于S和H2化合的温度,说明S的非金属性强于Si
D.HBr的热稳定性强于HI,则元素Br的非金属性比元素I强
√
跟踪训练
1
2
3
4
5
跟踪训练
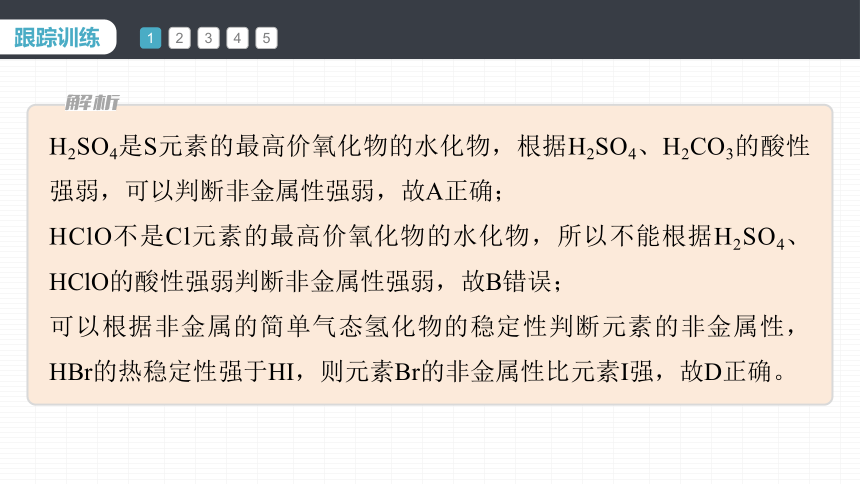
H2SO4是S元素的最高价氧化物的水化物,根据H2SO4、H2CO3的酸性强弱,可以判断非金属性强弱,故A正确;
HClO不是Cl元素的最高价氧化物的水化物,所以不能根据H2SO4、HClO的酸性强弱判断非金属性强弱,故B错误;
可以根据非金属的简单气态氢化物的稳定性判断元素的非金属性,HBr的热稳定性强于HI,则元素Br的非金属性比元素I强,故D正确。
1
3
4
5
2.下列说法错误的是
A.根据钠和镁分别与冷水反应的剧烈程度,可判断钠和镁的金属性强弱
B.根据铁与硫酸铜溶液反应有红色固体析出,可判断铁和铜的金属性强弱
C.根据Br2和I2分别与氢气反应的条件或生成的简单气态氢化物的热稳定性,
可判断溴和碘的非金属性强弱
D.根据向碳酸钠溶液中通入氯化氢有气泡产生,可判断碳和氯的非金属性
强弱
√
2
跟踪训练
1
3
4
5
2
跟踪训练
根据金属与水或酸反应放出氢气的难易程度、金属间的置换反应等,可判断元素金属性的强弱,则根据钠和镁分别与冷水反应的剧烈程度,可判断钠和镁的金属性强弱,故A正确;
铁与硫酸铜溶液反应有红色固体析出,可知铁的还原性比铜强,金属性越强,其还原性越强,则可判断铁和铜的金属性强弱,故B正确;
非金属单质与氢气化合的难易程度或非金属元素简单气态氢化物的稳定性可用于比较非金属性强弱,则根据Br2和I2分别与氢气反应的条件或生成的简单气态氢化物的热稳定性,可判断溴和碘的非金属性强弱,故C正确;
1
3
4
5
2
跟踪训练
向碳酸钠溶液中通入氯化氢产生气泡,只能证明氯化氢的酸性比碳酸强,但氯化氢不是氯的最高价氧化物对应的水化物,则不能判断碳和氯的非金属性强弱,故D错误。
3.下列事实不能说明元素的金属性或非金属性相对强弱的是
1
3
4
5
2
跟踪训练
选项 事实 推论
A 等物质的量的镁和铝分别和盐酸反应,铝放出的氢气多 金属性:Al>Mg
B NaOH的碱性强于Mg(OH)2 金属性:Na>Mg
C F2与H2在冷暗处就可以爆炸,Br2和H2则需要高温才能反应 非金属性:F>Br
D 稳定性:HBr>H2S 非金属性:Br>S
√
1
3
4
5
2
跟踪训练
可以根据非金属单质和H2化合的难易程度判断非金属性强弱,F2与H2在冷暗处就可以爆炸,Br2和H2则需要高温才能反应,说明F2更容易和H2化合,则F元素的非金属性更强,故C正确;
非金属性越强,说明生成的气态氢化物越稳定,稳定性:HBr>H2S,则非金属性:Br>S,故D正确。
4.下列叙述能说明氯元素非金属性比硫元素强的是
①HCl的溶解度比H2S大 ②HCl的酸性比H2S强 ③HCl的稳定性比H2S强 ④还原性:Cl-A.③④⑤⑦⑧ B.③⑥⑦⑧
C.③④⑥⑦⑧ D.①②③④⑤⑥⑦⑧
1
3
4
5
√
2
跟踪训练
1
3
4
5
2
跟踪训练
溶解度为物理性质,①不能说明;
比较酸性必须采用最高价含氧酸,②不能说明;
氢化物的稳定性可以说明氯元素的非金属性大于硫,③可以说明;
离子的还原性可以说明,④可以说明;
不是最高价含氧酸,⑤不能说明;
氯气的氧化性大于硫,⑥可以说明;
氯气与硫化氢生成硫单质,氧化剂的氧化性大于氧化产物的氧化性,⑦可以说明;
周期表中Cl处于S同周期的右侧,⑧可以说明;故选C。
1
3
4
5
5.(2022·北京汇文中学高一期末)为探究Na、Mg、Al的金属性强弱,某课外小组同学进行了如下实验:
2
跟踪训练
实验 1.将一小块金属钠放入滴有酚酞溶液的冷水中
2.将一小段用砂纸打磨后的镁带放入试管中,加入少量水,加热至水沸腾,冷却后,向试管中滴加酚酞溶液
3.将一小段镁带投入稀盐酸中
4.将一小片铝投入稀盐酸中
1
3
4
5
他们记录的实验现象有:
2
跟踪训练
实验现象 a.剧烈反应,迅速生成大量的气体
b.浮在水面上,熔成小球,不断游动,小球渐小,最终消失,溶液变红
c.反应不剧烈,产生无色气体
d.有气体产生,溶液变成红色
1
3
4
5
请帮助该小组同学补充下列实验报告中的内容:
(1)实验1对应的实验现象为_____(填a、b、c、d中一种,下同);实验3对应的实验现象为_____。
2
跟踪训练
b
a
实验 1.将一小块金属钠放入滴有酚酞溶液的冷水中
2.将一小段用砂纸打磨后的镁带放入试管中,加入少量水,加热至水沸腾,冷却后,向试管中滴加酚酞溶液
3.将一小段镁带投入稀盐酸中
4.将一小片铝投入稀盐酸中
金属与水、酸反应越剧烈,说明金属越活泼,结合实验和实验现象可知,实验1对应的现象为b,实验2对应的现象为d,实验3对应的现象是a,实验4对应的实验现象是c,根据实验现象可知金属性:Na>Mg>Al。
实验1:将一小块金属放入滴有酚酞溶液的冷水中,由于钠很活泼,钠与水剧烈反应生成氢氧化钠和氢气,溶液呈碱性,使酚酞溶液变红,钠的密度比水小,且熔点低,则其实验现象为浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色,故选b;
1
3
4
5
2
跟踪训练
实验3:将一小段镁带投入稀盐酸中,镁与盐酸剧烈反应,迅速生成大量的气体,故选a。
1
3
4
5
2
跟踪训练
1
3
4
5
(2)钠与水反应的离子方程式:________________________________。
2
跟踪训练
2Na+2H2O===2Na++2OH-+H2↑
钠与水反应生成氢氧化钠和氢气,反应的离子方程式为2Na+2H2O
===2Na++2OH-+H2↑。
1
3
4
5
(3)实验结论是____________________。
2
跟踪训练
金属性:Na>Mg>Al
Na与冷水剧烈反应,Mg与沸水反应,而Al与盐酸反应不如Mg与盐酸反应剧烈,从而可知金属性:Na>Mg>Al。
1
3
4
5
(4)用原子结构理论对上述实验结论进行解释:同周期元素从左至右,原子的电子层数相同,核电荷数逐渐增多,__________________________
___________________________。
2
跟踪训练
同周期元素从左至右,原子的电子层数相同,核电荷数逐渐增多,原子半径逐渐减小,原子核对核外电子的吸引作用逐渐增强,失电子能力逐渐减弱,金属性逐渐减弱。
原子半径逐渐减小,失电子能
力逐渐减弱,金属性逐渐减弱
本课结束
第四章 第一节
微专题4 元素金属性、非金属性
强弱的比较
1.金属性强弱的判断方法
金属性是指金属元素原子在化学反应中失电子的能力,通常用如下两种方法判断其强弱:
(1)根据金属单质与水或非氧化性酸反应置换出氢气的难易程度判断,置换出氢气越容易,则元素的金属性越强。
(2)根据金属元素最高价氧化物对应的水化物的碱性强弱判断,碱性越强,则元素的金属性越强。
2.非金属性强弱的判断方法
非金属性是指非金属元素原子得电子的能力,通常用如下两种方法判断:
(1)根据非金属单质与H2化合的难易程度、生成气态氢化物的稳定性判断,越易化合,生成的气态氢化物越稳定,则元素的非金属性越强。
(2)根据非金属元素最高价氧化物对应的水化物的酸性强弱判断,酸性越强,则元素的非金属性越强。
提示 不一定,如HClO为弱酸,H2SO4为强酸,但非金属性:Cl>S。比较元素的非金属性强弱,应比较元素对应的最高价含氧酸的酸性强弱,酸性越强,则非金属性越强。
【思考】 元素的非金属性越强,其含氧酸的酸性越强吗?为什么?
3.其他判断方法
(1)根据置换反应,金属性较强的金属单质可以置换金属性较弱的金属单质;非金属性较强的非金属单质可以置换非金属性较弱的非金属单质。
(2)根据离子的氧化性或还原性强弱,金属单质的还原性越强,则简单阳离子的氧化性越弱;非金属单质的氧化性越强,对应简单阴离子的还原性越弱。
1
2
3
4
5
1.下列关于元素金属性、非金属性的说法不正确的是
A.将碳酸钠加入稀硫酸中,能产生CO2气体,说明S的非金属性强于C
B.H2SO4的酸性强于HClO,则非金属性:S>Cl
C.Si与H2化合所需温度远高于S和H2化合的温度,说明S的非金属性强于Si
D.HBr的热稳定性强于HI,则元素Br的非金属性比元素I强
√
跟踪训练
1
2
3
4
5
跟踪训练
H2SO4是S元素的最高价氧化物的水化物,根据H2SO4、H2CO3的酸性强弱,可以判断非金属性强弱,故A正确;
HClO不是Cl元素的最高价氧化物的水化物,所以不能根据H2SO4、HClO的酸性强弱判断非金属性强弱,故B错误;
可以根据非金属的简单气态氢化物的稳定性判断元素的非金属性,HBr的热稳定性强于HI,则元素Br的非金属性比元素I强,故D正确。
1
3
4
5
2.下列说法错误的是
A.根据钠和镁分别与冷水反应的剧烈程度,可判断钠和镁的金属性强弱
B.根据铁与硫酸铜溶液反应有红色固体析出,可判断铁和铜的金属性强弱
C.根据Br2和I2分别与氢气反应的条件或生成的简单气态氢化物的热稳定性,
可判断溴和碘的非金属性强弱
D.根据向碳酸钠溶液中通入氯化氢有气泡产生,可判断碳和氯的非金属性
强弱
√
2
跟踪训练
1
3
4
5
2
跟踪训练
根据金属与水或酸反应放出氢气的难易程度、金属间的置换反应等,可判断元素金属性的强弱,则根据钠和镁分别与冷水反应的剧烈程度,可判断钠和镁的金属性强弱,故A正确;
铁与硫酸铜溶液反应有红色固体析出,可知铁的还原性比铜强,金属性越强,其还原性越强,则可判断铁和铜的金属性强弱,故B正确;
非金属单质与氢气化合的难易程度或非金属元素简单气态氢化物的稳定性可用于比较非金属性强弱,则根据Br2和I2分别与氢气反应的条件或生成的简单气态氢化物的热稳定性,可判断溴和碘的非金属性强弱,故C正确;
1
3
4
5
2
跟踪训练
向碳酸钠溶液中通入氯化氢产生气泡,只能证明氯化氢的酸性比碳酸强,但氯化氢不是氯的最高价氧化物对应的水化物,则不能判断碳和氯的非金属性强弱,故D错误。
3.下列事实不能说明元素的金属性或非金属性相对强弱的是
1
3
4
5
2
跟踪训练
选项 事实 推论
A 等物质的量的镁和铝分别和盐酸反应,铝放出的氢气多 金属性:Al>Mg
B NaOH的碱性强于Mg(OH)2 金属性:Na>Mg
C F2与H2在冷暗处就可以爆炸,Br2和H2则需要高温才能反应 非金属性:F>Br
D 稳定性:HBr>H2S 非金属性:Br>S
√
1
3
4
5
2
跟踪训练
可以根据非金属单质和H2化合的难易程度判断非金属性强弱,F2与H2在冷暗处就可以爆炸,Br2和H2则需要高温才能反应,说明F2更容易和H2化合,则F元素的非金属性更强,故C正确;
非金属性越强,说明生成的气态氢化物越稳定,稳定性:HBr>H2S,则非金属性:Br>S,故D正确。
4.下列叙述能说明氯元素非金属性比硫元素强的是
①HCl的溶解度比H2S大 ②HCl的酸性比H2S强 ③HCl的稳定性比H2S强 ④还原性:Cl-
C.③④⑥⑦⑧ D.①②③④⑤⑥⑦⑧
1
3
4
5
√
2
跟踪训练
1
3
4
5
2
跟踪训练
溶解度为物理性质,①不能说明;
比较酸性必须采用最高价含氧酸,②不能说明;
氢化物的稳定性可以说明氯元素的非金属性大于硫,③可以说明;
离子的还原性可以说明,④可以说明;
不是最高价含氧酸,⑤不能说明;
氯气的氧化性大于硫,⑥可以说明;
氯气与硫化氢生成硫单质,氧化剂的氧化性大于氧化产物的氧化性,⑦可以说明;
周期表中Cl处于S同周期的右侧,⑧可以说明;故选C。
1
3
4
5
5.(2022·北京汇文中学高一期末)为探究Na、Mg、Al的金属性强弱,某课外小组同学进行了如下实验:
2
跟踪训练
实验 1.将一小块金属钠放入滴有酚酞溶液的冷水中
2.将一小段用砂纸打磨后的镁带放入试管中,加入少量水,加热至水沸腾,冷却后,向试管中滴加酚酞溶液
3.将一小段镁带投入稀盐酸中
4.将一小片铝投入稀盐酸中
1
3
4
5
他们记录的实验现象有:
2
跟踪训练
实验现象 a.剧烈反应,迅速生成大量的气体
b.浮在水面上,熔成小球,不断游动,小球渐小,最终消失,溶液变红
c.反应不剧烈,产生无色气体
d.有气体产生,溶液变成红色
1
3
4
5
请帮助该小组同学补充下列实验报告中的内容:
(1)实验1对应的实验现象为_____(填a、b、c、d中一种,下同);实验3对应的实验现象为_____。
2
跟踪训练
b
a
实验 1.将一小块金属钠放入滴有酚酞溶液的冷水中
2.将一小段用砂纸打磨后的镁带放入试管中,加入少量水,加热至水沸腾,冷却后,向试管中滴加酚酞溶液
3.将一小段镁带投入稀盐酸中
4.将一小片铝投入稀盐酸中
金属与水、酸反应越剧烈,说明金属越活泼,结合实验和实验现象可知,实验1对应的现象为b,实验2对应的现象为d,实验3对应的现象是a,实验4对应的实验现象是c,根据实验现象可知金属性:Na>Mg>Al。
实验1:将一小块金属放入滴有酚酞溶液的冷水中,由于钠很活泼,钠与水剧烈反应生成氢氧化钠和氢气,溶液呈碱性,使酚酞溶液变红,钠的密度比水小,且熔点低,则其实验现象为浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色,故选b;
1
3
4
5
2
跟踪训练
实验3:将一小段镁带投入稀盐酸中,镁与盐酸剧烈反应,迅速生成大量的气体,故选a。
1
3
4
5
2
跟踪训练
1
3
4
5
(2)钠与水反应的离子方程式:________________________________。
2
跟踪训练
2Na+2H2O===2Na++2OH-+H2↑
钠与水反应生成氢氧化钠和氢气,反应的离子方程式为2Na+2H2O
===2Na++2OH-+H2↑。
1
3
4
5
(3)实验结论是____________________。
2
跟踪训练
金属性:Na>Mg>Al
Na与冷水剧烈反应,Mg与沸水反应,而Al与盐酸反应不如Mg与盐酸反应剧烈,从而可知金属性:Na>Mg>Al。
1
3
4
5
(4)用原子结构理论对上述实验结论进行解释:同周期元素从左至右,原子的电子层数相同,核电荷数逐渐增多,__________________________
___________________________。
2
跟踪训练
同周期元素从左至右,原子的电子层数相同,核电荷数逐渐增多,原子半径逐渐减小,原子核对核外电子的吸引作用逐渐增强,失电子能力逐渐减弱,金属性逐渐减弱。
原子半径逐渐减小,失电子能
力逐渐减弱,金属性逐渐减弱
本课结束
