第四章 第一节 第2课时 元素周期表 核素 (79张PPT)
文档属性
| 名称 | 第四章 第一节 第2课时 元素周期表 核素 (79张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-17 21:15:38 | ||
图片预览









文档简介
(共79张PPT)
第四章 第一节
第2课时 元素周期表 核素
1.通过了解元素周期表的结构(周期、族),认识原子结构与元素周期表中位置间
的关系,培养“宏观辨识与证据推理”的核心素养。
2.通过了解核素的含义及符号和元素、核素、同位素的内含与外延,培养“宏
观辨识与微观探析”的核心素养。
核心素养
发展目标
一、元素周期表的编排原则与结构
二、核素、同位素
课时对点练
内容索引
随堂演练 知识落实
元素周期表的编排原则与结构
一
1.原子序数
(1)含义:按照元素在 给元素编号。
(2)原子序数与元素的原子结构之间存在的关系:原子序数=核电荷数= = 。
周期表中的顺序
质子数
核外电子数
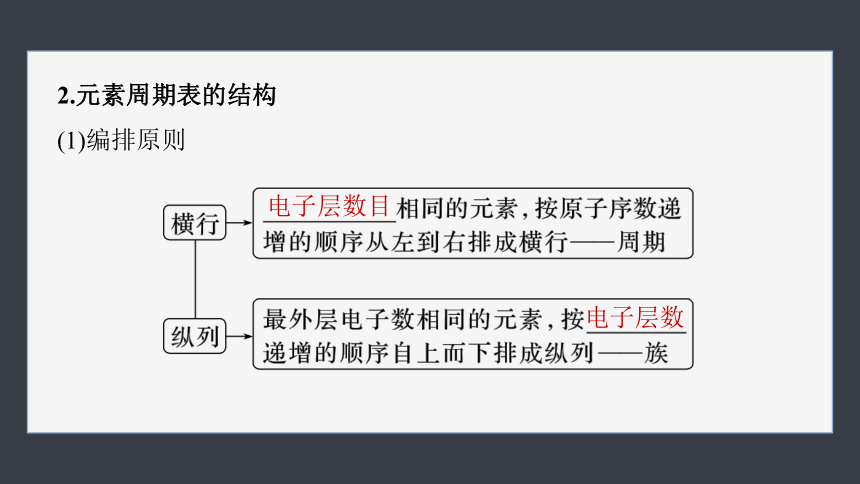
2.元素周期表的结构
(1)编排原则
电子层数目
电子层数
(2)元素周期表的结构
①周期的划分
一、二、三
2、8、8
四、五、六、七
18、18、32、32
【思考1】 在现行周期表中第四、五、六、七周期均有18列,为什么第四、五周期各有18种元素,而第六、七周期各有32种元素?
提示 第六周期中有镧系,共15种元素;第七周期第ⅢB族为锕系,共15种元素,比第四、五周期多出14种元素。
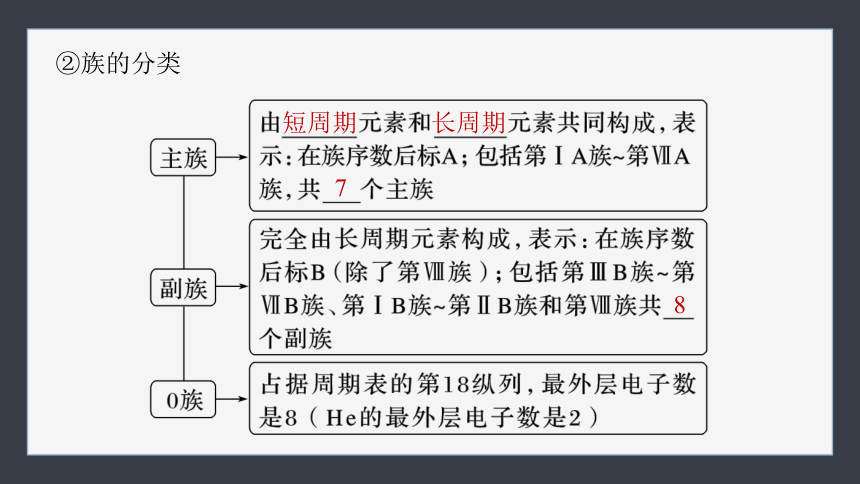
②族的分类
短周期
长周期
7
8
【思考2】 在周期表中第Ⅷ族元素包含8、9、10三个纵列,而其他族只有一个纵列,故第Ⅷ族元素种类最多,这种判断对吗?
提示 这种判断是错误的,元素种类最多的族为第ⅢB族,共32种元素(包括镧系元素和锕系元素)。
③常见族的别称
族 别称
第ⅠA族(除 外) 元素
第ⅦA族 元素
0族 稀有气体元素
氢
碱金属
卤族
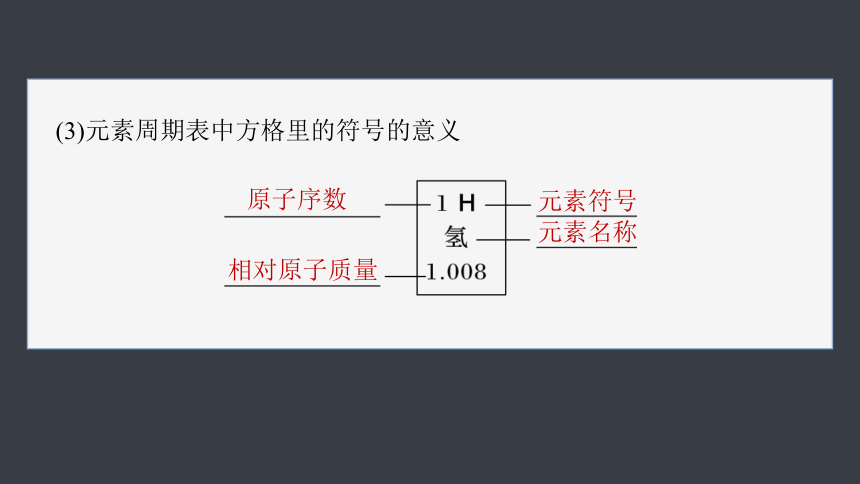
(3)元素周期表中方格里的符号的意义
原子序数
元素符号
相对原子质量
元素名称
【思考3】 同周期的第ⅡA、ⅢA族元素的原子序数差一定为“1”吗?
提示 不一定。第二、三周期差1,第四、五周期差11,原因是中间隔10格副族元素,第六、七周期差25,原因是中间隔10格副族元素,且第ⅢB族一格为15种元素。
应用体验
1.判断正误
(1)元素周期表中每一横行称为一周期,每一纵列称为一个族
(2)氧元素位于第二周期第Ⅵ族
(3)元素周期表中8、9、10纵列称为第ⅧB族
(4)第ⅠA族完全为金属元素
(5)最外层电子数是2的元素一定为第ⅡA族的元素
(6)同族元素的最外层电子数一定等于族序数
×
×
×
×
×
×
应用体验
2.1869年,俄国化学家制出了第一张元素周期表,随着科学的发展,元素周期表的形式变得更加完美,关于现代元素周期表的说法正确的是
A.第ⅠA、ⅡA族的元素全部是金属元素,均能与酸发生反应生成氢气
B.元素周期表中非金属元素都不位于副族
C.现代元素周期表是按照相对原子质量的大小顺序对元素进行排列的
D.0族元素中所有元素原子的最外层电子数都是8,化学性质稳定
√
第一周期第ⅠA族元素是H元素,不是金属元素,故A错误;
副族元素都是金属元素,故B正确;
现代元素周期表是按照原子的核电荷数的大小顺序对元素进行排列的,故C错误;
0族元素中He元素原子的最外层电子数是2,故D错误。
应用体验
3.我国一直致力研究开发自己的芯片,制造芯片需要单晶硅,其中硅元素在元素周期表中的位置是
A.第二周期第ⅤA族 B.第三周期第ⅥA族
C.第三周期第ⅣA族 D.第二周期第ⅣA族
√
硅是14号元素,Si原子核外有三个电子层,最外层电子数为4,根据周期序数等于电子层数,主族序数等于最外层电子数可知,硅在元素周期表中的位置为第三周期第ⅣA族,C正确。
归纳总结
元素周期表的结构
归纳总结
原子序数的定量关系
①同周期,第ⅡA族元素与第ⅢA族元素原子序数差可能为1、11、25。
②同族,相邻周期元素原子序数差:第ⅠA族~第ⅡA族:上一周期元素种类数;第ⅢA族~0族:下一周期元素种类数。如Na与K原子序数相差8,Cl与Br原子序数相差18。
③利用稀有气体元素的原子序数推断元素在周期表中的位置。
返回
核素、同位素
二
请在表格中填写三种氢原子的原子符号:
氢元素的原子核 原子名称 原子符号( )
质子数(Z) 中子数(N) 1 0 氕
1 1 氘
1 2 氚
【思考1】 氕、氘、氚的原子结构有何异同?它们是同一种元素吗?
提示 质子数相同而中子数不同,是同一种元素。
1.概念辨析
(1)元素:具有相同 的一类 的总称。
(2)核素:具有一定数目 和一定数目 的一种原子。
(3)同位素: 相同而 不同的同一 的不同原子互称为同位素(即同一 的不同 )。
质子数(核电荷数)
原子
质子
中子
质子数
中子数
元素
元素
核素
【思考2】 (1)O2和O3互为同位素吗?H2O和D2O互为同位素吗?
提示 不互为,因为O2和O3互为同素异形体,不是原子;
不互为,因为H2O和D2O是同种物质。
(2)填写下列空白:
同位素 同素异形体
本质
范畴
特性
质子数相同、中子数不同的核素
同种元素组成的不同单质
原子
单质
化学性质几乎相同,物理性质不同
组成元素相同,性质不同
2.同位素的应用
考古中推断文物的年代
制造氢弹的原料
核反应堆的原料
相对原子质量的标准原子
应用体验
1.判断正误
(1)任何原子都由质子、中子、电子构成
(2)23Na和23Mg互为同位素
(3)同位素原子的化学性质几乎相同,物理性质略有差异
(4)原子的种类大于元素的种类
(5) 为同一元素的不同微粒
×
×
√
√
√
应用体验
√
应用体验
√
返回
随堂演练 知识落实
1
2
3
4
1.下列关于元素周期表的说法正确的是
A.元素周期表有18个纵列,即18个族
B.短周期是指1到20号元素
C.元素周期表是按元素的原子序数由小到大的顺序排列的
D.某种元素的相对原子质量取整数值,就是其原子序数
√
随堂演练
5
1
2
3
4
随堂演练
周期表共有18个纵列,16个族,其中第Ⅷ族包括第 8、9、10 三个纵列,故A错误;
短周期是指第一、二、三周期,而19号、20号元素处于第四周期,故B错误;
现在的元素周期表是按照原子序数由小到大的顺序排列的,故C正确;
元素的原子序数等于元素的核电荷数或对应原子的质子数,故D错误。
5
2.(2023·长沙高一检测)下列说法正确的是
A.某短周期元素最外层有2个电子,则其一定是金属元素
B.主族元素的单原子阳离子一定具有稀有气体的电子层结构(H+除外)
C.元素周期表有7个主族、8个副族,副族均由长周期元素组成
D.主族元素在周期表中的位置只取决于该元素的电子层数
√
随堂演练
1
2
3
4
5
随堂演练
1
2
3
4
主族元素的单原子失去最外层电子转化为阳离子,则短周期主族元素的单原子阳离子一定具有稀有气体的电子层结构(H+除外),长周期主族元素不符合,如Ga失去3个电子后最外层电子数为18,故B错误;
元素周期表有18个纵列,分为7个主族,8个副族,1个0族,总共16个族,副族由长周期元素组成,故C正确;
主族元素的最外层电子数等于族序数,电子层数等于周期数,则主族元素在周期表中的位置取决于该元素的电子层数、最外层电子数,故D错误。
5
3.第116号元素的元素符号为Lv,其中文名为“ ”,下列说法不正确的是
A.Lv原子的最外层电子数是6
B.Lv是一种非金属元素
C.其中一种核素 的中子数为177
D.Lv在周期表的第七周期第ⅥA族
√
随堂演练
1
2
3
4
5
随堂演练
1
2
3
4
根据元素周期表及原子核外电子排布规律可知,116号元素Lv位于第七周期第ⅥA族,最外层电子数是6,A、D正确;
Lv是一种金属元素,B错误;
核素 的中子数为293-116=177,C正确。
5
4.2021年2月22日,嫦娥五号带回的月壤在人民大会堂首次公开亮相。据科学家预测,月球的土壤中吸附着数百万吨的3He,而在地球上He元素则主要以4He的形式存在。下列说法正确的是
A.4He原子核内含有4个质子
B.3He与4He互为同位素
C.3He与4He的电子数不同
D.4He的最外层电子数为2,故4He易失去最外层电子
随堂演练
1
2
3
4
√
5
随堂演练
1
2
3
4
He元素为2号元素,4He原子核内含有2个质子,2个中子,质量数为4,A错误;
3He含有2个质子、1个中子,3He与4He的质子数相同,中子数不同,是同一元素的不同核素,互为同位素,B正确;
核外电子数等于核内质子数,3He与4He的电子数均为2,则3He与4He的电子数相同,C错误;
4He的最外层为K层,K层电子数为2时,为稳定结构,故4He不易失去最外层电子,也不易得到电子,D错误。
5
5.(2022·重庆高一检测)A、B、C、D为短周期元素,在元素周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B元素原子的质子数。
(1)写出A元素的名称:_____。
(2)B位于周期表中第_____周期第_____族。
(3)C的原子结构示意图为_______。
(4)D的单质与水反应的化学方程式为________________________。
随堂演练
1
2
3
4
氮
三
ⅥA
Cl2+H2O===HCl+HClO
5
随堂演练
1
2
3
4
返回
令B的原子序数为x+8,则A的原子序数为x-1,C的原子序数为x+1,则x-1+x+1=x+8,x=8,故A为N,B为S,C为F,D为Cl。
5
课时对点练
1
2
3
4
5
6
7
8
9
题组一 元素周期表的结构
1.(2023·广东佛山高一检测)下列关于元素周期表的说法不正确的是
A.副族元素全部是金属元素
B.X2+的核外电子数为18,则X在第四周期第ⅡA族
C.同周期第ⅡA族与第ⅢA族元素的原子序数差值一定是1
D.元素周期表一共有18个纵列,但只有16个族
√
10
11
12
13
14
15
对点训练
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
元素周期表中,副族元素均为金属元素,故A正确;
X2+的核外电子数目为18,质子数为18+2=20,则X为Ca元素,在周期表中位于第四周期第ⅡA族,故B正确;
同周期第ⅡA族与第ⅢA族元素的原子序数差可能为1、11、25,故C错误。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2.(2022·丽江古城区校级期末)下列元素不属于短周期元素的是
A.铝 B.氯 C.铁 D.硫
√
2
Al位于第三周期第ⅢA族,为短周期元素,故A错误;
Cl位于第三周期第ⅦA族,属于短周期元素,故B错误;
Fe位于第四周期第Ⅷ族,属于长周期元素,故C正确;
S位于第三周期第ⅥA族,属于短周期元素,故D错误。
3.下列关于元素周期表的说法正确的是
A.地壳中含量最多的金属元素位于第四周期
B.主族元素都是短周期元素
C.最外层电子数相同的元素一定在同一族
D.元素周期表有7个周期
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
地壳中含量最多的金属元素是铝,位于第三周期,故A错误;
主族元素由短周期元素和长周期元素组成,故B错误;
氦和镁最外层电子数都是2,但不在同一族,故C错误;
元素周期表有7个横行,即有7个周期,故D正确。
题组二 同周期、同主族元素的序差规律
4.已知A为第ⅡA族元素,B为第ⅢA族元素,它们的原子序数分别为m和n,且A、B为同一周期的元素,下列关系式错误的是
A.n=m+1 B.n=m+11
C.n=m+25 D.n=m+10
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
若A、B为第二、三周期元素,n=m+1;若A、B为第四、五周期元素,n=m+11;若A、B为第六、七周期元素,n=m+25,综上分析,答案为D。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
5.原子序数为x的E元素在周期表中位于A、B、C、D四种元素中间(如图所示),则A、B、C、D四种元素(镧系、锕系、0族元素除外)的原子序数之和不可能是
A.4x B.4x+14
C.4x+10 D.4x+6
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
E元素位于图中A、B、C、D四种元素的中间,其原子
序数为x,因E元素的上方和左侧均有元素,则E不可能
属于第一、二周期。
当E元素位于第三周期时,E元素只能位于副族元素的右侧,或当E元素位于第四周期且在副族元素左侧时,A、B、C、D四种元素的原子序数分别为x-1、x-8、x+1、x+18,此时A、B、C、D四种元素的原子序数之和为4x+10;
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
当E元素位于第四周期且在副族元素右侧或第五周期
且在副族元素左侧时,A、B、C、D四种元素的原子
序数分别为x-1、x-18、x+1、x+18,此时A、B、
C、D四种元素的原子序数之和为4x;
当E元素位于第五周期且在副族元素右侧时,A、B、C、D四种元素的原子序数分别为x-1、x-18、x+1、x+32,此时A、B、C、D四种元素的原子序数之和为4x+14;
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
当E元素位于第六周期时,只能在副族元素右侧,A、B、C、D四种元素的原子序数分别为x-1、x-32、x+1、x+32,此时A、B、C、D四种元素的原子序数之和为4x;
综上所述,A、B、C、D四种元素的原子序数之和可能为4x、4x+10、4x+14,不可能是4x+6,D项符合题意。
2
题组三 核素 同位素
6.下列属于同位素的是
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
金刚石和石墨是同种元素形成的不同单质,互为同素异形体,故A错误;
O2和O3是同种元素形成的不同单质,互为同素异形体,故D错误。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
9.(2023·临沂第四中学高一期末)下列说法正确的是
A.家庭使用的玻璃体温计中的汞为主族元素
B.止咳祛痰药盐酸氨溴索中含有两种卤族元素
C.连花清瘟胶囊成分中的石膏CaSO4·2H2O 属于混合物
D.酒精能够有效杀灭病毒,浓度越高,消毒效果越好
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
√
家庭使用的玻璃体温计中的汞为副族元素,A错误;
止咳祛痰药盐酸氨溴索中含有氯、溴两种卤族元素,B正确;
连花清瘟胶囊成分中的石膏CaSO4·2H2O 属于化合物,C错误。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
11.短周期元素S、R、T、Q、W在元素周期表中的相对位置如图所示,其中Q为硅元素。则W元素的原子结构示意图为
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
√
已知Q为Si元素,根据元素在周期表中的相对
位置关系可知W为S元素,S的原子序数为16,
最外层电子数为6,所以S元素的原子结构示
意图为 ,D正确。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
12.《格物探源》中提到:“天地万物皆以六十四种元质配合而成,如金银铜铁养轻淡炭等皆是元质,皆由微渺面造”,“微渺”即现代之“原子”。下列说法错误的是
A.“元质”即现代之“元素”,现在人类发现的化学元素已超过六十四种
B.“养轻淡”即氧、氢、氮三种元素,均为短周期主族元素
C.上文中提到的八种“元质”中,有四种金属“元质”
D.“微渺”是组成物质的基本微粒,不可再分
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
由信息可知,“金银铜铁养轻淡炭等皆是元质”,“元质”即为元素,目前周期表中有100多种元素,人类发现的化学元素多于64种,A正确;
“养轻淡”即氧、氢、氮,均为短周期主族元素,B正确;
金、银、铜、铁为金属元素,“养轻淡炭”为非金属元素,8种“元质”包括4种金属元素、4种非金属元素,C正确;
原子由质子、中子、核外电子构成,“微渺”是组成物质的基本微粒,可再分,D错误。
13.(2022·西安高一检测)如图为元素周期表的一部分。
(1)Cl在元素周期表中位于________________,
其原子结构示意图为_________。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
第三周期第ⅦA族
由图可知Cl处于第三周期第ⅦA族,其原子结构示意图为 。
(2)14C在考古中常用于测定生物的死亡年
代,它与12C、13C互称为________。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
同位素
14C、12C、13C的质子数相同、中子数不同,三者互称为同位素。
(3)将N和Mg两种元素的简单离子组成的化合物X投入水中,反应生成白色沉淀,并释放出NH3。
①写出化合物X与水发生反应的化学方程式:
____________________________________。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
Mg3N2+6H2O===3Mg(OH)2↓+2NH3↑
Mg3N2与水反应生成Mg(OH)2和NH3,反应的化学方程式为Mg3N2+6H2O===3Mg(OH)2↓+2NH3↑。
②写出白色沉淀溶于盐酸的反应的离子方程
式:______________________________。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
Mg(OH)2+2H+===Mg2++2H2O
氢氧化镁和盐酸反应生成氯化镁和水,反应的离子方程式为Mg(OH)2+2H+===Mg2++2H2O。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
14.(1)原子序数大于4的主族元素A和B的离子Am+和Bn-,它们的核外电子排布相同,则:
①A和B的质子数之差为_______(用m、n表示)。
2
因Am+和Bn-核外电子排布相同,则电子数相同,即ZA-m=ZB+n,则A和B的质子数之差为ZA-ZB=m+n。
m+n
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
②B和A的族序数之差为___________(用含m、n的代数式表示)。
2
B的负价为-n,则B的族序数为8-n,而A的族序数为m,B和A的族序数之差为8-n-m。
8-n-m
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(2)A、B两元素,A的原子序数为x,A和B所在周期包含元素种类数目分别为m和n。
①如果A和B同在第ⅠA族,当B在A的上一周期时,B的原子序数为______;
2
如果A、B同在第ⅠA族,当B在A的上一周期时,B和A的原子序数之差恰好为B所在周期的元素种类数,则B的原子序数为x-n。
x-n
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
②如果A和B同在第ⅦA族,当B在A的上一周期时,B的原子序数为_______。
2
如果A、B同在第ⅦA族时,当B在A的上一周期时,A、B的原子序数之差恰好为相邻两周期下一周期的元素种类数,B的原子序数为x-m。
x-m
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
15.如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题。
(1)①②③④分别是
_______、_______、
_______、_______
(用元素符号表示)。
2
由元素在周期表中的位置可知,①为H元素、②为C元素、③为N元素、④为O元素。
H
C
N
O
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(2)①③④元素中的两种元素可
形成含10个电子的分子,它们
是________、________。
2
H元素与N、O元素形成的含10个电子的分子为NH3、H2O。
NH3
H2O
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(3)画出⑤的原子结构示意
图:__________。
2
⑤为Na元素,其原子结构示意图为 。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(4)⑧的单质与氢氧化钠溶液反
应的离子方程式为__________
____________________。
2
⑧为Cl元素,氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式为Cl2+2OH-===Cl-+ClO-+H2O。
Cl2+2OH-
===Cl-+ClO-+H2O
返回
本课结束
第四章 第一节
第2课时 元素周期表 核素
1.通过了解元素周期表的结构(周期、族),认识原子结构与元素周期表中位置间
的关系,培养“宏观辨识与证据推理”的核心素养。
2.通过了解核素的含义及符号和元素、核素、同位素的内含与外延,培养“宏
观辨识与微观探析”的核心素养。
核心素养
发展目标
一、元素周期表的编排原则与结构
二、核素、同位素
课时对点练
内容索引
随堂演练 知识落实
元素周期表的编排原则与结构
一
1.原子序数
(1)含义:按照元素在 给元素编号。
(2)原子序数与元素的原子结构之间存在的关系:原子序数=核电荷数= = 。
周期表中的顺序
质子数
核外电子数
2.元素周期表的结构
(1)编排原则
电子层数目
电子层数
(2)元素周期表的结构
①周期的划分
一、二、三
2、8、8
四、五、六、七
18、18、32、32
【思考1】 在现行周期表中第四、五、六、七周期均有18列,为什么第四、五周期各有18种元素,而第六、七周期各有32种元素?
提示 第六周期中有镧系,共15种元素;第七周期第ⅢB族为锕系,共15种元素,比第四、五周期多出14种元素。
②族的分类
短周期
长周期
7
8
【思考2】 在周期表中第Ⅷ族元素包含8、9、10三个纵列,而其他族只有一个纵列,故第Ⅷ族元素种类最多,这种判断对吗?
提示 这种判断是错误的,元素种类最多的族为第ⅢB族,共32种元素(包括镧系元素和锕系元素)。
③常见族的别称
族 别称
第ⅠA族(除 外) 元素
第ⅦA族 元素
0族 稀有气体元素
氢
碱金属
卤族
(3)元素周期表中方格里的符号的意义
原子序数
元素符号
相对原子质量
元素名称
【思考3】 同周期的第ⅡA、ⅢA族元素的原子序数差一定为“1”吗?
提示 不一定。第二、三周期差1,第四、五周期差11,原因是中间隔10格副族元素,第六、七周期差25,原因是中间隔10格副族元素,且第ⅢB族一格为15种元素。
应用体验
1.判断正误
(1)元素周期表中每一横行称为一周期,每一纵列称为一个族
(2)氧元素位于第二周期第Ⅵ族
(3)元素周期表中8、9、10纵列称为第ⅧB族
(4)第ⅠA族完全为金属元素
(5)最外层电子数是2的元素一定为第ⅡA族的元素
(6)同族元素的最外层电子数一定等于族序数
×
×
×
×
×
×
应用体验
2.1869年,俄国化学家制出了第一张元素周期表,随着科学的发展,元素周期表的形式变得更加完美,关于现代元素周期表的说法正确的是
A.第ⅠA、ⅡA族的元素全部是金属元素,均能与酸发生反应生成氢气
B.元素周期表中非金属元素都不位于副族
C.现代元素周期表是按照相对原子质量的大小顺序对元素进行排列的
D.0族元素中所有元素原子的最外层电子数都是8,化学性质稳定
√
第一周期第ⅠA族元素是H元素,不是金属元素,故A错误;
副族元素都是金属元素,故B正确;
现代元素周期表是按照原子的核电荷数的大小顺序对元素进行排列的,故C错误;
0族元素中He元素原子的最外层电子数是2,故D错误。
应用体验
3.我国一直致力研究开发自己的芯片,制造芯片需要单晶硅,其中硅元素在元素周期表中的位置是
A.第二周期第ⅤA族 B.第三周期第ⅥA族
C.第三周期第ⅣA族 D.第二周期第ⅣA族
√
硅是14号元素,Si原子核外有三个电子层,最外层电子数为4,根据周期序数等于电子层数,主族序数等于最外层电子数可知,硅在元素周期表中的位置为第三周期第ⅣA族,C正确。
归纳总结
元素周期表的结构
归纳总结
原子序数的定量关系
①同周期,第ⅡA族元素与第ⅢA族元素原子序数差可能为1、11、25。
②同族,相邻周期元素原子序数差:第ⅠA族~第ⅡA族:上一周期元素种类数;第ⅢA族~0族:下一周期元素种类数。如Na与K原子序数相差8,Cl与Br原子序数相差18。
③利用稀有气体元素的原子序数推断元素在周期表中的位置。
返回
核素、同位素
二
请在表格中填写三种氢原子的原子符号:
氢元素的原子核 原子名称 原子符号( )
质子数(Z) 中子数(N) 1 0 氕
1 1 氘
1 2 氚
【思考1】 氕、氘、氚的原子结构有何异同?它们是同一种元素吗?
提示 质子数相同而中子数不同,是同一种元素。
1.概念辨析
(1)元素:具有相同 的一类 的总称。
(2)核素:具有一定数目 和一定数目 的一种原子。
(3)同位素: 相同而 不同的同一 的不同原子互称为同位素(即同一 的不同 )。
质子数(核电荷数)
原子
质子
中子
质子数
中子数
元素
元素
核素
【思考2】 (1)O2和O3互为同位素吗?H2O和D2O互为同位素吗?
提示 不互为,因为O2和O3互为同素异形体,不是原子;
不互为,因为H2O和D2O是同种物质。
(2)填写下列空白:
同位素 同素异形体
本质
范畴
特性
质子数相同、中子数不同的核素
同种元素组成的不同单质
原子
单质
化学性质几乎相同,物理性质不同
组成元素相同,性质不同
2.同位素的应用
考古中推断文物的年代
制造氢弹的原料
核反应堆的原料
相对原子质量的标准原子
应用体验
1.判断正误
(1)任何原子都由质子、中子、电子构成
(2)23Na和23Mg互为同位素
(3)同位素原子的化学性质几乎相同,物理性质略有差异
(4)原子的种类大于元素的种类
(5) 为同一元素的不同微粒
×
×
√
√
√
应用体验
√
应用体验
√
返回
随堂演练 知识落实
1
2
3
4
1.下列关于元素周期表的说法正确的是
A.元素周期表有18个纵列,即18个族
B.短周期是指1到20号元素
C.元素周期表是按元素的原子序数由小到大的顺序排列的
D.某种元素的相对原子质量取整数值,就是其原子序数
√
随堂演练
5
1
2
3
4
随堂演练
周期表共有18个纵列,16个族,其中第Ⅷ族包括第 8、9、10 三个纵列,故A错误;
短周期是指第一、二、三周期,而19号、20号元素处于第四周期,故B错误;
现在的元素周期表是按照原子序数由小到大的顺序排列的,故C正确;
元素的原子序数等于元素的核电荷数或对应原子的质子数,故D错误。
5
2.(2023·长沙高一检测)下列说法正确的是
A.某短周期元素最外层有2个电子,则其一定是金属元素
B.主族元素的单原子阳离子一定具有稀有气体的电子层结构(H+除外)
C.元素周期表有7个主族、8个副族,副族均由长周期元素组成
D.主族元素在周期表中的位置只取决于该元素的电子层数
√
随堂演练
1
2
3
4
5
随堂演练
1
2
3
4
主族元素的单原子失去最外层电子转化为阳离子,则短周期主族元素的单原子阳离子一定具有稀有气体的电子层结构(H+除外),长周期主族元素不符合,如Ga失去3个电子后最外层电子数为18,故B错误;
元素周期表有18个纵列,分为7个主族,8个副族,1个0族,总共16个族,副族由长周期元素组成,故C正确;
主族元素的最外层电子数等于族序数,电子层数等于周期数,则主族元素在周期表中的位置取决于该元素的电子层数、最外层电子数,故D错误。
5
3.第116号元素的元素符号为Lv,其中文名为“ ”,下列说法不正确的是
A.Lv原子的最外层电子数是6
B.Lv是一种非金属元素
C.其中一种核素 的中子数为177
D.Lv在周期表的第七周期第ⅥA族
√
随堂演练
1
2
3
4
5
随堂演练
1
2
3
4
根据元素周期表及原子核外电子排布规律可知,116号元素Lv位于第七周期第ⅥA族,最外层电子数是6,A、D正确;
Lv是一种金属元素,B错误;
核素 的中子数为293-116=177,C正确。
5
4.2021年2月22日,嫦娥五号带回的月壤在人民大会堂首次公开亮相。据科学家预测,月球的土壤中吸附着数百万吨的3He,而在地球上He元素则主要以4He的形式存在。下列说法正确的是
A.4He原子核内含有4个质子
B.3He与4He互为同位素
C.3He与4He的电子数不同
D.4He的最外层电子数为2,故4He易失去最外层电子
随堂演练
1
2
3
4
√
5
随堂演练
1
2
3
4
He元素为2号元素,4He原子核内含有2个质子,2个中子,质量数为4,A错误;
3He含有2个质子、1个中子,3He与4He的质子数相同,中子数不同,是同一元素的不同核素,互为同位素,B正确;
核外电子数等于核内质子数,3He与4He的电子数均为2,则3He与4He的电子数相同,C错误;
4He的最外层为K层,K层电子数为2时,为稳定结构,故4He不易失去最外层电子,也不易得到电子,D错误。
5
5.(2022·重庆高一检测)A、B、C、D为短周期元素,在元素周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B元素原子的质子数。
(1)写出A元素的名称:_____。
(2)B位于周期表中第_____周期第_____族。
(3)C的原子结构示意图为_______。
(4)D的单质与水反应的化学方程式为________________________。
随堂演练
1
2
3
4
氮
三
ⅥA
Cl2+H2O===HCl+HClO
5
随堂演练
1
2
3
4
返回
令B的原子序数为x+8,则A的原子序数为x-1,C的原子序数为x+1,则x-1+x+1=x+8,x=8,故A为N,B为S,C为F,D为Cl。
5
课时对点练
1
2
3
4
5
6
7
8
9
题组一 元素周期表的结构
1.(2023·广东佛山高一检测)下列关于元素周期表的说法不正确的是
A.副族元素全部是金属元素
B.X2+的核外电子数为18,则X在第四周期第ⅡA族
C.同周期第ⅡA族与第ⅢA族元素的原子序数差值一定是1
D.元素周期表一共有18个纵列,但只有16个族
√
10
11
12
13
14
15
对点训练
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
元素周期表中,副族元素均为金属元素,故A正确;
X2+的核外电子数目为18,质子数为18+2=20,则X为Ca元素,在周期表中位于第四周期第ⅡA族,故B正确;
同周期第ⅡA族与第ⅢA族元素的原子序数差可能为1、11、25,故C错误。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2.(2022·丽江古城区校级期末)下列元素不属于短周期元素的是
A.铝 B.氯 C.铁 D.硫
√
2
Al位于第三周期第ⅢA族,为短周期元素,故A错误;
Cl位于第三周期第ⅦA族,属于短周期元素,故B错误;
Fe位于第四周期第Ⅷ族,属于长周期元素,故C正确;
S位于第三周期第ⅥA族,属于短周期元素,故D错误。
3.下列关于元素周期表的说法正确的是
A.地壳中含量最多的金属元素位于第四周期
B.主族元素都是短周期元素
C.最外层电子数相同的元素一定在同一族
D.元素周期表有7个周期
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
地壳中含量最多的金属元素是铝,位于第三周期,故A错误;
主族元素由短周期元素和长周期元素组成,故B错误;
氦和镁最外层电子数都是2,但不在同一族,故C错误;
元素周期表有7个横行,即有7个周期,故D正确。
题组二 同周期、同主族元素的序差规律
4.已知A为第ⅡA族元素,B为第ⅢA族元素,它们的原子序数分别为m和n,且A、B为同一周期的元素,下列关系式错误的是
A.n=m+1 B.n=m+11
C.n=m+25 D.n=m+10
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
若A、B为第二、三周期元素,n=m+1;若A、B为第四、五周期元素,n=m+11;若A、B为第六、七周期元素,n=m+25,综上分析,答案为D。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
5.原子序数为x的E元素在周期表中位于A、B、C、D四种元素中间(如图所示),则A、B、C、D四种元素(镧系、锕系、0族元素除外)的原子序数之和不可能是
A.4x B.4x+14
C.4x+10 D.4x+6
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
E元素位于图中A、B、C、D四种元素的中间,其原子
序数为x,因E元素的上方和左侧均有元素,则E不可能
属于第一、二周期。
当E元素位于第三周期时,E元素只能位于副族元素的右侧,或当E元素位于第四周期且在副族元素左侧时,A、B、C、D四种元素的原子序数分别为x-1、x-8、x+1、x+18,此时A、B、C、D四种元素的原子序数之和为4x+10;
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
当E元素位于第四周期且在副族元素右侧或第五周期
且在副族元素左侧时,A、B、C、D四种元素的原子
序数分别为x-1、x-18、x+1、x+18,此时A、B、
C、D四种元素的原子序数之和为4x;
当E元素位于第五周期且在副族元素右侧时,A、B、C、D四种元素的原子序数分别为x-1、x-18、x+1、x+32,此时A、B、C、D四种元素的原子序数之和为4x+14;
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
当E元素位于第六周期时,只能在副族元素右侧,A、B、C、D四种元素的原子序数分别为x-1、x-32、x+1、x+32,此时A、B、C、D四种元素的原子序数之和为4x;
综上所述,A、B、C、D四种元素的原子序数之和可能为4x、4x+10、4x+14,不可能是4x+6,D项符合题意。
2
题组三 核素 同位素
6.下列属于同位素的是
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
金刚石和石墨是同种元素形成的不同单质,互为同素异形体,故A错误;
O2和O3是同种元素形成的不同单质,互为同素异形体,故D错误。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
9.(2023·临沂第四中学高一期末)下列说法正确的是
A.家庭使用的玻璃体温计中的汞为主族元素
B.止咳祛痰药盐酸氨溴索中含有两种卤族元素
C.连花清瘟胶囊成分中的石膏CaSO4·2H2O 属于混合物
D.酒精能够有效杀灭病毒,浓度越高,消毒效果越好
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
√
家庭使用的玻璃体温计中的汞为副族元素,A错误;
止咳祛痰药盐酸氨溴索中含有氯、溴两种卤族元素,B正确;
连花清瘟胶囊成分中的石膏CaSO4·2H2O 属于化合物,C错误。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
11.短周期元素S、R、T、Q、W在元素周期表中的相对位置如图所示,其中Q为硅元素。则W元素的原子结构示意图为
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
√
已知Q为Si元素,根据元素在周期表中的相对
位置关系可知W为S元素,S的原子序数为16,
最外层电子数为6,所以S元素的原子结构示
意图为 ,D正确。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
12.《格物探源》中提到:“天地万物皆以六十四种元质配合而成,如金银铜铁养轻淡炭等皆是元质,皆由微渺面造”,“微渺”即现代之“原子”。下列说法错误的是
A.“元质”即现代之“元素”,现在人类发现的化学元素已超过六十四种
B.“养轻淡”即氧、氢、氮三种元素,均为短周期主族元素
C.上文中提到的八种“元质”中,有四种金属“元质”
D.“微渺”是组成物质的基本微粒,不可再分
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
由信息可知,“金银铜铁养轻淡炭等皆是元质”,“元质”即为元素,目前周期表中有100多种元素,人类发现的化学元素多于64种,A正确;
“养轻淡”即氧、氢、氮,均为短周期主族元素,B正确;
金、银、铜、铁为金属元素,“养轻淡炭”为非金属元素,8种“元质”包括4种金属元素、4种非金属元素,C正确;
原子由质子、中子、核外电子构成,“微渺”是组成物质的基本微粒,可再分,D错误。
13.(2022·西安高一检测)如图为元素周期表的一部分。
(1)Cl在元素周期表中位于________________,
其原子结构示意图为_________。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
第三周期第ⅦA族
由图可知Cl处于第三周期第ⅦA族,其原子结构示意图为 。
(2)14C在考古中常用于测定生物的死亡年
代,它与12C、13C互称为________。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
同位素
14C、12C、13C的质子数相同、中子数不同,三者互称为同位素。
(3)将N和Mg两种元素的简单离子组成的化合物X投入水中,反应生成白色沉淀,并释放出NH3。
①写出化合物X与水发生反应的化学方程式:
____________________________________。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
Mg3N2+6H2O===3Mg(OH)2↓+2NH3↑
Mg3N2与水反应生成Mg(OH)2和NH3,反应的化学方程式为Mg3N2+6H2O===3Mg(OH)2↓+2NH3↑。
②写出白色沉淀溶于盐酸的反应的离子方程
式:______________________________。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
Mg(OH)2+2H+===Mg2++2H2O
氢氧化镁和盐酸反应生成氯化镁和水,反应的离子方程式为Mg(OH)2+2H+===Mg2++2H2O。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
14.(1)原子序数大于4的主族元素A和B的离子Am+和Bn-,它们的核外电子排布相同,则:
①A和B的质子数之差为_______(用m、n表示)。
2
因Am+和Bn-核外电子排布相同,则电子数相同,即ZA-m=ZB+n,则A和B的质子数之差为ZA-ZB=m+n。
m+n
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
②B和A的族序数之差为___________(用含m、n的代数式表示)。
2
B的负价为-n,则B的族序数为8-n,而A的族序数为m,B和A的族序数之差为8-n-m。
8-n-m
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(2)A、B两元素,A的原子序数为x,A和B所在周期包含元素种类数目分别为m和n。
①如果A和B同在第ⅠA族,当B在A的上一周期时,B的原子序数为______;
2
如果A、B同在第ⅠA族,当B在A的上一周期时,B和A的原子序数之差恰好为B所在周期的元素种类数,则B的原子序数为x-n。
x-n
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
②如果A和B同在第ⅦA族,当B在A的上一周期时,B的原子序数为_______。
2
如果A、B同在第ⅦA族时,当B在A的上一周期时,A、B的原子序数之差恰好为相邻两周期下一周期的元素种类数,B的原子序数为x-m。
x-m
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
15.如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题。
(1)①②③④分别是
_______、_______、
_______、_______
(用元素符号表示)。
2
由元素在周期表中的位置可知,①为H元素、②为C元素、③为N元素、④为O元素。
H
C
N
O
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(2)①③④元素中的两种元素可
形成含10个电子的分子,它们
是________、________。
2
H元素与N、O元素形成的含10个电子的分子为NH3、H2O。
NH3
H2O
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(3)画出⑤的原子结构示意
图:__________。
2
⑤为Na元素,其原子结构示意图为 。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(4)⑧的单质与氢氧化钠溶液反
应的离子方程式为__________
____________________。
2
⑧为Cl元素,氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式为Cl2+2OH-===Cl-+ClO-+H2O。
Cl2+2OH-
===Cl-+ClO-+H2O
返回
本课结束
