第四章 第三节 第1课时 离子键 (72张PPT)
文档属性
| 名称 | 第四章 第三节 第1课时 离子键 (72张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 6.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-17 21:16:58 | ||
图片预览










文档简介
(共72张PPT)
第四章 第三节
第1课时 离子键
1.通过氯化钠的形成过程,认识离子键的形成,了解离子键和离子化合物的概
念,会判断离子化合物。
2.会用电子式表示常见离子化合物的形成过程,促进宏观辨识与微观探析化学
核心素养的发展。
核心素养
发展目标
一、离子键与离子化合物
二、电子式
课时对点练
内容索引
随堂演练 知识落实
离子键与离子化合物
一
1.微观探析,认识离子键的形成
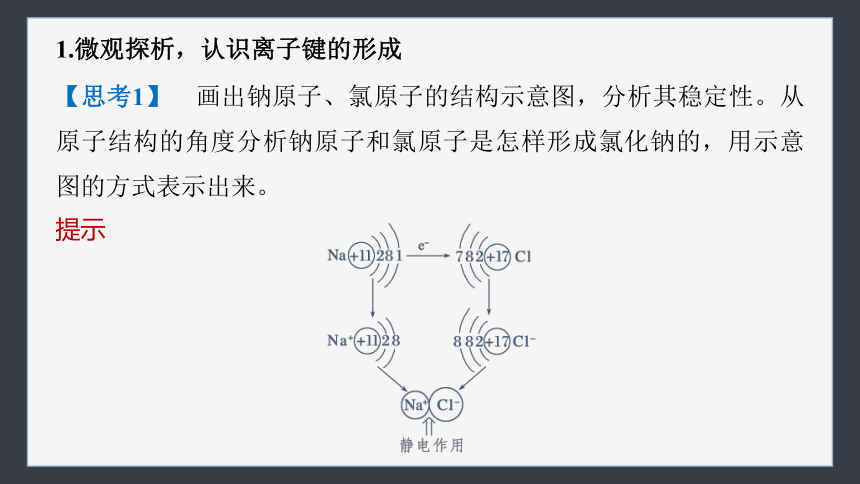
【思考1】 画出钠原子、氯原子的结构示意图,分析其稳定性。从原子结构的角度分析钠原子和氯原子是怎样形成氯化钠的,用示意图的方式表示出来。
提示
【思考2】 氯化钠中Na+和Cl-为什么可以结合在一起?它们之间存在哪些作用力?
提示 Na+和Cl-通过静电作用结合在一起;静电引力和静电斥力。
2.离子键
阅读课本,总结离子键,填写下列空白。
带相反电荷离子
阳离子和阴离子
静电作用
静电引力
静电斥力
金属
【思考3】 哪些元素间容易形成离子键?指出这些元素在元素周期表的位置?
提示 活泼金属与活泼非金属;活泼金属:第ⅠA族(Na、K),第ⅡA族(Ca、Mg);活泼非金属:第ⅥA族(O、S),第ⅦA族(F、Cl)。
归纳总结
3.离子化合物
(1)定义:由离子键构成的化合物叫做离子化合物。
【思考4】 判断下列哪些物质是离子化合物?(填“是”或“不是”)
①KBr________; ②HCl_______;
③NH4Cl ______; ④NaOH______;
⑤KNO3_______; ⑥Na2O_______。
是
不是
是
是
是
是
(2)与物质类别的关系
NaOH、KOH
应用体验
1.判断正误
(1)阴、阳离子之间的静电吸引形成离子键
(2)金属元素与非金属元素形成的化合物一定为离子化合物
(3)所有氧化物均为离子化合物
(4)第ⅠA族元素与第ⅦA族元素形成的化合物一定是离子化合物
(5)离子化合物中一定含有阴离子和阳离子,所以离子化合物一定能导电
×
×
×
×
×
应用体验
2.如图形象地表示了氯化钠的形成过程。下列叙述不正确的是
A.钠原子易失去1个电子,
氯原子易得到1个电子
B.钠离子与钠原子具有相
似的化学性质
C.钠原子与氯原子作用生成NaCl后,其结构的稳定性增强
D.氯化钠是离子化合物
√
应用体验
3.下列哪一组元素的原子间容易形成离子键
元素 a b c d e f g
M层电子数 1 2 3 4 5 6 7
A.a和c B.a和f C.d和g D.c和g
√
由原子a~g的M层电子数可知,M层即为原子的最外层,元素a~g均为第三周期元素,a为活泼的金属元素,f为活泼的非金属元素,所以a与f容易形成离子键。
归纳总结
(1)并不是所有的金属与非金属化合都能形成离子键,如AlCl3中不存在离子键。
(2)非金属元素间也可形成离子键,如NH4Cl中, 与Cl-间的化学键就是离子键。
(3)离子化合物中一定含有离子键,含离子键的化合物一定是离子化合物。
返回
电子式
二
1.电子式
(1)概念
在元素符号周围用“·”或“×”来表示原子的___________________
的式子。
最外层电子(价电子)
(2)常见粒子的电子式
粒子 电子式(举例)
原子
离子 阳离子
阴离子
化合物
【思考1】 有的同学将MgO的电子式写为 ,这样书写是否正确并说明原因?
提示 不正确。MgO为离子化合物,应写为 ,阴离子的电子式必须加[ ],并指明电荷数。
2.用电子式表示离子化合物的形成过程
【思考2】 有的同学用电子式表示化合物Na2S的形成过程为2Na+S=== ,这样书写是否正确并说明原因?
提示 不正确。应书写为 ,反应的原子应写为电子式,且电子式表示化合物形成过程不是化学方程式,不能用“===”,应用“―→”。
归纳总结
书写电子式的注意事项
(1)一个“·”或“×”代表一个电子,原子的电子式中“·”(或“×”)的个数即表示原子的最外层电子数。
(2)同一原子的电子式不能既用“×”又用“·”表示。
(3)“[ ]”在所有的阴离子、复杂的阳离子中出现。
归纳总结
(4)在化合物中,如果有多个阴、阳离子,阴、阳离子必须是间隔的,即不能将两个阴离子或两个阳离子写在一起,如CaCl2要写成 ,不能写成 ,也不能写成
。
(5)用电子式表示化合物形成过程时,由于不是化学方程式,不能用“===”,应用“―→”。“―→”前是原子的电子式,“―→”后是化合物的电子式。
应用体验
1.判断正误
(1) :
(2)Al3+:
(3)Na2O:
(4) :
×
×
×
×
应用体验
(5)KCl的形成过程:
(6)Mg3N2的形成过程:3Mg×+2 ―→
×
×
应用体验
2.下列化学用语正确的是
A.钠离子的电子式:
B.Cl-的结构示意图:
C.质量数为35的核素氯:
D.NaCl的形成过程:
√
A项,简单阳离子的电子式为其离子符号;
C项,质量数为35的核素氯应为 ;
D项,箭头右侧应为离子化合物的电子式,NaCl的形成过程应为
。
应用体验
3.用电子式表示下列离子化合物的形成过程:
BaCl2:______________________________;
MgS:_______________________;
K2O:_______________________。
返回
随堂演练 知识落实
1
2
3
4
1.下列说法正确的是
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属与所有非金属原子之间都能形成离子键
C.非金属元素之间一定不能形成离子键
D.含有离子键的化合物一定是离子化合物
√
随堂演练
1
2
3
4
随堂演练
离子键就是使阴、阳离子结合成化合物的静电作用,静电作用包含吸引力和排斥力,故A错误;
金属和非金属元素之间不可能都能形成离子键,如AlCl3中不含离子键,故B错误;
非金属元素之间也可能形成离子键,如铵盐(NH4Cl、NH4NO3等),故C错误;
含有离子键的化合物是离子化合物,所以离子化合物中一定含有离子键,故D正确。
2.(2022·北京昌平高一期末)下列物质中属于离子化合物的是
A.Cl2 B.HCl
C.NaCl D.N2
√
随堂演练
1
2
3
4
Cl2和N2为单质,不属于化合物,HCl中不含离子键,不属于离子化合物,故选C。
3.(2023·长沙高一期中)下列微粒的电子式书写错误的是
A.氯原子:
B.氧离子:
C.氟化钙:
D.硫化钠:
√
随堂演练
1
2
3
4
随堂演练
1
2
3
4
氯原子最外层电子数为7,电子式为 ,故A正确;
氧离子是氧原子得到两个电子形成的阴离子,最外层电子数8个,电子式为 ,故B正确;
氟化钙为离子化合物,钙离子直接用离子符号Ca2+表示,氟离子需要标出其最外层电子及所带电荷,两个氟离子需要放在钙离子的两边,氟化钙的电子式为 ,故C错误;
硫化钠是两个钠离子和一个硫离子构成的离子化合物,电子式为 ,故D正确。
4.(2022·沈阳高一月考)下列表示物质结构的化学用语正确的是
A.Na2O和Na2O2中阳离子和阴离子个数比分别为2∶1和1∶1
B.MgCl2的形成过程:
C.溴离子的结构示意图:
D.NH4Cl的电子式:
随堂演练
1
2
3
4
√
随堂演练
1
2
3
4
Na2O2由Na+和 构成,Na2O由Na+和O2-构成,则Na2O和Na2O2中阳离子和阴离子个数比均为2∶1,故A错误;
Mg与Cl2反应时,Mg失电子,Cl得电子,用电子式表示其形成过程为 ,故B正确;
Br-的质子数为35,核外电子数为36,核外电子分层排布,其结构示
意图为 ,故C错误;
随堂演练
1
2
3
4
返回
氯化铵是离子化合物,由铵根离子与氯离子构成,氯离子是阴离子,电子式应表示出最外层电子,其电子式为 ,故D错误。
课时对点练
1
2
3
4
5
6
7
8
9
题组一 离子键的概念及理解
1.下列说法不正确的是
①阳离子都是由一个金属原子失去电子而形成的
②阳离子核外电子排布一定与稀有气体元素原子相同
③元素周期表中第ⅠA族元素间不可能形成离子键
④在化合物Na2O中,两个钠离子之间也存在离子键
A.①④ B.②④
C.①②③ D.①②③④
√
10
11
12
13
14
15
对点训练
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
阳离子不一定都是由一个金属原子失去电子而形成的,还有非金属元素构成的阳离子,如铵根离子,故①错误;
氢离子是阳离子,核外电子数为0,则阳离子核外电子排布不一定与稀有气体元素原子相同,故②错误;
Na与H之间可以形成离子键,故③错误;
Na2O是离子化合物,钠离子与氧离子之间形成离子键,两个钠离子之间不存在化学键,故④错误。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2.(2022·金华高一月考)下列各组原子序数所表示的两种元素,不能形成离子键的是
A.6和8 B.8和11
C.12和9 D.11和17
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
原子序数为6和8对应的元素是C和O,都是不活泼的非金属元素,不能形成离子键,A选;
原子序数为8和11对应的元素是O和Na,组成物质Na2O,能形成离子键,B不选;
原子序数为12和9对应的元素是Mg和F,组成物质MgF2,能形成离子键,C不选;
原子序数为11和17对应的元素是Na和Cl,组成物质NaCl,能形成离子键,D不选。
2
3.(2022·北京房山区期中)下列物质含离子键的是
A.KCl B.H2O C.HCl D.CH4
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
A项,KCl中K+与Cl-之间通过离子键结合,符合题意;
B项,H2O分子是由H原子与O原子组成的化合物,不含离子键,不符合题意;
C项,HCl分子是由H原子与Cl原子组成的化合物,不含离子键,不符合题意;
D项,CH4是由H原子与C原子组成的化合物,不含离子键,不符合题意。
4.(2023·杭州高一期中)下列性质中可以证明某化合物内一定存在离子键的是
A.可溶于水 B.具有较高的熔点
C.水溶液能导电 D.熔融状态能导电
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
D项,构成物质的粒子有原子、分子和离子,若化合物在熔融状态下能导电,说明该化合物中存在离子,即存在离子键,正确。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
题组二 离子化合物的理解及判断
5.(2022·江西赣州期末)下列物质属于离子化合物的是
A.HClO B.NH3
C.NH4Cl D.CO2
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
A项,HClO分子由H、Cl、O原子构成,不含离子键,不属于离子化合物,不符合题意;
B项,NH3分子由N、H原子构成,不含离子键,不属于离子化合物,不符合题意;
C项,NH4Cl中由 和Cl-构成,含有离子键,属于离子化合物,符合题意;
D项,CO2分子由C、O原子构成,不含离子键,不属于离子化合物,不符合题意。
2
6.(2022·四川雅安高一期末)下列关于离子化合物的说法正确的是
A.离子化合物一定能导电
B.离子化合物不一定易溶于水
C.能导电的物质一定是离子化合物
D.溶于水能导电的化合物一定是离子化合物
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
A项,离子化合物不一定能导电,如固体氯化钠不导电,离子化合物在熔融状态下能导电,错误;
B项,离子化合物不一定易溶于水,如碳酸钙是离子化合物,但碳酸钙难溶于水,正确;
C项,能导电的物质不一定是离子化合物,如金属铜能导电,错误;
D项,溶于水能导电的化合物不一定是离子化合物,如氯化氢不是离子化合物,氯化氢的水溶液能导电,错误。
题组三 电子式
7.(2022·成都高一期末)下列化合物的电子式书写正确的是
A. B.
C. D.
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
氯化钙中Cl-不能合并书写,电子式应该是 ,故A错误;
S2-所带电荷标注方式错误,且Na+不能合并,电子式应该是
,故B错误;
Mg2+不应带“[ ]”,电子式应该是 ,故C错误。
2
8.(2022·郑州校级高一月考)下列用电子式表示物质的形成过程正确的是
A.
B.
C.
D.
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
用电子式表示MgCl2的形成过程为 ,
故A错误;
MgF2形成过程的正确表示方法为 ,故C错误;
溴化钠为离子化合物,由溴离子与钠离子通过离子键结合,用电子式表示溴化钠的形成过程为 ,故D错误。
2
9.下列有关化学用语的表示方法正确的是
A.Na2S的电子式为
B.MgCl2的电子式:
C.已知NH5是离子化合物,则其电子式是
D.KCl的电子式为
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
A项,Na2S的电子式为 Na+,错误;
B项,MgCl2的电子式为 ,错误;
D项,KCl是由钾离子和氯离子构成的离子化合物,电子式为
,错误。
2
综合强化
10.1个M原子失去2个电子转移到2个Y原子中去,形成离子化合物Z。下列说法正确的是
A.Z可表示为MY2 B.Z可表示为M2Y
C.Z的电子式可表示为 D.M形成+1价阳离子
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
√
1个M原子失去2个电子,转移到2个Y原子中去,故离子化合物Z可表示为MY2,A正确、B错误;
Z的电子式不应把2个Y-合并,C错误;
M形成+2价阳离子,D错误。
11.氢化钠(NaH)是一种白色的离子化合物,其中钠元素化合价是+1价,氢化钠与水反应生成H2和NaOH。下列叙述不正确的是
A.NaH的电子式为
B.H-的电子层排布与氦原子的电子层排布相同
C.微粒半径:H-D.NaH与H2O反应时,水做氧化剂
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
氢化钠(NaH)是一种白色的离子化合物,NaH的电子式为 ,A正确;
NaH中氢元素的化合价为-1价,其离子的电子层排布与氦原子的电子层排布相同,B正确;
Li+和H-的电子层排布相同,但是Li+的核电荷数比H-大,所以微粒半径:H->Li+,C不正确;
NaH与H2O反应生成H2和NaOH,在这个反应中只有氢元素的化合价发生了变化,NaH中H的化合价升高,做还原剂,被氧化,水中H的化合价降低被还原,做氧化剂,D正确。
12.(2022·四川大竹中学高一月考)W、X、Y、Z为原子序数依次增大的短周期主族元素,W的最外层电子数是内层电子数的3倍,Y在短周期元素中原子半径最大,Z的最高正价与最低负价代数和为4,下列说法不正确的是
A.简单气态氢化物的稳定性:X>W>Z
B.Y与W、X、Z形成的化合物都含有离子键
C.W与Z形成的一种化合物是导致酸雨的污染物
D.W与Y可以形成阴、阳离子个数比为1∶1的离子化合物
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
W的最外层电子数是内层电子数的3倍,W位于第二周期,为氧元素;
Y在短周期元素中原子半径最大,Y是钠元素;W、X、Y、Z为原子序数依次增大的短周期主族元素,X是氟元素;Z的最高正价与最低负价代数和为4,Z的最高正价是+6价,为硫元素。非金属性越强,简单气态氢化物越稳定,则简单气态氢化物的稳定性:X>W>Z,A正确;
W与Z形成的一种化合物为SO2,是导致酸雨的污染物,C正确;
钠元素和氧元素可以形成Na2O或者Na2O2,但两者的阴、阳离子个数比都为1∶2,D错误。
13.(2022·河南辉县市第二高级中学高一月考)有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C在空气中燃烧时呈现黄色火焰,C的单质在高温下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,试根据以上叙述回答下列问题:
(1)请写出元素A的名称:_____,B的简单离子结构示意图:___________;
D的简单离子的电子式:_________。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
碳
(2)D元素位于周期表中第______周期第________族,C2B2的电子式:
___________________。
(3)用电子式表示化合物C2D的形成过程:_________________________。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
三
ⅥA
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
14.(2022·福建德化县校级高一月考)氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生两种碱性物质,其中一种为NH3·H2O,请回答下列问题:
(1)氮化钠(Na3N)和水反应的化学方程式为__________________________
___________。
2
Na3N+4H2O===3NaOH
根据氮化钠与水作用产生两种碱性物质,其中有一种为NH3·H2O可知,氮化钠(Na3N)和水反应的化学方程式为Na3N+4H2O===3NaOH+NH3·
H2O。
+NH3·H2O
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
(2)Na3N的电子式是__________________,该化合物由_____键形成。
(3)Na3N与盐酸反应生成__种盐,其电子式是_______________________。
离子
两
Na3N与盐酸反应时,N3-先与HCl电离出的H+结合成NH3,NH3再与HCl反应生成NH4Cl,Na+与Cl-形成NaCl,故可生成两种盐。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
(4)比较Na3N中两种微粒的半径:r(Na+)______(填“>”“=”或“<”)
r(N3-)。
<
Na+、N3-的电子层结构相同,核电荷数大者,离子半径较小,故离子半径:r(Na+)1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
15.下表是元素周期表中的一部分。回答下列问题:
2
(1)在这些元素中,金属性最强的元素是_____(填元素符号,下同);除稀有气体元素以外的元素中,原子半径最大的是_____,原子半径最小的是_____。
K
K
F
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
由元素在元素周期表中的
位置可知,①为N、②为
F、③为Na、④为Mg、
⑤为Al、⑥为Si、⑦为S、
⑧为Cl、⑨为Ar、⑩为K、
为Ca、 为Br。
同周期元素自左而右金属性逐渐减弱,同主族元素自上而下金属性逐渐增强,故上述元素中K元素的金属性最强;
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
同周期元素自左而右原子半径逐渐减小,同主族元素自上而下原子半径逐渐增大,故上述除稀有气体元素以外的元素中,K的原子半径最大,F的原子半径最小。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(2)元素②和③形成的离子的电子层结构_____(填“相同”或“不相同”),两者形成的化合物是否是离子化合物?_____(填“是”或“否”),该化
合物的电子式为____________。
2
是
相同
元素②和③形成的离子分别为F-和Na+,都为10电子离子,它们的电子层结构相同,两者形成的化合物NaF由钠离子和氟离子构成,属于离子化合物,该化合物的电子式为 。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
(3)元素⑧的最高价氧化物对应的水化物的化学式为_______,名称为__________。
(4)元素 为_____,与元素⑦形成的化合物为_____,用电子式表示其形
成过程:_____________________。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
高氯酸
HClO4
Ca
CaS
返回
本课结束
第四章 第三节
第1课时 离子键
1.通过氯化钠的形成过程,认识离子键的形成,了解离子键和离子化合物的概
念,会判断离子化合物。
2.会用电子式表示常见离子化合物的形成过程,促进宏观辨识与微观探析化学
核心素养的发展。
核心素养
发展目标
一、离子键与离子化合物
二、电子式
课时对点练
内容索引
随堂演练 知识落实
离子键与离子化合物
一
1.微观探析,认识离子键的形成
【思考1】 画出钠原子、氯原子的结构示意图,分析其稳定性。从原子结构的角度分析钠原子和氯原子是怎样形成氯化钠的,用示意图的方式表示出来。
提示
【思考2】 氯化钠中Na+和Cl-为什么可以结合在一起?它们之间存在哪些作用力?
提示 Na+和Cl-通过静电作用结合在一起;静电引力和静电斥力。
2.离子键
阅读课本,总结离子键,填写下列空白。
带相反电荷离子
阳离子和阴离子
静电作用
静电引力
静电斥力
金属
【思考3】 哪些元素间容易形成离子键?指出这些元素在元素周期表的位置?
提示 活泼金属与活泼非金属;活泼金属:第ⅠA族(Na、K),第ⅡA族(Ca、Mg);活泼非金属:第ⅥA族(O、S),第ⅦA族(F、Cl)。
归纳总结
3.离子化合物
(1)定义:由离子键构成的化合物叫做离子化合物。
【思考4】 判断下列哪些物质是离子化合物?(填“是”或“不是”)
①KBr________; ②HCl_______;
③NH4Cl ______; ④NaOH______;
⑤KNO3_______; ⑥Na2O_______。
是
不是
是
是
是
是
(2)与物质类别的关系
NaOH、KOH
应用体验
1.判断正误
(1)阴、阳离子之间的静电吸引形成离子键
(2)金属元素与非金属元素形成的化合物一定为离子化合物
(3)所有氧化物均为离子化合物
(4)第ⅠA族元素与第ⅦA族元素形成的化合物一定是离子化合物
(5)离子化合物中一定含有阴离子和阳离子,所以离子化合物一定能导电
×
×
×
×
×
应用体验
2.如图形象地表示了氯化钠的形成过程。下列叙述不正确的是
A.钠原子易失去1个电子,
氯原子易得到1个电子
B.钠离子与钠原子具有相
似的化学性质
C.钠原子与氯原子作用生成NaCl后,其结构的稳定性增强
D.氯化钠是离子化合物
√
应用体验
3.下列哪一组元素的原子间容易形成离子键
元素 a b c d e f g
M层电子数 1 2 3 4 5 6 7
A.a和c B.a和f C.d和g D.c和g
√
由原子a~g的M层电子数可知,M层即为原子的最外层,元素a~g均为第三周期元素,a为活泼的金属元素,f为活泼的非金属元素,所以a与f容易形成离子键。
归纳总结
(1)并不是所有的金属与非金属化合都能形成离子键,如AlCl3中不存在离子键。
(2)非金属元素间也可形成离子键,如NH4Cl中, 与Cl-间的化学键就是离子键。
(3)离子化合物中一定含有离子键,含离子键的化合物一定是离子化合物。
返回
电子式
二
1.电子式
(1)概念
在元素符号周围用“·”或“×”来表示原子的___________________
的式子。
最外层电子(价电子)
(2)常见粒子的电子式
粒子 电子式(举例)
原子
离子 阳离子
阴离子
化合物
【思考1】 有的同学将MgO的电子式写为 ,这样书写是否正确并说明原因?
提示 不正确。MgO为离子化合物,应写为 ,阴离子的电子式必须加[ ],并指明电荷数。
2.用电子式表示离子化合物的形成过程
【思考2】 有的同学用电子式表示化合物Na2S的形成过程为2Na+S=== ,这样书写是否正确并说明原因?
提示 不正确。应书写为 ,反应的原子应写为电子式,且电子式表示化合物形成过程不是化学方程式,不能用“===”,应用“―→”。
归纳总结
书写电子式的注意事项
(1)一个“·”或“×”代表一个电子,原子的电子式中“·”(或“×”)的个数即表示原子的最外层电子数。
(2)同一原子的电子式不能既用“×”又用“·”表示。
(3)“[ ]”在所有的阴离子、复杂的阳离子中出现。
归纳总结
(4)在化合物中,如果有多个阴、阳离子,阴、阳离子必须是间隔的,即不能将两个阴离子或两个阳离子写在一起,如CaCl2要写成 ,不能写成 ,也不能写成
。
(5)用电子式表示化合物形成过程时,由于不是化学方程式,不能用“===”,应用“―→”。“―→”前是原子的电子式,“―→”后是化合物的电子式。
应用体验
1.判断正误
(1) :
(2)Al3+:
(3)Na2O:
(4) :
×
×
×
×
应用体验
(5)KCl的形成过程:
(6)Mg3N2的形成过程:3Mg×+2 ―→
×
×
应用体验
2.下列化学用语正确的是
A.钠离子的电子式:
B.Cl-的结构示意图:
C.质量数为35的核素氯:
D.NaCl的形成过程:
√
A项,简单阳离子的电子式为其离子符号;
C项,质量数为35的核素氯应为 ;
D项,箭头右侧应为离子化合物的电子式,NaCl的形成过程应为
。
应用体验
3.用电子式表示下列离子化合物的形成过程:
BaCl2:______________________________;
MgS:_______________________;
K2O:_______________________。
返回
随堂演练 知识落实
1
2
3
4
1.下列说法正确的是
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属与所有非金属原子之间都能形成离子键
C.非金属元素之间一定不能形成离子键
D.含有离子键的化合物一定是离子化合物
√
随堂演练
1
2
3
4
随堂演练
离子键就是使阴、阳离子结合成化合物的静电作用,静电作用包含吸引力和排斥力,故A错误;
金属和非金属元素之间不可能都能形成离子键,如AlCl3中不含离子键,故B错误;
非金属元素之间也可能形成离子键,如铵盐(NH4Cl、NH4NO3等),故C错误;
含有离子键的化合物是离子化合物,所以离子化合物中一定含有离子键,故D正确。
2.(2022·北京昌平高一期末)下列物质中属于离子化合物的是
A.Cl2 B.HCl
C.NaCl D.N2
√
随堂演练
1
2
3
4
Cl2和N2为单质,不属于化合物,HCl中不含离子键,不属于离子化合物,故选C。
3.(2023·长沙高一期中)下列微粒的电子式书写错误的是
A.氯原子:
B.氧离子:
C.氟化钙:
D.硫化钠:
√
随堂演练
1
2
3
4
随堂演练
1
2
3
4
氯原子最外层电子数为7,电子式为 ,故A正确;
氧离子是氧原子得到两个电子形成的阴离子,最外层电子数8个,电子式为 ,故B正确;
氟化钙为离子化合物,钙离子直接用离子符号Ca2+表示,氟离子需要标出其最外层电子及所带电荷,两个氟离子需要放在钙离子的两边,氟化钙的电子式为 ,故C错误;
硫化钠是两个钠离子和一个硫离子构成的离子化合物,电子式为 ,故D正确。
4.(2022·沈阳高一月考)下列表示物质结构的化学用语正确的是
A.Na2O和Na2O2中阳离子和阴离子个数比分别为2∶1和1∶1
B.MgCl2的形成过程:
C.溴离子的结构示意图:
D.NH4Cl的电子式:
随堂演练
1
2
3
4
√
随堂演练
1
2
3
4
Na2O2由Na+和 构成,Na2O由Na+和O2-构成,则Na2O和Na2O2中阳离子和阴离子个数比均为2∶1,故A错误;
Mg与Cl2反应时,Mg失电子,Cl得电子,用电子式表示其形成过程为 ,故B正确;
Br-的质子数为35,核外电子数为36,核外电子分层排布,其结构示
意图为 ,故C错误;
随堂演练
1
2
3
4
返回
氯化铵是离子化合物,由铵根离子与氯离子构成,氯离子是阴离子,电子式应表示出最外层电子,其电子式为 ,故D错误。
课时对点练
1
2
3
4
5
6
7
8
9
题组一 离子键的概念及理解
1.下列说法不正确的是
①阳离子都是由一个金属原子失去电子而形成的
②阳离子核外电子排布一定与稀有气体元素原子相同
③元素周期表中第ⅠA族元素间不可能形成离子键
④在化合物Na2O中,两个钠离子之间也存在离子键
A.①④ B.②④
C.①②③ D.①②③④
√
10
11
12
13
14
15
对点训练
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
阳离子不一定都是由一个金属原子失去电子而形成的,还有非金属元素构成的阳离子,如铵根离子,故①错误;
氢离子是阳离子,核外电子数为0,则阳离子核外电子排布不一定与稀有气体元素原子相同,故②错误;
Na与H之间可以形成离子键,故③错误;
Na2O是离子化合物,钠离子与氧离子之间形成离子键,两个钠离子之间不存在化学键,故④错误。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2.(2022·金华高一月考)下列各组原子序数所表示的两种元素,不能形成离子键的是
A.6和8 B.8和11
C.12和9 D.11和17
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
原子序数为6和8对应的元素是C和O,都是不活泼的非金属元素,不能形成离子键,A选;
原子序数为8和11对应的元素是O和Na,组成物质Na2O,能形成离子键,B不选;
原子序数为12和9对应的元素是Mg和F,组成物质MgF2,能形成离子键,C不选;
原子序数为11和17对应的元素是Na和Cl,组成物质NaCl,能形成离子键,D不选。
2
3.(2022·北京房山区期中)下列物质含离子键的是
A.KCl B.H2O C.HCl D.CH4
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
A项,KCl中K+与Cl-之间通过离子键结合,符合题意;
B项,H2O分子是由H原子与O原子组成的化合物,不含离子键,不符合题意;
C项,HCl分子是由H原子与Cl原子组成的化合物,不含离子键,不符合题意;
D项,CH4是由H原子与C原子组成的化合物,不含离子键,不符合题意。
4.(2023·杭州高一期中)下列性质中可以证明某化合物内一定存在离子键的是
A.可溶于水 B.具有较高的熔点
C.水溶液能导电 D.熔融状态能导电
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
D项,构成物质的粒子有原子、分子和离子,若化合物在熔融状态下能导电,说明该化合物中存在离子,即存在离子键,正确。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
题组二 离子化合物的理解及判断
5.(2022·江西赣州期末)下列物质属于离子化合物的是
A.HClO B.NH3
C.NH4Cl D.CO2
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
A项,HClO分子由H、Cl、O原子构成,不含离子键,不属于离子化合物,不符合题意;
B项,NH3分子由N、H原子构成,不含离子键,不属于离子化合物,不符合题意;
C项,NH4Cl中由 和Cl-构成,含有离子键,属于离子化合物,符合题意;
D项,CO2分子由C、O原子构成,不含离子键,不属于离子化合物,不符合题意。
2
6.(2022·四川雅安高一期末)下列关于离子化合物的说法正确的是
A.离子化合物一定能导电
B.离子化合物不一定易溶于水
C.能导电的物质一定是离子化合物
D.溶于水能导电的化合物一定是离子化合物
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
A项,离子化合物不一定能导电,如固体氯化钠不导电,离子化合物在熔融状态下能导电,错误;
B项,离子化合物不一定易溶于水,如碳酸钙是离子化合物,但碳酸钙难溶于水,正确;
C项,能导电的物质不一定是离子化合物,如金属铜能导电,错误;
D项,溶于水能导电的化合物不一定是离子化合物,如氯化氢不是离子化合物,氯化氢的水溶液能导电,错误。
题组三 电子式
7.(2022·成都高一期末)下列化合物的电子式书写正确的是
A. B.
C. D.
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
氯化钙中Cl-不能合并书写,电子式应该是 ,故A错误;
S2-所带电荷标注方式错误,且Na+不能合并,电子式应该是
,故B错误;
Mg2+不应带“[ ]”,电子式应该是 ,故C错误。
2
8.(2022·郑州校级高一月考)下列用电子式表示物质的形成过程正确的是
A.
B.
C.
D.
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
用电子式表示MgCl2的形成过程为 ,
故A错误;
MgF2形成过程的正确表示方法为 ,故C错误;
溴化钠为离子化合物,由溴离子与钠离子通过离子键结合,用电子式表示溴化钠的形成过程为 ,故D错误。
2
9.下列有关化学用语的表示方法正确的是
A.Na2S的电子式为
B.MgCl2的电子式:
C.已知NH5是离子化合物,则其电子式是
D.KCl的电子式为
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
A项,Na2S的电子式为 Na+,错误;
B项,MgCl2的电子式为 ,错误;
D项,KCl是由钾离子和氯离子构成的离子化合物,电子式为
,错误。
2
综合强化
10.1个M原子失去2个电子转移到2个Y原子中去,形成离子化合物Z。下列说法正确的是
A.Z可表示为MY2 B.Z可表示为M2Y
C.Z的电子式可表示为 D.M形成+1价阳离子
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
√
1个M原子失去2个电子,转移到2个Y原子中去,故离子化合物Z可表示为MY2,A正确、B错误;
Z的电子式不应把2个Y-合并,C错误;
M形成+2价阳离子,D错误。
11.氢化钠(NaH)是一种白色的离子化合物,其中钠元素化合价是+1价,氢化钠与水反应生成H2和NaOH。下列叙述不正确的是
A.NaH的电子式为
B.H-的电子层排布与氦原子的电子层排布相同
C.微粒半径:H-
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
氢化钠(NaH)是一种白色的离子化合物,NaH的电子式为 ,A正确;
NaH中氢元素的化合价为-1价,其离子的电子层排布与氦原子的电子层排布相同,B正确;
Li+和H-的电子层排布相同,但是Li+的核电荷数比H-大,所以微粒半径:H->Li+,C不正确;
NaH与H2O反应生成H2和NaOH,在这个反应中只有氢元素的化合价发生了变化,NaH中H的化合价升高,做还原剂,被氧化,水中H的化合价降低被还原,做氧化剂,D正确。
12.(2022·四川大竹中学高一月考)W、X、Y、Z为原子序数依次增大的短周期主族元素,W的最外层电子数是内层电子数的3倍,Y在短周期元素中原子半径最大,Z的最高正价与最低负价代数和为4,下列说法不正确的是
A.简单气态氢化物的稳定性:X>W>Z
B.Y与W、X、Z形成的化合物都含有离子键
C.W与Z形成的一种化合物是导致酸雨的污染物
D.W与Y可以形成阴、阳离子个数比为1∶1的离子化合物
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
W的最外层电子数是内层电子数的3倍,W位于第二周期,为氧元素;
Y在短周期元素中原子半径最大,Y是钠元素;W、X、Y、Z为原子序数依次增大的短周期主族元素,X是氟元素;Z的最高正价与最低负价代数和为4,Z的最高正价是+6价,为硫元素。非金属性越强,简单气态氢化物越稳定,则简单气态氢化物的稳定性:X>W>Z,A正确;
W与Z形成的一种化合物为SO2,是导致酸雨的污染物,C正确;
钠元素和氧元素可以形成Na2O或者Na2O2,但两者的阴、阳离子个数比都为1∶2,D错误。
13.(2022·河南辉县市第二高级中学高一月考)有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C在空气中燃烧时呈现黄色火焰,C的单质在高温下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,试根据以上叙述回答下列问题:
(1)请写出元素A的名称:_____,B的简单离子结构示意图:___________;
D的简单离子的电子式:_________。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
碳
(2)D元素位于周期表中第______周期第________族,C2B2的电子式:
___________________。
(3)用电子式表示化合物C2D的形成过程:_________________________。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
三
ⅥA
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
14.(2022·福建德化县校级高一月考)氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生两种碱性物质,其中一种为NH3·H2O,请回答下列问题:
(1)氮化钠(Na3N)和水反应的化学方程式为__________________________
___________。
2
Na3N+4H2O===3NaOH
根据氮化钠与水作用产生两种碱性物质,其中有一种为NH3·H2O可知,氮化钠(Na3N)和水反应的化学方程式为Na3N+4H2O===3NaOH+NH3·
H2O。
+NH3·H2O
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
(2)Na3N的电子式是__________________,该化合物由_____键形成。
(3)Na3N与盐酸反应生成__种盐,其电子式是_______________________。
离子
两
Na3N与盐酸反应时,N3-先与HCl电离出的H+结合成NH3,NH3再与HCl反应生成NH4Cl,Na+与Cl-形成NaCl,故可生成两种盐。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
(4)比较Na3N中两种微粒的半径:r(Na+)______(填“>”“=”或“<”)
r(N3-)。
<
Na+、N3-的电子层结构相同,核电荷数大者,离子半径较小,故离子半径:r(Na+)
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
15.下表是元素周期表中的一部分。回答下列问题:
2
(1)在这些元素中,金属性最强的元素是_____(填元素符号,下同);除稀有气体元素以外的元素中,原子半径最大的是_____,原子半径最小的是_____。
K
K
F
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
由元素在元素周期表中的
位置可知,①为N、②为
F、③为Na、④为Mg、
⑤为Al、⑥为Si、⑦为S、
⑧为Cl、⑨为Ar、⑩为K、
为Ca、 为Br。
同周期元素自左而右金属性逐渐减弱,同主族元素自上而下金属性逐渐增强,故上述元素中K元素的金属性最强;
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
同周期元素自左而右原子半径逐渐减小,同主族元素自上而下原子半径逐渐增大,故上述除稀有气体元素以外的元素中,K的原子半径最大,F的原子半径最小。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
(2)元素②和③形成的离子的电子层结构_____(填“相同”或“不相同”),两者形成的化合物是否是离子化合物?_____(填“是”或“否”),该化
合物的电子式为____________。
2
是
相同
元素②和③形成的离子分别为F-和Na+,都为10电子离子,它们的电子层结构相同,两者形成的化合物NaF由钠离子和氟离子构成,属于离子化合物,该化合物的电子式为 。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
(3)元素⑧的最高价氧化物对应的水化物的化学式为_______,名称为__________。
(4)元素 为_____,与元素⑦形成的化合物为_____,用电子式表示其形
成过程:_____________________。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
高氯酸
HClO4
Ca
CaS
返回
本课结束
