第一章 第三节 第1课时 氧化还原反应 (68张PPT)
文档属性
| 名称 | 第一章 第三节 第1课时 氧化还原反应 (68张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-17 22:01:29 | ||
图片预览










文档简介
(共68张PPT)
第一章 第三节
第1课时 氧化还原反应
1.能通过分析元素化合价的变化判断化学反应是否是氧化还原反应。
2.知道氧化还原反应的本质是电子转移,能分析简单氧化还原反应中电子转移
的方向和数目。
3.理清氧化还原反应与四种基本反应类型之间的关系。
核心素养
发展目标
一、多角度认识氧化还原反应
二、氧化还原反应中电子转移的表示方法
课时对点练
内容索引
随堂演练 知识落实
多角度认识氧化还原反应
一
1.从得失氧的角度认识氧化还原反应
【思考1】 请根据初中学过的氧化反应与还原反应的知识,分析以下反应,完成表格。
物质 反应物 发生的反应(氧化反应或还原反应)
得氧物质 ________ _________
失氧物质 ____________ _________
C、CO
CuO、Fe2O3
氧化反应
还原反应
结论:一种物质得到氧发生 反应,必然有一种物质失去氧发生
反应。也就是说,氧化反应和还原反应是在一个反应中同时发生的,这样的反应称为氧化还原反应。
氧化
还原
2.从元素化合价升降的角度认识氧化还原反应
【思考2】 (1)请标出思考1中两个反应中各物质所含元素的化合价,比较反应前后价态有无变化。
提示
(2)在这两个反应中,得氧物质:C和CO发生 反应时,相应元素化合价 。
失氧物质:CuO和Fe2O3发生 反应时,相应元素化合价 。
结论:凡是有元素 的反应都是氧化还原反应,物质所含元素化合价 的反应称为氧化反应,物质所含元素化合价______
的反应称为还原反应。
氧化
升高
还原
降低
化合价升降
升高
降低
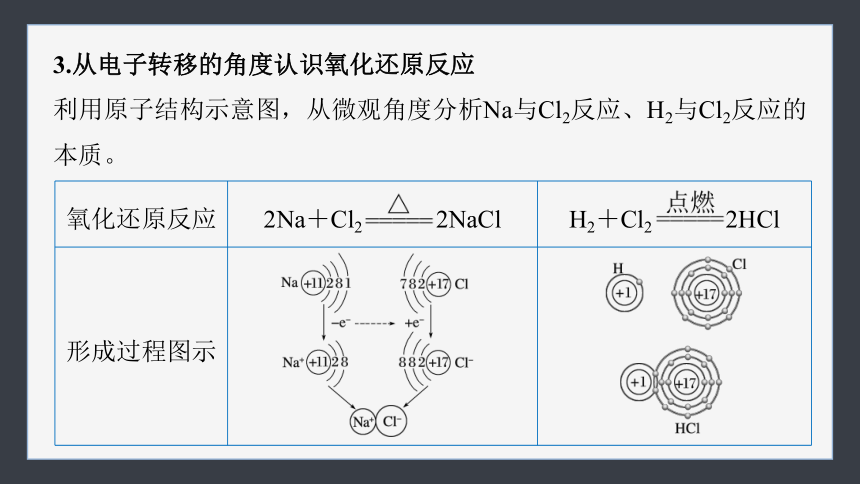
3.从电子转移的角度认识氧化还原反应
利用原子结构示意图,从微观角度分析Na与Cl2反应、H2与Cl2反应的本质。
氧化还原反应 2Na+Cl2 2NaCl H2+Cl2 2HCl
形成过程图示
变化过 程图示
微观分析或解释 NaCl是通过 电子形成的,由于氯原子得1个电子,氯元素化合价从0价降低到-1价,发生 反应;钠原子失去1个电子,钠元素化合价从0价升高到+1价,发生 反应 HCl是通过 形成的,由于氯原子得电子能力更强,共用电子对偏向氯原子,氯元素显 价,氢元素显___
价。氯元素化合价降低,发生
反应,氢元素化合价升高,发生 反应
得失
还原
氧化
共用电子对
负
正
还原
氧化
结论 氧化还原反应的本质是 ( 或________
),氧化还原反应的特征是___________________
电子转移
电子得失
共用电
子对偏移
有元素化合价的升降
【思考3】 从化合价变化角度判断以下反应是不是氧化还原反应,并思考氧化还原反应与四种基本反应类型的关系。
⑤Na2SO4+BaCl2===2NaCl+BaSO4↓
⑥H2O2+H2S===S↓+2H2O
(1)既是氧化还原反应又是化合反应的为_______(填序号,下同)。
(2)属于非氧化还原反应的为______。
(3)不属于四种基本反应类型的为______。
(4)属于置换反应的为______。
①②
⑤
⑥
③
归纳总结
氧化还原反应与四种基本反应类型之间的关系
应用体验
1.判断正误
(1)氧化还原反应中所有元素的化合价一定都发生变化
(2)一个反应中可以只有元素化合价升高,而无元素化合价降低
(3)氧化还原反应中被氧化的物质与被还原的物质可以是同一种物质
(4)有单质参加的反应一定是氧化还原反应
×
×
√
×
应用体验
2.完成下列填空:
(1)C+H2O(g) CO+H2中发生氧化反应的物质是______,被还原的元素是_____。
(2)2KClO3 2KCl+3O2↑中被氧化的元素是______,被还原的元素是_____。
(3)2H2S+SO2===3S+2H2O中被还原的物质是______,被氧化的物质是______,被氧化的元素是_____,被还原的元素是_____。
返回
C
H
O
Cl
SO2
H2S
S
S
氧化还原反应中电子转移的表示方法
二
1.双线桥法
表示反应前后 由反应物转化为生成物时电子转移的情况。
同一元素
(1)标价态:写出变价元素的化合价。
(2)连双线:连接反应前后同种元素的不同价态的原子。
(3)注得失:元素化合价升高的标出“失去”,元素化合价降低的标出“得到”。
(4)算数目:按照原子个数计算得失电子的数目。
2.单线桥法
(1)连单线:箭头由反应物中 电子元素的元素符号出发,箭尾指向反应物中 电子元素的元素符号。
(2) 标明“得到”或“失去”,只标明电子转移 。
例如,Fe2O3与H2的反应用单线桥法表示电子转移的数目如下:
失
得
不需要
数目
应用体验
标出变价元素的化合价,用双线桥法标出电子转移情况,其中②④同时用单线桥法标出电子转移情况。
答案
应用体验
答案
应用体验
③Cl2+2NaOH===NaCl+NaClO+H2O
答案
④2H2S+SO2===3S+2H2O
答案
练后反思
两种“线桥”的比较
(1)双线桥法的“线桥”从反应物到产物,单线桥法的“线桥”只连反应物。
(2)表示氧化还原反应中化合价升降、物质被氧化或被还原等时,用双线桥法较方便;表示电子转移的方向和数目时,用单线桥法较方便。
返回
随堂演练 知识落实
1
2
3
4
1.(2022·贵州黔东南高一检测)诗词是中华民族的文化瑰宝。下列诗词中不涉及氧化还原反应的是
A.爆竹声中一岁除 B.吹尽狂沙始到金
C.野火烧不尽 D.蜡炬成灰泪始干
√
随堂演练
爆竹声中一岁除,涉及元素化合价变化,属于氧化还原反应,A不合题意;
吹尽狂沙始到金,为物理法淘金,不涉及氧化还原反应,B合题意;
野火烧不尽、蜡炬成灰泪始干,存在燃烧现象,燃烧属于氧化还原反应,C、D不合题意。
2.下列反应属于氧化还原反应的是
A.SO3+H2O===H2SO4
B.NH4Cl NH3↑+HCl↑
C.Fe+2HCl===FeCl2+H2↑
D.NaOH+HNO3===NaNO3+H2O
√
随堂演练
1
2
3
4
随堂演练
1
2
3
4
反应SO3+H2O===H2SO4中,各元素化合价不变,不属于氧化还原反应,故A不选;
反应NH4Cl NH3↑+HCl↑中,各元素化合价不变,不属于氧化还原反应,故B不选;
反应Fe+2HCl===FeCl2+H2↑中,Fe元素化合价由0价升高到+2价、氢元素化合价由+1价降低到0价,有电子转移,属于氧化还原反应,故C选;
反应NaOH+HNO3===NaNO3+H2O中,各元素化合价不变,不属于氧化还原反应,故D不选。
3.氧化还原反应与四种基本反应类型的关系如图所示,下列化学反应属于阴影区域的是
随堂演练
1
2
3
4
√
阴影区域的反应必须属于氧化还原反应,
且不属于化合、分解、置换反应。A项,
该反应既属于分解反应,又属于氧化还
原反应;
B项,该反应属于分解反应,不属于氧化还原反应;
C项,该反应既属于化合反应,又属于氧化还原反应;
D项,该反应属于氧化还原反应,但不属于化合、分解、置换反应中的任意一种,故属于阴影区域。
随堂演练
1
2
3
4
4.完成下列填空。
(1)3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
①被氧化的元素是______(填元素符号,下同),被还原的元素是_____。
②发生氧化反应的物质是______(填化学式,下同),发生还原反应的物质是_______。
③用单线桥表示反应电子得失的方向和数目:_____________________
__________________________。
随堂演练
1
2
3
4
Cu
N
Cu
HNO3
(稀)===
3Cu(NO3)2+2NO↑+4H2O
①碳元素被_______,硫元素被_______,氮元素被_______,氧元素既没被氧化也没被还原。
②发生氧化反应的物质是_____,发生还原反应的物质是___________。
随堂演练
1
2
3
4
氧化
还原
还原
返回
C
S和KNO3
课时对点练
1
2
3
4
5
6
7
8
9
题组一 氧化还原反应的概念及判断
1.(2022·福建仙游一中高一期中)成语是中华民族灿烂文化中的瑰宝,许多成语中蕴含着丰富的化学原理,下列成语中涉及氧化还原反应的是
A.聚沙成塔 B.刀耕火种
C.滴水成冰 D.水乳交融
√
10
11
12
13
14
15
对点训练
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
聚沙成塔是将沙子聚集在一起,没有新物质生成,属于物理变化,A不符合题意;
刀耕火种,包含物质的燃烧,涉及氧化还原反应,B符合题意;
滴水成冰是物质状态的改变,没有新物质生成,属于物理变化,C不符合题意;
水乳交融,没有新物质生成,属于物理变化,D不符合题意。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2.下列说法正确的是
A.有电子转移是氧化还原反应的实质,有元素化合价的变化是氧化还原
反应的外在表现
B.一种物质被氧化,必然有另一种物质被还原
C.被氧化的物质得到电子或电子对偏向,被还原的物质失去电子或电子
对偏离
D.氧化反应就是得到电子或电子对偏向的反应,还原反应就是失去电子
或电子对偏离的反应
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
氧化还原反应的发生,是发生电子转移的结果,有电子转移,元素的化合价就发生了变化;被氧化和被还原的物质可能是同一种物质;
一种物质得到电子或电子对偏向,这种物质就被还原或者说发生了还原反应,其中某元素的化合价就会降低;
一种物质失去电子或电子对偏离,这种物质就被氧化或者说发生了氧化反应,其中某元素的化合价就会升高。
2
3.(2023·济南质检)下列各反应中,氧化反应与还原反应在同种元素中进行的是
A.Cl2+2NaOH===NaCl+NaClO+H2O
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
A项,一部分氯元素的化合价由0价升高到+1价,被氧化,同时还有一部分氯元素的化合价由0价降低到-1价,被还原,氧化反应与还原反应均在氯元素中进行;
B项,氯元素化合价由+5价降低到-1价,被还原,氧元素化合价由-2价升高到0价,被氧化,氧化反应与还原反应未在同种元素中进行;
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
C项,碳元素化合价由+2价升高到+4价,被氧化,氧元素化合价由0价降低到-2价,被还原,氧化反应与还原反应未在同种元素中进行;
D项,氢元素化合价由+1价降低到0价,被还原,氧元素化合价由-2价升高到0价,被氧化,氧化反应与还原反应未在同种元素中进行。
4.(2022·金华高一期中)在反应3SiO2+6C+2N2 Si3N4+6CO中,氧化反应得到的产物是
A.N2 B.Si3N4
C.CO D.Si3N4和CO
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
反应3SiO2+6C+2N2 Si3N4+6CO中,C元素化合价升高,发生氧化反应生成CO。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
题组二 氧化还原反应中电子转移的表示方法
5.下列氧化还原反应中电子转移方向和数目表示错误的是
A. B.
C. D.
2
√
6.(2022·宁波高一期中)下列化学反应中电子转移的表示方法正确的是
A. B.
C. D.
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
部分氯元素化合价由0价升高为
+1价,部分氯元素化合价从0价
降低为-1价,该反应中1个Cl2转
化为Ca(ClO)2,失去2×e-,1个Cl2转化为CaCl2,得到2×e-,A错误;
Cu元素化合价由0价升高为+2价,S元素化合价由+6价降低为+4价,箭头应指向浓硫酸中的S,C错误;
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
NO中N元素化合价由+2价降低为0价,NH3中N元素化合价从-3价升高为0价,该反应中电子由NH3中的N转移到NO中的N,共转移12e-,D错误。
题组三 氧化还原反应与四种基本反应类型的关系
7.(2022·沈阳高一检测)下列反应不属于四种基本反应类型,但属于氧化还原反应的是
A.Fe+CuSO4===FeSO4+Cu
B.2H2O2 2H2O+O2↑
C.AgNO3+NaCl===AgCl↓+NaNO3
D.2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
Fe+CuSO4===FeSO4+Cu属于置换反应,Fe由0价变成+2价,Cu由+2
价变成0价,有化合价的改变,也属于氧化还原反应,A不符合题意;
2H2O2 2H2O+O2↑属于分解反应,O由-1价变成-2价和0价,
有化合价的改变,也属于氧化还原反应,B不符合题意;
AgNO3+NaCl===AgCl↓+NaNO3属于复分解反应,没有化合价的改变,不属于氧化还原反应,C不符合题意;
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O不属于四种基本反应类型,Mn由+7价变成+2价,Cl由-1价变成0价,有化合价的改变,属于氧化还原反应,D符合题意。
2
8.(2022·山西芮城中学高一月考)“4种基本类型的反应与氧化还原反应的关系”如图所示,用Ⅰ~Ⅳ阴影部分表示反应所属的区域,下列说法正确的是
A.粗硅提纯:Si(粗)+3HCl SiHCl3+H2,所属
区域可能是Ⅰ或Ⅱ
B.金属钠在空气中燃烧:2Na+O2 Na2O2,所
属的区域一定是Ⅲ
C.实验室制取氯气:4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O,所属的区
域可能是Ⅲ
D.土法制碱:Na2CO3+Ca(OH)2===2NaOH+CaCO3↓,所属的区域一定是Ⅳ
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
粗硅提纯:Si(粗)+3HCl SiHCl3+H2,该
反应属于置换反应,属于Ⅲ,A错误;
金属钠在空气中燃烧:2Na+O2 Na2O2,属
于化合反应和氧化还原反应,所属的区域应该为Ⅰ或Ⅱ,B错误;
实验室制取氯气:4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O,属于氧化还原反应,但不是置换反应,不可能属于Ⅲ,C错误;
土法制碱:Na2CO3+Ca(OH)2===2NaOH+CaCO3↓,属于复分解反应,一定不是氧化还原反应,所属的区域一定是Ⅳ,D正确。
2
9.(2022·安庆高一检测)2021年6月17日,搭载神舟十二号载人飞船的长征二号F遥十二运载火箭,在酒泉卫星发射中心点火发射,火箭的第一、二级发动机中使用的燃料是偏二甲肼(C2H8N2中氮元素的化合价为-2价)和四氧化二氮(N2O4),燃烧时发生反应的化学方程式为C2H8N2+2N2O4
===2CO2↑+3N2↑+4H2O。下列有关该反应的说法正确的是
A.该反应是分解反应 B.该反应是非氧化还原反应
C.N2O4发生还原反应 D.反应中碳元素的化合价降低
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
由化学方程式可知,该反应的反应物为偏二甲肼和四氧化二氮,不是分解反应,故A错误;
反应中有元素化合价变化,属于氧化还原反应,故B错误;
四氧化二氮中氮元素的化合价降低,被还原,故C正确;
偏二甲肼中碳元素的化合价升高,故D错误。
2
综合强化
10.化学实验中若使某步中的有害产物作为另一步的反应物,形成一个循环,则可不再向环境排放该种有害物质。在如图所示有编号的反应中,属于氧化还原反应的有
A.3个 B.4个
C.5个 D.6个
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
Na2Cr2O7中Cr显+6价,CrCl3中
Cr显+3价,Cr的化合价降低,
反应①属于氧化还原反应;
CrCl3和Cr(OH)3中Cr的化合价都
显+3价,化合价没有发生变化,反应②不属于氧化还原反应;
Cr(OH)3和NaCrO2中Cr的化合价都显+3价,没有化合价的改变,反应③不属于氧化还原反应;
2
综合强化
1
3
4
5
6
7
8
9
10
11
12
13
14
15
CrCl3中Cr显+3价,Na2CrO4中
Cr显+6价,化合价发生改变,
反应④属于氧化还原反应;
Na2Cr2O7和Na2CrO4中Cr的价态
都是+6价,没有化合价发生变化,反应⑤不属于氧化还原反应;
Na2CrO4中Cr显+6价,NaCrO2中Cr显+3价,化合价降低,反应⑥属于氧化还原反应,因此属于氧化还原反应的是①④⑥,故选项A正确。
2
综合强化
11.我国近代炼丹家、医学家葛洪所著《抱朴子》一书中记载有“丹砂烧之成水银,积变又还成丹砂”。这句话所涉及的反应有:①HgS+O2
Hg+SO2;②Hg+S===HgS。下列有关说法错误的是
A.反应①②均为氧化还原反应
B.反应①中Hg、O两种元素被还原
C.反应①中每生成1个SO2分子共转移4个电子
D.反应②中Hg元素被氧化、S元素被还原
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
①中O2中O元素的化合价降低,HgS中Hg元素的化合价降低,HgS中S元素的化合价升高,因此①属于氧化还原反应,②中Hg的化合价升高,S的化合价降低,②属于氧化还原反应,故A、B说法正确;
反应①中HgS中Hg的化合价由+2价→0价,化合价降低2价,S的化合价由-2价→+4价,化合价升高6价,O2中O元素化合价由0价→-2价,降低4价,因此每生成1个SO2分子转移6个电子,故C说法错误;
反应②中Hg的化合价由0价→+2价,化合价升高,被氧化,S的化合价由0价→-2价,化合价降低,被还原,故D说法正确。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
12.歌曲《青花瓷》中唱到“帘外芭蕉惹骤雨,门环惹铜绿”,其中“铜绿”的化学成分是碱式碳酸铜。铜在潮湿的空气中生锈的化学反应:2Cu+O2+CO2+H2O===Cu2(OH)2CO3。下列有关该反应说法不正确的是
A.该反应是氧化还原反应,发生化合价变化的有两种元素
B.O2得电子,发生的是还原反应
C.铜的化合价升高,被氧化
D.碱式碳酸铜中铜元素的化合价是+1价
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
在该反应中,铜元素的化合价从0价升高到+2价,氧元素的化合价从0价降低到-2价,碳元素和氢元素的化合价没有发生变化,发生化合价变化的有两种元素,故A正确;
氧气中氧元素的化合价从0价降低到-2价,得到电子,发生还原反应,故B正确;
铜的化合价升高,被氧化,故C正确;
碱式碳酸铜中铜元素的化合价为+2价,故D错误。
13.化学反应按照不同的分类方法,可以分为化合反应、分解反应、置换反应、复分解反应,或者分为氧化还原反应和非氧化还原反应。现有下列反应:
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
⑨2Al+2NaOH+6H2O===2Na[Al(OH)4]+3H2↑ ⑩SO2+H2O===H2SO3
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
(1)其中属于化合反应的有_________(填序号,下同),属于置换反应的有______。
①④⑩
⑤⑦
⑨2Al+2NaOH+6H2O===2Na[Al(OH)4]+3H2↑ ⑩SO2+H2O===H2SO3
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
(2)在化学反应前后元素的化合价没有发生变化的是_______。
(3)上述反应中,既是分解反应又是氧化还原反应的是____。
(4)上述反应中,既是溶液中的离子反应,又是氧化还原反应的是______。
②⑩
⑧
③⑨
⑨2Al+2NaOH+6H2O===2Na[Al(OH)4]+3H2↑ ⑩SO2+H2O===H2SO3
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
复分解反应一定不是氧化还原反应;置换反应一定是氧化还原反应;化合反应和分解反应中若元素化合价有变化,则是氧化还原反应,若元素化合价无变化,则不是氧化还原反应。离子反应是否属于氧化还原反应也要根据元素化合价在反应前后是否发生变化来判断。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
请回答下列问题:
(1)上述反应中,______元素的化合价升高,则该元素的原子_______(填“得到”或“失去”)电子;而_____元素的化合价降低,该元素发生______反应。
2
Al
失去
N
还原
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
(2)用双线桥法表示反应中电子转移的方向和数目:
_______________________________________。
在题述反应中铝元素由0价变为+3价,化合价升高,失去电子,被氧化;氮元素由+5价变为0价,化合价降低,得到电子,被还原。
15.二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯代物。下列两种方法可制备ClO2:
方法一:2NaClO3+4HCl===2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4===2ClO2↑+O2↑+Na2SO4+2H2O
(1)方法一的离子方程式:________________________________________;
其中被氧化的氯元素与被还原的氯元素的个数比为______。
(2)方法二中被氧化的物质是_______;发生还原反应的物质是_________。若反应中消耗2个硫酸分子,则反应中转移____个电子。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
1∶1
H2O2
NaClO3
4
返回
本课结束
第一章 第三节
第1课时 氧化还原反应
1.能通过分析元素化合价的变化判断化学反应是否是氧化还原反应。
2.知道氧化还原反应的本质是电子转移,能分析简单氧化还原反应中电子转移
的方向和数目。
3.理清氧化还原反应与四种基本反应类型之间的关系。
核心素养
发展目标
一、多角度认识氧化还原反应
二、氧化还原反应中电子转移的表示方法
课时对点练
内容索引
随堂演练 知识落实
多角度认识氧化还原反应
一
1.从得失氧的角度认识氧化还原反应
【思考1】 请根据初中学过的氧化反应与还原反应的知识,分析以下反应,完成表格。
物质 反应物 发生的反应(氧化反应或还原反应)
得氧物质 ________ _________
失氧物质 ____________ _________
C、CO
CuO、Fe2O3
氧化反应
还原反应
结论:一种物质得到氧发生 反应,必然有一种物质失去氧发生
反应。也就是说,氧化反应和还原反应是在一个反应中同时发生的,这样的反应称为氧化还原反应。
氧化
还原
2.从元素化合价升降的角度认识氧化还原反应
【思考2】 (1)请标出思考1中两个反应中各物质所含元素的化合价,比较反应前后价态有无变化。
提示
(2)在这两个反应中,得氧物质:C和CO发生 反应时,相应元素化合价 。
失氧物质:CuO和Fe2O3发生 反应时,相应元素化合价 。
结论:凡是有元素 的反应都是氧化还原反应,物质所含元素化合价 的反应称为氧化反应,物质所含元素化合价______
的反应称为还原反应。
氧化
升高
还原
降低
化合价升降
升高
降低
3.从电子转移的角度认识氧化还原反应
利用原子结构示意图,从微观角度分析Na与Cl2反应、H2与Cl2反应的本质。
氧化还原反应 2Na+Cl2 2NaCl H2+Cl2 2HCl
形成过程图示
变化过 程图示
微观分析或解释 NaCl是通过 电子形成的,由于氯原子得1个电子,氯元素化合价从0价降低到-1价,发生 反应;钠原子失去1个电子,钠元素化合价从0价升高到+1价,发生 反应 HCl是通过 形成的,由于氯原子得电子能力更强,共用电子对偏向氯原子,氯元素显 价,氢元素显___
价。氯元素化合价降低,发生
反应,氢元素化合价升高,发生 反应
得失
还原
氧化
共用电子对
负
正
还原
氧化
结论 氧化还原反应的本质是 ( 或________
),氧化还原反应的特征是___________________
电子转移
电子得失
共用电
子对偏移
有元素化合价的升降
【思考3】 从化合价变化角度判断以下反应是不是氧化还原反应,并思考氧化还原反应与四种基本反应类型的关系。
⑤Na2SO4+BaCl2===2NaCl+BaSO4↓
⑥H2O2+H2S===S↓+2H2O
(1)既是氧化还原反应又是化合反应的为_______(填序号,下同)。
(2)属于非氧化还原反应的为______。
(3)不属于四种基本反应类型的为______。
(4)属于置换反应的为______。
①②
⑤
⑥
③
归纳总结
氧化还原反应与四种基本反应类型之间的关系
应用体验
1.判断正误
(1)氧化还原反应中所有元素的化合价一定都发生变化
(2)一个反应中可以只有元素化合价升高,而无元素化合价降低
(3)氧化还原反应中被氧化的物质与被还原的物质可以是同一种物质
(4)有单质参加的反应一定是氧化还原反应
×
×
√
×
应用体验
2.完成下列填空:
(1)C+H2O(g) CO+H2中发生氧化反应的物质是______,被还原的元素是_____。
(2)2KClO3 2KCl+3O2↑中被氧化的元素是______,被还原的元素是_____。
(3)2H2S+SO2===3S+2H2O中被还原的物质是______,被氧化的物质是______,被氧化的元素是_____,被还原的元素是_____。
返回
C
H
O
Cl
SO2
H2S
S
S
氧化还原反应中电子转移的表示方法
二
1.双线桥法
表示反应前后 由反应物转化为生成物时电子转移的情况。
同一元素
(1)标价态:写出变价元素的化合价。
(2)连双线:连接反应前后同种元素的不同价态的原子。
(3)注得失:元素化合价升高的标出“失去”,元素化合价降低的标出“得到”。
(4)算数目:按照原子个数计算得失电子的数目。
2.单线桥法
(1)连单线:箭头由反应物中 电子元素的元素符号出发,箭尾指向反应物中 电子元素的元素符号。
(2) 标明“得到”或“失去”,只标明电子转移 。
例如,Fe2O3与H2的反应用单线桥法表示电子转移的数目如下:
失
得
不需要
数目
应用体验
标出变价元素的化合价,用双线桥法标出电子转移情况,其中②④同时用单线桥法标出电子转移情况。
答案
应用体验
答案
应用体验
③Cl2+2NaOH===NaCl+NaClO+H2O
答案
④2H2S+SO2===3S+2H2O
答案
练后反思
两种“线桥”的比较
(1)双线桥法的“线桥”从反应物到产物,单线桥法的“线桥”只连反应物。
(2)表示氧化还原反应中化合价升降、物质被氧化或被还原等时,用双线桥法较方便;表示电子转移的方向和数目时,用单线桥法较方便。
返回
随堂演练 知识落实
1
2
3
4
1.(2022·贵州黔东南高一检测)诗词是中华民族的文化瑰宝。下列诗词中不涉及氧化还原反应的是
A.爆竹声中一岁除 B.吹尽狂沙始到金
C.野火烧不尽 D.蜡炬成灰泪始干
√
随堂演练
爆竹声中一岁除,涉及元素化合价变化,属于氧化还原反应,A不合题意;
吹尽狂沙始到金,为物理法淘金,不涉及氧化还原反应,B合题意;
野火烧不尽、蜡炬成灰泪始干,存在燃烧现象,燃烧属于氧化还原反应,C、D不合题意。
2.下列反应属于氧化还原反应的是
A.SO3+H2O===H2SO4
B.NH4Cl NH3↑+HCl↑
C.Fe+2HCl===FeCl2+H2↑
D.NaOH+HNO3===NaNO3+H2O
√
随堂演练
1
2
3
4
随堂演练
1
2
3
4
反应SO3+H2O===H2SO4中,各元素化合价不变,不属于氧化还原反应,故A不选;
反应NH4Cl NH3↑+HCl↑中,各元素化合价不变,不属于氧化还原反应,故B不选;
反应Fe+2HCl===FeCl2+H2↑中,Fe元素化合价由0价升高到+2价、氢元素化合价由+1价降低到0价,有电子转移,属于氧化还原反应,故C选;
反应NaOH+HNO3===NaNO3+H2O中,各元素化合价不变,不属于氧化还原反应,故D不选。
3.氧化还原反应与四种基本反应类型的关系如图所示,下列化学反应属于阴影区域的是
随堂演练
1
2
3
4
√
阴影区域的反应必须属于氧化还原反应,
且不属于化合、分解、置换反应。A项,
该反应既属于分解反应,又属于氧化还
原反应;
B项,该反应属于分解反应,不属于氧化还原反应;
C项,该反应既属于化合反应,又属于氧化还原反应;
D项,该反应属于氧化还原反应,但不属于化合、分解、置换反应中的任意一种,故属于阴影区域。
随堂演练
1
2
3
4
4.完成下列填空。
(1)3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
①被氧化的元素是______(填元素符号,下同),被还原的元素是_____。
②发生氧化反应的物质是______(填化学式,下同),发生还原反应的物质是_______。
③用单线桥表示反应电子得失的方向和数目:_____________________
__________________________。
随堂演练
1
2
3
4
Cu
N
Cu
HNO3
(稀)===
3Cu(NO3)2+2NO↑+4H2O
①碳元素被_______,硫元素被_______,氮元素被_______,氧元素既没被氧化也没被还原。
②发生氧化反应的物质是_____,发生还原反应的物质是___________。
随堂演练
1
2
3
4
氧化
还原
还原
返回
C
S和KNO3
课时对点练
1
2
3
4
5
6
7
8
9
题组一 氧化还原反应的概念及判断
1.(2022·福建仙游一中高一期中)成语是中华民族灿烂文化中的瑰宝,许多成语中蕴含着丰富的化学原理,下列成语中涉及氧化还原反应的是
A.聚沙成塔 B.刀耕火种
C.滴水成冰 D.水乳交融
√
10
11
12
13
14
15
对点训练
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
聚沙成塔是将沙子聚集在一起,没有新物质生成,属于物理变化,A不符合题意;
刀耕火种,包含物质的燃烧,涉及氧化还原反应,B符合题意;
滴水成冰是物质状态的改变,没有新物质生成,属于物理变化,C不符合题意;
水乳交融,没有新物质生成,属于物理变化,D不符合题意。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2.下列说法正确的是
A.有电子转移是氧化还原反应的实质,有元素化合价的变化是氧化还原
反应的外在表现
B.一种物质被氧化,必然有另一种物质被还原
C.被氧化的物质得到电子或电子对偏向,被还原的物质失去电子或电子
对偏离
D.氧化反应就是得到电子或电子对偏向的反应,还原反应就是失去电子
或电子对偏离的反应
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
氧化还原反应的发生,是发生电子转移的结果,有电子转移,元素的化合价就发生了变化;被氧化和被还原的物质可能是同一种物质;
一种物质得到电子或电子对偏向,这种物质就被还原或者说发生了还原反应,其中某元素的化合价就会降低;
一种物质失去电子或电子对偏离,这种物质就被氧化或者说发生了氧化反应,其中某元素的化合价就会升高。
2
3.(2023·济南质检)下列各反应中,氧化反应与还原反应在同种元素中进行的是
A.Cl2+2NaOH===NaCl+NaClO+H2O
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
A项,一部分氯元素的化合价由0价升高到+1价,被氧化,同时还有一部分氯元素的化合价由0价降低到-1价,被还原,氧化反应与还原反应均在氯元素中进行;
B项,氯元素化合价由+5价降低到-1价,被还原,氧元素化合价由-2价升高到0价,被氧化,氧化反应与还原反应未在同种元素中进行;
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
C项,碳元素化合价由+2价升高到+4价,被氧化,氧元素化合价由0价降低到-2价,被还原,氧化反应与还原反应未在同种元素中进行;
D项,氢元素化合价由+1价降低到0价,被还原,氧元素化合价由-2价升高到0价,被氧化,氧化反应与还原反应未在同种元素中进行。
4.(2022·金华高一期中)在反应3SiO2+6C+2N2 Si3N4+6CO中,氧化反应得到的产物是
A.N2 B.Si3N4
C.CO D.Si3N4和CO
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
反应3SiO2+6C+2N2 Si3N4+6CO中,C元素化合价升高,发生氧化反应生成CO。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
题组二 氧化还原反应中电子转移的表示方法
5.下列氧化还原反应中电子转移方向和数目表示错误的是
A. B.
C. D.
2
√
6.(2022·宁波高一期中)下列化学反应中电子转移的表示方法正确的是
A. B.
C. D.
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
部分氯元素化合价由0价升高为
+1价,部分氯元素化合价从0价
降低为-1价,该反应中1个Cl2转
化为Ca(ClO)2,失去2×e-,1个Cl2转化为CaCl2,得到2×e-,A错误;
Cu元素化合价由0价升高为+2价,S元素化合价由+6价降低为+4价,箭头应指向浓硫酸中的S,C错误;
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
NO中N元素化合价由+2价降低为0价,NH3中N元素化合价从-3价升高为0价,该反应中电子由NH3中的N转移到NO中的N,共转移12e-,D错误。
题组三 氧化还原反应与四种基本反应类型的关系
7.(2022·沈阳高一检测)下列反应不属于四种基本反应类型,但属于氧化还原反应的是
A.Fe+CuSO4===FeSO4+Cu
B.2H2O2 2H2O+O2↑
C.AgNO3+NaCl===AgCl↓+NaNO3
D.2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
Fe+CuSO4===FeSO4+Cu属于置换反应,Fe由0价变成+2价,Cu由+2
价变成0价,有化合价的改变,也属于氧化还原反应,A不符合题意;
2H2O2 2H2O+O2↑属于分解反应,O由-1价变成-2价和0价,
有化合价的改变,也属于氧化还原反应,B不符合题意;
AgNO3+NaCl===AgCl↓+NaNO3属于复分解反应,没有化合价的改变,不属于氧化还原反应,C不符合题意;
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O不属于四种基本反应类型,Mn由+7价变成+2价,Cl由-1价变成0价,有化合价的改变,属于氧化还原反应,D符合题意。
2
8.(2022·山西芮城中学高一月考)“4种基本类型的反应与氧化还原反应的关系”如图所示,用Ⅰ~Ⅳ阴影部分表示反应所属的区域,下列说法正确的是
A.粗硅提纯:Si(粗)+3HCl SiHCl3+H2,所属
区域可能是Ⅰ或Ⅱ
B.金属钠在空气中燃烧:2Na+O2 Na2O2,所
属的区域一定是Ⅲ
C.实验室制取氯气:4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O,所属的区
域可能是Ⅲ
D.土法制碱:Na2CO3+Ca(OH)2===2NaOH+CaCO3↓,所属的区域一定是Ⅳ
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
2
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
对点训练
粗硅提纯:Si(粗)+3HCl SiHCl3+H2,该
反应属于置换反应,属于Ⅲ,A错误;
金属钠在空气中燃烧:2Na+O2 Na2O2,属
于化合反应和氧化还原反应,所属的区域应该为Ⅰ或Ⅱ,B错误;
实验室制取氯气:4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O,属于氧化还原反应,但不是置换反应,不可能属于Ⅲ,C错误;
土法制碱:Na2CO3+Ca(OH)2===2NaOH+CaCO3↓,属于复分解反应,一定不是氧化还原反应,所属的区域一定是Ⅳ,D正确。
2
9.(2022·安庆高一检测)2021年6月17日,搭载神舟十二号载人飞船的长征二号F遥十二运载火箭,在酒泉卫星发射中心点火发射,火箭的第一、二级发动机中使用的燃料是偏二甲肼(C2H8N2中氮元素的化合价为-2价)和四氧化二氮(N2O4),燃烧时发生反应的化学方程式为C2H8N2+2N2O4
===2CO2↑+3N2↑+4H2O。下列有关该反应的说法正确的是
A.该反应是分解反应 B.该反应是非氧化还原反应
C.N2O4发生还原反应 D.反应中碳元素的化合价降低
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
由化学方程式可知,该反应的反应物为偏二甲肼和四氧化二氮,不是分解反应,故A错误;
反应中有元素化合价变化,属于氧化还原反应,故B错误;
四氧化二氮中氮元素的化合价降低,被还原,故C正确;
偏二甲肼中碳元素的化合价升高,故D错误。
2
综合强化
10.化学实验中若使某步中的有害产物作为另一步的反应物,形成一个循环,则可不再向环境排放该种有害物质。在如图所示有编号的反应中,属于氧化还原反应的有
A.3个 B.4个
C.5个 D.6个
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
Na2Cr2O7中Cr显+6价,CrCl3中
Cr显+3价,Cr的化合价降低,
反应①属于氧化还原反应;
CrCl3和Cr(OH)3中Cr的化合价都
显+3价,化合价没有发生变化,反应②不属于氧化还原反应;
Cr(OH)3和NaCrO2中Cr的化合价都显+3价,没有化合价的改变,反应③不属于氧化还原反应;
2
综合强化
1
3
4
5
6
7
8
9
10
11
12
13
14
15
CrCl3中Cr显+3价,Na2CrO4中
Cr显+6价,化合价发生改变,
反应④属于氧化还原反应;
Na2Cr2O7和Na2CrO4中Cr的价态
都是+6价,没有化合价发生变化,反应⑤不属于氧化还原反应;
Na2CrO4中Cr显+6价,NaCrO2中Cr显+3价,化合价降低,反应⑥属于氧化还原反应,因此属于氧化还原反应的是①④⑥,故选项A正确。
2
综合强化
11.我国近代炼丹家、医学家葛洪所著《抱朴子》一书中记载有“丹砂烧之成水银,积变又还成丹砂”。这句话所涉及的反应有:①HgS+O2
Hg+SO2;②Hg+S===HgS。下列有关说法错误的是
A.反应①②均为氧化还原反应
B.反应①中Hg、O两种元素被还原
C.反应①中每生成1个SO2分子共转移4个电子
D.反应②中Hg元素被氧化、S元素被还原
√
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
①中O2中O元素的化合价降低,HgS中Hg元素的化合价降低,HgS中S元素的化合价升高,因此①属于氧化还原反应,②中Hg的化合价升高,S的化合价降低,②属于氧化还原反应,故A、B说法正确;
反应①中HgS中Hg的化合价由+2价→0价,化合价降低2价,S的化合价由-2价→+4价,化合价升高6价,O2中O元素化合价由0价→-2价,降低4价,因此每生成1个SO2分子转移6个电子,故C说法错误;
反应②中Hg的化合价由0价→+2价,化合价升高,被氧化,S的化合价由0价→-2价,化合价降低,被还原,故D说法正确。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
2
综合强化
12.歌曲《青花瓷》中唱到“帘外芭蕉惹骤雨,门环惹铜绿”,其中“铜绿”的化学成分是碱式碳酸铜。铜在潮湿的空气中生锈的化学反应:2Cu+O2+CO2+H2O===Cu2(OH)2CO3。下列有关该反应说法不正确的是
A.该反应是氧化还原反应,发生化合价变化的有两种元素
B.O2得电子,发生的是还原反应
C.铜的化合价升高,被氧化
D.碱式碳酸铜中铜元素的化合价是+1价
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
√
2
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
在该反应中,铜元素的化合价从0价升高到+2价,氧元素的化合价从0价降低到-2价,碳元素和氢元素的化合价没有发生变化,发生化合价变化的有两种元素,故A正确;
氧气中氧元素的化合价从0价降低到-2价,得到电子,发生还原反应,故B正确;
铜的化合价升高,被氧化,故C正确;
碱式碳酸铜中铜元素的化合价为+2价,故D错误。
13.化学反应按照不同的分类方法,可以分为化合反应、分解反应、置换反应、复分解反应,或者分为氧化还原反应和非氧化还原反应。现有下列反应:
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
⑨2Al+2NaOH+6H2O===2Na[Al(OH)4]+3H2↑ ⑩SO2+H2O===H2SO3
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
(1)其中属于化合反应的有_________(填序号,下同),属于置换反应的有______。
①④⑩
⑤⑦
⑨2Al+2NaOH+6H2O===2Na[Al(OH)4]+3H2↑ ⑩SO2+H2O===H2SO3
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
(2)在化学反应前后元素的化合价没有发生变化的是_______。
(3)上述反应中,既是分解反应又是氧化还原反应的是____。
(4)上述反应中,既是溶液中的离子反应,又是氧化还原反应的是______。
②⑩
⑧
③⑨
⑨2Al+2NaOH+6H2O===2Na[Al(OH)4]+3H2↑ ⑩SO2+H2O===H2SO3
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
复分解反应一定不是氧化还原反应;置换反应一定是氧化还原反应;化合反应和分解反应中若元素化合价有变化,则是氧化还原反应,若元素化合价无变化,则不是氧化还原反应。离子反应是否属于氧化还原反应也要根据元素化合价在反应前后是否发生变化来判断。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
请回答下列问题:
(1)上述反应中,______元素的化合价升高,则该元素的原子_______(填“得到”或“失去”)电子;而_____元素的化合价降低,该元素发生______反应。
2
Al
失去
N
还原
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
(2)用双线桥法表示反应中电子转移的方向和数目:
_______________________________________。
在题述反应中铝元素由0价变为+3价,化合价升高,失去电子,被氧化;氮元素由+5价变为0价,化合价降低,得到电子,被还原。
15.二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯代物。下列两种方法可制备ClO2:
方法一:2NaClO3+4HCl===2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4===2ClO2↑+O2↑+Na2SO4+2H2O
(1)方法一的离子方程式:________________________________________;
其中被氧化的氯元素与被还原的氯元素的个数比为______。
(2)方法二中被氧化的物质是_______;发生还原反应的物质是_________。若反应中消耗2个硫酸分子,则反应中转移____个电子。
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
1∶1
H2O2
NaClO3
4
返回
本课结束
