化学人教版(2019)选择性必修1 4.1.2化学电源 课件(共62张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 4.1.2化学电源 课件(共62张ppt) |
|
|
| 格式 | pptx | ||
| 文件大小 | 18.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-18 00:00:00 | ||
图片预览









文档简介
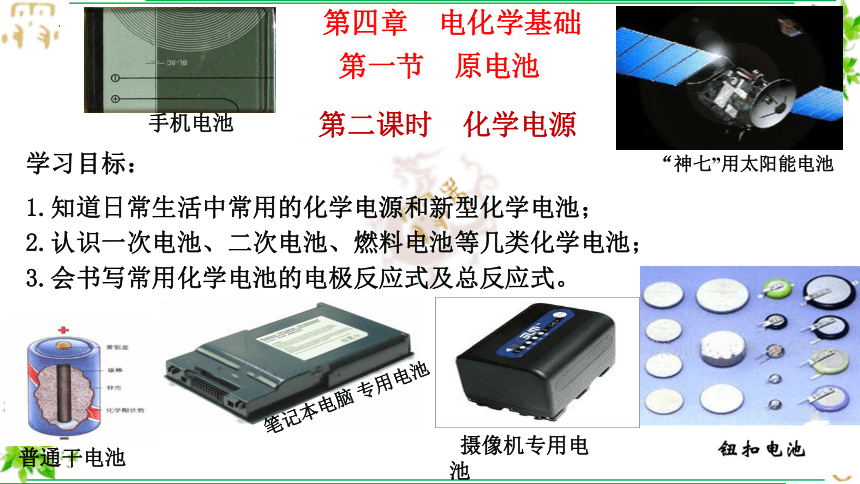
(共62张PPT)
1.知道日常生活中常用的化学电源和新型化学电池;
2.认识一次电池、二次电池、燃料电池等几类化学电池;
3.会书写常用化学电池的电极反应式及总反应式。
学习目标:
普通干电池
笔记本电脑 专用电池
摄像机专用电池
“神七”用太阳能电池
手机电池
第四章 电化学基础
第一节 原电池
第二课时 化学电源
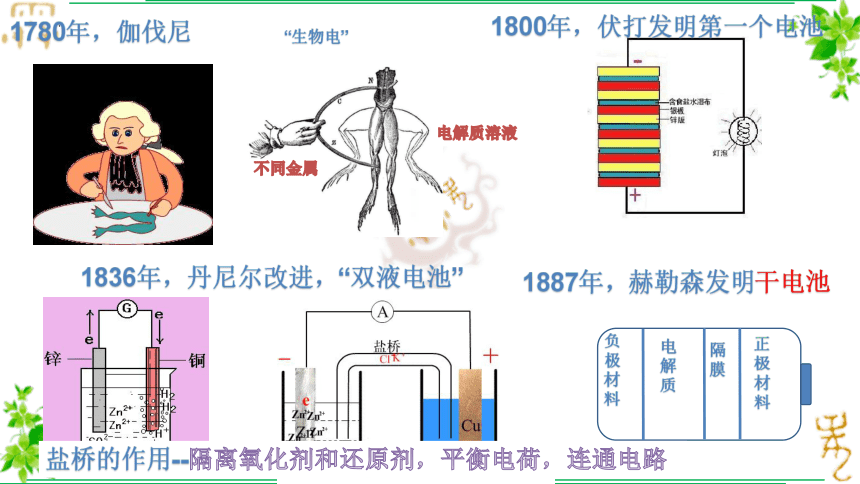
1780年,伽伐尼
“生物电”
不同金属
电解质溶液
1800年,伏打发明第一个电池
1836年,丹尼尔改进,“双液电池”
负极材料
电解质
隔膜
正极材料
1887年,赫勒森发明干电池
盐桥的作用--隔离氧化剂和还原剂,平衡电荷,连通电路
2019年诺贝尔化学奖用于奖励锂离子电池的发展。这种重量轻、可再充电且功能强大的电池,如今被用于从手机到笔记本电脑和电动汽车的各个领域。它还可以储存大量来自太阳能和风能的能源,使一个无化石燃料的社会成为可能。
2019年诺贝尔化学奖揭晓
北京时间10月9日下午5点45分,瑞典皇家科学院在斯德哥尔摩宣布,将2019年度诺贝尔化学奖授予美国得州大学奥斯汀分校约翰 B 古迪纳夫教授(John B. Goodenough。1922年生,得克萨斯大学奥斯汀分校机械工程和材料科学教授)、纽约州立大学宾汉姆顿分校 M 斯坦利 威廷汉教授(M. Stanley Whittingham。1941年生,纽约州立大学宾厄姆顿大学特聘教)和日本化学家吉野彰(Akira Yoshino。1948年生,东京旭化成株式会社名誉研究员、名古屋明治大学教授。),以表彰其在锂离子电池的发展方面作出的贡献。他们创造了一个可再充电的世界。
他们将分享900万瑞典克朗(约合人民币647万元)的奖金。
约翰 B 古迪纳夫
M 斯坦利 威廷汉
吉野彰
学习任务二 化学电源
1.化学电池是将_____能转变为____能的装置。
____电池(干电池):_______________物质消耗到一定程度,就不能使用;
____电池(充电电池或蓄电池):放电后可以再____使活性物质获得_____;
____电池:一种连续将_____和_________的化学能________转换成电能的化学电池。
2.化学电池的分类:它主要包括____电池、____电池、____电池。
化学
电能
一次
二次
燃料
一次
(一)概述
氧化还原反应
二次
充电
再生
燃料
燃料
氧化剂
直接
3.化学电池的用途:
种类繁多的化学电源在生产、生活和科研中得到广泛应用。如手机、照相机、计算器、汽车、卫星、太空站、贮能领域等均要使用电池。
4.化学电池的优点:能量转化率较______,供能___________,可以制成各种______、_______和_______不同的电池及电池组,使用方便携带,易于_______,并可在各种环境下工作。
较高
稳定可靠
形状
大小
容量
维护
5.衡量电池优劣及用途的指标:
(1)比能量:电池单位质量或单位体积所能输出______的多少,符号(w·h)/kg ,(w·h)/L
(2)比功率:电池单位质量或单位体积所能输出____的大小,符号w/kg ,w/L
(3)储存时间:电池的储存时间的______。除特殊情况外,质量___、体积___而输出功率______和储存时间______的电池,更适合使用者的需要。
电能
功率
长短
小
小
大
长
正极:常选用金属_______
隔膜:较高离子传输能力(相当于_____)。
负极:常选用较______金属
氧化物
盐桥
活泼
资料卡片
与电化学相关的物理知识:
1.元电荷:
2.法拉利常数:
F=eNA=96500c/mol
3.电功:
1度电=1kw·h=1000w×3600s = 3.6×106J
Q=96500×n(e-)
e=1.6×10-19c
W=UQ= UIt= Pt
W=UQ=U×96500×n(e-) J
1J=
3.6×106
1
kw·h=
3.6×103
1
w·h
6.化学电源的组成:
负极材料
电解质
隔膜
正极材料
活性物质
活性物质
MnO2
PbO2
Ag2O
O2
Mg
Li
Pb
H2
1.一次电池(又叫干电池)
普通锌锰电池
碱性电池
锌筒
石墨棒
MnO2和C
普通锌-锰干电池的结构
NH4Cl、ZnCl2 和 H2O等
(1)普通干电池
负极
正极
总反应:
(Zn):
(MnO2和C):
优点:制作简单、价格便宜。 缺点:放电时间短,电压下降快。
2MnO2+ 2e- +2NH4+=2NH3↑+Mn2O3+H2O
Zn+2NH4++2MnO2= Zn2++2NH3↑+Mn2O3+H2O
(二)化学电池分类例析:
Zn – 2e- = Zn2+
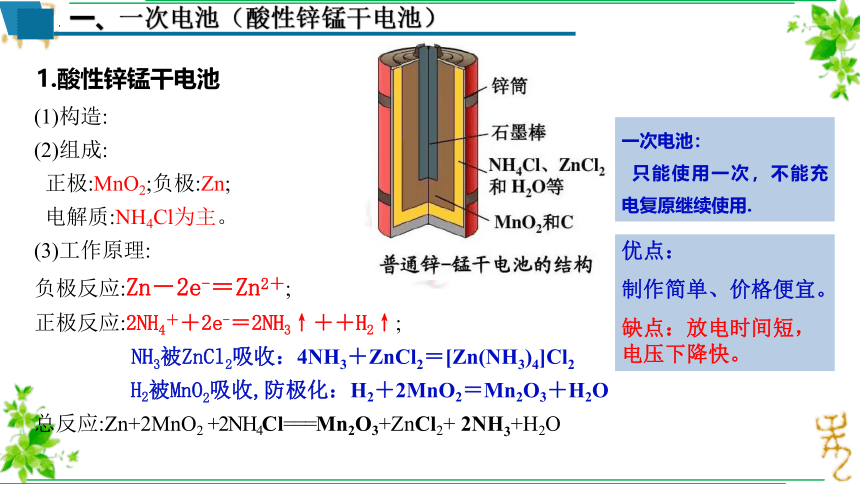
一、一次电池(酸性锌锰干电池)
1.酸性锌锰干电池
(1)构造:
(2)组成:
正极:MnO2;负极:Zn;
电解质:NH4Cl为主。
(3)工作原理:
负极反应:Zn-2e-=Zn2+;
正极反应:2NH4++2e-=2NH3↑++H2↑;
NH3被ZnCl2吸收:4NH3+ZnCl2=[Zn(NH3)4]Cl2
H2被MnO2吸收,防极化:H2+2MnO2=Mn2O3+H2O
总反应:Zn+2MnO2 +2NH4Cl===Mn2O3+ZnCl2+ 2NH3+H2O
优点:
制作简单、价格便宜。
缺点:放电时间短,电压下降快。
一次电池:
只能使用一次,不能充电复原继续使用.
+正极
-正极
正极MnO2糊状混合物
隔离膜
负极锌膏
金属外壳
负极金属棒
(2)碱性锌-锰干电池
电解质:
KOH
负极Zn :
正极MnO2:
缺点:多数只能一次使用,不能充电;价格较贵。
优点:比能量和储存时间有所提高,适用于大电流和连续放电。
Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2
氢氧化氧锰
2MnO2+2e-+2H2O=2MnOOH+2OH-
Zn - 2e- + 2OH- = Zn(OH)2
总反应:
一、一次电池(银锌纽扣电池)
3.银锌电池
银锌电池的负极是Zn,正极是Ag2O,电解质是KOH,其电极反应如下:
负极:Zn+2OH--2e- ==== Zn(OH)2;
正极:Ag2O+H2O+2e- ==== Ag+2OH-;
总反应:Zn+Ag2O+H2O ==== Zn(OH)2+2Ag。
这种电池比能量大、电压稳定,储存时间长,适宜小电流连续放电,常制成纽扣式电池,广泛用于电子手表、照相机、计算器和其他微型电子仪器。
一、一次电池(锂金属电池)
4.锂亚硫酰氯(Li/SOCl2)电池
Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为8Li+3SOCl2===6LiCl+Li2SO3+2S。
(1)负极材料为____,电极反应为_________________。
(2)正极的电极反应为_______________________________。
锂
8Li-8e-===8Li+
3SOCl2+8e-===2S+ +6Cl-
必须在无水、无氧的条件下组装锂金属电池,原因是构成电池的两个主要成份Li能和氧气水反应,且SOCl2也与水反应。
可重复使用、电压稳定、使用方便、安全可靠、价格低廉。
铅酸电池由两组栅状电极板交替排列而成,正极板上覆盖有PbO2,负极板上覆盖有Pb,电解质溶液为H2SO4溶液。
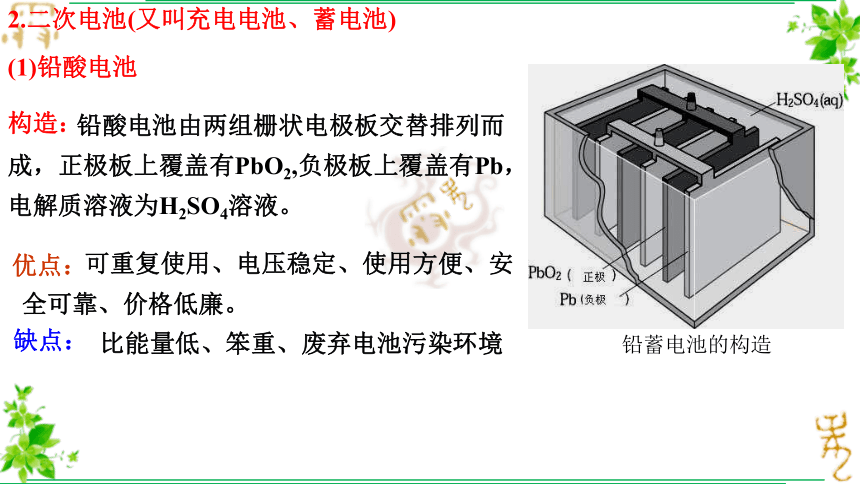
2.二次电池(又叫充电电池、蓄电池)
(1)铅酸电池
构造:
铅蓄电池的构造
缺点:
优点:
比能量低、笨重、废弃电池污染环境
总反应:
Pb+PbO2+2H2SO4=2PbSO4+2H2O
Pb -2e- + SO42- =PbSO4
正极:
PbO2 +2e- + 4H++SO42-=PbSO4 +2H2O
氧化反应
还原反应
负极:
①放电过程:
铅蓄电池充电的反应则是上述反应的逆过程
②充电过程:
PbSO4 +2e- =Pb + SO42-
还原反应
阴极(接负极):
阳极(接正极):
PbSO4 -2e- +2H2O = PbO2 + 4H++ SO42-
氧化反应
总反应:
2PbSO4+2H2O=Pb+PbO2+2H2SO4
充放电过程:
Pb+PbO2+2H2SO4 2PbSO4+2H2O
放电
充电
【微思考1】铅酸蓄电池在放电一段时间后,正极、负极的质量将如何变化
答案 铅酸蓄电池放电时,正极部分PbO2变为PbSO4,质量变大;负极部分Pb变为PbSO4,质量也变大。
铅蓄电池
优点:可重复使用、电压稳定、使用方便、安全可靠、价格低廉
缺点:比能量低、废弃电池污染环境
二、二次电池(铅酸蓄电池)
重难点一
——二次电池的工作原理
2.二次电池放电原理
1.放电、充电反应及充电连接
正极:
负极:
电解质是KOH
总反应:
资料
(1)锌银电池:
锌银电池比能量___、电压____,储存时间___,适宜____电流连续放电,常制成____式微型电池,广泛用于电子手表、照相机、_____和其他微型电子仪器。
Zn -2e- +2OH-=Zn(OH)2
Ag2O + 2e- + H2O=2Ag+2OH-
Zn + Ag2O + H2O = 2Ag + Zn(OH)2
大
稳定
长
较小
纽扣
手表
优点:
(2)镍镉电池
负极:
正极:
放电
阳极:
充电
阴极:
Cd + 2NiO(OH) + 2H2O Cd(OH)2 + 2Ni(OH)2
放电
充电
缺点:
电解质溶液为KOH溶液
比铅蓄电池耐用,可密封反复使用。
镉金属对于环境有污染,电池容量小,寿命短,有电池记忆
Cd-2e- +2OH-= Cd(OH)2
2NiO(OH) +2e- +2H2O=2Ni(OH)2+ 2OH-
Cd(OH)2+2e- =Cd+2OH-
Ni(OH)2-2e- + OH- = NiO(OH)+H2O
总反应:
(3)镍氢电池
圆柱可充镍氢电池
方形可充镍氢电池
能量密度高;无镉污染,是一种绿色电池;可大电流快速充放电;电池工作电压为1.2V;在小型便携电子器件、电动工具、电动车辆和混合动力车上逐步得到应用。
优点:
H2 + 2NiOOH 2Ni(OH)2
放电
充电
正极:
负极:
放电
阳极:
阴极:
充电
总反应:
H2 - 2e- + 2OH- = 2H2O
2NiOOH +2 e- + 2H2O = 2Ni(OH)2 +2 OH-
2H2O +2 e- = H2 + 2OH-
2 Ni(OH)2 -2 e- + 2OH-= 2NiOOH +2 H2O
(4)锂离子电池
总反应:
正极:
负极:
放电
阳极:
阴极:
充电
LixC6 +Li1-xCoO2 LiCoO2+6C
放电
充电
负极材料:嵌锂层状石墨(LixC6 )
正极材料:钴酸锂(Li1-xCoO2)
电解液:锂导电有机电解液
铜集流板
铝集流板
锂导电有机电解液
LixC6
Li1-xCoO2
石墨钴酸锂锂离子电池结构
LixC6 - xe-= 6C+xLi+
Li1-xCoO2+xe-+xLi =LiCoO2
6C+xe-+xLi+=LixC6
LiCoO2-xe- =Li1-xCoO2+xLi+
锂离子电池工作原理:
放电时:
负极反应:
正极反应:
总反应:
Li+由石墨中脱嵌移向正极,嵌入LiCoO2晶体
充电时:
阴极反应:
阳极反应:
总反应:
Cy+xe-+xLi+=LixCy
LiCoO2-xe-=xLi++Li1-xCoO2
LiCoO2+Cy=Li1-xCoO2+LixCy
LixCy-xe-=xLi++Cy
Li1-xCoO2+xe-+xLi+=LiCoO2
Li1-xCoO2+LixCy=LiCoO2+Cy
LiCoO2-xe-=xLi++Li1-xCoO2
Li+从LiCoO2晶体中脱嵌,由正极回到负极,嵌入石墨中
剪开的锂离子电池
铜箔和铝箔之间夹有微孔结构的白色薄膜,浸泡在有机电解液——溶解有六氟磷酸锂的碳酸酯中。
负极:覆盖有石墨粉的铜箔
正极:覆盖有钴酸锂的铝箔
充满电的负极
磷酸铁锂系锂离子电池:
负极:
正极:
放电
充电
阴极:
正极:
LixC6+ Li1-xFePO4 6C+LiFePO4
放电
充电
6C +xLi+ + xe- = LixC6
LiFePO4 - xe-=Li1-xFePO4 + xLi+
LixC6 - xe- = xLi+ + 6C
Li1-xFePO4 + xe- + xLi+ = LiFePO4
总反应:
电子自动从负极材料离开,通过外电路流向正极,失去电子的锂离子也从石墨层间脱嵌而出
从负极脱嵌后的锂离子通过电解液及隔膜重新回到正极材料,结合通过外部电路到达正极的电子,形成比较稳定的嵌锂正极材料
正极:Li1-xCoO2+xe-+xLi+ =LiCoO2
负极:LixC6 - xe-= 6C+xLi+
放电:
锂离子脱嵌
锂离子嵌入
钴酸锂
嵌锂石墨
放电
新制作或放电后锂离子嵌在正极材料的层状结构中
开始充电后,在外加电场的作用下,正极材料失去电子,锂离子从正极材料中脱嵌而出
继续充电中,正极材料持续失去电子,锂离子也持续脱嵌,直至充电完成
阳极:LiCoO2-xe- =Li1-xCoO2+xLi+
充电:
锂离子脱嵌
(正极)
钴酸锂
LiCoO2
阳极(正极)充电
锂离子通过电解液和隔膜,移动到负极石墨材料
锂离子嵌入石墨层中,同时电子通过外电路到达负极,形成相对稳定的嵌锂石墨,充电完成。
阴极(负极): 6C+xe-+xLi+=LixC6
充电:
嵌锂石墨
石墨
阴极(负极)充电
两种不同类型的锂电池
(1)锂金属电池 锂电池分为锂金属电池和锂离子电池。
锂金属电池的负极材料是金属锂或锂合金,工作时金属锂失去电子被氧化为Li+。由于单质锂是活泼金属,易与空气中的H2O、O2反应,
所以必须在无水、无氧的条件下组装锂金属电池。
(2)锂离子电池 锂离子电池的正极材料一般为含Li+的化合物,目前已商业化的正极材料有LiFePO4、LiCoO2、LiMn2O4等,充电、放电时这些正极材料上的电极反应、电池总反应如表:
正极材料 充电时阳极反应式 放电时正极反应式 电池总反应式
LiFePO4 LiFePO4-xe- =Li1-xFePO4+xLi+ Li1-xFePO4+xLi++xe-=LiFePO4 LiFePO4+6C充电
Li1-xFePO4+LixC6
LiCoO2 LiCoO2-xe- =Li1-xCoO2+xLi+ Li1-xCoO2+xLi++xe-===LiCoO2 LiCoO2+6C充电
Li1-xCoO2+LixC6
LiMn2O4 LiMn2O4-xe- =Li1-xMn2O4+xLi+ Li1-xMn2O4+xLi++xe-===LiMn2O4 LiMn2O4+6C充电
Li1-xMn2O4+LixC6
放电时:
①负极区域,LixC6失去电子形成碳单质。
②正极区域过渡区域金属元素化合价降低,得到电子
充电时阳极:
①碳单质得到电子形成LixC6
②LiFePO4、LiCoO2、LiMn2O4等释放Li+,过渡区域金属元素化合价升高失去电子
2.市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li的高分子材料。这种锂离子电池的电池反应为:
Li+2Li
下列说法不正确的是( )
A.放电时,负极的电极反应式:Li-e-===Li+
B.充电时,Li0.85NiO2既发生氧化反应又发生还原反应
C.该电池不能用水溶液作为电解质
D.放电过程中Li+向负极移动
√
负极材料
正极材料
三元锂离子电池
锂离子电池的优越性能:
相对于传统的镉镍电池(Ni/Cd)和氢镍电池(Ni/MH),锂离子电池的电压大约是它们的3倍;重量比能量密度提高了约3倍;对于同样的功率消耗,锂离子电池的使用期限约为镍镉电池的2.25~2.57倍.现在锂离子电池已经是电子信息产品设计人员的普通配置.
①工作电压高 、②比能量大、 ③循环寿命长、 ④自放电率低 、⑤无记忆效应、 ⑥污染小。
二、二次电池(其他)
其他二次电池还有:
爱迪生电池(铁镍蓄电池): Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2
二次电池的充放电规律
(1)充电时电极的连接:充电的目的是使电池恢复其供电能力,因此负极应与电源的负极相连以获得电子,可简记为负接负后作阴极,正接正后作阳极。
(2)工作时的电极反应式:同一电极上的电极反应式,在充电与放电时,形式上恰好是相反的;同一电极周围的溶液,充电与放电时pH的变化趋势也恰好相反。
3、燃料电池
将燃料和氧化剂的化学能直接转化为电能的化学电池
负极
H2,CO,烃类,醇类,其他有机物
失电子
不同电解质体系下的特定结构形式
正极
通常为氧气
得电子
不同电解质体系下的特定结构形式
如OH-,H2O,O2-
3.燃料电池
燃料电池是一种连续地将燃料和氧化剂的化学能直接转换成电能的化学电池。(氢气、烃、肼、甲醇、氨、煤气燃料电池……)
(1)氢氧燃料电池
①酸性电解质
负极:
正极:
总反应:
负极:
正极:
总反应:
②碱性电解质
2H2 - 4e- = 4H+
O2 + 4e- + 4H+ = 2H2O
2H2 + O2 = 2H2O
2H2 - 4e- + 4OH- = 4H2O
O2+ 4e- + 2H2O = 4OH-
2H2+ O2 = 2H2O
(2)甲烷-氧燃料电池
负极:
正极:
电池总反应式:
电解质为KOH
CH4 - 8e- + 10OH- = CO32- + 7H2O
2O2 + 8e- + 4H2O = 8OH-
CH4+2O2+2OH -=CO32-+3H2O
(3)甲醇燃料电池
电解质为KOH
负极:
正极:
电池总反应式:
CH3OH - 6e- + 8OH- = CO32- + 6H2O
O2 + 4e- + 2H2O = 4OH-
2CH3OH +3O2 + 4OH-=2CO32- +6H2O
(4)肼燃料电池
N H4-4e- +4OH-= N ↑ + 4H O
电解质为KOH
负极:
正极:
电池总反应式:
O + 4e- + 2H O= 4OH-
N H4 + O = N ↑ + 2H O
一种熔融碳酸盐燃料电池原理示意图如下。
[典例精练]
【答案】D
注意:1、燃料电池的规律
①燃料做负极,助燃剂氧气为正极
②电极材料一般不参加化学反应,只起传导电子的作用。
③能量转化率高(超过80%),普通的只有30%,有利于节约能源。
2、燃料电池与前几种电池的差别:
①氧化剂与还原剂在工作时不断补充;
②反应产物不断排出
(5)固体燃料电池
介质 电池反应: 负极
正极
负极
正极
2H2 - 4e- = 4H+
O2 + 4H+ + 4e-= 2H2O
2H2 - 4e- +2O2-= 2H2O
O2 + 4e-= 2O2-
2H2 +O2 = 2H2O
例、一种新燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料说法正确的是 ( )
A、在熔融电解质中,O2-由负极移向正极
B、电池的总反应是:
2C4H10 + 13O2 → 8CO2 + 10H2O
C、通入空气的一极是正极,电极反应为:
O2 + 4e- = 2O2-
D、通入丁烷的一极是正极,电极反应为:
C4H10 + 26e- + 13O2 = 4CO2 + 5H2O
BC
1、燃料电池结构特征及应用
正极—助燃剂(氧气)
负极—燃料(H2 CO CH4 C2H6 C2H5OH等)
电极材料—一般不参加反应,传导电子
原料不断补充、产物不断排出
优点:能量转化率高,可持续使用,对环境友好
用途:宇宙飞船,应用前景广阔
规律小结
(1)碱性溶液:
(2)酸性溶液:
(3)能传导O2-的固体介质:
(4)熔融碳酸盐介质:
O2+4e-+2H2O=4OH-
O2+ 4e-+ 4H+=2H2O
O2 + 4e-= 2O2-
O2 +4e- +2CO2= 2CO32-
2、燃料电池中不同介质环境下的正极反应
3、书写电极反应式应注意事项
a.确定原电池的正负极,弄清正负极上发生反应的物质;
b.电极反应是一种离子反应,遵循书写离子反应的所有规则(如“拆”、“平”)
c.将两极反应的电子得失数配平后,相加得到总反应,总反应减去一极反应即得到另一极反应;
d.负极失电子所得氧化产物和正极得电子所得还原产物,与溶液的酸碱性有关(如+4价的C在酸性溶液中以CO2形式存在,在碱性溶液中以CO32-形式存在);
e.溶液中不存在O2-:在酸性溶液中它与H+结合成H2O、在碱性或中性溶液中它与水结合成OH-。
3、书写电极反应式应注意事项
(6)铝-空气-海水电池
负极:
正极:
电池总反应式:
1991年,我国首创,用作海上标志灯。以海水为电解液,靠空气中的氧使铝不断氧化而产生电流。
4A1-12e- = 4A13+
3O2+12e-+6H2O =12OH-
4A1+3O2+6H2O=4A1(OH)3
这种海水电池比“干电池”的能量高20~50倍。
4.液流电池(主要用于储能)
(1)铁铬液流电池
Fe 3+ + Cr 2+ Fe2+ + Cr 3+
放电
充电
阴极: Cr 3+ + e-= Cr 2+
阳极: Fe2+ -e-= Fe 3+
负极: Cr 2+ -e-= Cr 3+
正极: Fe 3+ +e-= Fe2+
充电
放电
(2)全钒液流电池
负极:V2+-e-=V3+
正极:VO2++2H++e-=VO2++H2O
放电
离子颜色: V2+紫色, V3+绿色,
VO2+蓝色,VO2+黄色
阴极:V3++ e-=V2+
阳极:VO2+-e-+H2O=VO2++2H+
充电
VO2++2H++ V2+ V3+ +VO2++H2O
放电
充电
▲书写电极反应式应注意以下几点:
2.负极失电子所得氧化产物和正极得电子所得还原产物,与溶液的酸碱性有关(如+4价的C在酸性溶液中以CO2形式存在,在碱性溶液中以CO32-形式存在);
1.将两极反应的电子得失数配平后,相加得到总反应,总反应减去一极反应即得到另一极反应;
3.溶液中不存在O2-:在酸性溶液中它与H+结合成H2O、在碱性或中性溶液中它与水结合成OH-;
废电池污染治理刻不容缓
减少污染、节约资源
电池中含有大量的重金属如锌、铅、镉、汞、锰等。据专家测试,一节纽扣电池能污染60万升水;一节一号电池烂在地里,能使一平方米的土地失去利用价值。若将废旧电池混入生活垃圾一起填埋,渗出的重金属物质就会渗透土壤、污染地下水,进而进入鱼类、农作物等,破坏人类的生存环境,间接威胁到人类的健康,有的还能致癌。所以我们不要乱扔电池,要及时回收。
化学电源
概述
优点
分类
概念
优劣指标
组成
例析
一次电池
锌锰干电池
锌银电池
锂电池
二次电池
铅蓄电池
镍镉(氢)电池
锂离子电池
燃料电池:
氢气、甲烷、甲醇、铝、肼等
W=UQ=U×96500×n(e-) J
小结:
1J=
3.6×106
1
kw·h=
3.6×103
1
w·h
1.下面是几种常见的化学电源示意图,有关说法不正确的是( )
A.上述电池分别属于一次电池、二次电池和燃料电池
B.干电池在长时间使用后,锌筒被破坏
C.铅蓄电池工作过程中,每转移2mol电子,负极质量减小207g
D.氢氧燃料电池是一种具有广阔应用前景的绿色电源
学习评价:
C
2.某燃料电池可实现NO和CO的无害转化,其结构如图所示。下列说法正确的是( )
A.石墨Ⅰ电极上发生氧化反应
C.石墨Ⅱ电极上的反应式为
D.电路中每通过6mol电子,生成1mol
B.电池工作时 向石墨Ⅱ电极处移动
C
A.充电时a极接外电源的正极
B.放电时在电解质中 由a极向b极迁移
C.充电时若转移0.02mol电子,石墨电极将减少0.14g
D.该废旧电池进行“放电处理”有利于锂在 极回收
3.(双选)2019年诺贝尔化学奖授予了在锂离子电池研发领域作出贡献的三位科学家。一种锂离子电池的结构如图所示,电池反应为:
。下列说法正确的是( )
AD
4. (双选)科学家研发了“全氢电池”,其工作原理如图所示。下列说法不正确的是( )
A.右边吸附层中发生了还原反应
B.负极的电极反应是H2-2e-+2OH-= 2H2O
C.电池的总反应是2H2+O2 = 2H2O
D.电解质溶液中Na+向左移动,ClO4-向右移动
CD
再 见 !
1.知道日常生活中常用的化学电源和新型化学电池;
2.认识一次电池、二次电池、燃料电池等几类化学电池;
3.会书写常用化学电池的电极反应式及总反应式。
学习目标:
普通干电池
笔记本电脑 专用电池
摄像机专用电池
“神七”用太阳能电池
手机电池
第四章 电化学基础
第一节 原电池
第二课时 化学电源
1780年,伽伐尼
“生物电”
不同金属
电解质溶液
1800年,伏打发明第一个电池
1836年,丹尼尔改进,“双液电池”
负极材料
电解质
隔膜
正极材料
1887年,赫勒森发明干电池
盐桥的作用--隔离氧化剂和还原剂,平衡电荷,连通电路
2019年诺贝尔化学奖用于奖励锂离子电池的发展。这种重量轻、可再充电且功能强大的电池,如今被用于从手机到笔记本电脑和电动汽车的各个领域。它还可以储存大量来自太阳能和风能的能源,使一个无化石燃料的社会成为可能。
2019年诺贝尔化学奖揭晓
北京时间10月9日下午5点45分,瑞典皇家科学院在斯德哥尔摩宣布,将2019年度诺贝尔化学奖授予美国得州大学奥斯汀分校约翰 B 古迪纳夫教授(John B. Goodenough。1922年生,得克萨斯大学奥斯汀分校机械工程和材料科学教授)、纽约州立大学宾汉姆顿分校 M 斯坦利 威廷汉教授(M. Stanley Whittingham。1941年生,纽约州立大学宾厄姆顿大学特聘教)和日本化学家吉野彰(Akira Yoshino。1948年生,东京旭化成株式会社名誉研究员、名古屋明治大学教授。),以表彰其在锂离子电池的发展方面作出的贡献。他们创造了一个可再充电的世界。
他们将分享900万瑞典克朗(约合人民币647万元)的奖金。
约翰 B 古迪纳夫
M 斯坦利 威廷汉
吉野彰
学习任务二 化学电源
1.化学电池是将_____能转变为____能的装置。
____电池(干电池):_______________物质消耗到一定程度,就不能使用;
____电池(充电电池或蓄电池):放电后可以再____使活性物质获得_____;
____电池:一种连续将_____和_________的化学能________转换成电能的化学电池。
2.化学电池的分类:它主要包括____电池、____电池、____电池。
化学
电能
一次
二次
燃料
一次
(一)概述
氧化还原反应
二次
充电
再生
燃料
燃料
氧化剂
直接
3.化学电池的用途:
种类繁多的化学电源在生产、生活和科研中得到广泛应用。如手机、照相机、计算器、汽车、卫星、太空站、贮能领域等均要使用电池。
4.化学电池的优点:能量转化率较______,供能___________,可以制成各种______、_______和_______不同的电池及电池组,使用方便携带,易于_______,并可在各种环境下工作。
较高
稳定可靠
形状
大小
容量
维护
5.衡量电池优劣及用途的指标:
(1)比能量:电池单位质量或单位体积所能输出______的多少,符号(w·h)/kg ,(w·h)/L
(2)比功率:电池单位质量或单位体积所能输出____的大小,符号w/kg ,w/L
(3)储存时间:电池的储存时间的______。除特殊情况外,质量___、体积___而输出功率______和储存时间______的电池,更适合使用者的需要。
电能
功率
长短
小
小
大
长
正极:常选用金属_______
隔膜:较高离子传输能力(相当于_____)。
负极:常选用较______金属
氧化物
盐桥
活泼
资料卡片
与电化学相关的物理知识:
1.元电荷:
2.法拉利常数:
F=eNA=96500c/mol
3.电功:
1度电=1kw·h=1000w×3600s = 3.6×106J
Q=96500×n(e-)
e=1.6×10-19c
W=UQ= UIt= Pt
W=UQ=U×96500×n(e-) J
1J=
3.6×106
1
kw·h=
3.6×103
1
w·h
6.化学电源的组成:
负极材料
电解质
隔膜
正极材料
活性物质
活性物质
MnO2
PbO2
Ag2O
O2
Mg
Li
Pb
H2
1.一次电池(又叫干电池)
普通锌锰电池
碱性电池
锌筒
石墨棒
MnO2和C
普通锌-锰干电池的结构
NH4Cl、ZnCl2 和 H2O等
(1)普通干电池
负极
正极
总反应:
(Zn):
(MnO2和C):
优点:制作简单、价格便宜。 缺点:放电时间短,电压下降快。
2MnO2+ 2e- +2NH4+=2NH3↑+Mn2O3+H2O
Zn+2NH4++2MnO2= Zn2++2NH3↑+Mn2O3+H2O
(二)化学电池分类例析:
Zn – 2e- = Zn2+
一、一次电池(酸性锌锰干电池)
1.酸性锌锰干电池
(1)构造:
(2)组成:
正极:MnO2;负极:Zn;
电解质:NH4Cl为主。
(3)工作原理:
负极反应:Zn-2e-=Zn2+;
正极反应:2NH4++2e-=2NH3↑++H2↑;
NH3被ZnCl2吸收:4NH3+ZnCl2=[Zn(NH3)4]Cl2
H2被MnO2吸收,防极化:H2+2MnO2=Mn2O3+H2O
总反应:Zn+2MnO2 +2NH4Cl===Mn2O3+ZnCl2+ 2NH3+H2O
优点:
制作简单、价格便宜。
缺点:放电时间短,电压下降快。
一次电池:
只能使用一次,不能充电复原继续使用.
+正极
-正极
正极MnO2糊状混合物
隔离膜
负极锌膏
金属外壳
负极金属棒
(2)碱性锌-锰干电池
电解质:
KOH
负极Zn :
正极MnO2:
缺点:多数只能一次使用,不能充电;价格较贵。
优点:比能量和储存时间有所提高,适用于大电流和连续放电。
Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2
氢氧化氧锰
2MnO2+2e-+2H2O=2MnOOH+2OH-
Zn - 2e- + 2OH- = Zn(OH)2
总反应:
一、一次电池(银锌纽扣电池)
3.银锌电池
银锌电池的负极是Zn,正极是Ag2O,电解质是KOH,其电极反应如下:
负极:Zn+2OH--2e- ==== Zn(OH)2;
正极:Ag2O+H2O+2e- ==== Ag+2OH-;
总反应:Zn+Ag2O+H2O ==== Zn(OH)2+2Ag。
这种电池比能量大、电压稳定,储存时间长,适宜小电流连续放电,常制成纽扣式电池,广泛用于电子手表、照相机、计算器和其他微型电子仪器。
一、一次电池(锂金属电池)
4.锂亚硫酰氯(Li/SOCl2)电池
Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为8Li+3SOCl2===6LiCl+Li2SO3+2S。
(1)负极材料为____,电极反应为_________________。
(2)正极的电极反应为_______________________________。
锂
8Li-8e-===8Li+
3SOCl2+8e-===2S+ +6Cl-
必须在无水、无氧的条件下组装锂金属电池,原因是构成电池的两个主要成份Li能和氧气水反应,且SOCl2也与水反应。
可重复使用、电压稳定、使用方便、安全可靠、价格低廉。
铅酸电池由两组栅状电极板交替排列而成,正极板上覆盖有PbO2,负极板上覆盖有Pb,电解质溶液为H2SO4溶液。
2.二次电池(又叫充电电池、蓄电池)
(1)铅酸电池
构造:
铅蓄电池的构造
缺点:
优点:
比能量低、笨重、废弃电池污染环境
总反应:
Pb+PbO2+2H2SO4=2PbSO4+2H2O
Pb -2e- + SO42- =PbSO4
正极:
PbO2 +2e- + 4H++SO42-=PbSO4 +2H2O
氧化反应
还原反应
负极:
①放电过程:
铅蓄电池充电的反应则是上述反应的逆过程
②充电过程:
PbSO4 +2e- =Pb + SO42-
还原反应
阴极(接负极):
阳极(接正极):
PbSO4 -2e- +2H2O = PbO2 + 4H++ SO42-
氧化反应
总反应:
2PbSO4+2H2O=Pb+PbO2+2H2SO4
充放电过程:
Pb+PbO2+2H2SO4 2PbSO4+2H2O
放电
充电
【微思考1】铅酸蓄电池在放电一段时间后,正极、负极的质量将如何变化
答案 铅酸蓄电池放电时,正极部分PbO2变为PbSO4,质量变大;负极部分Pb变为PbSO4,质量也变大。
铅蓄电池
优点:可重复使用、电压稳定、使用方便、安全可靠、价格低廉
缺点:比能量低、废弃电池污染环境
二、二次电池(铅酸蓄电池)
重难点一
——二次电池的工作原理
2.二次电池放电原理
1.放电、充电反应及充电连接
正极:
负极:
电解质是KOH
总反应:
资料
(1)锌银电池:
锌银电池比能量___、电压____,储存时间___,适宜____电流连续放电,常制成____式微型电池,广泛用于电子手表、照相机、_____和其他微型电子仪器。
Zn -2e- +2OH-=Zn(OH)2
Ag2O + 2e- + H2O=2Ag+2OH-
Zn + Ag2O + H2O = 2Ag + Zn(OH)2
大
稳定
长
较小
纽扣
手表
优点:
(2)镍镉电池
负极:
正极:
放电
阳极:
充电
阴极:
Cd + 2NiO(OH) + 2H2O Cd(OH)2 + 2Ni(OH)2
放电
充电
缺点:
电解质溶液为KOH溶液
比铅蓄电池耐用,可密封反复使用。
镉金属对于环境有污染,电池容量小,寿命短,有电池记忆
Cd-2e- +2OH-= Cd(OH)2
2NiO(OH) +2e- +2H2O=2Ni(OH)2+ 2OH-
Cd(OH)2+2e- =Cd+2OH-
Ni(OH)2-2e- + OH- = NiO(OH)+H2O
总反应:
(3)镍氢电池
圆柱可充镍氢电池
方形可充镍氢电池
能量密度高;无镉污染,是一种绿色电池;可大电流快速充放电;电池工作电压为1.2V;在小型便携电子器件、电动工具、电动车辆和混合动力车上逐步得到应用。
优点:
H2 + 2NiOOH 2Ni(OH)2
放电
充电
正极:
负极:
放电
阳极:
阴极:
充电
总反应:
H2 - 2e- + 2OH- = 2H2O
2NiOOH +2 e- + 2H2O = 2Ni(OH)2 +2 OH-
2H2O +2 e- = H2 + 2OH-
2 Ni(OH)2 -2 e- + 2OH-= 2NiOOH +2 H2O
(4)锂离子电池
总反应:
正极:
负极:
放电
阳极:
阴极:
充电
LixC6 +Li1-xCoO2 LiCoO2+6C
放电
充电
负极材料:嵌锂层状石墨(LixC6 )
正极材料:钴酸锂(Li1-xCoO2)
电解液:锂导电有机电解液
铜集流板
铝集流板
锂导电有机电解液
LixC6
Li1-xCoO2
石墨钴酸锂锂离子电池结构
LixC6 - xe-= 6C+xLi+
Li1-xCoO2+xe-+xLi =LiCoO2
6C+xe-+xLi+=LixC6
LiCoO2-xe- =Li1-xCoO2+xLi+
锂离子电池工作原理:
放电时:
负极反应:
正极反应:
总反应:
Li+由石墨中脱嵌移向正极,嵌入LiCoO2晶体
充电时:
阴极反应:
阳极反应:
总反应:
Cy+xe-+xLi+=LixCy
LiCoO2-xe-=xLi++Li1-xCoO2
LiCoO2+Cy=Li1-xCoO2+LixCy
LixCy-xe-=xLi++Cy
Li1-xCoO2+xe-+xLi+=LiCoO2
Li1-xCoO2+LixCy=LiCoO2+Cy
LiCoO2-xe-=xLi++Li1-xCoO2
Li+从LiCoO2晶体中脱嵌,由正极回到负极,嵌入石墨中
剪开的锂离子电池
铜箔和铝箔之间夹有微孔结构的白色薄膜,浸泡在有机电解液——溶解有六氟磷酸锂的碳酸酯中。
负极:覆盖有石墨粉的铜箔
正极:覆盖有钴酸锂的铝箔
充满电的负极
磷酸铁锂系锂离子电池:
负极:
正极:
放电
充电
阴极:
正极:
LixC6+ Li1-xFePO4 6C+LiFePO4
放电
充电
6C +xLi+ + xe- = LixC6
LiFePO4 - xe-=Li1-xFePO4 + xLi+
LixC6 - xe- = xLi+ + 6C
Li1-xFePO4 + xe- + xLi+ = LiFePO4
总反应:
电子自动从负极材料离开,通过外电路流向正极,失去电子的锂离子也从石墨层间脱嵌而出
从负极脱嵌后的锂离子通过电解液及隔膜重新回到正极材料,结合通过外部电路到达正极的电子,形成比较稳定的嵌锂正极材料
正极:Li1-xCoO2+xe-+xLi+ =LiCoO2
负极:LixC6 - xe-= 6C+xLi+
放电:
锂离子脱嵌
锂离子嵌入
钴酸锂
嵌锂石墨
放电
新制作或放电后锂离子嵌在正极材料的层状结构中
开始充电后,在外加电场的作用下,正极材料失去电子,锂离子从正极材料中脱嵌而出
继续充电中,正极材料持续失去电子,锂离子也持续脱嵌,直至充电完成
阳极:LiCoO2-xe- =Li1-xCoO2+xLi+
充电:
锂离子脱嵌
(正极)
钴酸锂
LiCoO2
阳极(正极)充电
锂离子通过电解液和隔膜,移动到负极石墨材料
锂离子嵌入石墨层中,同时电子通过外电路到达负极,形成相对稳定的嵌锂石墨,充电完成。
阴极(负极): 6C+xe-+xLi+=LixC6
充电:
嵌锂石墨
石墨
阴极(负极)充电
两种不同类型的锂电池
(1)锂金属电池 锂电池分为锂金属电池和锂离子电池。
锂金属电池的负极材料是金属锂或锂合金,工作时金属锂失去电子被氧化为Li+。由于单质锂是活泼金属,易与空气中的H2O、O2反应,
所以必须在无水、无氧的条件下组装锂金属电池。
(2)锂离子电池 锂离子电池的正极材料一般为含Li+的化合物,目前已商业化的正极材料有LiFePO4、LiCoO2、LiMn2O4等,充电、放电时这些正极材料上的电极反应、电池总反应如表:
正极材料 充电时阳极反应式 放电时正极反应式 电池总反应式
LiFePO4 LiFePO4-xe- =Li1-xFePO4+xLi+ Li1-xFePO4+xLi++xe-=LiFePO4 LiFePO4+6C充电
Li1-xFePO4+LixC6
LiCoO2 LiCoO2-xe- =Li1-xCoO2+xLi+ Li1-xCoO2+xLi++xe-===LiCoO2 LiCoO2+6C充电
Li1-xCoO2+LixC6
LiMn2O4 LiMn2O4-xe- =Li1-xMn2O4+xLi+ Li1-xMn2O4+xLi++xe-===LiMn2O4 LiMn2O4+6C充电
Li1-xMn2O4+LixC6
放电时:
①负极区域,LixC6失去电子形成碳单质。
②正极区域过渡区域金属元素化合价降低,得到电子
充电时阳极:
①碳单质得到电子形成LixC6
②LiFePO4、LiCoO2、LiMn2O4等释放Li+,过渡区域金属元素化合价升高失去电子
2.市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li的高分子材料。这种锂离子电池的电池反应为:
Li+2Li
下列说法不正确的是( )
A.放电时,负极的电极反应式:Li-e-===Li+
B.充电时,Li0.85NiO2既发生氧化反应又发生还原反应
C.该电池不能用水溶液作为电解质
D.放电过程中Li+向负极移动
√
负极材料
正极材料
三元锂离子电池
锂离子电池的优越性能:
相对于传统的镉镍电池(Ni/Cd)和氢镍电池(Ni/MH),锂离子电池的电压大约是它们的3倍;重量比能量密度提高了约3倍;对于同样的功率消耗,锂离子电池的使用期限约为镍镉电池的2.25~2.57倍.现在锂离子电池已经是电子信息产品设计人员的普通配置.
①工作电压高 、②比能量大、 ③循环寿命长、 ④自放电率低 、⑤无记忆效应、 ⑥污染小。
二、二次电池(其他)
其他二次电池还有:
爱迪生电池(铁镍蓄电池): Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2
二次电池的充放电规律
(1)充电时电极的连接:充电的目的是使电池恢复其供电能力,因此负极应与电源的负极相连以获得电子,可简记为负接负后作阴极,正接正后作阳极。
(2)工作时的电极反应式:同一电极上的电极反应式,在充电与放电时,形式上恰好是相反的;同一电极周围的溶液,充电与放电时pH的变化趋势也恰好相反。
3、燃料电池
将燃料和氧化剂的化学能直接转化为电能的化学电池
负极
H2,CO,烃类,醇类,其他有机物
失电子
不同电解质体系下的特定结构形式
正极
通常为氧气
得电子
不同电解质体系下的特定结构形式
如OH-,H2O,O2-
3.燃料电池
燃料电池是一种连续地将燃料和氧化剂的化学能直接转换成电能的化学电池。(氢气、烃、肼、甲醇、氨、煤气燃料电池……)
(1)氢氧燃料电池
①酸性电解质
负极:
正极:
总反应:
负极:
正极:
总反应:
②碱性电解质
2H2 - 4e- = 4H+
O2 + 4e- + 4H+ = 2H2O
2H2 + O2 = 2H2O
2H2 - 4e- + 4OH- = 4H2O
O2+ 4e- + 2H2O = 4OH-
2H2+ O2 = 2H2O
(2)甲烷-氧燃料电池
负极:
正极:
电池总反应式:
电解质为KOH
CH4 - 8e- + 10OH- = CO32- + 7H2O
2O2 + 8e- + 4H2O = 8OH-
CH4+2O2+2OH -=CO32-+3H2O
(3)甲醇燃料电池
电解质为KOH
负极:
正极:
电池总反应式:
CH3OH - 6e- + 8OH- = CO32- + 6H2O
O2 + 4e- + 2H2O = 4OH-
2CH3OH +3O2 + 4OH-=2CO32- +6H2O
(4)肼燃料电池
N H4-4e- +4OH-= N ↑ + 4H O
电解质为KOH
负极:
正极:
电池总反应式:
O + 4e- + 2H O= 4OH-
N H4 + O = N ↑ + 2H O
一种熔融碳酸盐燃料电池原理示意图如下。
[典例精练]
【答案】D
注意:1、燃料电池的规律
①燃料做负极,助燃剂氧气为正极
②电极材料一般不参加化学反应,只起传导电子的作用。
③能量转化率高(超过80%),普通的只有30%,有利于节约能源。
2、燃料电池与前几种电池的差别:
①氧化剂与还原剂在工作时不断补充;
②反应产物不断排出
(5)固体燃料电池
介质 电池反应: 负极
正极
负极
正极
2H2 - 4e- = 4H+
O2 + 4H+ + 4e-= 2H2O
2H2 - 4e- +2O2-= 2H2O
O2 + 4e-= 2O2-
2H2 +O2 = 2H2O
例、一种新燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料说法正确的是 ( )
A、在熔融电解质中,O2-由负极移向正极
B、电池的总反应是:
2C4H10 + 13O2 → 8CO2 + 10H2O
C、通入空气的一极是正极,电极反应为:
O2 + 4e- = 2O2-
D、通入丁烷的一极是正极,电极反应为:
C4H10 + 26e- + 13O2 = 4CO2 + 5H2O
BC
1、燃料电池结构特征及应用
正极—助燃剂(氧气)
负极—燃料(H2 CO CH4 C2H6 C2H5OH等)
电极材料—一般不参加反应,传导电子
原料不断补充、产物不断排出
优点:能量转化率高,可持续使用,对环境友好
用途:宇宙飞船,应用前景广阔
规律小结
(1)碱性溶液:
(2)酸性溶液:
(3)能传导O2-的固体介质:
(4)熔融碳酸盐介质:
O2+4e-+2H2O=4OH-
O2+ 4e-+ 4H+=2H2O
O2 + 4e-= 2O2-
O2 +4e- +2CO2= 2CO32-
2、燃料电池中不同介质环境下的正极反应
3、书写电极反应式应注意事项
a.确定原电池的正负极,弄清正负极上发生反应的物质;
b.电极反应是一种离子反应,遵循书写离子反应的所有规则(如“拆”、“平”)
c.将两极反应的电子得失数配平后,相加得到总反应,总反应减去一极反应即得到另一极反应;
d.负极失电子所得氧化产物和正极得电子所得还原产物,与溶液的酸碱性有关(如+4价的C在酸性溶液中以CO2形式存在,在碱性溶液中以CO32-形式存在);
e.溶液中不存在O2-:在酸性溶液中它与H+结合成H2O、在碱性或中性溶液中它与水结合成OH-。
3、书写电极反应式应注意事项
(6)铝-空气-海水电池
负极:
正极:
电池总反应式:
1991年,我国首创,用作海上标志灯。以海水为电解液,靠空气中的氧使铝不断氧化而产生电流。
4A1-12e- = 4A13+
3O2+12e-+6H2O =12OH-
4A1+3O2+6H2O=4A1(OH)3
这种海水电池比“干电池”的能量高20~50倍。
4.液流电池(主要用于储能)
(1)铁铬液流电池
Fe 3+ + Cr 2+ Fe2+ + Cr 3+
放电
充电
阴极: Cr 3+ + e-= Cr 2+
阳极: Fe2+ -e-= Fe 3+
负极: Cr 2+ -e-= Cr 3+
正极: Fe 3+ +e-= Fe2+
充电
放电
(2)全钒液流电池
负极:V2+-e-=V3+
正极:VO2++2H++e-=VO2++H2O
放电
离子颜色: V2+紫色, V3+绿色,
VO2+蓝色,VO2+黄色
阴极:V3++ e-=V2+
阳极:VO2+-e-+H2O=VO2++2H+
充电
VO2++2H++ V2+ V3+ +VO2++H2O
放电
充电
▲书写电极反应式应注意以下几点:
2.负极失电子所得氧化产物和正极得电子所得还原产物,与溶液的酸碱性有关(如+4价的C在酸性溶液中以CO2形式存在,在碱性溶液中以CO32-形式存在);
1.将两极反应的电子得失数配平后,相加得到总反应,总反应减去一极反应即得到另一极反应;
3.溶液中不存在O2-:在酸性溶液中它与H+结合成H2O、在碱性或中性溶液中它与水结合成OH-;
废电池污染治理刻不容缓
减少污染、节约资源
电池中含有大量的重金属如锌、铅、镉、汞、锰等。据专家测试,一节纽扣电池能污染60万升水;一节一号电池烂在地里,能使一平方米的土地失去利用价值。若将废旧电池混入生活垃圾一起填埋,渗出的重金属物质就会渗透土壤、污染地下水,进而进入鱼类、农作物等,破坏人类的生存环境,间接威胁到人类的健康,有的还能致癌。所以我们不要乱扔电池,要及时回收。
化学电源
概述
优点
分类
概念
优劣指标
组成
例析
一次电池
锌锰干电池
锌银电池
锂电池
二次电池
铅蓄电池
镍镉(氢)电池
锂离子电池
燃料电池:
氢气、甲烷、甲醇、铝、肼等
W=UQ=U×96500×n(e-) J
小结:
1J=
3.6×106
1
kw·h=
3.6×103
1
w·h
1.下面是几种常见的化学电源示意图,有关说法不正确的是( )
A.上述电池分别属于一次电池、二次电池和燃料电池
B.干电池在长时间使用后,锌筒被破坏
C.铅蓄电池工作过程中,每转移2mol电子,负极质量减小207g
D.氢氧燃料电池是一种具有广阔应用前景的绿色电源
学习评价:
C
2.某燃料电池可实现NO和CO的无害转化,其结构如图所示。下列说法正确的是( )
A.石墨Ⅰ电极上发生氧化反应
C.石墨Ⅱ电极上的反应式为
D.电路中每通过6mol电子,生成1mol
B.电池工作时 向石墨Ⅱ电极处移动
C
A.充电时a极接外电源的正极
B.放电时在电解质中 由a极向b极迁移
C.充电时若转移0.02mol电子,石墨电极将减少0.14g
D.该废旧电池进行“放电处理”有利于锂在 极回收
3.(双选)2019年诺贝尔化学奖授予了在锂离子电池研发领域作出贡献的三位科学家。一种锂离子电池的结构如图所示,电池反应为:
。下列说法正确的是( )
AD
4. (双选)科学家研发了“全氢电池”,其工作原理如图所示。下列说法不正确的是( )
A.右边吸附层中发生了还原反应
B.负极的电极反应是H2-2e-+2OH-= 2H2O
C.电池的总反应是2H2+O2 = 2H2O
D.电解质溶液中Na+向左移动,ClO4-向右移动
CD
再 见 !
