化学人教版(2019)必修第一册1.2.2离子反应 课件(共25张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.2.2离子反应 课件(共25张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-18 06:57:04 | ||
图片预览







文档简介
(共25张PPT)
第一章 物质及其变化
第二节 离子反应
第二课时 离子反应
1.认识离子反应及其发生的条件。
2.学会离子方程式的书写。
学习目标
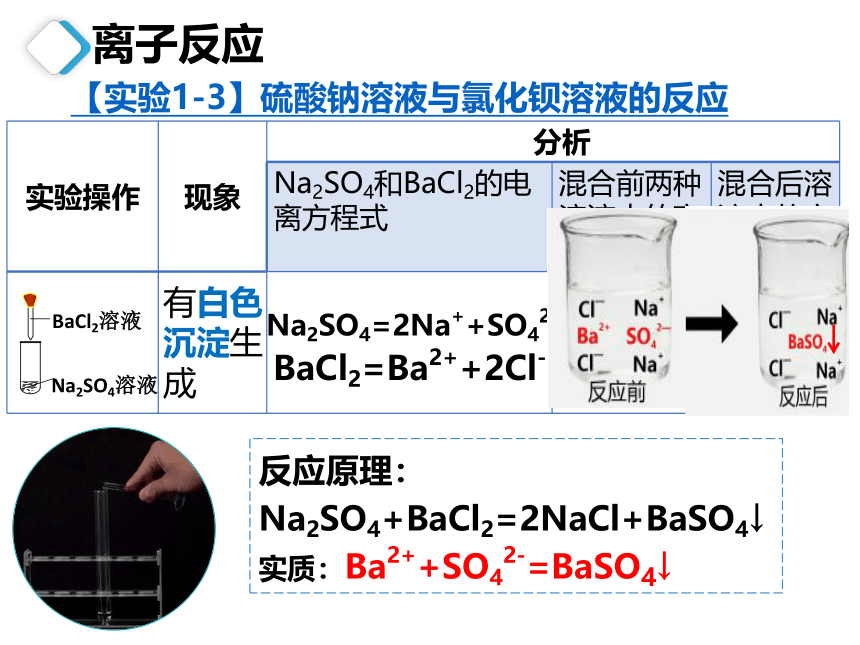
反应原理:Na2SO4+BaCl2=2NaCl+BaSO4↓
实质:Ba2++SO42-=BaSO4↓
【实验1-3】硫酸钠溶液与氯化钡溶液的反应
实验操作 现象 分析 Na2SO4和BaCl2的电离方程式 混合前两种溶液中的离子 混合后溶液中的离子
Na2SO4=2Na++SO42-
BaCl2=Ba2++2Cl-
有白色沉淀生成
Na+、Cl-
Na+、SO42-
Ba2+、Cl-
BaCl2溶液
Na2SO4溶液
离子反应
1.概念:由于电解质溶于水后电离成为离子,所以电解质在溶液中的反应实质上是离子之间的反应,这样的反应属于离子反应。
实质:离子反应使溶液中某些离子数目减少
表示方法——离子方程式(用实际参与反应的离子符号来表示反应的式子)
反应原理:Na2SO4+BaCl2=2NaCl+BaSO4↓
实质:Ba2++SO42-=BaSO4↓
离子反应
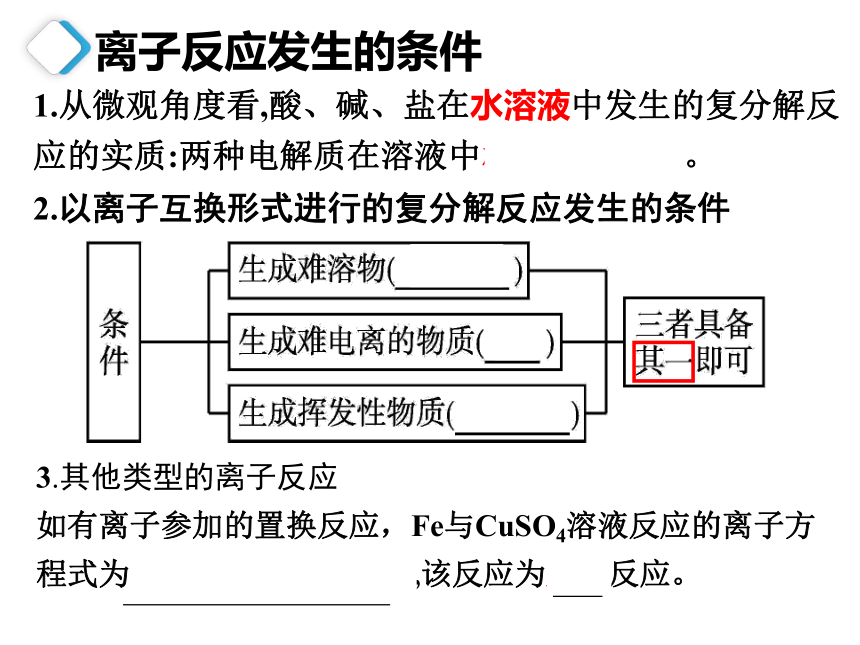
1.从微观角度看,酸、碱、盐在水溶液中发生的复分解反应的实质:两种电解质在溶液中相互交换离子。
2.以离子互换形式进行的复分解反应发生的条件
3.其他类型的离子反应
如有离子参加的置换反应,Fe与CuSO4溶液反应的离子方程式为Fe+Cu2+ === Cu+Fe2+,该反应为置换反应。
离子反应发生的条件
(1)定义:用实际参加反应的离子符号来表示反应的式子
①写出反应的化学方程式:
Na2SO4+BaCl2=BaSO4↓+2NaCl
②
2Na++SO42-+Ba2++2Cl-=BaSO4↓+2Na++2Cl-
③删去方程式两边不参加反应的离子
2Na++SO42-+Ba2++2Cl-=BaSO4↓+2Na++2Cl-
④检查方程式两边各元素的原子个数和电荷总数是
否相等 SO42-+Ba2+=BaSO4↓
写
拆
删
查
把易溶于水且易电离的物质拆成离子形式(如强酸、强碱和大部分可溶性盐),难溶的物质、单质、气体和难电离的物质(如水、醋酸),氧化物等仍用化学式表示
离子方程式
重难点:书写离子方程式时“拆”与“不能拆”
可拆
离子方程式
重难点:书写离子方程式时“拆”与“不能拆”
可拆
熟记课本P127页【溶解性规律表】
不能拆
熟记课本P127页【溶解性规律表】
多元弱酸的酸式酸根不能拆
三大强酸中浓硫酸不拆,浓盐酸和浓硝酸拆
离子方程式
反应物 化学方程式 离子方程式
HCl + NaOH
HCl + KOH H2SO4+NaOH H2SO4+KOH 【思考与讨论】完成下表,思考两种方程式不同
强酸、强碱发生中和反应的实质是:
(3)意义:不仅可以表示某一个具体的反应,还可以表示同一类型的反应。
强酸电离出H+与强碱电离出的OH-结合成水。
H2SO4+2KOH=K2SO4+2H2O
对点即练
(正确的打“√”,错误的打“×”)
( )
( )
( )
( )
( )
Fe+2H+=Fe2++H2↑
CO32-+2H+=H2O+CO2↑
Ba2++CO32-=BaCO3↓
OH-+H+=H2O
×
√
×
√
×
【练一练】写出下列反应的离子方程式 (一定遵循写、
拆、删、查四步)
(1)CuSO4溶液与Ba(OH)2溶液反应
(2)氢氧化铁与盐酸反应
(3)氧化铜与稀硫酸反应
(4)NaHSO4溶液与NaOH溶液反应
对点即练
Cu2++ SO4 2-+Ba2++2OH-=BaSO4 ↓+ Cu(OH)2↓
H++OH- =H2O
CuSO4+ Ba(OH)2 = BaSO4 ↓+ Cu(OH)2 ↓
写
拆
删
查
Cu2++ SO4 2-+Ba2++2OH-=BaSO4 ↓+Cu(OH)2↓
Cu2++ SO4 2-+Ba2++2OH-=BaSO4 ↓+Cu(OH)2↓
Cu2++ SO4 2-+Ba2++2OH-=BaSO4 ↓+Cu(OH)2↓
(2)氢氧化铁与盐酸反应
(3)氧化铜与稀硫酸反应
(4)NaHSO4溶液与NaOH溶液反应
NaHSO4+ NaOH = Na2SO4 +H2O
写
拆
删
查
Na++H+ + SO42-+Na++OH-=2Na+ + SO42- +H2O
Na++H+ + SO42-+Na++OH-=2Na+ + SO42- +H2O
H++OH- =H2O
“六看”判断离子方程式的正误
(1) 看是否符合客观事实
如Fe加入硫酸铜溶液中:
Fe+Cu2+=Fe2++Cu ( √ )
2Fe+3Cu2+=2Fe3++3Cu ( )
(2) 看是否符合拆写原则
如石灰石加入稀盐酸中:
CO32-+2H+=H2O+CO2↑ ( )
CO32-+2H+=H2O+CO2↑ ( √ )
×
×
(3) 看是否遵守质量守恒定律如Na2CO3与稀硫酸反应:
CaCO3+2H+=Ca2++CO2↑+H2O ( √ )
CO32-+H+=H2O+CO2↑ ( )
×
(4)看是否遵守电荷守恒
如钠与稀硫酸反应:
“六看”判断离子方程式的正误
(5)看是否漏掉参加反应的离子如CuSO4与Ba(OH)2溶液反应:
(6)看是否符合阴、阳离子的个数配比
如Ba(OH)2溶液和稀硫酸反应:
Ba2++SO42-=BaSO4↓ ( )
Cu2++ SO4 2-+Ba2++2OH-=BaSO4 ↓+ Cu(OH)2↓( √ )
×
Ba2++2OH-+2H++SO42- =BaSO4↓+2H2O ( √ )
Ba2++OH-+H++SO42- =BaSO4↓+H2O ( )
Na+2H+=Na++H2↑( )
2Na+2H+=2Na++H2↑ ( √ )
×
×
×
×
×
×
对点即练
CaCO3
Ba2++2OH-+2H++SO42- =BaSO4↓+2H2O
2
2
不反应
2.下列离子反应方程式书写正确的是( )
A
Fe2+
CaCO3
Ba2++2OH-+2H++SO42- =BaSO4↓+2H2O
B
Cu(OH)2+2H+=Cu2++2H2O
Ca(OH)2+CO2=CaCO3↓+H2O
二氧化碳和氯化钙不反应
对点即练
2.写出下列反应的离子方程式。(1)足量稀硝酸与CaCO3反应的离子方程式: ______________________________。(2)稀硫酸和氢氧化钡溶液反应的离子方程式: ____________________________。(3)澄清石灰水和少量碳酸氢钠反应的离子方程式:_________________________。
CaCO3+2H+ =Ca2+ +CO2 ↑+H2O
2H++SO42-+ Ba2++2OH-=BaSO4↓+2H2O
Ca2++HCO3-+OH-=CaCO3↓+H2O
1.离子方程式CO32-+2H+=H2O+CO2↑中的代表的物质可以是( )A.CaCO3 B.Na2CO3C.BaCO3 D.MgCO3
B
CaCO3+2H+=H2O+CO2↑+Ca2+
B
自我提升
4.蛋白质是人类必需的营养物质。蛋白质在①H2SO4、②NaOH溶液或酶的作用下,可水解成各种氨基酸。少量的③Na2SO4或④(NH4)2SO4能促进蛋白质的溶解,当向蛋白质中加入的上述物质的溶液达到一定浓度时,反而会使蛋白质从溶液中析出。在⑤C2H5OH或福尔马林的作用下蛋白质会失去生理活性。临床上,患者可通过服用生鸡蛋、牛奶、豆浆等来解救⑥Cu、汞等重金属盐中毒。蛋白质在人体中代谢的最终产物有⑦CO2、⑧H2O、氮氧化物以及尿素等。
回答下列问题:(1)在上述短文标有序号的物质中,属于盐的是________________(填序号,下同);属于电解质的是________________;能导电的是________。
③④
①②③④⑧
⑥
(2)铁质物件表面容易生锈(其主要成分是Fe2O3),可用物质①除铁锈,写出反应的离子方程式:______________________________,在除锈过程中若有气泡产生,则说明除锈基本完成,写出产生气泡的离子方程式: __________________________________________。(3)物质②容易吸收空气中的物质⑦而变质,写出反应的离子方程式:_____________________________________________。
Fe2O3+6H+=2Fe3++3H2O
Fe+2H+=Fe2++H2↑
CO2+2OH-=CO32-+H2O
②NaOH ⑦CO2
第一章 物质及其变化
第二节 离子反应
第二课时 离子反应
1.认识离子反应及其发生的条件。
2.学会离子方程式的书写。
学习目标
反应原理:Na2SO4+BaCl2=2NaCl+BaSO4↓
实质:Ba2++SO42-=BaSO4↓
【实验1-3】硫酸钠溶液与氯化钡溶液的反应
实验操作 现象 分析 Na2SO4和BaCl2的电离方程式 混合前两种溶液中的离子 混合后溶液中的离子
Na2SO4=2Na++SO42-
BaCl2=Ba2++2Cl-
有白色沉淀生成
Na+、Cl-
Na+、SO42-
Ba2+、Cl-
BaCl2溶液
Na2SO4溶液
离子反应
1.概念:由于电解质溶于水后电离成为离子,所以电解质在溶液中的反应实质上是离子之间的反应,这样的反应属于离子反应。
实质:离子反应使溶液中某些离子数目减少
表示方法——离子方程式(用实际参与反应的离子符号来表示反应的式子)
反应原理:Na2SO4+BaCl2=2NaCl+BaSO4↓
实质:Ba2++SO42-=BaSO4↓
离子反应
1.从微观角度看,酸、碱、盐在水溶液中发生的复分解反应的实质:两种电解质在溶液中相互交换离子。
2.以离子互换形式进行的复分解反应发生的条件
3.其他类型的离子反应
如有离子参加的置换反应,Fe与CuSO4溶液反应的离子方程式为Fe+Cu2+ === Cu+Fe2+,该反应为置换反应。
离子反应发生的条件
(1)定义:用实际参加反应的离子符号来表示反应的式子
①写出反应的化学方程式:
Na2SO4+BaCl2=BaSO4↓+2NaCl
②
2Na++SO42-+Ba2++2Cl-=BaSO4↓+2Na++2Cl-
③删去方程式两边不参加反应的离子
2Na++SO42-+Ba2++2Cl-=BaSO4↓+2Na++2Cl-
④检查方程式两边各元素的原子个数和电荷总数是
否相等 SO42-+Ba2+=BaSO4↓
写
拆
删
查
把易溶于水且易电离的物质拆成离子形式(如强酸、强碱和大部分可溶性盐),难溶的物质、单质、气体和难电离的物质(如水、醋酸),氧化物等仍用化学式表示
离子方程式
重难点:书写离子方程式时“拆”与“不能拆”
可拆
离子方程式
重难点:书写离子方程式时“拆”与“不能拆”
可拆
熟记课本P127页【溶解性规律表】
不能拆
熟记课本P127页【溶解性规律表】
多元弱酸的酸式酸根不能拆
三大强酸中浓硫酸不拆,浓盐酸和浓硝酸拆
离子方程式
反应物 化学方程式 离子方程式
HCl + NaOH
HCl + KOH H2SO4+NaOH H2SO4+KOH 【思考与讨论】完成下表,思考两种方程式不同
强酸、强碱发生中和反应的实质是:
(3)意义:不仅可以表示某一个具体的反应,还可以表示同一类型的反应。
强酸电离出H+与强碱电离出的OH-结合成水。
H2SO4+2KOH=K2SO4+2H2O
对点即练
(正确的打“√”,错误的打“×”)
( )
( )
( )
( )
( )
Fe+2H+=Fe2++H2↑
CO32-+2H+=H2O+CO2↑
Ba2++CO32-=BaCO3↓
OH-+H+=H2O
×
√
×
√
×
【练一练】写出下列反应的离子方程式 (一定遵循写、
拆、删、查四步)
(1)CuSO4溶液与Ba(OH)2溶液反应
(2)氢氧化铁与盐酸反应
(3)氧化铜与稀硫酸反应
(4)NaHSO4溶液与NaOH溶液反应
对点即练
Cu2++ SO4 2-+Ba2++2OH-=BaSO4 ↓+ Cu(OH)2↓
H++OH- =H2O
CuSO4+ Ba(OH)2 = BaSO4 ↓+ Cu(OH)2 ↓
写
拆
删
查
Cu2++ SO4 2-+Ba2++2OH-=BaSO4 ↓+Cu(OH)2↓
Cu2++ SO4 2-+Ba2++2OH-=BaSO4 ↓+Cu(OH)2↓
Cu2++ SO4 2-+Ba2++2OH-=BaSO4 ↓+Cu(OH)2↓
(2)氢氧化铁与盐酸反应
(3)氧化铜与稀硫酸反应
(4)NaHSO4溶液与NaOH溶液反应
NaHSO4+ NaOH = Na2SO4 +H2O
写
拆
删
查
Na++H+ + SO42-+Na++OH-=2Na+ + SO42- +H2O
Na++H+ + SO42-+Na++OH-=2Na+ + SO42- +H2O
H++OH- =H2O
“六看”判断离子方程式的正误
(1) 看是否符合客观事实
如Fe加入硫酸铜溶液中:
Fe+Cu2+=Fe2++Cu ( √ )
2Fe+3Cu2+=2Fe3++3Cu ( )
(2) 看是否符合拆写原则
如石灰石加入稀盐酸中:
CO32-+2H+=H2O+CO2↑ ( )
CO32-+2H+=H2O+CO2↑ ( √ )
×
×
(3) 看是否遵守质量守恒定律如Na2CO3与稀硫酸反应:
CaCO3+2H+=Ca2++CO2↑+H2O ( √ )
CO32-+H+=H2O+CO2↑ ( )
×
(4)看是否遵守电荷守恒
如钠与稀硫酸反应:
“六看”判断离子方程式的正误
(5)看是否漏掉参加反应的离子如CuSO4与Ba(OH)2溶液反应:
(6)看是否符合阴、阳离子的个数配比
如Ba(OH)2溶液和稀硫酸反应:
Ba2++SO42-=BaSO4↓ ( )
Cu2++ SO4 2-+Ba2++2OH-=BaSO4 ↓+ Cu(OH)2↓( √ )
×
Ba2++2OH-+2H++SO42- =BaSO4↓+2H2O ( √ )
Ba2++OH-+H++SO42- =BaSO4↓+H2O ( )
Na+2H+=Na++H2↑( )
2Na+2H+=2Na++H2↑ ( √ )
×
×
×
×
×
×
对点即练
CaCO3
Ba2++2OH-+2H++SO42- =BaSO4↓+2H2O
2
2
不反应
2.下列离子反应方程式书写正确的是( )
A
Fe2+
CaCO3
Ba2++2OH-+2H++SO42- =BaSO4↓+2H2O
B
Cu(OH)2+2H+=Cu2++2H2O
Ca(OH)2+CO2=CaCO3↓+H2O
二氧化碳和氯化钙不反应
对点即练
2.写出下列反应的离子方程式。(1)足量稀硝酸与CaCO3反应的离子方程式: ______________________________。(2)稀硫酸和氢氧化钡溶液反应的离子方程式: ____________________________。(3)澄清石灰水和少量碳酸氢钠反应的离子方程式:_________________________。
CaCO3+2H+ =Ca2+ +CO2 ↑+H2O
2H++SO42-+ Ba2++2OH-=BaSO4↓+2H2O
Ca2++HCO3-+OH-=CaCO3↓+H2O
1.离子方程式CO32-+2H+=H2O+CO2↑中的代表的物质可以是( )A.CaCO3 B.Na2CO3C.BaCO3 D.MgCO3
B
CaCO3+2H+=H2O+CO2↑+Ca2+
B
自我提升
4.蛋白质是人类必需的营养物质。蛋白质在①H2SO4、②NaOH溶液或酶的作用下,可水解成各种氨基酸。少量的③Na2SO4或④(NH4)2SO4能促进蛋白质的溶解,当向蛋白质中加入的上述物质的溶液达到一定浓度时,反而会使蛋白质从溶液中析出。在⑤C2H5OH或福尔马林的作用下蛋白质会失去生理活性。临床上,患者可通过服用生鸡蛋、牛奶、豆浆等来解救⑥Cu、汞等重金属盐中毒。蛋白质在人体中代谢的最终产物有⑦CO2、⑧H2O、氮氧化物以及尿素等。
回答下列问题:(1)在上述短文标有序号的物质中,属于盐的是________________(填序号,下同);属于电解质的是________________;能导电的是________。
③④
①②③④⑧
⑥
(2)铁质物件表面容易生锈(其主要成分是Fe2O3),可用物质①除铁锈,写出反应的离子方程式:______________________________,在除锈过程中若有气泡产生,则说明除锈基本完成,写出产生气泡的离子方程式: __________________________________________。(3)物质②容易吸收空气中的物质⑦而变质,写出反应的离子方程式:_____________________________________________。
Fe2O3+6H+=2Fe3++3H2O
Fe+2H+=Fe2++H2↑
CO2+2OH-=CO32-+H2O
②NaOH ⑦CO2
