科粤版九年级上册《第4章+生命之源---水》单元测试卷(含解析)
文档属性
| 名称 | 科粤版九年级上册《第4章+生命之源---水》单元测试卷(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 138.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-18 08:20:34 | ||
图片预览



文档简介
科粤版九年级上册《第4章 生命之源---水》单元测试卷
一、选择题
1.下列关于水的叙述,正确的是( )
A.“一水多用”是爱护水资源的重要方法
B.我国是水资源丰富的国家,不用担心缺水
C.长期饮用蒸馏水有利于人体健康
D.过滤可降低水的硬度
2.下列变化中,能用质量守恒定律解释的是( )
A.木炭燃烧,质量减少
B.5g水受热变成5g水蒸气
C.5g蔗糖溶解在95g水中,得到100g蔗糖溶液
D.100mL水中加入100mL酒精,得到体积小于200mL的溶液
3.木炭在高温条件下遇到水会发生剧烈反应生成多种气体的混合物,该气体混合物中不可能含有( )
A.CO B.CO2 C.H2 D.SO2
4.相同质量的下列单质分别与足量的氧气反应,消耗氧气最多的是( )
A.镁 B.硫 C.铜 D.碳
5.在一个密闭的容器中,充入a个CO和a个O2分子,在一定条件下充分反应(设反应前后原子个数不变),则容器内碳原子与氧原子个数之比为﹣﹣﹣( )
A.1:1 B.1:2 C.1:3 D.2:3
6.在化学反应A+2B═C+2D中,已知B和C的相对分子质量之比为8:11,当16g A与一定量B恰好完全反应后,生成44g C,则生成D的质量是( )
A.9g B.18g C.36g D.48g
7.在化学方程式2A+B═C+3D中,A、B、C的相对分子质量依次分别为103、71、160,则D相对分子质量为( )
A.39 B.117 C.114 D.38
8.某物质在氧气中完全燃烧时,生成质量比为44:27的CO2和H2O,则该物质可能是( )
A.CO B.CH4 C.C2H2 D.C2H5OH
9.“84“消毒液的主要成分是次氯酸钠(NaClO).“洁厕灵“的主要成分是盐酸,这两种日用品不能混用,否则会产生有毒的氯气(Cl2),其反应的化学方程式为2HCl+NaClO=NaCl+Cl2↑+X,则X是( )
A.O2 B.CO2 C.H2 D.H2O
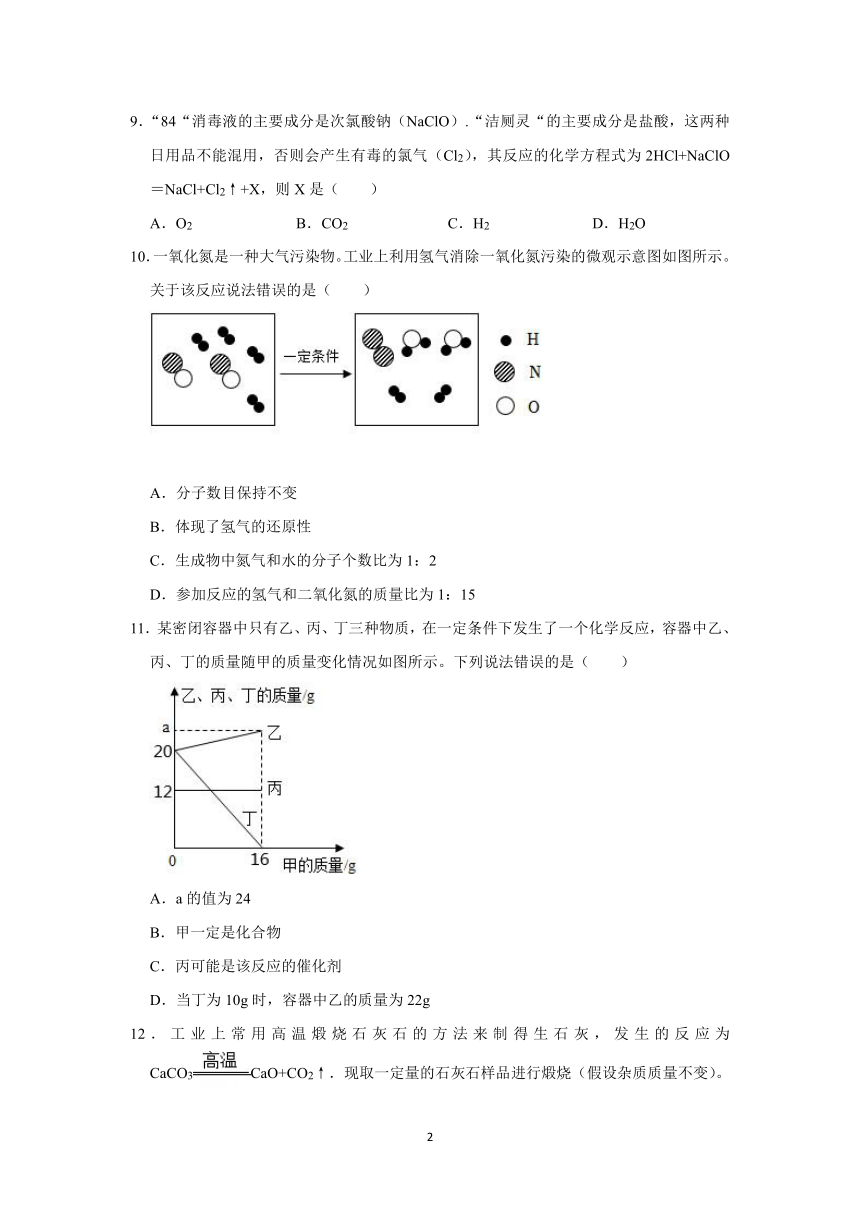
10.一氧化氮是一种大气污染物。工业上利用氢气消除一氧化氮污染的微观示意图如图所示。关于该反应说法错误的是( )
A.分子数目保持不变
B.体现了氢气的还原性
C.生成物中氮气和水的分子个数比为1:2
D.参加反应的氢气和二氧化氮的质量比为1:15
11.某密闭容器中只有乙、丙、丁三种物质,在一定条件下发生了一个化学反应,容器中乙、丙、丁的质量随甲的质量变化情况如图所示。下列说法错误的是( )
A.a的值为24
B.甲一定是化合物
C.丙可能是该反应的催化剂
D.当丁为10g时,容器中乙的质量为22g
12.工业上常用高温煅烧石灰石的方法来制得生石灰,发生的反应为CaCO3CaO+CO2↑.现取一定量的石灰石样品进行煅烧(假设杂质质量不变)。某变量y随时间的变化趋势如图所示,则纵坐标表示的是( )
A.生成CO2的体积 B.生成CaO的质量
C.固体中杂质的质量分数 D.固体中氧元素的质量
13.物质X在5g氧气中充分燃烧,反应方程式为X+3O2RO2+2SO2(R为某种未知元素),测得RO2和SO2的质量分别为2.2g和6.4g,下列判断正确的是( )
A.RO2中R的化合价为+2价
B.X中含有R、S、O三种元素
C.参加反应的X的质量为3.6g
D.反应后的混合物中有三种物质
14.一定质量的硫铁矿(主要成分是FeS2),高温烧发生如下反应(杂质不参加反应):4FeS2+11O2+8SO2+2Fe2O3,生成的SO2经过一系列反应全部变成H2SO4,把生成的H2SO4稀释后加入足量BaCl2溶液完全反应生成4.66t的沉淀,则硫铁矿中FeS2的质量为( )
A.1.2t B.2.28t C.1.28t D.2.4t
15.实验室用16克高锰酸钾放在试管中加热制取氧气,反应后称得的剩余固体物质的质量为14.4克,则剩余固体物质是( )
A.K2MnO4 B.K2MnO4和MnO2
C.KMnO4和K2MnO4 D.KMnO4和K2MnO4和MnO2
二、填空题
16.根据下列反应事实写出相应的化学方程式.
(1)常温下,铝和氧气发生反应,在铝表面形成致密的氧化铝膜
(2)稀盐酸与氧化铁反应,生成水和氯化铁溶液
(3)炼铁高炉内焦炭与二氧化碳反应生成一氧化碳:
(4)铁粉浸入硫酸铜溶液中,置换出单质铜,生成硫酸亚铁溶液 .
17.质量守恒在化学生活中广泛应用。
(1)某化合物完全燃烧消耗氧气14.4g,共生成13.2g二氧化碳和8.1g水,则该化合物组成中一定含有的元素是 。(填元素符号)
(2)化学反应A+B→C+D中,所加入的反应物A和B的质量分别为ag和bg,则生成的C和D的质量之和一定 (a+b)g(填“等于”“小于等于”或“大于等于”)。
(3)某工厂排放的废气中含有NO、NO2、N2中的两种或三种,则该废气中氧元素的质量分数不可能是 。(填序号)
A.20%
B.40%
C.60%
D.80%
(4)金属锂除了制造锂电池外,还可以用于储存氢气,其原理是金属锂(锂在化合物中通常显+1价)与氢气化合生成白色粉末状的氢化锂,氢化锂与水反应生成氢氧化锂和氢气。写出氢化锂与水反应的化学方程式 。
18.1909年德国化学家哈伯将氮气和氢气在高温、高压条件下合成氨气(NH3),反应的原理为:2N2+3H32NH3
(1)该反应中化合价降低的元素是 。
(2)若用下面a、b、c三幅模型图表示合成氨气的微观过程,则从反应开始到结束的排列顺序为 (用字母表示)。
(3)化学家维勒再将二氧化碳和氨气在一定条件下反应生成尿素【CO(NH2)2】和水,这一反应过程中,氨气和尿素的质量比为 。
三、实验题
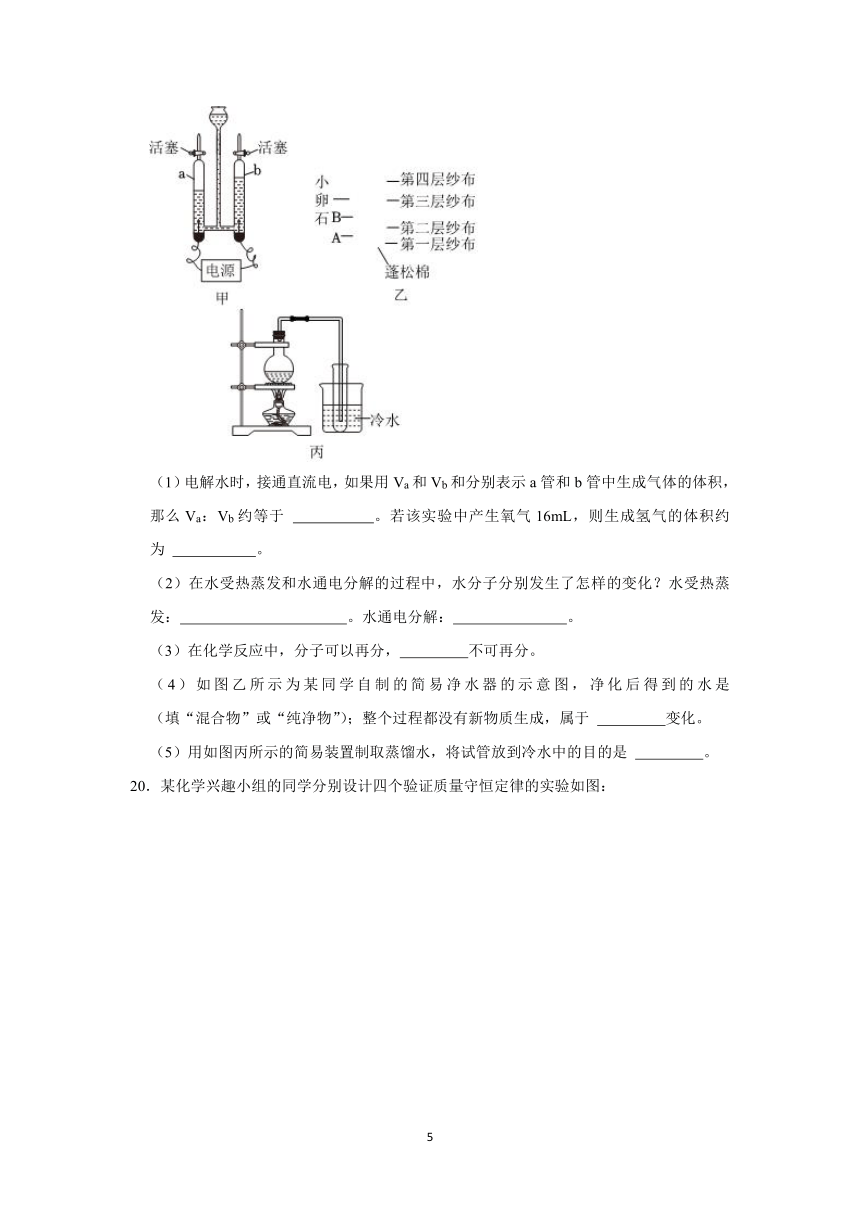
19.水是生命之源。请据图完成下列有关水的实验探究:
(1)电解水时,接通直流电,如果用Va和Vb和分别表示a管和b管中生成气体的体积,那么Va:Vb约等于 。若该实验中产生氧气16mL,则生成氢气的体积约为 。
(2)在水受热蒸发和水通电分解的过程中,水分子分别发生了怎样的变化?水受热蒸发: 。水通电分解: 。
(3)在化学反应中,分子可以再分, 不可再分。
(4)如图乙所示为某同学自制的简易净水器的示意图,净化后得到的水是 (填“混合物”或“纯净物”);整个过程都没有新物质生成,属于 变化。
(5)用如图丙所示的简易装置制取蒸馏水,将试管放到冷水中的目的是 。
20.某化学兴趣小组的同学分别设计四个验证质量守恒定律的实验如图:
(1)实验A中,发生化学反应的化学方程式为 ,小气球的作用除了密闭装置还有 。
(2)实验B中,反应前天平平衡,然后将稀盐酸倒入烧杯中与石灰石小块充分反应后再称量,观察到反应后天平不平衡,则天平指针向 偏转,其原因是 。
(3)如图C所示的小实验,在一根用细铜丝吊着的长玻璃棒两端分别绕上10cm长的粗铜线,并使玻璃棒保持水平;然后,用酒精灯给左边一端铜丝加热1﹣2分钟。冷却后,他们观察到的现象是:① ,② ,其原因是 。
(4)如图D所示的小实验,实验过程中,镁条完全燃烧后,称量石棉网上留下的固体质量反而比反应前镁条还轻,其原因可能是 ;若用该实验验证质量守恒定律,则应将该实验改在 的环境中进行。
四、计算题
21.小强买一包纯碱,包装如图,进行实验:准确称取5.5g样品放入烧杯中,向其中滴加盐酸至刚好完全反应(忽略CO2溶于水),共用去稀盐酸25g,得到溶液质量为28.3g(注:杂质溶于水,且与盐酸不反应。)求:
(1)生成CO2的质量;
(2)通过计算判断纯碱样品中碳酸钠的质量分数是否与包装说明相符。
(计算结果精确到0.1%)
五、解答题
22.推广使用车用乙醇汽油可以减少汽车尾气污染。利用秸秆可生产乙醇(化学式为C2H6O),该过程中包含葡萄糖(化学式为C6H12O6)转化为乙醇的反应:C6H12O62C2H6O+2CO2↑。
(1)生产2.3t乙醇,理论上参加反应的葡萄糖的质量为 。
(2)氧气充足时,乙醇在氧气中燃烧只生成二氧化碳和水,请写出该反应的化学方程式: 。
(3)氧气不足时,乙醇不完全燃烧会产生一氧化碳,某实验测得反应前后各物质的质量如表所示:
物质 乙醇 氧气 二氧化碳 水 一氧化碳
反应前质量/g 4.6 8.8 0 0 0
反应后质量/g 0 0 6.6 5.4 a
①表中a的值为 。
②该反应的化学方程式为4C2H6O+11O2 CO2+ H2O+ CO。
科粤版九年级上册《第4章 生命之源---水》单元测试卷
参考答案
一、选择题
1.【解答】解:A、“一水多用”能节约用水,是爱护水资源的重要方法,故选项说法正确。
B、我国人均淡水资源约占世界人均淡水资源的四分之一,许多地区出现水资源短缺,要节约用水,故选项说法错误。
C、蒸馏水中不含人体所需的微量的元素和矿物质,长期饮用蒸馏水不利于人体健康,故选项说法错误。
D、过滤只能除去水的不溶性杂质,不能除去可溶的钙、镁化合物,不能降低水的硬度,故选项说法错误。
故选:A。
2.【解答】解:A、木炭燃烧后质量减小,是因为燃烧生成的二氧化碳逸散到空气中,该变化中有新物质生成,属于化学变化,能用质量守恒定律解释,选项正确;
B、5g水受热变成5g水蒸气,是水状态的变化,该变化中没有新物质生成,属于物理变化,不能用质量守恒定律解释,选项错误;
C、5g蔗糖完全溶于95g水中,得到100g蔗糖溶液,是物质的溶解过程,该变化中没有新物质生成,属于物理变化,不能用质量守恒定律解释,选项错误;
D、向100mL水中加入100mL酒精,得到体积小于200mL的溶液,是因为分子之间有间隔,该变化中没有新物质生成,属于物理变化,不能用质量守恒定律解释,选项错误。
故选:A。
3.【解答】解:木炭在高温条件下遇到水会发生剧烈反应生成多种气体的混合物,木炭中有碳元素,水中有氢、氧元素,根据质量守恒定律,生成的气体混合物中只能含有碳、氢、氧元素,SO2中含有硫元素,所以该气体混合物中不可能含有SO2。
故选:D。
4.【解答】解:根据所该物质写出这4个反应的化学方程式,按O2的化学计量数为1进行配平,计算每种物质与O2的质量比:5
2Mg+O22MgO
S+O2SO2
2Cu+O22CuO
C+O2CO2
由此可知:消耗32份质量的O2所需4种物质的相对质量分别为:48、32、128、12,所以相同质量的这4种物质消耗O2最多的是碳;
故选:D。
5.【解答】解:由质量守恒定律可知,反应前后的原子个数不变,
则反应后容器内碳原子与氧原子个数等于反应前容器内碳原子与氧原子个数,
a个CO和a个O2分子中碳原子的个数为a×1=a,
a个CO和a个O2分子中氧原子的个数为a×1+a×2=3a,
则容器内碳原子与氧原子个数之比为a:3a=1:3,
故选:C。
6.【解答】解:B和C的相对分子质量之比为8:11,则B、C恰好完全反应时质量比是16:11,当16g A与一定量B恰好完全反应后,生成44g C,反应的B质量:44g×16÷11=64g,则生成D的质量是:16g+64g﹣44g=36g,
故选:C。
7.【解答】解:依据质量守恒定律可知,反应前后各物质的相对分子量之和相等,故有103×2+71=160+3D,很显然,D相对分子量为39。
故选:A。
8.【解答】解:根据题意“生成的CO2与水的质量比为44:27”,所以生成物中碳元素和氢元素的质量比=(44g××100%):(27g××100%)=4:1,
A、CO中不含氢元素,不会生成水,故A错误;
B、CH4中碳元素与氢元素的质量比=12:(1×4)=3:1,故B错误;
C、C2H2中碳元素与氢元素的质量比=(12×2):(1×2)=12:1,故C错误;
D、C2H5OH中碳元素与氢元素的质量比=(12×2):(1×6)=4:1,故D正确。
故选:D。
9.【解答】解:根据化学反应前后,原子的种类和数目不变可知,
反应物中含一个Na原子、3个Cl原子、2个H原子、1个O原子,生成物中含1个Na原子、3个Cl原子,故生成物中还应含2个H原子、1个O原子,
故X的化学式为:H2O。
故选:D。
10.【解答】解:由微观反应示意图可知,该反应是由一氧化氮和氢气在一定条件下反应生成氮气和水,化学方程式为2NO+2H2N2+2H2O。
A、由化学方程式可知,反应前后分子数目不同,故A说法错误;
B、在该反应中,氢气夺去了一氧化氮中的氧元素,体现了氢气的还原性,故B说法正确;
C、由化学方程式可知,生成物中氮气和水的分子个数比为1:2,故C说法正确;
D、由化学方程式可知,参加反应的氢气和一氧化氮的质量比为(2×2):(30×2)=1:15,故D说法正确。
故选:A。
11.【解答】解:A、丁反应了20g,生成了16g甲,生成乙的质量:20g﹣16g=4g,a=20+4=24,该选项说法正确;
B、丁分解生成甲和乙,因此甲可能是单质,该选项说法不正确;
C、丙反应前后质量不变,可能是该反应的催化剂,该选项说法正确;
D、丁和乙反应的质量比是20:4,当丁为10g时,即反应的丁质量是10g时,生成乙的质量是2g,容器中乙的质量为:20g+2g=22g,该选项说法正确。
故选:B。
12.【解答】解:A、碳酸钙高温煅烧后生成氧化钙、二氧化碳,开始固体中不含二氧化碳,应从零开始,故A错误;
B、碳酸钙高温煅烧后生成氧化钙、二氧化碳,开始固体中不含氧化钙,应从零开始,故B错误;
C、高温煅烧碳酸钙达到分解温度才开始分解,反应开始后,碳酸钙的质量减少,生成二氧化碳,所以固体总质量减少,但杂质不变,所以固体中杂质的质量分数会增大,当碳酸钙完全分解后,质量分数不再变化,故C正确;
D、碳酸钙高温煅烧后生成氧化钙、二氧化碳,根据质量守恒定律反应前后氧元素的质量不变,反应前碳酸钙中氧元素的质量分数为:×100%=48%,反应后,反应后,氧化钙中氧元素的质量分数为:×100%≈28.6%,固体中氧元素的质量分数减小,故D错误;
故选:C。
13.【解答】解:A.在化合物中,氧元素显﹣2价,由化合物中各元素正负化合价的代数和为零原则可知,R元素显+4价,选项说法错误;
B.设参加反应的氧气质量为m,RO2的相对分子质量为n,则:
X+3O2RO2+2SO2
96 n 128
m 2.2g 6.4g
m=4.8g
n=44
R的相对原子质量为:44﹣32=12
由质量守恒定律可知,X中一定含有R元素与硫元素,2.2gRO2中R元素的质量为:2.2g×=0.6g,其中含氧元素的质量为:2.2g﹣0.6g=1.6g
6.4gSO2中含硫元素的质量为:6.4g×=3.2g,其中含氧元素的质量为:6.4g﹣3.2g=3.2g
3.2g+1.6g=4.8g,所以X中只含R元素与硫元素,不含氧元素,选项说法错误;
C.由质量守恒定律可知,参加反应的X的质量为:2.2g+6.4g﹣4.8g=3.8g,选项说法错误;
D.由以上分析可知,反应后氧气有剩余,所以反应后的混合物中有氧气、RO2和SO2三种物质,选项说法正确。
故选:D。
14.【解答】解:设参加硫铁矿中FeS2的质量为x
FeS2﹣﹣﹣﹣﹣﹣﹣﹣2S﹣﹣﹣﹣﹣﹣2BaSO4,
120 466
x 4.66t
=
x=1.2t
故选:A。
15.【解答】解:首先只要反应就生成二氧化锰,排除选项AC.BD的区别就在于是否剩余高锰酸钾,所以只需求算高锰酸钾是否完全反应。
根据质量守恒定律可知生成的氧气的质量为16g﹣14.4g=1.6g
设参加反应的高锰酸钾的质量为x。
2KMnO4K2MnO4+MnO2+O2↑
316 32
x 1.6g
=
x=15.8g
即高锰酸钾没有完全反应,有剩余。故选D。
故选:D。
二、填空题
16.【解答】解:(1)铝和氧气反应的化学方程式为:4Al+3O2═2Al2O3;
(2)氧化铁和稀盐酸反应的化学方程式为:Fe2O3+6HCl═2FeCl3+3H2O;
(3)二氧化碳和碳反应的化学方程式为:CO2+C2CO;
(4)铁和硫酸铜反应的化学方程式为:Fe+CuSO4═FeSO4+Cu.
故填:4Al+3O2═2Al2O3;Fe2O3+6HCl═2FeCl3+3H2O;CO2+C2CO;Fe+CuSO4═FeSO4+Cu.
17.【解答】解:(1)根据质量守恒定律,该化合物和氧气反应生成二氧化碳和水,则该化合物中一定含有碳元素和氢元素,可能含有氧元素;13.2g二氧化碳中氧元素的质量为13.2g××100%=9.6g;8.1g水中氧元素的质量为8.1g××100%=7.2g;生成物中氧元素的质量之和9.6g+7.2g=16.8g>14.4g,则化合物中也含有氧元素,因此该化合物组成中一定含有的元素是C、H、O;故答案为:C、H、O;
(2)化学反应A+B→C+D中,所加入的反应物A和B的质量分别为ag和bg,若A和B恰好完全反应,则生成的C和D的质量之和为(a+b)g;若A和B不恰好完全反应,则生成的C和D的质量之和<(a+b)g;因此生成的C和D的质量之和一定小于等于(a+b)g;故答案为:小于等于;
(3)NO中氧元素的质量分数为×100%≈53.3%;NO2中氧元素的质量分数为×100%≈69.6%;N2中氧元素的质量分数为0;其中NO2的质量分数最高,不管与另外的一种或两种气体混合,废气中氧元素的质量分数都不可能大于69.6%;因此废气中氧元素的质量分数在0~69.6%之间,故选;D;
(4)氢化锂与水反应生成氢氧化锂和氢气,反应的化学方程式为:LiH+H2O=LiOH+H2↑;故答案为:LiH+H2O=LiOH+H2↑。
18.【解答】解:(1)由物质的变化和化合价原则可知,氮元素由0价变为﹣3价,化合价降低;
(2)由化学变化的实质是分子破裂原子的重新组合可知,合成氨气的微观过程从反应开始到结束的排列顺序为acb;
(3)将二氧化碳和氨气在一定条件下反应生成尿素和水,反应的方程式是:2NH3+CO2CO(NH2)2+H2O,由方程式的意义可知,氨气和尿素的质量比为 (17×2):60=17:30.
故答案为:(1)氮元素;
(2)acb;
(3)17:30.
三、实验题
19.【解答】解:(1)电解水时,生成的氧气和氢气的体积比为1:2,由于b玻璃管中产生的气体少,则b玻璃管中的气体为氧气,那么Va:Vb约等于2:1,若产生氧气16mL,则生成氢气的体积为16mL×2=32mL。
(2)水受热蒸发的过程中,水分子种类不变,只是水分子之间的间隔改变;水通电分解的过程中,水分子发生了改变。
(3)在化学变化中,分子可再分,原子不可再分。
(4)水通过简易净水器只能除去其中的难溶性杂质、颜色及异味,但净化后得到的水中仍含有可溶性杂质,则为混合物;由于整个过程都没有新物质生成,属于物理变化。
(5)图丙为蒸馏的简易装置,其中将试管放到冷水中的目的是降温。
故答案为:(1)2:1;32mL;
(2)水分子种类不变,只是水分子之间的间隔改变;水分子发生了改变;
(3)原子;
(4)混合物;物理;
(5)降温。
20.【解答】解:(1)实验A中,发生化学反应的化学方程式为4P+5O22P2O5,小气球的作用除了密闭装置还有平衡装置内外气压,防止瓶塞飞出。
故答案为:4P+5O22P2O5;平衡装置内外气压,防止瓶塞飞出。
(2)实验B中,反应前天平平衡,然后将稀盐酸倒入烧杯中与石灰石小块充分反应后再称量,观察到反应后天平不平衡,则天平指针向右偏转,其原因是反应生成的二氧化碳逸出装置。
故答案为:右;反应生成的二氧化碳逸出装置。
(3)观察到的现象是a端红色固体变黑色,a端下降,b端上升,其原因是加热时铜和氧气反应生成氧化铜。
故答案为:a端红色固体变黑色;a端下降,b端上升;加热时铜和氧气反应生成氧化铜。
(4)如图D所示的小实验,实验过程中,镁条完全燃烧后,称量石棉网上留下的固体质量反而比反应前镁条还轻,其原因可能是反应生成的部分氧化镁扩散到空气中;若用该实验验证质量守恒定律,则应将该实验改在密封装置的环境中进行。
故答案为:反应生成的部分氧化镁扩散到空气中;密封装置。
四、计算题
21.【解答】解:(1)反应放出气体二氧化碳质量=5.5g+25g﹣28.3g=2.2g。
(2)设5.5g样品中含有碳酸钠的质量为x。
Na2CO3+2HCl=2NaCl+CO2↑+H2O
106 44
x 2.2g
则,解得x=5.3g
则样品中碳酸钠的质量分数为×100%≈96.4%
因为96.4%<98%,所以与包装说明不符
故答案为:(1)2.2g;(2)经计算,碳酸钠的质量分数为96.4%,与包装说明不符。
五、解答题
22.【解答】解:(1)设葡萄糖质量为x。
C6H12O62C2H6O+2CO2↑
180 92
x 2.3t
x=4.5t
答:生产2.3t乙醇,理论上参加反应的葡萄糖的质量是4.5t;
(2)乙醇完全燃烧生成二氧化碳和水,反应的化学方程式为:C2H6O+3O22CO2+3H2O;
(3)①根据化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,因此4.6g+8.8g+0g+0g+0g=0g+0g+6.6g+5.4g+a,a=1.4g;
②由表中的数据可知,生成二氧化碳6.6g,生成一氧化碳1.4g,因此生成的二氧化碳与一氧化碳的分子个数比为:=3:1;由化学反应前后原子的种类和数目不变可知,该实验发生反应的化学方程式为:4C2H6O+11O26CO2+12H2O+2CO。
故答案为:(1)4.5t;
(2)C2H6O+3O22CO2+3H2O;
(3)①1.4;
②6;12;2
(
1
)
一、选择题
1.下列关于水的叙述,正确的是( )
A.“一水多用”是爱护水资源的重要方法
B.我国是水资源丰富的国家,不用担心缺水
C.长期饮用蒸馏水有利于人体健康
D.过滤可降低水的硬度
2.下列变化中,能用质量守恒定律解释的是( )
A.木炭燃烧,质量减少
B.5g水受热变成5g水蒸气
C.5g蔗糖溶解在95g水中,得到100g蔗糖溶液
D.100mL水中加入100mL酒精,得到体积小于200mL的溶液
3.木炭在高温条件下遇到水会发生剧烈反应生成多种气体的混合物,该气体混合物中不可能含有( )
A.CO B.CO2 C.H2 D.SO2
4.相同质量的下列单质分别与足量的氧气反应,消耗氧气最多的是( )
A.镁 B.硫 C.铜 D.碳
5.在一个密闭的容器中,充入a个CO和a个O2分子,在一定条件下充分反应(设反应前后原子个数不变),则容器内碳原子与氧原子个数之比为﹣﹣﹣( )
A.1:1 B.1:2 C.1:3 D.2:3
6.在化学反应A+2B═C+2D中,已知B和C的相对分子质量之比为8:11,当16g A与一定量B恰好完全反应后,生成44g C,则生成D的质量是( )
A.9g B.18g C.36g D.48g
7.在化学方程式2A+B═C+3D中,A、B、C的相对分子质量依次分别为103、71、160,则D相对分子质量为( )
A.39 B.117 C.114 D.38
8.某物质在氧气中完全燃烧时,生成质量比为44:27的CO2和H2O,则该物质可能是( )
A.CO B.CH4 C.C2H2 D.C2H5OH
9.“84“消毒液的主要成分是次氯酸钠(NaClO).“洁厕灵“的主要成分是盐酸,这两种日用品不能混用,否则会产生有毒的氯气(Cl2),其反应的化学方程式为2HCl+NaClO=NaCl+Cl2↑+X,则X是( )
A.O2 B.CO2 C.H2 D.H2O
10.一氧化氮是一种大气污染物。工业上利用氢气消除一氧化氮污染的微观示意图如图所示。关于该反应说法错误的是( )
A.分子数目保持不变
B.体现了氢气的还原性
C.生成物中氮气和水的分子个数比为1:2
D.参加反应的氢气和二氧化氮的质量比为1:15
11.某密闭容器中只有乙、丙、丁三种物质,在一定条件下发生了一个化学反应,容器中乙、丙、丁的质量随甲的质量变化情况如图所示。下列说法错误的是( )
A.a的值为24
B.甲一定是化合物
C.丙可能是该反应的催化剂
D.当丁为10g时,容器中乙的质量为22g
12.工业上常用高温煅烧石灰石的方法来制得生石灰,发生的反应为CaCO3CaO+CO2↑.现取一定量的石灰石样品进行煅烧(假设杂质质量不变)。某变量y随时间的变化趋势如图所示,则纵坐标表示的是( )
A.生成CO2的体积 B.生成CaO的质量
C.固体中杂质的质量分数 D.固体中氧元素的质量
13.物质X在5g氧气中充分燃烧,反应方程式为X+3O2RO2+2SO2(R为某种未知元素),测得RO2和SO2的质量分别为2.2g和6.4g,下列判断正确的是( )
A.RO2中R的化合价为+2价
B.X中含有R、S、O三种元素
C.参加反应的X的质量为3.6g
D.反应后的混合物中有三种物质
14.一定质量的硫铁矿(主要成分是FeS2),高温烧发生如下反应(杂质不参加反应):4FeS2+11O2+8SO2+2Fe2O3,生成的SO2经过一系列反应全部变成H2SO4,把生成的H2SO4稀释后加入足量BaCl2溶液完全反应生成4.66t的沉淀,则硫铁矿中FeS2的质量为( )
A.1.2t B.2.28t C.1.28t D.2.4t
15.实验室用16克高锰酸钾放在试管中加热制取氧气,反应后称得的剩余固体物质的质量为14.4克,则剩余固体物质是( )
A.K2MnO4 B.K2MnO4和MnO2
C.KMnO4和K2MnO4 D.KMnO4和K2MnO4和MnO2
二、填空题
16.根据下列反应事实写出相应的化学方程式.
(1)常温下,铝和氧气发生反应,在铝表面形成致密的氧化铝膜
(2)稀盐酸与氧化铁反应,生成水和氯化铁溶液
(3)炼铁高炉内焦炭与二氧化碳反应生成一氧化碳:
(4)铁粉浸入硫酸铜溶液中,置换出单质铜,生成硫酸亚铁溶液 .
17.质量守恒在化学生活中广泛应用。
(1)某化合物完全燃烧消耗氧气14.4g,共生成13.2g二氧化碳和8.1g水,则该化合物组成中一定含有的元素是 。(填元素符号)
(2)化学反应A+B→C+D中,所加入的反应物A和B的质量分别为ag和bg,则生成的C和D的质量之和一定 (a+b)g(填“等于”“小于等于”或“大于等于”)。
(3)某工厂排放的废气中含有NO、NO2、N2中的两种或三种,则该废气中氧元素的质量分数不可能是 。(填序号)
A.20%
B.40%
C.60%
D.80%
(4)金属锂除了制造锂电池外,还可以用于储存氢气,其原理是金属锂(锂在化合物中通常显+1价)与氢气化合生成白色粉末状的氢化锂,氢化锂与水反应生成氢氧化锂和氢气。写出氢化锂与水反应的化学方程式 。
18.1909年德国化学家哈伯将氮气和氢气在高温、高压条件下合成氨气(NH3),反应的原理为:2N2+3H32NH3
(1)该反应中化合价降低的元素是 。
(2)若用下面a、b、c三幅模型图表示合成氨气的微观过程,则从反应开始到结束的排列顺序为 (用字母表示)。
(3)化学家维勒再将二氧化碳和氨气在一定条件下反应生成尿素【CO(NH2)2】和水,这一反应过程中,氨气和尿素的质量比为 。
三、实验题
19.水是生命之源。请据图完成下列有关水的实验探究:
(1)电解水时,接通直流电,如果用Va和Vb和分别表示a管和b管中生成气体的体积,那么Va:Vb约等于 。若该实验中产生氧气16mL,则生成氢气的体积约为 。
(2)在水受热蒸发和水通电分解的过程中,水分子分别发生了怎样的变化?水受热蒸发: 。水通电分解: 。
(3)在化学反应中,分子可以再分, 不可再分。
(4)如图乙所示为某同学自制的简易净水器的示意图,净化后得到的水是 (填“混合物”或“纯净物”);整个过程都没有新物质生成,属于 变化。
(5)用如图丙所示的简易装置制取蒸馏水,将试管放到冷水中的目的是 。
20.某化学兴趣小组的同学分别设计四个验证质量守恒定律的实验如图:
(1)实验A中,发生化学反应的化学方程式为 ,小气球的作用除了密闭装置还有 。
(2)实验B中,反应前天平平衡,然后将稀盐酸倒入烧杯中与石灰石小块充分反应后再称量,观察到反应后天平不平衡,则天平指针向 偏转,其原因是 。
(3)如图C所示的小实验,在一根用细铜丝吊着的长玻璃棒两端分别绕上10cm长的粗铜线,并使玻璃棒保持水平;然后,用酒精灯给左边一端铜丝加热1﹣2分钟。冷却后,他们观察到的现象是:① ,② ,其原因是 。
(4)如图D所示的小实验,实验过程中,镁条完全燃烧后,称量石棉网上留下的固体质量反而比反应前镁条还轻,其原因可能是 ;若用该实验验证质量守恒定律,则应将该实验改在 的环境中进行。
四、计算题
21.小强买一包纯碱,包装如图,进行实验:准确称取5.5g样品放入烧杯中,向其中滴加盐酸至刚好完全反应(忽略CO2溶于水),共用去稀盐酸25g,得到溶液质量为28.3g(注:杂质溶于水,且与盐酸不反应。)求:
(1)生成CO2的质量;
(2)通过计算判断纯碱样品中碳酸钠的质量分数是否与包装说明相符。
(计算结果精确到0.1%)
五、解答题
22.推广使用车用乙醇汽油可以减少汽车尾气污染。利用秸秆可生产乙醇(化学式为C2H6O),该过程中包含葡萄糖(化学式为C6H12O6)转化为乙醇的反应:C6H12O62C2H6O+2CO2↑。
(1)生产2.3t乙醇,理论上参加反应的葡萄糖的质量为 。
(2)氧气充足时,乙醇在氧气中燃烧只生成二氧化碳和水,请写出该反应的化学方程式: 。
(3)氧气不足时,乙醇不完全燃烧会产生一氧化碳,某实验测得反应前后各物质的质量如表所示:
物质 乙醇 氧气 二氧化碳 水 一氧化碳
反应前质量/g 4.6 8.8 0 0 0
反应后质量/g 0 0 6.6 5.4 a
①表中a的值为 。
②该反应的化学方程式为4C2H6O+11O2 CO2+ H2O+ CO。
科粤版九年级上册《第4章 生命之源---水》单元测试卷
参考答案
一、选择题
1.【解答】解:A、“一水多用”能节约用水,是爱护水资源的重要方法,故选项说法正确。
B、我国人均淡水资源约占世界人均淡水资源的四分之一,许多地区出现水资源短缺,要节约用水,故选项说法错误。
C、蒸馏水中不含人体所需的微量的元素和矿物质,长期饮用蒸馏水不利于人体健康,故选项说法错误。
D、过滤只能除去水的不溶性杂质,不能除去可溶的钙、镁化合物,不能降低水的硬度,故选项说法错误。
故选:A。
2.【解答】解:A、木炭燃烧后质量减小,是因为燃烧生成的二氧化碳逸散到空气中,该变化中有新物质生成,属于化学变化,能用质量守恒定律解释,选项正确;
B、5g水受热变成5g水蒸气,是水状态的变化,该变化中没有新物质生成,属于物理变化,不能用质量守恒定律解释,选项错误;
C、5g蔗糖完全溶于95g水中,得到100g蔗糖溶液,是物质的溶解过程,该变化中没有新物质生成,属于物理变化,不能用质量守恒定律解释,选项错误;
D、向100mL水中加入100mL酒精,得到体积小于200mL的溶液,是因为分子之间有间隔,该变化中没有新物质生成,属于物理变化,不能用质量守恒定律解释,选项错误。
故选:A。
3.【解答】解:木炭在高温条件下遇到水会发生剧烈反应生成多种气体的混合物,木炭中有碳元素,水中有氢、氧元素,根据质量守恒定律,生成的气体混合物中只能含有碳、氢、氧元素,SO2中含有硫元素,所以该气体混合物中不可能含有SO2。
故选:D。
4.【解答】解:根据所该物质写出这4个反应的化学方程式,按O2的化学计量数为1进行配平,计算每种物质与O2的质量比:5
2Mg+O22MgO
S+O2SO2
2Cu+O22CuO
C+O2CO2
由此可知:消耗32份质量的O2所需4种物质的相对质量分别为:48、32、128、12,所以相同质量的这4种物质消耗O2最多的是碳;
故选:D。
5.【解答】解:由质量守恒定律可知,反应前后的原子个数不变,
则反应后容器内碳原子与氧原子个数等于反应前容器内碳原子与氧原子个数,
a个CO和a个O2分子中碳原子的个数为a×1=a,
a个CO和a个O2分子中氧原子的个数为a×1+a×2=3a,
则容器内碳原子与氧原子个数之比为a:3a=1:3,
故选:C。
6.【解答】解:B和C的相对分子质量之比为8:11,则B、C恰好完全反应时质量比是16:11,当16g A与一定量B恰好完全反应后,生成44g C,反应的B质量:44g×16÷11=64g,则生成D的质量是:16g+64g﹣44g=36g,
故选:C。
7.【解答】解:依据质量守恒定律可知,反应前后各物质的相对分子量之和相等,故有103×2+71=160+3D,很显然,D相对分子量为39。
故选:A。
8.【解答】解:根据题意“生成的CO2与水的质量比为44:27”,所以生成物中碳元素和氢元素的质量比=(44g××100%):(27g××100%)=4:1,
A、CO中不含氢元素,不会生成水,故A错误;
B、CH4中碳元素与氢元素的质量比=12:(1×4)=3:1,故B错误;
C、C2H2中碳元素与氢元素的质量比=(12×2):(1×2)=12:1,故C错误;
D、C2H5OH中碳元素与氢元素的质量比=(12×2):(1×6)=4:1,故D正确。
故选:D。
9.【解答】解:根据化学反应前后,原子的种类和数目不变可知,
反应物中含一个Na原子、3个Cl原子、2个H原子、1个O原子,生成物中含1个Na原子、3个Cl原子,故生成物中还应含2个H原子、1个O原子,
故X的化学式为:H2O。
故选:D。
10.【解答】解:由微观反应示意图可知,该反应是由一氧化氮和氢气在一定条件下反应生成氮气和水,化学方程式为2NO+2H2N2+2H2O。
A、由化学方程式可知,反应前后分子数目不同,故A说法错误;
B、在该反应中,氢气夺去了一氧化氮中的氧元素,体现了氢气的还原性,故B说法正确;
C、由化学方程式可知,生成物中氮气和水的分子个数比为1:2,故C说法正确;
D、由化学方程式可知,参加反应的氢气和一氧化氮的质量比为(2×2):(30×2)=1:15,故D说法正确。
故选:A。
11.【解答】解:A、丁反应了20g,生成了16g甲,生成乙的质量:20g﹣16g=4g,a=20+4=24,该选项说法正确;
B、丁分解生成甲和乙,因此甲可能是单质,该选项说法不正确;
C、丙反应前后质量不变,可能是该反应的催化剂,该选项说法正确;
D、丁和乙反应的质量比是20:4,当丁为10g时,即反应的丁质量是10g时,生成乙的质量是2g,容器中乙的质量为:20g+2g=22g,该选项说法正确。
故选:B。
12.【解答】解:A、碳酸钙高温煅烧后生成氧化钙、二氧化碳,开始固体中不含二氧化碳,应从零开始,故A错误;
B、碳酸钙高温煅烧后生成氧化钙、二氧化碳,开始固体中不含氧化钙,应从零开始,故B错误;
C、高温煅烧碳酸钙达到分解温度才开始分解,反应开始后,碳酸钙的质量减少,生成二氧化碳,所以固体总质量减少,但杂质不变,所以固体中杂质的质量分数会增大,当碳酸钙完全分解后,质量分数不再变化,故C正确;
D、碳酸钙高温煅烧后生成氧化钙、二氧化碳,根据质量守恒定律反应前后氧元素的质量不变,反应前碳酸钙中氧元素的质量分数为:×100%=48%,反应后,反应后,氧化钙中氧元素的质量分数为:×100%≈28.6%,固体中氧元素的质量分数减小,故D错误;
故选:C。
13.【解答】解:A.在化合物中,氧元素显﹣2价,由化合物中各元素正负化合价的代数和为零原则可知,R元素显+4价,选项说法错误;
B.设参加反应的氧气质量为m,RO2的相对分子质量为n,则:
X+3O2RO2+2SO2
96 n 128
m 2.2g 6.4g
m=4.8g
n=44
R的相对原子质量为:44﹣32=12
由质量守恒定律可知,X中一定含有R元素与硫元素,2.2gRO2中R元素的质量为:2.2g×=0.6g,其中含氧元素的质量为:2.2g﹣0.6g=1.6g
6.4gSO2中含硫元素的质量为:6.4g×=3.2g,其中含氧元素的质量为:6.4g﹣3.2g=3.2g
3.2g+1.6g=4.8g,所以X中只含R元素与硫元素,不含氧元素,选项说法错误;
C.由质量守恒定律可知,参加反应的X的质量为:2.2g+6.4g﹣4.8g=3.8g,选项说法错误;
D.由以上分析可知,反应后氧气有剩余,所以反应后的混合物中有氧气、RO2和SO2三种物质,选项说法正确。
故选:D。
14.【解答】解:设参加硫铁矿中FeS2的质量为x
FeS2﹣﹣﹣﹣﹣﹣﹣﹣2S﹣﹣﹣﹣﹣﹣2BaSO4,
120 466
x 4.66t
=
x=1.2t
故选:A。
15.【解答】解:首先只要反应就生成二氧化锰,排除选项AC.BD的区别就在于是否剩余高锰酸钾,所以只需求算高锰酸钾是否完全反应。
根据质量守恒定律可知生成的氧气的质量为16g﹣14.4g=1.6g
设参加反应的高锰酸钾的质量为x。
2KMnO4K2MnO4+MnO2+O2↑
316 32
x 1.6g
=
x=15.8g
即高锰酸钾没有完全反应,有剩余。故选D。
故选:D。
二、填空题
16.【解答】解:(1)铝和氧气反应的化学方程式为:4Al+3O2═2Al2O3;
(2)氧化铁和稀盐酸反应的化学方程式为:Fe2O3+6HCl═2FeCl3+3H2O;
(3)二氧化碳和碳反应的化学方程式为:CO2+C2CO;
(4)铁和硫酸铜反应的化学方程式为:Fe+CuSO4═FeSO4+Cu.
故填:4Al+3O2═2Al2O3;Fe2O3+6HCl═2FeCl3+3H2O;CO2+C2CO;Fe+CuSO4═FeSO4+Cu.
17.【解答】解:(1)根据质量守恒定律,该化合物和氧气反应生成二氧化碳和水,则该化合物中一定含有碳元素和氢元素,可能含有氧元素;13.2g二氧化碳中氧元素的质量为13.2g××100%=9.6g;8.1g水中氧元素的质量为8.1g××100%=7.2g;生成物中氧元素的质量之和9.6g+7.2g=16.8g>14.4g,则化合物中也含有氧元素,因此该化合物组成中一定含有的元素是C、H、O;故答案为:C、H、O;
(2)化学反应A+B→C+D中,所加入的反应物A和B的质量分别为ag和bg,若A和B恰好完全反应,则生成的C和D的质量之和为(a+b)g;若A和B不恰好完全反应,则生成的C和D的质量之和<(a+b)g;因此生成的C和D的质量之和一定小于等于(a+b)g;故答案为:小于等于;
(3)NO中氧元素的质量分数为×100%≈53.3%;NO2中氧元素的质量分数为×100%≈69.6%;N2中氧元素的质量分数为0;其中NO2的质量分数最高,不管与另外的一种或两种气体混合,废气中氧元素的质量分数都不可能大于69.6%;因此废气中氧元素的质量分数在0~69.6%之间,故选;D;
(4)氢化锂与水反应生成氢氧化锂和氢气,反应的化学方程式为:LiH+H2O=LiOH+H2↑;故答案为:LiH+H2O=LiOH+H2↑。
18.【解答】解:(1)由物质的变化和化合价原则可知,氮元素由0价变为﹣3价,化合价降低;
(2)由化学变化的实质是分子破裂原子的重新组合可知,合成氨气的微观过程从反应开始到结束的排列顺序为acb;
(3)将二氧化碳和氨气在一定条件下反应生成尿素和水,反应的方程式是:2NH3+CO2CO(NH2)2+H2O,由方程式的意义可知,氨气和尿素的质量比为 (17×2):60=17:30.
故答案为:(1)氮元素;
(2)acb;
(3)17:30.
三、实验题
19.【解答】解:(1)电解水时,生成的氧气和氢气的体积比为1:2,由于b玻璃管中产生的气体少,则b玻璃管中的气体为氧气,那么Va:Vb约等于2:1,若产生氧气16mL,则生成氢气的体积为16mL×2=32mL。
(2)水受热蒸发的过程中,水分子种类不变,只是水分子之间的间隔改变;水通电分解的过程中,水分子发生了改变。
(3)在化学变化中,分子可再分,原子不可再分。
(4)水通过简易净水器只能除去其中的难溶性杂质、颜色及异味,但净化后得到的水中仍含有可溶性杂质,则为混合物;由于整个过程都没有新物质生成,属于物理变化。
(5)图丙为蒸馏的简易装置,其中将试管放到冷水中的目的是降温。
故答案为:(1)2:1;32mL;
(2)水分子种类不变,只是水分子之间的间隔改变;水分子发生了改变;
(3)原子;
(4)混合物;物理;
(5)降温。
20.【解答】解:(1)实验A中,发生化学反应的化学方程式为4P+5O22P2O5,小气球的作用除了密闭装置还有平衡装置内外气压,防止瓶塞飞出。
故答案为:4P+5O22P2O5;平衡装置内外气压,防止瓶塞飞出。
(2)实验B中,反应前天平平衡,然后将稀盐酸倒入烧杯中与石灰石小块充分反应后再称量,观察到反应后天平不平衡,则天平指针向右偏转,其原因是反应生成的二氧化碳逸出装置。
故答案为:右;反应生成的二氧化碳逸出装置。
(3)观察到的现象是a端红色固体变黑色,a端下降,b端上升,其原因是加热时铜和氧气反应生成氧化铜。
故答案为:a端红色固体变黑色;a端下降,b端上升;加热时铜和氧气反应生成氧化铜。
(4)如图D所示的小实验,实验过程中,镁条完全燃烧后,称量石棉网上留下的固体质量反而比反应前镁条还轻,其原因可能是反应生成的部分氧化镁扩散到空气中;若用该实验验证质量守恒定律,则应将该实验改在密封装置的环境中进行。
故答案为:反应生成的部分氧化镁扩散到空气中;密封装置。
四、计算题
21.【解答】解:(1)反应放出气体二氧化碳质量=5.5g+25g﹣28.3g=2.2g。
(2)设5.5g样品中含有碳酸钠的质量为x。
Na2CO3+2HCl=2NaCl+CO2↑+H2O
106 44
x 2.2g
则,解得x=5.3g
则样品中碳酸钠的质量分数为×100%≈96.4%
因为96.4%<98%,所以与包装说明不符
故答案为:(1)2.2g;(2)经计算,碳酸钠的质量分数为96.4%,与包装说明不符。
五、解答题
22.【解答】解:(1)设葡萄糖质量为x。
C6H12O62C2H6O+2CO2↑
180 92
x 2.3t
x=4.5t
答:生产2.3t乙醇,理论上参加反应的葡萄糖的质量是4.5t;
(2)乙醇完全燃烧生成二氧化碳和水,反应的化学方程式为:C2H6O+3O22CO2+3H2O;
(3)①根据化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,因此4.6g+8.8g+0g+0g+0g=0g+0g+6.6g+5.4g+a,a=1.4g;
②由表中的数据可知,生成二氧化碳6.6g,生成一氧化碳1.4g,因此生成的二氧化碳与一氧化碳的分子个数比为:=3:1;由化学反应前后原子的种类和数目不变可知,该实验发生反应的化学方程式为:4C2H6O+11O26CO2+12H2O+2CO。
故答案为:(1)4.5t;
(2)C2H6O+3O22CO2+3H2O;
(3)①1.4;
②6;12;2
(
1
)
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
