高二化学人教版选择性必修一第三章 第二节 第1课时 水的电离(共28张ppt)
文档属性
| 名称 | 高二化学人教版选择性必修一第三章 第二节 第1课时 水的电离(共28张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 175.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-18 11:36:52 | ||
图片预览






文档简介
第二节 水的电离和溶液的pH
第1课时 水的电离
第三章 水溶液中的离子反应与平衡
[学习目标]
1.通过电离平衡理论模型认识水的电离平衡及其影响因素,知道水的
离子积常数(重点)。
2.能用Kw计算一定温度、一定浓度酸碱溶液中水电离的H+(或OH-)
浓度,建立从定量的视角分析外因对水的电离平衡影响的思维模型
(重、难点)。
问题讨论
已知水是弱电解质,做溶剂的水是全部以分子形式存在,还是部分以离子形式存在呢? 如何证明水电离的存在呢?
实验表明,纯水大部分以水分子形式存在,只存在极少的离子。
水的电离极其微弱。
精确的电导性实验表明:纯水大部分以H2O分子的形式存在,但其中也存在着极少量的离子。
电导率仪
一、水的电离 水的离子积
1.水的电离
(1)水是一种极弱的电解质,能发生微弱的电离。
实验证明,常温下1 L水约有1.0×10-7 mol发生电离,请计算常温下纯水的电离度。
1 L 水质量约 1000 g,n(H2O)=1000?g18?g·mol-1?≈55.6 mol,
则水的电离度为1.0×10?755.6×100%≈1.8×10-7%
?
1.水的电离
(2)水的电离是吸热过程
+
+
2H2O
OH-
H3O+
电离方程式:
H2O+ H2O H3O+ +OH-
简写:H2O H+ +OH-
(3)水的电离平衡常数表达式
K =c(H+)·c(OH?)c(H2O)
?
纯水及稀溶液中c(H2O)为常数
K?c(H2O)=c(H+)·c(OH?)
?
Kw=?c(H+)·c(OH?)
?
一、水的电离 水的离子积
2.水的离子积常数
(1)概念:水的电离达到平衡时,电离产物H+和OH-浓度之积是一个常数
简称水的离子积,记作Kw
(2)表达式: Kw=c(H+)·c(OH-) ? 25 ℃,Kw=1.0×10-14
(3)影响因素:只与温度有关,升温Kw增大;与溶液的酸碱性无关
(4)Kw 适用于纯水及稀的电解质溶液
一、水的电离 水的离子积
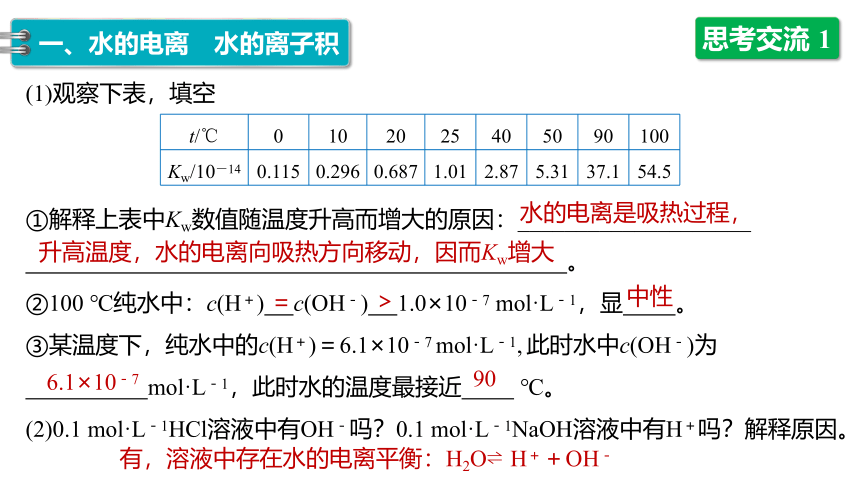
思考交流 1
(1)观察下表,填空
①解释上表中Kw数值随温度升高而增大的原因:____________________
。
②100 ℃纯水中:c(H+) c(OH-) 1.0×10-7 mol·L-1,显 。
③某温度下,纯水中的c(H+)=6.1×10-7 mol·L-1, 此时水中c(OH-)为
mol·L-1,此时水的温度最接近 ℃。
(2)0.1 mol·L-1HCl溶液中有OH-吗?0.1 mol·L-1NaOH溶液中有H+吗?解释原因。
t/℃
0
10
20
25
40
50
90
100
Kw/10-14
0.115
0.296
0.687
1.01
2.87
5.31
37.1
54.5
水的电离是吸热过程,
升高温度,水的电离向吸热方向移动,因而Kw增大
=
>
中性
6.1×10-7
90
有,溶液中存在水的电离平衡:H2O?H++OH-
一、水的电离 水的离子积
3.外界条件对水的电离平衡的影响
运用电离平衡理论,分析改变下列条件对水电离平衡的影响,并填表:
改变条件
平衡移动方向
c(H+)
c(OH-)
水的电离程度
Kw
升高温度
右移
增大
增大
增大
增大
加入HCl(g)
左移
增大
减小
减小
不变
加入NaOH(s)
左移
减小
增大
减小
不变
加入活泼金属(如Na)
右移
减小
增大
增大
不变
加入NaHSO4(s)
左移
增大
减小
减小
不变
一、水的电离 水的离子积
思考交流 2
1.正误判断
(1)升高温度,水的电离程度减小
(2)向水中加入少量氨水,水的电离平衡逆向移动,c(OH-)降低
(3)常温下,加水稀释稀醋酸溶液,溶液中所有的离子浓度都减小
(4)溶液中c(H+)、c(OH-)可能不同,但水电离出的H+与OH-总是相等的
×
×
×
√
一、水的电离 水的离子积
思考交流 2
2.分析下列过程中H2O的电离程度的变化(25 ℃)。
(1)Zn与稀硫酸反应制H2:______。
(2)氨水加水稀释时:_____。
(3)向NaOH溶液中滴入盐酸至过量:_____________。
(4)向SO2水溶液中通入Cl2至恰好反应:_____。
增大
增大
先增大后减小
减小
一、水的电离 水的离子积
二、水的离子积常数的应用
1.计算酸(或碱)溶液中水电离的c水(H+)或c水(OH-)
(1)25 ℃时,0.1 mol·L-1稀盐酸中,水电离的c水(H+)、c水(OH-)各为多少?
(2)25 ℃时,0.01 mol·L-1NaOH溶液中,水电离的c水(H+)、c水(OH-)各为多少?
c水电离(H+) 小,可忽略,c总浓度(H+)≈c(HCl)=0.1 mol·L-1,
c(OH-)= Kw/ c总浓度(H+)=1.0×10-13 mol·L-1,溶液中OH-全部由水电离产生。
c水(OH-)=c水(H+)=1.0×10-13 mol·L-1,酸电离的H+抑制水的电离。
c水电离(OH-) 小,可忽略,c总浓度(OH-)≈c(NaOH)=0.01 mol·L-1,
c(H+)= Kw/ c总浓度(OH-)=1.0×10-12mol·L-1,溶液中H+全部由水电离产生。
c水(H+)=c水(OH-) =1.0×10-12 mol·L-1,碱电离的OH-抑制水的电离。
问题探究
1.计算酸(或碱)溶液中水电离的c水(H+)或c水(OH-)
(1)酸或碱均抑制水的电离,但c水(H+)=c水(OH-);
(2)酸溶液中c水(H+)=c水(OH-)=Kwc总(H+)? [忽略c水(H+)], c酸(H+)认为是c总(H+);
(3)碱溶液中c水(OH-)=c水(H+)=Kwc总(OH-)? [忽略c水(OH-)], c碱(OH-)认为是c总(OH-)。
?
室温下,c水电离(H+)=1×10-13 mol·L-1的溶液呈酸性还是碱性?
均有可能
二、水的离子积常数的应用
归纳总结
2. 水的电离平衡曲线的理解与识别
(1)曲线上的任意点:Kw都相同 (a、b、c)
即c(H+)·c(OH-)相同,温度相同。
(2)曲线外的任意点(如d)与曲线上任意点:
Kw不同,温度不同。
(3)曲线上点之间转化: 需温度不变,改变酸碱性;
曲线上点与曲线外点之间的转化:一定改变温度。
某温度下水的电离平衡曲线
二、水的离子积常数的应用
2. 水的电离平衡曲线的理解与识别
思考交流
在不同温度的水溶液中c(H+)与c(OH-)关系如图。请回答下列问题:
(1)曲线Ⅰ代表的温度下,水的离子积为_______,曲线Ⅰ所代表的温度
_____(填“高于”“低于”或“等于”)曲线Ⅱ所代表的温度。
你判断的依据是________________________________
______________________________________________
______________________________________________
(2)曲线Ⅰ所代表的温度下,0.01 mol·L-1的NaOH溶液
的c(H+)为________ mol·L-1。
1×10-12
高于
曲线Ⅱ所代表的水的离子积比曲线Ⅰ的小,由于水的电离过程是吸热过程,温度越高,水的离子积越大,故曲线Ⅱ代表的温度低
10-10
二、水的离子积常数的应用
自我测试
1.25 ℃时,有相同物质的量浓度的下列溶液:①NaCl;②NaOH;③H2SO4。其中水的电离程度按由大到小顺序排列的一组是
A.③>②>① B.②>③>①
C.③>①>② D.①>②>③
√
不影响
均抑制
浓度大,抑制程度大
自我测试
2.下列有关水的电离的叙述正确的是
A.向水中加入少量固体硫酸氢钠,c(H+)增大,水的电离平衡逆向移动
B.水的离子积常数Kw随溶液中酸碱性强弱的变化而变化
C.水的离子积常数Kw与水的电离平衡常数K电离是同一个物理量
D.纯水升高温度,Kw变大,c(H+)增大,酸性增强
√
电离出H+
Kw是温度的函数
两个量[Kw=K电离·c(H2O)]
c(H+)=c(OH-),仍为中性
自我测试
3.某温度时,水溶液中Kw=4×10-14。则
(1)该温度______(填“高于”“低于”或“等于”)室温(25 ℃),该温度下纯水中
c(H+)= _________ mol·L-1。
(2)若温度不变,滴入稀盐酸使c(H+)=5.0×10-6 mol·L-1,则c(OH-)= __________ mol·L-1,水电离的c水(H+)=__________ mol·L-1。
高于
2×10-7
8.0×10-9
8.0×10-9
本节内容结束
第1课时 水的电离
第三章 水溶液中的离子反应与平衡
[学习目标]
1.通过电离平衡理论模型认识水的电离平衡及其影响因素,知道水的
离子积常数(重点)。
2.能用Kw计算一定温度、一定浓度酸碱溶液中水电离的H+(或OH-)
浓度,建立从定量的视角分析外因对水的电离平衡影响的思维模型
(重、难点)。
问题讨论
已知水是弱电解质,做溶剂的水是全部以分子形式存在,还是部分以离子形式存在呢? 如何证明水电离的存在呢?
实验表明,纯水大部分以水分子形式存在,只存在极少的离子。
水的电离极其微弱。
精确的电导性实验表明:纯水大部分以H2O分子的形式存在,但其中也存在着极少量的离子。
电导率仪
一、水的电离 水的离子积
1.水的电离
(1)水是一种极弱的电解质,能发生微弱的电离。
实验证明,常温下1 L水约有1.0×10-7 mol发生电离,请计算常温下纯水的电离度。
1 L 水质量约 1000 g,n(H2O)=1000?g18?g·mol-1?≈55.6 mol,
则水的电离度为1.0×10?755.6×100%≈1.8×10-7%
?
1.水的电离
(2)水的电离是吸热过程
+
+
2H2O
OH-
H3O+
电离方程式:
H2O+ H2O H3O+ +OH-
简写:H2O H+ +OH-
(3)水的电离平衡常数表达式
K =c(H+)·c(OH?)c(H2O)
?
纯水及稀溶液中c(H2O)为常数
K?c(H2O)=c(H+)·c(OH?)
?
Kw=?c(H+)·c(OH?)
?
一、水的电离 水的离子积
2.水的离子积常数
(1)概念:水的电离达到平衡时,电离产物H+和OH-浓度之积是一个常数
简称水的离子积,记作Kw
(2)表达式: Kw=c(H+)·c(OH-) ? 25 ℃,Kw=1.0×10-14
(3)影响因素:只与温度有关,升温Kw增大;与溶液的酸碱性无关
(4)Kw 适用于纯水及稀的电解质溶液
一、水的电离 水的离子积
思考交流 1
(1)观察下表,填空
①解释上表中Kw数值随温度升高而增大的原因:____________________
。
②100 ℃纯水中:c(H+) c(OH-) 1.0×10-7 mol·L-1,显 。
③某温度下,纯水中的c(H+)=6.1×10-7 mol·L-1, 此时水中c(OH-)为
mol·L-1,此时水的温度最接近 ℃。
(2)0.1 mol·L-1HCl溶液中有OH-吗?0.1 mol·L-1NaOH溶液中有H+吗?解释原因。
t/℃
0
10
20
25
40
50
90
100
Kw/10-14
0.115
0.296
0.687
1.01
2.87
5.31
37.1
54.5
水的电离是吸热过程,
升高温度,水的电离向吸热方向移动,因而Kw增大
=
>
中性
6.1×10-7
90
有,溶液中存在水的电离平衡:H2O?H++OH-
一、水的电离 水的离子积
3.外界条件对水的电离平衡的影响
运用电离平衡理论,分析改变下列条件对水电离平衡的影响,并填表:
改变条件
平衡移动方向
c(H+)
c(OH-)
水的电离程度
Kw
升高温度
右移
增大
增大
增大
增大
加入HCl(g)
左移
增大
减小
减小
不变
加入NaOH(s)
左移
减小
增大
减小
不变
加入活泼金属(如Na)
右移
减小
增大
增大
不变
加入NaHSO4(s)
左移
增大
减小
减小
不变
一、水的电离 水的离子积
思考交流 2
1.正误判断
(1)升高温度,水的电离程度减小
(2)向水中加入少量氨水,水的电离平衡逆向移动,c(OH-)降低
(3)常温下,加水稀释稀醋酸溶液,溶液中所有的离子浓度都减小
(4)溶液中c(H+)、c(OH-)可能不同,但水电离出的H+与OH-总是相等的
×
×
×
√
一、水的电离 水的离子积
思考交流 2
2.分析下列过程中H2O的电离程度的变化(25 ℃)。
(1)Zn与稀硫酸反应制H2:______。
(2)氨水加水稀释时:_____。
(3)向NaOH溶液中滴入盐酸至过量:_____________。
(4)向SO2水溶液中通入Cl2至恰好反应:_____。
增大
增大
先增大后减小
减小
一、水的电离 水的离子积
二、水的离子积常数的应用
1.计算酸(或碱)溶液中水电离的c水(H+)或c水(OH-)
(1)25 ℃时,0.1 mol·L-1稀盐酸中,水电离的c水(H+)、c水(OH-)各为多少?
(2)25 ℃时,0.01 mol·L-1NaOH溶液中,水电离的c水(H+)、c水(OH-)各为多少?
c水电离(H+) 小,可忽略,c总浓度(H+)≈c(HCl)=0.1 mol·L-1,
c(OH-)= Kw/ c总浓度(H+)=1.0×10-13 mol·L-1,溶液中OH-全部由水电离产生。
c水(OH-)=c水(H+)=1.0×10-13 mol·L-1,酸电离的H+抑制水的电离。
c水电离(OH-) 小,可忽略,c总浓度(OH-)≈c(NaOH)=0.01 mol·L-1,
c(H+)= Kw/ c总浓度(OH-)=1.0×10-12mol·L-1,溶液中H+全部由水电离产生。
c水(H+)=c水(OH-) =1.0×10-12 mol·L-1,碱电离的OH-抑制水的电离。
问题探究
1.计算酸(或碱)溶液中水电离的c水(H+)或c水(OH-)
(1)酸或碱均抑制水的电离,但c水(H+)=c水(OH-);
(2)酸溶液中c水(H+)=c水(OH-)=Kwc总(H+)? [忽略c水(H+)], c酸(H+)认为是c总(H+);
(3)碱溶液中c水(OH-)=c水(H+)=Kwc总(OH-)? [忽略c水(OH-)], c碱(OH-)认为是c总(OH-)。
?
室温下,c水电离(H+)=1×10-13 mol·L-1的溶液呈酸性还是碱性?
均有可能
二、水的离子积常数的应用
归纳总结
2. 水的电离平衡曲线的理解与识别
(1)曲线上的任意点:Kw都相同 (a、b、c)
即c(H+)·c(OH-)相同,温度相同。
(2)曲线外的任意点(如d)与曲线上任意点:
Kw不同,温度不同。
(3)曲线上点之间转化: 需温度不变,改变酸碱性;
曲线上点与曲线外点之间的转化:一定改变温度。
某温度下水的电离平衡曲线
二、水的离子积常数的应用
2. 水的电离平衡曲线的理解与识别
思考交流
在不同温度的水溶液中c(H+)与c(OH-)关系如图。请回答下列问题:
(1)曲线Ⅰ代表的温度下,水的离子积为_______,曲线Ⅰ所代表的温度
_____(填“高于”“低于”或“等于”)曲线Ⅱ所代表的温度。
你判断的依据是________________________________
______________________________________________
______________________________________________
(2)曲线Ⅰ所代表的温度下,0.01 mol·L-1的NaOH溶液
的c(H+)为________ mol·L-1。
1×10-12
高于
曲线Ⅱ所代表的水的离子积比曲线Ⅰ的小,由于水的电离过程是吸热过程,温度越高,水的离子积越大,故曲线Ⅱ代表的温度低
10-10
二、水的离子积常数的应用
自我测试
1.25 ℃时,有相同物质的量浓度的下列溶液:①NaCl;②NaOH;③H2SO4。其中水的电离程度按由大到小顺序排列的一组是
A.③>②>① B.②>③>①
C.③>①>② D.①>②>③
√
不影响
均抑制
浓度大,抑制程度大
自我测试
2.下列有关水的电离的叙述正确的是
A.向水中加入少量固体硫酸氢钠,c(H+)增大,水的电离平衡逆向移动
B.水的离子积常数Kw随溶液中酸碱性强弱的变化而变化
C.水的离子积常数Kw与水的电离平衡常数K电离是同一个物理量
D.纯水升高温度,Kw变大,c(H+)增大,酸性增强
√
电离出H+
Kw是温度的函数
两个量[Kw=K电离·c(H2O)]
c(H+)=c(OH-),仍为中性
自我测试
3.某温度时,水溶液中Kw=4×10-14。则
(1)该温度______(填“高于”“低于”或“等于”)室温(25 ℃),该温度下纯水中
c(H+)= _________ mol·L-1。
(2)若温度不变,滴入稀盐酸使c(H+)=5.0×10-6 mol·L-1,则c(OH-)= __________ mol·L-1,水电离的c水(H+)=__________ mol·L-1。
高于
2×10-7
8.0×10-9
8.0×10-9
本节内容结束
