高二化学人教版选择性必修一第三章 第一节 第1课时 弱电解质的电离平衡(共29张PPT)
文档属性
| 名称 | 高二化学人教版选择性必修一第三章 第一节 第1课时 弱电解质的电离平衡(共29张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 6.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-18 11:38:31 | ||
图片预览







文档简介
(共29张PPT)
第一节 电离平衡
第1课时 弱电解质的电离平衡
第三章 水溶液中的离子反应与平衡
[学习目标]
1.了解电解质的分类,并能从微观层面理解强、弱电解质的本质。
2.掌握电离平衡及其影响因素,能运用电离平衡描述和解释化学现象
(重点)。
3.会判断电解质溶液的导电性的强弱(难点)。
能导电的物质都是电解质吗?电解质一定能导电吗?举例说明
均不一定
金属铜可以导电,但单质既不是电解质也不是非电解质;
固体氯化钠是电解质,但因钠离子、铝离子不能自由移动,不能导电。
知识回顾
一、电解质及其分类
1.电解质和非电解质
电解质:在水溶液或熔融状态下能够导电的化合物
非电解质:在水溶液和熔融状态下都不能导电的化合物
下列物质中,能导电的是_______(填序号,下同),属于电解质的是_________,属于非电解质的是________。
①H2SO4 ②稀盐酸 ③氯气 ④硫酸钡 ⑤乙醇 ⑥铜 ⑦CH3COOH
⑧熔融的KCl ⑨CO2
②⑥⑧
①④⑦⑧
⑤⑨
单质和混合物既不是电解质,也不是非电解质。
思考交流 1
酸、碱、盐都是电解质,在水中都能电离出离子。不同电解质的电离程度是否有区别?你能否设计实验证实你的想法
探究讨论
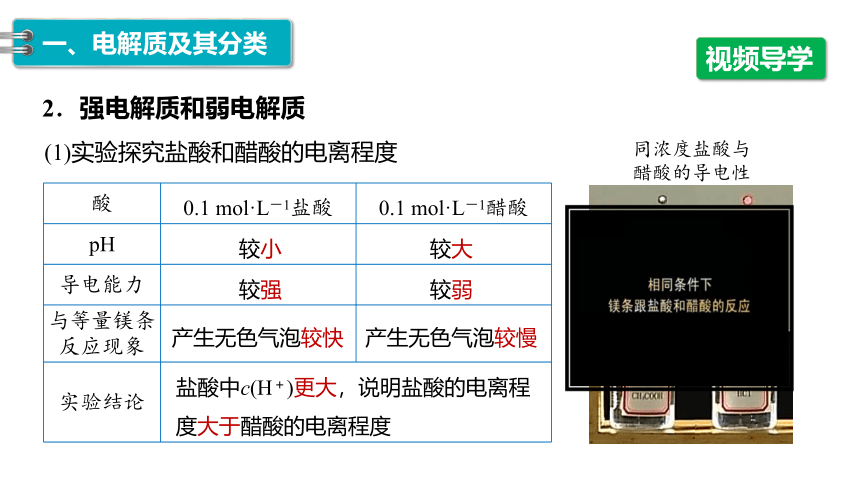
同条件下,实验探究盐酸和醋酸的电离程度
等体积、等浓度的盐酸和醋酸与等量的镁反应
一、电解质及其分类
同浓度盐酸与醋酸的导电性
(1)实验探究盐酸和醋酸的电离程度
酸 0.1 mol·L-1盐酸 0.1 mol·L-1醋酸
pH
导电能力
与等量镁条反应现象
实验结论
一、电解质及其分类
2.强电解质和弱电解质
较小
较大
较强
较弱
产生无色气泡较快
产生无色气泡较慢
盐酸中c(H+)更大,说明盐酸的电离程度大于醋酸的电离程度
视频导学
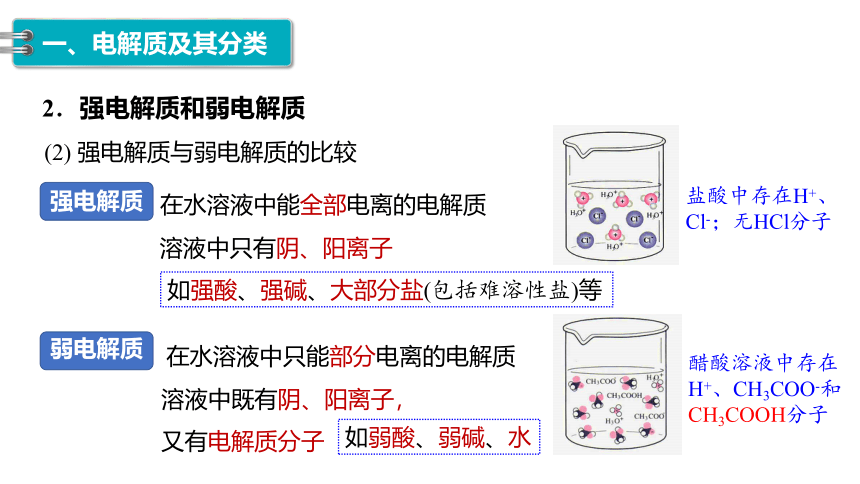
强电解质
盐酸中存在H+、Cl-;无HCl分子
在水溶液中能全部电离的电解质
溶液中只有阴、阳离子
如强酸、强碱、大部分盐(包括难溶性盐)等
醋酸溶液中存在H+、CH3COO-和CH3COOH分子
弱电解质
在水溶液中只能部分电离的电解质
溶液中既有阴、阳离子,又有电解质分子
如弱酸、弱碱、水
一、电解质及其分类
(2) 强电解质与弱电解质的比较
2.强电解质和弱电解质
思考交流 2
以下九种物质中:①H2SO4 ②稀盐酸 ③氯气 ④硫酸钡 ⑤乙醇
⑥铜 ⑦CH3COOH ⑧熔融的KCl ⑨CO2
其中属于强电解质的是________(填序号,下同),属于弱电解质的是_____。
2.请列举你目前知道的强酸、强碱、弱酸和弱碱。
①④⑧
⑦
强酸:HCl、HNO3、H2SO4等;
强碱:KOH、NaOH、Ba(OH)2等;
弱酸:H2CO3、CH3COOH、HClO等;
弱碱:NH3·H2O等
一、电解质及其分类
CH3COOH → H++CH3COO-
H++CH3COO- → CH3COOH
实际上在醋酸的水溶液中存在下面的平衡:
为什么醋酸溶于水时只有部分分子电离成H+和CH3COO-呢?
CH3COOH H++CH3COO-
问题讨论
一、电解质及其分类
3.电离方程式的书写
强电解质用“===”
H2SO4:___________________,
NaOH:____________________。
NaHSO4(水溶液中):_________________________,
NaHSO4(熔融):__________________________,
NaHCO3:__________________________________________。
NaOH===Na++OH-
水溶液中完全电离
NaHSO4===Na++
一、电解质及其分类
3.电离方程式的书写
多元弱酸分步书写,第一步为主,一级比一级难电离;
多元弱碱用一步电离表示。
一、电解质及其分类
3.电离方程式的书写
弱电解质用“ ”
CH3COOH:_____________________________,
H2CO3:________________________________________,
NH3·H2O:_________________________,
Cu(OH)2:_______________________。
思考交流 3
1.正误判断
(1)盐酸能导电,所以盐酸是电解质
(2)干冰、葡萄糖和金刚石都不导电,它们都是非电解质
(3)NH3溶于水能导电,所以NH3是电解质
(4)强电解质都是离子化合物,而弱电解质都是共价化合物
×
×
×
×
一、电解质及其分类
NaHCO3===Na++
NaHSO4(熔融)===Na++
分步电离
√
一、电解质及其分类
2.下列电离方程式中正确的是
A.NaHCO3的水溶液:NaHCO3===Na++H++
B.熔融状态的NaHSO4:NaHSO4===Na++H++
C.HClO的水溶液:HClO H++ClO-
D.H2S的水溶液:H2S 2H++S2-
思考交流 3
二、弱电解质的电离平衡
电离
结合
CH3COOH CH3COO-+H+
开始时,v电离 和 v结合怎样变化?
当v电离=v结合时,可逆过程达到一种什么样的状态?
一定条件(如温度、浓度)下,当v正(电离) = v逆(结合),达到电离平衡状态。
v
t
v电离
v电离 = v结合
t1
v结合
t0
1.电离平衡状态
思考讨论
(2)概念
在一定条件下,弱电解质分子电离成离子的速率与离子结合成弱电解质分子的速率相等,溶液中各分子和离子的浓度都不再发生变化时达到了电离平衡状态。
二、弱电解质的电离平衡
v
t
v电离
v电离 = v结合
t1
v结合
t0
1.电离平衡状态
(1)建立过程
电离
结合
CH3COOH CH3COO-+H+
研究对象是弱电解质
v电离=v结合
动态平衡
平衡时,各微粒(分子、离子)的浓度保持不变
条件改变,平衡会发生移动
弱
等
动
定
变
二、弱电解质的电离平衡
1.电离平衡状态
(3)电离平衡的特征
电离
结合
CH3COOH CH3COO-+H+
电离平衡和化学平衡一样,当外界条件改变时符合勒夏特列原理。
温度:电离是吸热过程,升温平衡向右移动;
浓度:浓度越大,电离程度越小,加水稀释,平衡向右移动;
加入CH3COO-或H+ ,平衡逆向移动;
加入与离子反应的物质如OH -等,平衡向右移动。
二、弱电解质的电离平衡
探究讨论
2.外界条件对弱电解质的电离平衡的影响
以0.1 mol·L-1醋酸溶液为例,CH3COOH CH3COO-+H+ ΔH>0,哪些条件的改变会使平衡发生移动?
改变条件 平衡移动方向 n(H+) c(H+)
加水稀释
加入少量冰醋酸
通入HCl(g)
加入NaOH(s)
加CH3COONa(s)
加入镁粉
升高温度
向右 增大 减小
向右 增大 增大
向左 增大 增大
向右 减小 减小
向左 减小 减小
向右 减小 减小
向右 增大 增大
二、弱电解质的电离平衡
2.外界条件对弱电解质的电离平衡的影响
以0.1 mol·L-1醋酸溶液为例,外界条件对CH3COOH CH3COO-+H+ ΔH>0的影响
金属为什么可以导电? 电解质溶液为什么也能导电?
如何增强电解质溶液导电能力?
有自由移动的电子
有自由移动的离子
离子浓度越大,离子所带电荷越多,导电能力越强
二、弱电解质的电离平衡
3.电解质溶液的导电性
问题讨论
(1)导电原理:电解质在溶液中电离成自由移动的阴、阳离子,定向移动,形成电流
注意 金属导电是因为其含有自由移动的电子。
(2)影响因素
特别提示 离子浓度越大,所带电荷越多,导电能力越强。
离子浓度
离子所带电荷多少
二、弱电解质的电离平衡
3.电解质溶液的导电性
1.正误判断
(1)电离平衡向右移动,电解质分子浓度一定减小,离子浓度一定增大
(2)电离平衡向右移动,弱电解质的电离程度一定增大
(3)导电能力强的溶液里自由移动的离子数目一定比导电能力弱的溶液里自由移动的离子数目多
(4)盐酸的导电能力一定比醋酸溶液的强
(5)随着温度的升高,弱电解质溶液和金属的导电能力均增强
(6)向H2S溶液中通入Cl2直至过量,混合溶液的导电能力增强
×
×
×
×
×
√
二、弱电解质的电离平衡
思考交流
2.某化学小组在一定温度下,将冰醋酸加水稀释,溶液的导电
能力I 随加入水的体积V变化的曲线如图所示。
(1)O点导电能力几乎为0的原因是___________________________________________。
(2)图像中a~b阶段,加水稀释,溶液中c(H+)如何
变化?______,简述原因:__________________________________________
_________________________________________________________________。
增大
加水稀释,醋酸的电离平衡向右移动,n(H+)增大,但溶液体积增大没有n(H+)增大的明显,因而c(H+)增大
O点冰醋酸中没有水,醋酸未电离,无离子存在
二、弱电解质的电离平衡
思考交流
2.某化学小组在一定温度下,将冰醋酸加水稀释,溶液的导电
能力I 随加入水的体积V变化的曲线如图所示。
(3)图像中b~c阶段,加水稀释,溶液中c(H+)如何变化?______,
简述原因:_____________________________________________________
_______________________________________________________________。
二、弱电解质的电离平衡
减小
加水稀释,醋酸的电离平衡向右移动,n(H+)增大,但溶液体积增大更明显,因而c(H+)减小
思考交流
3.用“>”“<”或“=”填空。
(1)将c(H+)=0.1 mol·L-1的醋酸稀释100倍,所得溶液的c(H+)_____
1.0×10-3 mol·L-1。
(2)将c(H+)=0.1 mol·L-1的醋酸稀释至c(H+)=1.0×10-3 mol·L-1,稀释倍数_______100。
(3)将某醋酸溶液稀释100倍使其c(H+)=1.0×10-3,则原溶液的c(H+)
______0.1 mol·L-1。
>
>
<
二、弱电解质的电离平衡
思考交流
自我测试
1.下列物质的分类组合全部正确的是
单质既不是电解质也不是非电解质
选项 强电解质 弱电解质 非电解质
A NaCl HF Cl2
B NaHCO3 NH3·H2O CCl4
C Ba(OH)2 HCl Cu
D AgCl H2S HClO
√
弱电解质
自我测试
√
2.下列对氨水中存在的电离平衡:NH3·H2O +OH-叙述正确的是
A.加水后,溶液中n(OH-)增大
B.加入少量浓盐酸,溶液中c(OH-)增大
C.加入少量浓氢氧化钠溶液,电离平衡正向移动
D.加入少量氯化铵固体,溶液中c()减少
电离平衡右移
使 c(OH-)减小
向左移动
增大
自我测试
3.已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中 的值增大,可以采取的措施是
A.加少量烧碱溶液
B.加少量醋酸钠
C.加少量冰醋酸
D.加水
消耗H+,平衡右移,n(H+)、n(CH3COOH)均减小,但n(H+)减小程度大,比值减小
平衡左移,n(H+)减小,n(CH3COOH)增大,比值减小
平衡右移,n(H+)增大,n(CH3COOH)增大程度大,比值减小
平衡右移,n(H+)增大,n(CH3COOH)减小,比值增大
√
自我测试
4.已知:H2S和H2SO3都是弱酸,且H2S的酸性更弱;H2S被SO2、Cl2、O2氧化后的产物都是S。向H2S饱和溶液中通入足量SO2,溶液导电能力与通入气体体积的关系可用图中的_____(填字母,下同)表示;向H2S饱和溶液中通入足量Cl2,溶液导电能力与通入气体体积的关系可用图中的______表示;向H2S饱和溶液中通入足量O2,溶液导电能力与通入气体体积的关系可用图中的_____表示。
A
C
D
本节内容结束
第一节 电离平衡
第1课时 弱电解质的电离平衡
第三章 水溶液中的离子反应与平衡
[学习目标]
1.了解电解质的分类,并能从微观层面理解强、弱电解质的本质。
2.掌握电离平衡及其影响因素,能运用电离平衡描述和解释化学现象
(重点)。
3.会判断电解质溶液的导电性的强弱(难点)。
能导电的物质都是电解质吗?电解质一定能导电吗?举例说明
均不一定
金属铜可以导电,但单质既不是电解质也不是非电解质;
固体氯化钠是电解质,但因钠离子、铝离子不能自由移动,不能导电。
知识回顾
一、电解质及其分类
1.电解质和非电解质
电解质:在水溶液或熔融状态下能够导电的化合物
非电解质:在水溶液和熔融状态下都不能导电的化合物
下列物质中,能导电的是_______(填序号,下同),属于电解质的是_________,属于非电解质的是________。
①H2SO4 ②稀盐酸 ③氯气 ④硫酸钡 ⑤乙醇 ⑥铜 ⑦CH3COOH
⑧熔融的KCl ⑨CO2
②⑥⑧
①④⑦⑧
⑤⑨
单质和混合物既不是电解质,也不是非电解质。
思考交流 1
酸、碱、盐都是电解质,在水中都能电离出离子。不同电解质的电离程度是否有区别?你能否设计实验证实你的想法
探究讨论
同条件下,实验探究盐酸和醋酸的电离程度
等体积、等浓度的盐酸和醋酸与等量的镁反应
一、电解质及其分类
同浓度盐酸与醋酸的导电性
(1)实验探究盐酸和醋酸的电离程度
酸 0.1 mol·L-1盐酸 0.1 mol·L-1醋酸
pH
导电能力
与等量镁条反应现象
实验结论
一、电解质及其分类
2.强电解质和弱电解质
较小
较大
较强
较弱
产生无色气泡较快
产生无色气泡较慢
盐酸中c(H+)更大,说明盐酸的电离程度大于醋酸的电离程度
视频导学
强电解质
盐酸中存在H+、Cl-;无HCl分子
在水溶液中能全部电离的电解质
溶液中只有阴、阳离子
如强酸、强碱、大部分盐(包括难溶性盐)等
醋酸溶液中存在H+、CH3COO-和CH3COOH分子
弱电解质
在水溶液中只能部分电离的电解质
溶液中既有阴、阳离子,又有电解质分子
如弱酸、弱碱、水
一、电解质及其分类
(2) 强电解质与弱电解质的比较
2.强电解质和弱电解质
思考交流 2
以下九种物质中:①H2SO4 ②稀盐酸 ③氯气 ④硫酸钡 ⑤乙醇
⑥铜 ⑦CH3COOH ⑧熔融的KCl ⑨CO2
其中属于强电解质的是________(填序号,下同),属于弱电解质的是_____。
2.请列举你目前知道的强酸、强碱、弱酸和弱碱。
①④⑧
⑦
强酸:HCl、HNO3、H2SO4等;
强碱:KOH、NaOH、Ba(OH)2等;
弱酸:H2CO3、CH3COOH、HClO等;
弱碱:NH3·H2O等
一、电解质及其分类
CH3COOH → H++CH3COO-
H++CH3COO- → CH3COOH
实际上在醋酸的水溶液中存在下面的平衡:
为什么醋酸溶于水时只有部分分子电离成H+和CH3COO-呢?
CH3COOH H++CH3COO-
问题讨论
一、电解质及其分类
3.电离方程式的书写
强电解质用“===”
H2SO4:___________________,
NaOH:____________________。
NaHSO4(水溶液中):_________________________,
NaHSO4(熔融):__________________________,
NaHCO3:__________________________________________。
NaOH===Na++OH-
水溶液中完全电离
NaHSO4===Na++
一、电解质及其分类
3.电离方程式的书写
多元弱酸分步书写,第一步为主,一级比一级难电离;
多元弱碱用一步电离表示。
一、电解质及其分类
3.电离方程式的书写
弱电解质用“ ”
CH3COOH:_____________________________,
H2CO3:________________________________________,
NH3·H2O:_________________________,
Cu(OH)2:_______________________。
思考交流 3
1.正误判断
(1)盐酸能导电,所以盐酸是电解质
(2)干冰、葡萄糖和金刚石都不导电,它们都是非电解质
(3)NH3溶于水能导电,所以NH3是电解质
(4)强电解质都是离子化合物,而弱电解质都是共价化合物
×
×
×
×
一、电解质及其分类
NaHCO3===Na++
NaHSO4(熔融)===Na++
分步电离
√
一、电解质及其分类
2.下列电离方程式中正确的是
A.NaHCO3的水溶液:NaHCO3===Na++H++
B.熔融状态的NaHSO4:NaHSO4===Na++H++
C.HClO的水溶液:HClO H++ClO-
D.H2S的水溶液:H2S 2H++S2-
思考交流 3
二、弱电解质的电离平衡
电离
结合
CH3COOH CH3COO-+H+
开始时,v电离 和 v结合怎样变化?
当v电离=v结合时,可逆过程达到一种什么样的状态?
一定条件(如温度、浓度)下,当v正(电离) = v逆(结合),达到电离平衡状态。
v
t
v电离
v电离 = v结合
t1
v结合
t0
1.电离平衡状态
思考讨论
(2)概念
在一定条件下,弱电解质分子电离成离子的速率与离子结合成弱电解质分子的速率相等,溶液中各分子和离子的浓度都不再发生变化时达到了电离平衡状态。
二、弱电解质的电离平衡
v
t
v电离
v电离 = v结合
t1
v结合
t0
1.电离平衡状态
(1)建立过程
电离
结合
CH3COOH CH3COO-+H+
研究对象是弱电解质
v电离=v结合
动态平衡
平衡时,各微粒(分子、离子)的浓度保持不变
条件改变,平衡会发生移动
弱
等
动
定
变
二、弱电解质的电离平衡
1.电离平衡状态
(3)电离平衡的特征
电离
结合
CH3COOH CH3COO-+H+
电离平衡和化学平衡一样,当外界条件改变时符合勒夏特列原理。
温度:电离是吸热过程,升温平衡向右移动;
浓度:浓度越大,电离程度越小,加水稀释,平衡向右移动;
加入CH3COO-或H+ ,平衡逆向移动;
加入与离子反应的物质如OH -等,平衡向右移动。
二、弱电解质的电离平衡
探究讨论
2.外界条件对弱电解质的电离平衡的影响
以0.1 mol·L-1醋酸溶液为例,CH3COOH CH3COO-+H+ ΔH>0,哪些条件的改变会使平衡发生移动?
改变条件 平衡移动方向 n(H+) c(H+)
加水稀释
加入少量冰醋酸
通入HCl(g)
加入NaOH(s)
加CH3COONa(s)
加入镁粉
升高温度
向右 增大 减小
向右 增大 增大
向左 增大 增大
向右 减小 减小
向左 减小 减小
向右 减小 减小
向右 增大 增大
二、弱电解质的电离平衡
2.外界条件对弱电解质的电离平衡的影响
以0.1 mol·L-1醋酸溶液为例,外界条件对CH3COOH CH3COO-+H+ ΔH>0的影响
金属为什么可以导电? 电解质溶液为什么也能导电?
如何增强电解质溶液导电能力?
有自由移动的电子
有自由移动的离子
离子浓度越大,离子所带电荷越多,导电能力越强
二、弱电解质的电离平衡
3.电解质溶液的导电性
问题讨论
(1)导电原理:电解质在溶液中电离成自由移动的阴、阳离子,定向移动,形成电流
注意 金属导电是因为其含有自由移动的电子。
(2)影响因素
特别提示 离子浓度越大,所带电荷越多,导电能力越强。
离子浓度
离子所带电荷多少
二、弱电解质的电离平衡
3.电解质溶液的导电性
1.正误判断
(1)电离平衡向右移动,电解质分子浓度一定减小,离子浓度一定增大
(2)电离平衡向右移动,弱电解质的电离程度一定增大
(3)导电能力强的溶液里自由移动的离子数目一定比导电能力弱的溶液里自由移动的离子数目多
(4)盐酸的导电能力一定比醋酸溶液的强
(5)随着温度的升高,弱电解质溶液和金属的导电能力均增强
(6)向H2S溶液中通入Cl2直至过量,混合溶液的导电能力增强
×
×
×
×
×
√
二、弱电解质的电离平衡
思考交流
2.某化学小组在一定温度下,将冰醋酸加水稀释,溶液的导电
能力I 随加入水的体积V变化的曲线如图所示。
(1)O点导电能力几乎为0的原因是___________________________________________。
(2)图像中a~b阶段,加水稀释,溶液中c(H+)如何
变化?______,简述原因:__________________________________________
_________________________________________________________________。
增大
加水稀释,醋酸的电离平衡向右移动,n(H+)增大,但溶液体积增大没有n(H+)增大的明显,因而c(H+)增大
O点冰醋酸中没有水,醋酸未电离,无离子存在
二、弱电解质的电离平衡
思考交流
2.某化学小组在一定温度下,将冰醋酸加水稀释,溶液的导电
能力I 随加入水的体积V变化的曲线如图所示。
(3)图像中b~c阶段,加水稀释,溶液中c(H+)如何变化?______,
简述原因:_____________________________________________________
_______________________________________________________________。
二、弱电解质的电离平衡
减小
加水稀释,醋酸的电离平衡向右移动,n(H+)增大,但溶液体积增大更明显,因而c(H+)减小
思考交流
3.用“>”“<”或“=”填空。
(1)将c(H+)=0.1 mol·L-1的醋酸稀释100倍,所得溶液的c(H+)_____
1.0×10-3 mol·L-1。
(2)将c(H+)=0.1 mol·L-1的醋酸稀释至c(H+)=1.0×10-3 mol·L-1,稀释倍数_______100。
(3)将某醋酸溶液稀释100倍使其c(H+)=1.0×10-3,则原溶液的c(H+)
______0.1 mol·L-1。
>
>
<
二、弱电解质的电离平衡
思考交流
自我测试
1.下列物质的分类组合全部正确的是
单质既不是电解质也不是非电解质
选项 强电解质 弱电解质 非电解质
A NaCl HF Cl2
B NaHCO3 NH3·H2O CCl4
C Ba(OH)2 HCl Cu
D AgCl H2S HClO
√
弱电解质
自我测试
√
2.下列对氨水中存在的电离平衡:NH3·H2O +OH-叙述正确的是
A.加水后,溶液中n(OH-)增大
B.加入少量浓盐酸,溶液中c(OH-)增大
C.加入少量浓氢氧化钠溶液,电离平衡正向移动
D.加入少量氯化铵固体,溶液中c()减少
电离平衡右移
使 c(OH-)减小
向左移动
增大
自我测试
3.已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中 的值增大,可以采取的措施是
A.加少量烧碱溶液
B.加少量醋酸钠
C.加少量冰醋酸
D.加水
消耗H+,平衡右移,n(H+)、n(CH3COOH)均减小,但n(H+)减小程度大,比值减小
平衡左移,n(H+)减小,n(CH3COOH)增大,比值减小
平衡右移,n(H+)增大,n(CH3COOH)增大程度大,比值减小
平衡右移,n(H+)增大,n(CH3COOH)减小,比值增大
√
自我测试
4.已知:H2S和H2SO3都是弱酸,且H2S的酸性更弱;H2S被SO2、Cl2、O2氧化后的产物都是S。向H2S饱和溶液中通入足量SO2,溶液导电能力与通入气体体积的关系可用图中的_____(填字母,下同)表示;向H2S饱和溶液中通入足量Cl2,溶液导电能力与通入气体体积的关系可用图中的______表示;向H2S饱和溶液中通入足量O2,溶液导电能力与通入气体体积的关系可用图中的_____表示。
A
C
D
本节内容结束
