高二化学人教版选择性必修一第三章 第二节 第2课时 溶液的酸碱性与pH(共24张PPT)
文档属性
| 名称 | 高二化学人教版选择性必修一第三章 第二节 第2课时 溶液的酸碱性与pH(共24张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 75.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-18 11:39:38 | ||
图片预览






文档简介
(共24张PPT)
第二节 水的电离和溶液的pH
第2课时 溶液的酸碱性与pH
第三章 水溶液中的离子反应与平衡
[学习目标]
1.掌握溶液的酸碱性与pH的关系,掌握检测溶液pH的方法(重点)。
2.了解溶液pH调控的意义。
3.能正确计算酸碱溶液的pH(难点)。
问题导入
如何简单进行测定溶液的酸碱性?
酸性溶液中是否存在c(OH-) ,碱性溶液中是否存在c(H+)?
用酸碱指示剂定性测定
用 pH试纸定量测定
一、溶液的酸碱性与pH
思考交流
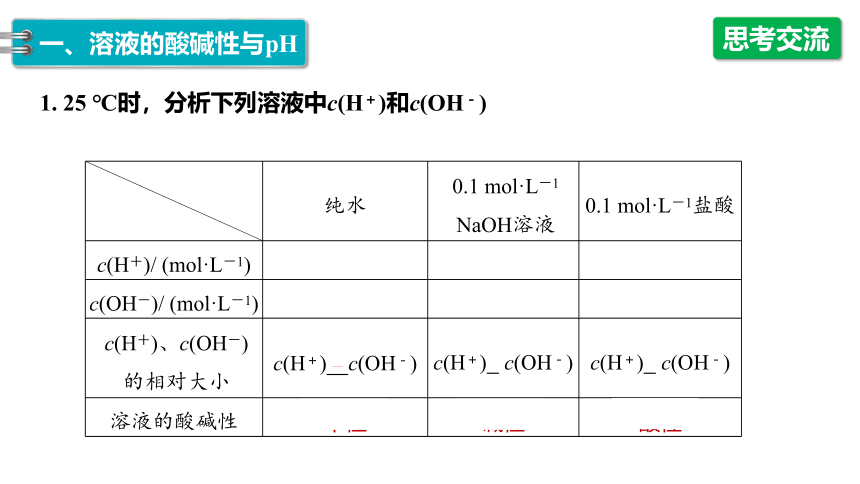
1. 25 ℃时,分析下列溶液中c(H+)和c(OH-)
纯水 0.1 mol·L-1 NaOH溶液 0.1 mol·L-1盐酸
c(H+)/ (mol·L-1) 1×10-7 1×10-13 0.1
c(OH-)/ (mol·L-1) 1×10-7 0.1 1×10-13
c(H+)、c(OH-) 的相对大小 c(H+)=c(OH-) c(H+)< c(OH-) c(H+)> c(OH-)
溶液的酸碱性 中性 碱性 酸性
2.溶液的酸碱性与c(H+)、c(OH-)的关系
(1)任何水溶液中都有H+和OH-
(2)溶液的酸碱性取决于溶液中c(H+)、c(OH-)的相对大小
酸性溶液:c(H+)>c(OH-)
中性溶液:c(H+)=c(OH-)
碱性溶液:c(H+)常温
c(H+)>1×10-7 mol·L-1
=1×10-7 mol·L-1
c(H+)<1×10-7 mol·L-1
一、溶液的酸碱性与pH
视频导学
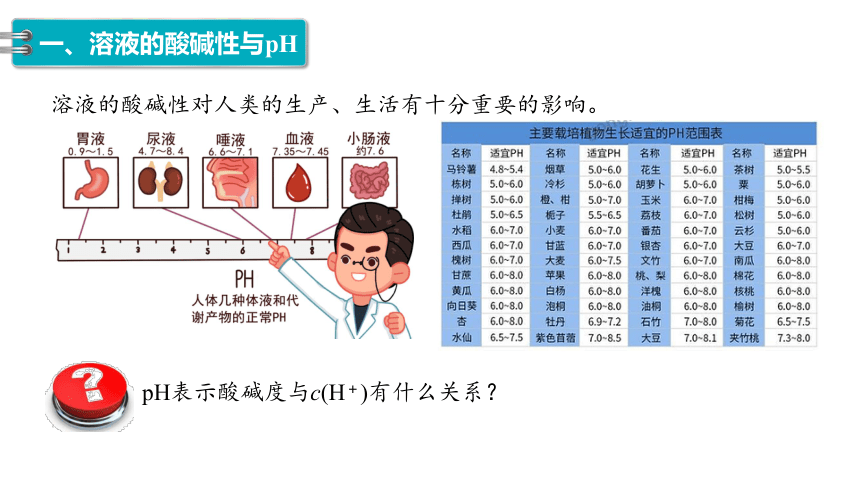
pH表示酸碱度与c(H+)有什么关系?
溶液的酸碱性对人类的生产、生活有十分重要的影响。
一、溶液的酸碱性与pH
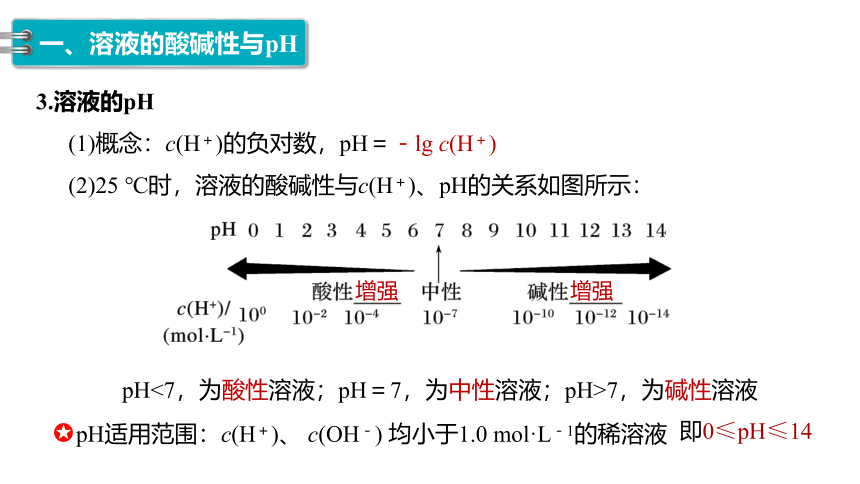
3.溶液的pH
(1)概念:c(H+)的负对数,pH=-lg c(H+)
(2)25 ℃时,溶液的酸碱性与c(H+)、pH的关系如图所示:
pH<7,为酸性溶液;pH=7,为中性溶液;pH>7,为碱性溶液
pH适用范围:c(H+)、 c(OH-) 均小于1.0 mol·L-1的稀溶液
增强
增强
即0≤pH≤14
一、溶液的酸碱性与pH
思考交流
1.根据公式计算下列溶液的pH(常温),并比较其酸碱性的强弱。
(1)①c(H+)=1×10-5 mol·L-1溶液pH=____;
②0.001 mol·L-1的稀盐酸pH=______;
③0.005 mol·L-1的稀硫酸pH=______;
上述三种溶液酸性由强到弱的顺序:___________(填序号)。
(2)①c(H+)=1×10-9 mol·L-1的溶液pH=_____;
②c(OH-)=1×10-4的溶液pH=______;
③0.001 mol·L-1的稀NaOH溶液pH=______;
上述三种溶液碱性由强到弱的顺序___________(填序号)。
5
3
2
③>②>①
9
10
11
③>②>①
一、溶液的酸碱性与pH
思考交流
2.pH=7的溶液一定呈中性吗?用pH判断溶液酸碱性时,要注意什么?
pH=7的溶液不一定呈中性。如100 ℃时,pH=6为中性。只有在室温下才能用pH与7的大小来判断溶液的酸碱性。
3.常温下pH=1的盐酸和pH=11的NaOH溶液由水电离出的c(H+)分别是多少?
1×10-13 mol·L-1、1×10-11 mol·L-1
4.25 ℃时,某溶液中由水电离出的c(H+)=1×10-12 mol·L-1,请探究该溶液的pH可能为多少?
2或者12
一、溶液的酸碱性与pH
计算酸碱溶液的pH
酸性:先求c(H+) —→ pH(注意元数)
一、溶液的酸碱性与pH
归纳总结
二、 pH的测定和调控的意义
1. pH的测定
(1) pH试纸
①广泛pH试纸:范围1~ 14,差约1
②精密pH试纸:范围较窄,差约0.2或0.3
(2) pH计 也叫酸度计,可精密测量pH,量程为0~14
思考交流
(1)某盐酸由于长期放置,标签脱落,若确定其pH,用pH试纸测量的
具体操作为______________________________________________________
_________________________________________________________________
_____________________________。
若使用时将试纸湿润,则测定结果如何变化?____。用湿润的pH试纸测量任何溶液一定有误差吗?__________________________________。
(2)用广泛pH试纸测量溶液的pH时,记录的数据有何特点?
(3)是否可用pH试纸测定氯水的pH?简述理由。
用镊子取一小片pH试纸放在干燥、洁净的玻璃片(或表面皿)上,用干净的玻璃棒蘸取待测液滴在试纸的中部,试纸变色后,与标准比色卡对照比色,确定溶液的pH
偏高
不一定,溶液为中性时测定结果不变
读出的pH只能是1~14的整数。
不能,因为氯水具有漂白性。
二、 pH的测定和调控的意义
2. 测定和调控溶液pH的应用
人体健康
人体各种体液都有一定的pH。可以利用检测血液的pH来诊断疾病
生活应用
护发素保护头发,就是调节头发pH使之达到适宜的酸碱度
环保领域
酸性或碱性废水的处理,可利用中和反应调节pH
农业生产
土壤pH影响植物对养分的吸收,不同作物生长对土壤pH范围有不同要求
科学实验
工业生产
溶液的pH控制是影响实验结果或产品质量、产量的一个重要因素
二、 pH的测定和调控的意义
三、酸碱溶液稀释或混合时pH计算
1.下列溶液被稀释后,计算所得溶液的pH(常温)
溶液稀释 pH
pH=3的稀盐酸加水稀释100倍 5
pH=2的稀硫酸加水稀释100倍 4
pH=11的NaOH溶液加水稀释10倍 10
pH=12的Ba(OH)2溶液加水稀释10倍 11
pH=5的稀盐酸加水稀释1 000倍 约为7,略小于7
pH=9的NaOH溶液加水稀释1 000倍 约为7,略大于7
问题探究
2.(1)pH=3的醋酸加水稀释到原来的10倍,溶液的pH范围:________。
(2)pH=12的氨水加水稀释到原来的10倍,溶液的pH范围:_________。
3 11酸碱溶液稀释时pH变化规律(常温)
(1)强酸(或强碱)每稀释10倍,pH向7靠拢1个单位。
(2)弱酸(碱)每稀释10倍,pH向7靠拢不到一个单位。
(3)酸碱溶液无限稀释,pH只能接近7。
三、酸碱溶液稀释或混合时pH计算
归纳总结
3.常温下,计算下列溶液混合后的pH。
(1)pH=3的盐酸与pH=5的硫酸溶液等体积混合后溶液的pH为______。
(2)pH=2的盐酸与pH=4的硫酸,若按1∶10的体积比混合(溶液体积变化忽略不计)。混合后溶液的pH为________。
(3)pH=10和pH=12的两种NaOH溶液等体积混合后溶液的pH为______。
3.3
问题探究
=1×10-3 mol·L-1
3
11.7
三、酸碱溶液稀释或混合时pH计算
4. 0.015 mol·L-1的硫酸与0.01 mol·L-1的NaOH溶液等体积混合后溶液的pH是_______。
2
问题探究
酸过量,假设体积为V
5.常温下,pH=12的NaOH溶液和pH=4的HCl溶液等体积混合后溶液的pH为________。
11.7
c(OH-)=10-2 mol·L-1 c(H+)=10-4 mol·L-1 碱过量
三、酸碱溶液稀释或混合时pH计算
酸碱中和反应后pH计算的一般思路(常温)
恰好完全反应呈中性 pH=7
酸过量
碱过量
三、酸碱溶液稀释或混合时pH计算
归纳总结
自我测试
1.正误判断
(1)任何温度下,如果c(H+)不等于c(OH-),则溶液一定呈现酸碱性
(2)将pH试纸放入溶液中,观察其颜色变化并与标准比色卡对照
(3)用蒸馏水润湿的pH试纸测溶液的pH,一定会使结果偏低
(4)用pH计测得某溶液的pH为7.45
×
×
√
√
自我测试
2.下列关于溶液的酸碱性说法正确的是
A.pH=7的溶液呈中性
B.中性溶液中一定有c(H+)=1.0×10-7 mol·L-1
C.c(OH-)=c(H+)的溶液呈中性
D.在100 ℃时,纯水的pH<7,因此显酸性
√
未给出温度
不一定等于1.0×10-7 mol·L-1
c(H+)=c(OH-),还是呈中性
自我测试
3.常温下,某可乐饮料的pH=3,某西红柿汁饮料的pH=4,则这两种饮料中的c(OH-)之比是
A.3∶4
B.1∶10
C.10∶1
D.无法确定
√
c(H+)=10-3 mol·L-1
c(OH-)=10-11 mol·L-1
c(H+)=10-4 mol·L-1
c(OH-)=10-10 mol·L-1
自我测试
4.将pH=2的硫酸溶液与pH=5的硫酸溶液等体积混合,则混合溶液的pH约为(已知:lg 2=0.3)
A.3.3 B.3.5
C.2.3 D.4.7
√
自我测试
5.常温下将0.1 mol·L-1盐酸和0.06 mol·L-1氢氧化钡溶液等体积混合后,该混合溶液的pH=________。
12
OH-过量
本节内容结束
第二节 水的电离和溶液的pH
第2课时 溶液的酸碱性与pH
第三章 水溶液中的离子反应与平衡
[学习目标]
1.掌握溶液的酸碱性与pH的关系,掌握检测溶液pH的方法(重点)。
2.了解溶液pH调控的意义。
3.能正确计算酸碱溶液的pH(难点)。
问题导入
如何简单进行测定溶液的酸碱性?
酸性溶液中是否存在c(OH-) ,碱性溶液中是否存在c(H+)?
用酸碱指示剂定性测定
用 pH试纸定量测定
一、溶液的酸碱性与pH
思考交流
1. 25 ℃时,分析下列溶液中c(H+)和c(OH-)
纯水 0.1 mol·L-1 NaOH溶液 0.1 mol·L-1盐酸
c(H+)/ (mol·L-1) 1×10-7 1×10-13 0.1
c(OH-)/ (mol·L-1) 1×10-7 0.1 1×10-13
c(H+)、c(OH-) 的相对大小 c(H+)=c(OH-) c(H+)< c(OH-) c(H+)> c(OH-)
溶液的酸碱性 中性 碱性 酸性
2.溶液的酸碱性与c(H+)、c(OH-)的关系
(1)任何水溶液中都有H+和OH-
(2)溶液的酸碱性取决于溶液中c(H+)、c(OH-)的相对大小
酸性溶液:c(H+)>c(OH-)
中性溶液:c(H+)=c(OH-)
碱性溶液:c(H+)
c(H+)>1×10-7 mol·L-1
=1×10-7 mol·L-1
c(H+)<1×10-7 mol·L-1
一、溶液的酸碱性与pH
视频导学
pH表示酸碱度与c(H+)有什么关系?
溶液的酸碱性对人类的生产、生活有十分重要的影响。
一、溶液的酸碱性与pH
3.溶液的pH
(1)概念:c(H+)的负对数,pH=-lg c(H+)
(2)25 ℃时,溶液的酸碱性与c(H+)、pH的关系如图所示:
pH<7,为酸性溶液;pH=7,为中性溶液;pH>7,为碱性溶液
pH适用范围:c(H+)、 c(OH-) 均小于1.0 mol·L-1的稀溶液
增强
增强
即0≤pH≤14
一、溶液的酸碱性与pH
思考交流
1.根据公式计算下列溶液的pH(常温),并比较其酸碱性的强弱。
(1)①c(H+)=1×10-5 mol·L-1溶液pH=____;
②0.001 mol·L-1的稀盐酸pH=______;
③0.005 mol·L-1的稀硫酸pH=______;
上述三种溶液酸性由强到弱的顺序:___________(填序号)。
(2)①c(H+)=1×10-9 mol·L-1的溶液pH=_____;
②c(OH-)=1×10-4的溶液pH=______;
③0.001 mol·L-1的稀NaOH溶液pH=______;
上述三种溶液碱性由强到弱的顺序___________(填序号)。
5
3
2
③>②>①
9
10
11
③>②>①
一、溶液的酸碱性与pH
思考交流
2.pH=7的溶液一定呈中性吗?用pH判断溶液酸碱性时,要注意什么?
pH=7的溶液不一定呈中性。如100 ℃时,pH=6为中性。只有在室温下才能用pH与7的大小来判断溶液的酸碱性。
3.常温下pH=1的盐酸和pH=11的NaOH溶液由水电离出的c(H+)分别是多少?
1×10-13 mol·L-1、1×10-11 mol·L-1
4.25 ℃时,某溶液中由水电离出的c(H+)=1×10-12 mol·L-1,请探究该溶液的pH可能为多少?
2或者12
一、溶液的酸碱性与pH
计算酸碱溶液的pH
酸性:先求c(H+) —→ pH(注意元数)
一、溶液的酸碱性与pH
归纳总结
二、 pH的测定和调控的意义
1. pH的测定
(1) pH试纸
①广泛pH试纸:范围1~ 14,差约1
②精密pH试纸:范围较窄,差约0.2或0.3
(2) pH计 也叫酸度计,可精密测量pH,量程为0~14
思考交流
(1)某盐酸由于长期放置,标签脱落,若确定其pH,用pH试纸测量的
具体操作为______________________________________________________
_________________________________________________________________
_____________________________。
若使用时将试纸湿润,则测定结果如何变化?____。用湿润的pH试纸测量任何溶液一定有误差吗?__________________________________。
(2)用广泛pH试纸测量溶液的pH时,记录的数据有何特点?
(3)是否可用pH试纸测定氯水的pH?简述理由。
用镊子取一小片pH试纸放在干燥、洁净的玻璃片(或表面皿)上,用干净的玻璃棒蘸取待测液滴在试纸的中部,试纸变色后,与标准比色卡对照比色,确定溶液的pH
偏高
不一定,溶液为中性时测定结果不变
读出的pH只能是1~14的整数。
不能,因为氯水具有漂白性。
二、 pH的测定和调控的意义
2. 测定和调控溶液pH的应用
人体健康
人体各种体液都有一定的pH。可以利用检测血液的pH来诊断疾病
生活应用
护发素保护头发,就是调节头发pH使之达到适宜的酸碱度
环保领域
酸性或碱性废水的处理,可利用中和反应调节pH
农业生产
土壤pH影响植物对养分的吸收,不同作物生长对土壤pH范围有不同要求
科学实验
工业生产
溶液的pH控制是影响实验结果或产品质量、产量的一个重要因素
二、 pH的测定和调控的意义
三、酸碱溶液稀释或混合时pH计算
1.下列溶液被稀释后,计算所得溶液的pH(常温)
溶液稀释 pH
pH=3的稀盐酸加水稀释100倍 5
pH=2的稀硫酸加水稀释100倍 4
pH=11的NaOH溶液加水稀释10倍 10
pH=12的Ba(OH)2溶液加水稀释10倍 11
pH=5的稀盐酸加水稀释1 000倍 约为7,略小于7
pH=9的NaOH溶液加水稀释1 000倍 约为7,略大于7
问题探究
2.(1)pH=3的醋酸加水稀释到原来的10倍,溶液的pH范围:________。
(2)pH=12的氨水加水稀释到原来的10倍,溶液的pH范围:_________。
3
(1)强酸(或强碱)每稀释10倍,pH向7靠拢1个单位。
(2)弱酸(碱)每稀释10倍,pH向7靠拢不到一个单位。
(3)酸碱溶液无限稀释,pH只能接近7。
三、酸碱溶液稀释或混合时pH计算
归纳总结
3.常温下,计算下列溶液混合后的pH。
(1)pH=3的盐酸与pH=5的硫酸溶液等体积混合后溶液的pH为______。
(2)pH=2的盐酸与pH=4的硫酸,若按1∶10的体积比混合(溶液体积变化忽略不计)。混合后溶液的pH为________。
(3)pH=10和pH=12的两种NaOH溶液等体积混合后溶液的pH为______。
3.3
问题探究
=1×10-3 mol·L-1
3
11.7
三、酸碱溶液稀释或混合时pH计算
4. 0.015 mol·L-1的硫酸与0.01 mol·L-1的NaOH溶液等体积混合后溶液的pH是_______。
2
问题探究
酸过量,假设体积为V
5.常温下,pH=12的NaOH溶液和pH=4的HCl溶液等体积混合后溶液的pH为________。
11.7
c(OH-)=10-2 mol·L-1 c(H+)=10-4 mol·L-1 碱过量
三、酸碱溶液稀释或混合时pH计算
酸碱中和反应后pH计算的一般思路(常温)
恰好完全反应呈中性 pH=7
酸过量
碱过量
三、酸碱溶液稀释或混合时pH计算
归纳总结
自我测试
1.正误判断
(1)任何温度下,如果c(H+)不等于c(OH-),则溶液一定呈现酸碱性
(2)将pH试纸放入溶液中,观察其颜色变化并与标准比色卡对照
(3)用蒸馏水润湿的pH试纸测溶液的pH,一定会使结果偏低
(4)用pH计测得某溶液的pH为7.45
×
×
√
√
自我测试
2.下列关于溶液的酸碱性说法正确的是
A.pH=7的溶液呈中性
B.中性溶液中一定有c(H+)=1.0×10-7 mol·L-1
C.c(OH-)=c(H+)的溶液呈中性
D.在100 ℃时,纯水的pH<7,因此显酸性
√
未给出温度
不一定等于1.0×10-7 mol·L-1
c(H+)=c(OH-),还是呈中性
自我测试
3.常温下,某可乐饮料的pH=3,某西红柿汁饮料的pH=4,则这两种饮料中的c(OH-)之比是
A.3∶4
B.1∶10
C.10∶1
D.无法确定
√
c(H+)=10-3 mol·L-1
c(OH-)=10-11 mol·L-1
c(H+)=10-4 mol·L-1
c(OH-)=10-10 mol·L-1
自我测试
4.将pH=2的硫酸溶液与pH=5的硫酸溶液等体积混合,则混合溶液的pH约为(已知:lg 2=0.3)
A.3.3 B.3.5
C.2.3 D.4.7
√
自我测试
5.常温下将0.1 mol·L-1盐酸和0.06 mol·L-1氢氧化钡溶液等体积混合后,该混合溶液的pH=________。
12
OH-过量
本节内容结束
