高二化学人教版选择性必修一第三章 第一节 第2课时 电离平衡常数 强酸与弱酸比较(共26张PPT)
文档属性
| 名称 | 高二化学人教版选择性必修一第三章 第一节 第2课时 电离平衡常数 强酸与弱酸比较(共26张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 33.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-18 00:00:00 | ||
图片预览








文档简介
(共26张PPT)
第一节 电离平衡
第2课时 电离平衡常数 强酸与弱酸比较
第三章 水溶液中的离子反应与平衡
[学习目标]
1.了解电离平衡常数的含义,能利用电离平衡常数进行相关计算(重点)。
2.利用电离平衡常数相对大小关系,建立判断强弱电解质和“强酸制
弱酸”的思维模型(难点)。
温故知新
可逆反应mA(g)+nB(g) pC(g)+qD(g),化学平衡常数如何表示?化学平衡常数的大小与什么有关?
只与温度有关
Ka =
cp(C)·cq(D)
cm(A)·cn(B)
电离平衡与化学平衡类似,请根据化学平衡常数的表达式,推断弱电解质CH3COOH H++CH3COO-的电离平衡常数的表达式?
Ka =
c(CH3COO-)·c(H+)
c(CH3COOH)
一、电离平衡常数
1. 电离平衡常数
(1)概念:
弱电解质溶液中 之比是一个常数,
简称电离常数
对于AB A++B-,Ka或Kb= (酸用Ka,碱用Kb)
c(A+) ·c(B-)
c(AB)
电离生成的各离子浓度乘积
未电离分子的浓度
(2)表示方法:
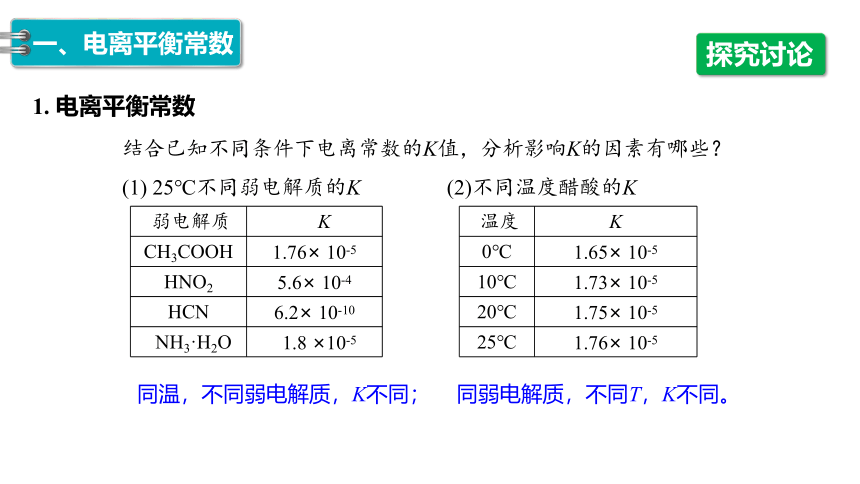
结合已知不同条件下电离常数的K值,分析影响K的因素有哪些?
(1) 25℃不同弱电解质的K (2)不同温度醋酸的K
1. 电离平衡常数
弱电解质 K
CH3COOH 1.76× 10-5
HNO2 5.6× 10-4
HCN 6.2× 10-10
NH3·H2O 1.8 ×10-5
探究讨论
温度 K
0℃ 1.65× 10-5
10℃ 1.73× 10-5
20℃ 1.75× 10-5
25℃ 1.76× 10-5
同温,不同弱电解质,K不同;
同弱电解质,不同T,K不同。
一、电离平衡常数
1. 电离平衡常数
(1)概念:
弱电解质溶液中 之比是一个常数,
简称电离常数
对于AB A++B-,Ka或Kb= (酸用Ka,碱用Kb)
c(A+) ·c(B-)
c(AB)
电离生成的各离子浓度乘积
未电离分子的浓度
(2)表示方法:
(3)影响因素:
①同温,不同弱电解质的K取决于弱电解质的性质;(内因)
②同一弱电解质的稀溶液,K只与温度有关。(外因)
一、电离平衡常数
2.多元弱酸的电离平衡常数
(1)多元弱酸每一步电离都有电离平衡常数
25℃ K
H2CO3 Ka1 = 4.5 ×10-7
Ka2 = 4.7 ×10-11
H2SO3 Ka1 = 1.4 ×10-2
Ka2 = 6.0 ×10-8
25 ℃ H2CO3 H++
Ka1 =
c(H+)·c()
c(H2CO3)
H++
Ka2 =
c(H+)·c()
c()
(2)多元弱酸各步电离常数的大小比较:
Ka1>Ka2>Ka3……
当Ka1 Ka2时,多元弱酸的酸性主要由第一步电离决定。
一、电离平衡常数
思考交流
1.正误判断
(1)改变条件,电离平衡正向移动,电离平衡常数一定增大
(2)同一弱电解质,浓度大的电离平衡常数大
(3)H2CO3的电离常数表达式为Ka=
×
×
×
2.已知25 ℃时Ka(HCOOH)=1.8×10-4,0 ℃时,Ka(HCOOH)______1.8×10-4
(填“>”“<”或“=”)。
<
一、电离平衡常数
思考交流
3.如何从定量角度判断醋酸溶液中加水稀释一倍后,电离平衡移动方向?
一、电离平衡常数
思考交流
4.在某温度时,溶质的物质的量浓度为0.20 mol·L-1的氨水中,达到电离平衡时,已电离的NH3·H2O为1.7×10-3 mol·L-1,试计算该温度下NH3·H2O的电离常数Kb。
NH3·H2O + OH-
起始/(mol·L-1) 0.20 0 0
变化/(mol·L-1) 1.7×10-3 1.7×10-3 1.7×10-3
平衡/(mol·L-1) 0.20-1.7×10-3 1.7×10-3 1.7×10-3
c(NH3·H2O)=(0.20-1.7×10-3)mol·L-1≈0.20 mol·L-1
一、电离平衡常数
思考交流
5.已知25 ℃时,CH3COOH的Ka=1.75×10-5,计算0.10 mol·L-1的CH3COOH溶液达到电离平衡时c(H+)的浓度。
设醋酸电离达到平衡时H+的浓度为x mol·L-1
CH3COOH H++CH3COO-
初始/(mol·L-1) 0.10 0 0
平衡/(mol·L-1) 0.10-x x x
当Ka数值很小时,x的数值很小,可作近似处理:0.10-x≈0.10
一、电离平衡常数
有关电离平衡常数的计算模板
HX H+ + X-
起始 c(HX) 0 0
平衡 c(HX)-c(H+) c(H+) c(X-)
一、电离平衡常数
归纳总结
二、电离平衡常数的应用
向盛有2 mL 1 mol/L醋酸的试管中滴加1 mol/L Na2CO3溶液,观察现象。你能否由此推测CH3COOH的Ka和H2CO3的Ka1的大小
现象:产生气泡
离子方程式
+2CH3COOH==
2CH3COO-+CO2↑+H2O
结论:Ka(CH3COOH)>Ka1(H2CO3)
探究讨论
1. 电离平衡常数K的意义
K的大小表征了弱电解质的相对强弱。
2. 电离平衡常数的应用
(1)根据电离常数判断弱酸(碱)的强弱
同温,弱酸Ka越大,电离程度越大,酸性越强;
弱碱Kb越大,电离程度越大,碱性越强。
(2)根据强酸制弱酸比较电离常数
例如向盛有醋酸的试管中滴加Na2CO3溶液,产生气泡,说明醋酸的酸性比碳酸的酸性强,同时也证明K(醋酸)>K(碳酸)
二、电离平衡常数的应用
思考交流
1.已知:25 ℃时,下列四种弱酸的电离常数:
CH3COOH HCOOH HClO H2CO3
K 1.75×10-5 1.8×10-4 4.0×10-8 Ka1=4.5×10-7,Ka2=4.7×10-11
(1)试比较相同浓度的CH3COOH、HCOOH、HClO、H2CO3溶液的酸性强弱。
(2)向CH3COOH溶液中加入一定量的盐酸时,CH3COOH的电离平衡向哪个方向移动?
_________。CH3COOH的电离常数________(填“变大”“变小”或“不变”),理由
是_______________________。
K越大,酸性越强,故酸性:HCOOH>CH3COOH>H2CO3>HClO。
逆向移动
不变
电离常数只与温度有关
二、电离平衡常数的应用
思考交流
(3)由表格中的数据判断下列离子方程式不正确的是_____(填字母)。
a.2ClO-+H2O+CO2== 2HClO+
b.HCOOH+ == HCOO-+
c.HCOOH+CH3COO- == HCOO-+CH3COOH
d.Cl2+H2O+2 == 2+Cl-+ClO-
a
电离程度:次氯酸大于碳酸氢根离子
二、电离平衡常数的应用
1.已知:25 ℃时,下列四种弱酸的电离常数:
CH3COOH HCOOH HClO H2CO3
K 1.75×10-5 1.8×10-4 4.0×10-8 Ka1=4.5×10-7,Ka2=4.7×10-11
思考交流
(4)写出向NaClO和CH3COONa的混合溶液中通入少量CO2的化学方程式:_________________________________。
二、电离平衡常数的应用
1.已知:25 ℃时,下列四种弱酸的电离常数:
CH3COOH HCOOH HClO H2CO3
K 1.75×10-5 1.8×10-4 4.0×10-8 Ka1=4.5×10-7,Ka2=4.7×10-11
思考交流
2.已知下面三个数据6.3×10-4、5.6×10-4、6.2×10-10分别是下列有关的三种酸的电离常数(25 ℃),若已知下列反应可以发生:
NaCN+HNO2===HCN+NaNO2、
NaCN+HF===HCN+NaF、
NaNO2+HF===HNO2+NaF。
(1)三种酸的强弱顺序是________________。
(2)HF的电离常数Ka(HF)=__________。
(3)HCN的电离常数Ka(HCN)=__________。
HF>HNO2>HCN
6.3×10-4
6.2×10-10
二、电离平衡常数的应用
思考交流
3.在一定温度下,加水逐渐稀释1 mol·L-1氨水的过程中,随着水量的增加,请说明溶液中下列含量的变化:
(1)n(OH-)______(填“增大”“减小”或“不变”,下同)。
增大
增大
不变
加水稀释,平衡向电离方向移动,n() 、n(OH-)均增大;
Kb=
c() ·c(OH-)
c(NH3·H2O)
不变
=
c(OH-)
c(NH3·H2O)
n(OH-)
n(NH3·H2O)
,n(NH3·H2O)逐渐减小;
二、电离平衡常数的应用
三、强酸、弱酸与活泼金属反应的特点
向两个锥形瓶中各加入0.05 g镁条,塞紧橡胶塞,然后用注射器分别注入2 mL 2 mol·L-1盐酸、2 mL 2 mol·L-1醋酸,测得锥形瓶内气体的压强随时间的变化如图所示:
(1)两个反应的反应速率及其变化有什么特点
(2)反应结束时,两个锥形瓶内气体的压强基本相等,由此你能得出什么结论
思考讨论
1. 同条件,镁条与盐酸、醋酸的反应
宏观辨识 微观探析
反应初期 v盐酸 比 v醋酸 大 盐酸是强酸,完全电离,醋酸是弱酸,部分电离,两者同浓度,盐酸中的c(H+)较大,因而反应速率较大
反应过程中 v盐酸始终大,v盐酸减小明显,v醋酸减小不明显 随反应进行,醋酸电离平衡正向移动,消耗的H+能及时电离补充,所以一段时间内速率变化不明显
最终 二者产生H2的量基本相等,速率几乎都变为零 镁条稍过量,两种酸的物质的量相同,随醋酸电离,平衡正向移动,醋酸几乎消耗完全,最终二者与镁条反应的H+的物质的量几乎相同,因而产生的H2量几乎相同。
两种酸都几乎消耗完全,反应停止,速率几乎都变为0
三、强酸、弱酸与活泼金属反应的特点
2.一元强酸和一元弱酸的比较
(1)同体积、同物质的量浓度的一元强酸(如盐酸)与一元弱酸(如醋酸)的比较
比较项目 酸 c(H+) 酸性 中和碱 的能力 与足量活泼金属反应产生H2的总量 与同一金属反应时的起始反应速率
一元强酸
一元弱酸
(2)同体积、同c(H+)的一元强酸(如盐酸)与一元弱酸(如醋酸)的比较
比较项目 酸 c(H+) 酸性 中和碱 的能力 与足量活泼金属反应产生H2的总量 与同一金属反应时的起始反应速率
一元强酸
一元弱酸
三、强酸、弱酸与活泼金属反应的特点
大
小
强
弱
相同
相同
大
小
相同
相同
小
大
少
多
相同
自我测试
1.已知25 ℃时,CH3COOH的电离平衡常数Ka=1.75×10-5。下列说法正确的是
A.向该溶液中加入一定量的硫酸,Ka增大
B.升高温度,Ka增大
C.向CH3COOH溶液中加入少量水,Ka增大
D.向CH3COOH溶液中加入少量氢氧化钠溶液,Ka增大
√
K只受温度影响,电离是吸热过程
自我测试
2.常温条件下,H2A(酸):Ka1=4.3×10-7,Ka2=2.1×10-12;H2B(酸):Ka1=1.0×10-7,Ka2=6.3×10-13。在浓度相同的两种溶液中,用“>”“<”或“=”填空。
(1)H+的浓度:H2A______H2B。
(2)酸根离子的浓度:c(A2-)_____c(B2-)。
(3)酸分子的浓度:c(H2A)_____c(H2B)。
(4)溶液的导电能力:H2A______H2B。
>
>
<
>
自我测试
3.某温度下,NH3·H2O的Kb=1.8×10-5,
(1)计算0.10 mol·L-1NH3·H2O的c(OH-)=____________________ (可以不化简)。
(2)若向其中加入固体NH4Cl,使 的浓度达到0.20 mol·L-1,计算c(OH-)=__________________。
9.0×10-6 mol·L-1
c(NH3·H2O)≈0.10 mol·L-1,c(OH-)≈c()
温度不变,加入NH4Cl固体,NH3·H2O的电离平衡逆向移动,c(NH3·H2O)更接近0.10 mol·L-1,
本节内容结束
第一节 电离平衡
第2课时 电离平衡常数 强酸与弱酸比较
第三章 水溶液中的离子反应与平衡
[学习目标]
1.了解电离平衡常数的含义,能利用电离平衡常数进行相关计算(重点)。
2.利用电离平衡常数相对大小关系,建立判断强弱电解质和“强酸制
弱酸”的思维模型(难点)。
温故知新
可逆反应mA(g)+nB(g) pC(g)+qD(g),化学平衡常数如何表示?化学平衡常数的大小与什么有关?
只与温度有关
Ka =
cp(C)·cq(D)
cm(A)·cn(B)
电离平衡与化学平衡类似,请根据化学平衡常数的表达式,推断弱电解质CH3COOH H++CH3COO-的电离平衡常数的表达式?
Ka =
c(CH3COO-)·c(H+)
c(CH3COOH)
一、电离平衡常数
1. 电离平衡常数
(1)概念:
弱电解质溶液中 之比是一个常数,
简称电离常数
对于AB A++B-,Ka或Kb= (酸用Ka,碱用Kb)
c(A+) ·c(B-)
c(AB)
电离生成的各离子浓度乘积
未电离分子的浓度
(2)表示方法:
结合已知不同条件下电离常数的K值,分析影响K的因素有哪些?
(1) 25℃不同弱电解质的K (2)不同温度醋酸的K
1. 电离平衡常数
弱电解质 K
CH3COOH 1.76× 10-5
HNO2 5.6× 10-4
HCN 6.2× 10-10
NH3·H2O 1.8 ×10-5
探究讨论
温度 K
0℃ 1.65× 10-5
10℃ 1.73× 10-5
20℃ 1.75× 10-5
25℃ 1.76× 10-5
同温,不同弱电解质,K不同;
同弱电解质,不同T,K不同。
一、电离平衡常数
1. 电离平衡常数
(1)概念:
弱电解质溶液中 之比是一个常数,
简称电离常数
对于AB A++B-,Ka或Kb= (酸用Ka,碱用Kb)
c(A+) ·c(B-)
c(AB)
电离生成的各离子浓度乘积
未电离分子的浓度
(2)表示方法:
(3)影响因素:
①同温,不同弱电解质的K取决于弱电解质的性质;(内因)
②同一弱电解质的稀溶液,K只与温度有关。(外因)
一、电离平衡常数
2.多元弱酸的电离平衡常数
(1)多元弱酸每一步电离都有电离平衡常数
25℃ K
H2CO3 Ka1 = 4.5 ×10-7
Ka2 = 4.7 ×10-11
H2SO3 Ka1 = 1.4 ×10-2
Ka2 = 6.0 ×10-8
25 ℃ H2CO3 H++
Ka1 =
c(H+)·c()
c(H2CO3)
H++
Ka2 =
c(H+)·c()
c()
(2)多元弱酸各步电离常数的大小比较:
Ka1>Ka2>Ka3……
当Ka1 Ka2时,多元弱酸的酸性主要由第一步电离决定。
一、电离平衡常数
思考交流
1.正误判断
(1)改变条件,电离平衡正向移动,电离平衡常数一定增大
(2)同一弱电解质,浓度大的电离平衡常数大
(3)H2CO3的电离常数表达式为Ka=
×
×
×
2.已知25 ℃时Ka(HCOOH)=1.8×10-4,0 ℃时,Ka(HCOOH)______1.8×10-4
(填“>”“<”或“=”)。
<
一、电离平衡常数
思考交流
3.如何从定量角度判断醋酸溶液中加水稀释一倍后,电离平衡移动方向?
一、电离平衡常数
思考交流
4.在某温度时,溶质的物质的量浓度为0.20 mol·L-1的氨水中,达到电离平衡时,已电离的NH3·H2O为1.7×10-3 mol·L-1,试计算该温度下NH3·H2O的电离常数Kb。
NH3·H2O + OH-
起始/(mol·L-1) 0.20 0 0
变化/(mol·L-1) 1.7×10-3 1.7×10-3 1.7×10-3
平衡/(mol·L-1) 0.20-1.7×10-3 1.7×10-3 1.7×10-3
c(NH3·H2O)=(0.20-1.7×10-3)mol·L-1≈0.20 mol·L-1
一、电离平衡常数
思考交流
5.已知25 ℃时,CH3COOH的Ka=1.75×10-5,计算0.10 mol·L-1的CH3COOH溶液达到电离平衡时c(H+)的浓度。
设醋酸电离达到平衡时H+的浓度为x mol·L-1
CH3COOH H++CH3COO-
初始/(mol·L-1) 0.10 0 0
平衡/(mol·L-1) 0.10-x x x
当Ka数值很小时,x的数值很小,可作近似处理:0.10-x≈0.10
一、电离平衡常数
有关电离平衡常数的计算模板
HX H+ + X-
起始 c(HX) 0 0
平衡 c(HX)-c(H+) c(H+) c(X-)
一、电离平衡常数
归纳总结
二、电离平衡常数的应用
向盛有2 mL 1 mol/L醋酸的试管中滴加1 mol/L Na2CO3溶液,观察现象。你能否由此推测CH3COOH的Ka和H2CO3的Ka1的大小
现象:产生气泡
离子方程式
+2CH3COOH==
2CH3COO-+CO2↑+H2O
结论:Ka(CH3COOH)>Ka1(H2CO3)
探究讨论
1. 电离平衡常数K的意义
K的大小表征了弱电解质的相对强弱。
2. 电离平衡常数的应用
(1)根据电离常数判断弱酸(碱)的强弱
同温,弱酸Ka越大,电离程度越大,酸性越强;
弱碱Kb越大,电离程度越大,碱性越强。
(2)根据强酸制弱酸比较电离常数
例如向盛有醋酸的试管中滴加Na2CO3溶液,产生气泡,说明醋酸的酸性比碳酸的酸性强,同时也证明K(醋酸)>K(碳酸)
二、电离平衡常数的应用
思考交流
1.已知:25 ℃时,下列四种弱酸的电离常数:
CH3COOH HCOOH HClO H2CO3
K 1.75×10-5 1.8×10-4 4.0×10-8 Ka1=4.5×10-7,Ka2=4.7×10-11
(1)试比较相同浓度的CH3COOH、HCOOH、HClO、H2CO3溶液的酸性强弱。
(2)向CH3COOH溶液中加入一定量的盐酸时,CH3COOH的电离平衡向哪个方向移动?
_________。CH3COOH的电离常数________(填“变大”“变小”或“不变”),理由
是_______________________。
K越大,酸性越强,故酸性:HCOOH>CH3COOH>H2CO3>HClO。
逆向移动
不变
电离常数只与温度有关
二、电离平衡常数的应用
思考交流
(3)由表格中的数据判断下列离子方程式不正确的是_____(填字母)。
a.2ClO-+H2O+CO2== 2HClO+
b.HCOOH+ == HCOO-+
c.HCOOH+CH3COO- == HCOO-+CH3COOH
d.Cl2+H2O+2 == 2+Cl-+ClO-
a
电离程度:次氯酸大于碳酸氢根离子
二、电离平衡常数的应用
1.已知:25 ℃时,下列四种弱酸的电离常数:
CH3COOH HCOOH HClO H2CO3
K 1.75×10-5 1.8×10-4 4.0×10-8 Ka1=4.5×10-7,Ka2=4.7×10-11
思考交流
(4)写出向NaClO和CH3COONa的混合溶液中通入少量CO2的化学方程式:_________________________________。
二、电离平衡常数的应用
1.已知:25 ℃时,下列四种弱酸的电离常数:
CH3COOH HCOOH HClO H2CO3
K 1.75×10-5 1.8×10-4 4.0×10-8 Ka1=4.5×10-7,Ka2=4.7×10-11
思考交流
2.已知下面三个数据6.3×10-4、5.6×10-4、6.2×10-10分别是下列有关的三种酸的电离常数(25 ℃),若已知下列反应可以发生:
NaCN+HNO2===HCN+NaNO2、
NaCN+HF===HCN+NaF、
NaNO2+HF===HNO2+NaF。
(1)三种酸的强弱顺序是________________。
(2)HF的电离常数Ka(HF)=__________。
(3)HCN的电离常数Ka(HCN)=__________。
HF>HNO2>HCN
6.3×10-4
6.2×10-10
二、电离平衡常数的应用
思考交流
3.在一定温度下,加水逐渐稀释1 mol·L-1氨水的过程中,随着水量的增加,请说明溶液中下列含量的变化:
(1)n(OH-)______(填“增大”“减小”或“不变”,下同)。
增大
增大
不变
加水稀释,平衡向电离方向移动,n() 、n(OH-)均增大;
Kb=
c() ·c(OH-)
c(NH3·H2O)
不变
=
c(OH-)
c(NH3·H2O)
n(OH-)
n(NH3·H2O)
,n(NH3·H2O)逐渐减小;
二、电离平衡常数的应用
三、强酸、弱酸与活泼金属反应的特点
向两个锥形瓶中各加入0.05 g镁条,塞紧橡胶塞,然后用注射器分别注入2 mL 2 mol·L-1盐酸、2 mL 2 mol·L-1醋酸,测得锥形瓶内气体的压强随时间的变化如图所示:
(1)两个反应的反应速率及其变化有什么特点
(2)反应结束时,两个锥形瓶内气体的压强基本相等,由此你能得出什么结论
思考讨论
1. 同条件,镁条与盐酸、醋酸的反应
宏观辨识 微观探析
反应初期 v盐酸 比 v醋酸 大 盐酸是强酸,完全电离,醋酸是弱酸,部分电离,两者同浓度,盐酸中的c(H+)较大,因而反应速率较大
反应过程中 v盐酸始终大,v盐酸减小明显,v醋酸减小不明显 随反应进行,醋酸电离平衡正向移动,消耗的H+能及时电离补充,所以一段时间内速率变化不明显
最终 二者产生H2的量基本相等,速率几乎都变为零 镁条稍过量,两种酸的物质的量相同,随醋酸电离,平衡正向移动,醋酸几乎消耗完全,最终二者与镁条反应的H+的物质的量几乎相同,因而产生的H2量几乎相同。
两种酸都几乎消耗完全,反应停止,速率几乎都变为0
三、强酸、弱酸与活泼金属反应的特点
2.一元强酸和一元弱酸的比较
(1)同体积、同物质的量浓度的一元强酸(如盐酸)与一元弱酸(如醋酸)的比较
比较项目 酸 c(H+) 酸性 中和碱 的能力 与足量活泼金属反应产生H2的总量 与同一金属反应时的起始反应速率
一元强酸
一元弱酸
(2)同体积、同c(H+)的一元强酸(如盐酸)与一元弱酸(如醋酸)的比较
比较项目 酸 c(H+) 酸性 中和碱 的能力 与足量活泼金属反应产生H2的总量 与同一金属反应时的起始反应速率
一元强酸
一元弱酸
三、强酸、弱酸与活泼金属反应的特点
大
小
强
弱
相同
相同
大
小
相同
相同
小
大
少
多
相同
自我测试
1.已知25 ℃时,CH3COOH的电离平衡常数Ka=1.75×10-5。下列说法正确的是
A.向该溶液中加入一定量的硫酸,Ka增大
B.升高温度,Ka增大
C.向CH3COOH溶液中加入少量水,Ka增大
D.向CH3COOH溶液中加入少量氢氧化钠溶液,Ka增大
√
K只受温度影响,电离是吸热过程
自我测试
2.常温条件下,H2A(酸):Ka1=4.3×10-7,Ka2=2.1×10-12;H2B(酸):Ka1=1.0×10-7,Ka2=6.3×10-13。在浓度相同的两种溶液中,用“>”“<”或“=”填空。
(1)H+的浓度:H2A______H2B。
(2)酸根离子的浓度:c(A2-)_____c(B2-)。
(3)酸分子的浓度:c(H2A)_____c(H2B)。
(4)溶液的导电能力:H2A______H2B。
>
>
<
>
自我测试
3.某温度下,NH3·H2O的Kb=1.8×10-5,
(1)计算0.10 mol·L-1NH3·H2O的c(OH-)=____________________ (可以不化简)。
(2)若向其中加入固体NH4Cl,使 的浓度达到0.20 mol·L-1,计算c(OH-)=__________________。
9.0×10-6 mol·L-1
c(NH3·H2O)≈0.10 mol·L-1,c(OH-)≈c()
温度不变,加入NH4Cl固体,NH3·H2O的电离平衡逆向移动,c(NH3·H2O)更接近0.10 mol·L-1,
本节内容结束
