2.1.2 影响化学反应速率的因素 课件(共39张PPT)2023—2024学年上学期高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.1.2 影响化学反应速率的因素 课件(共39张PPT)2023—2024学年上学期高二化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 579.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-18 12:56:45 | ||
图片预览






文档简介
(共39张PPT)
影响化学反应速率的因素
1.通过实验,从宏观上认识外界因素影响化学反应速率的规律。
2.建立分析探究外界因素影响化学反应速率的思维模型。
3.通过定性与定量研究影响化学反应速率的因素,提高学生设计探究方案、进
行实验探究的能力。
学习目标
Ⅰ、定性研究影响化学反应速率的因素
1.科学研究的基本步骤
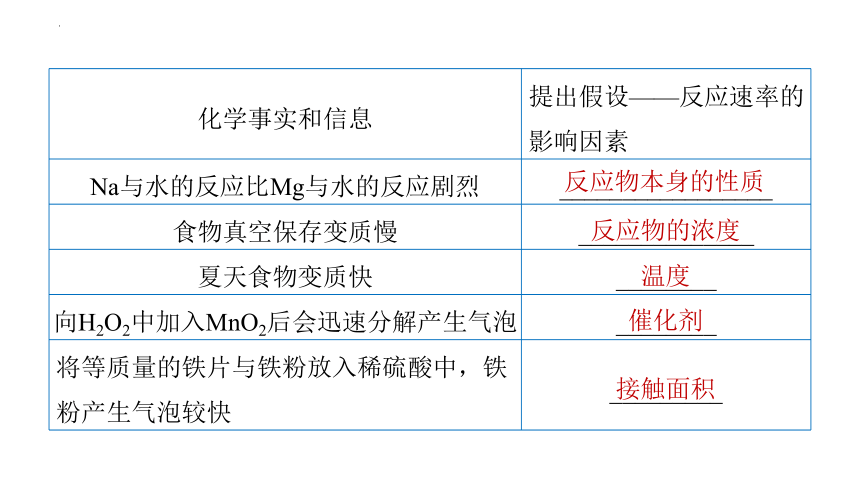
提出问题→收集化学事实与信息→提出假设→设计实验方案→实验探究→得出结论
化学事实和信息 提出假设——反应速率的影响因素
Na与水的反应比Mg与水的反应剧烈 _________________
食物真空保存变质慢 ______________
夏天食物变质快 ________
向H2O2中加入MnO2后会迅速分解产生气泡 ________
将等质量的铁片与铁粉放入稀硫酸中,铁粉产生气泡较快 _________
反应物本身的性质
反应物的浓度
温度
催化剂
接触面积
2.化学反应速率的定性描述
能体现化学反应速率的反应现象有:颜色 快慢,产生气泡 ,产生浑浊快慢,固体减少快慢等。
3.定性研究影响化学反应速率的因素
(1)实验原理
Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O
变化
快慢
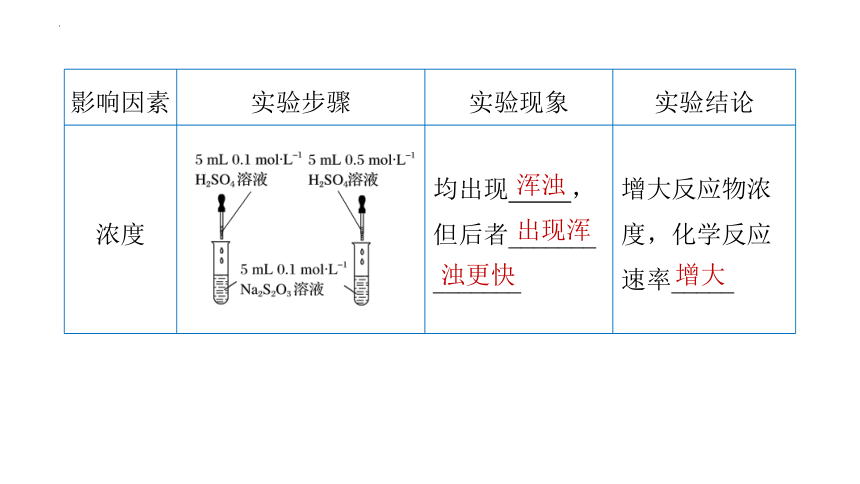
影响因素 实验步骤 实验现象 实验结论
浓度 均出现 ,但后者_______ _______ 增大反应物浓度,化学反应速率_____
浑浊
出现浑
浊更快
增大
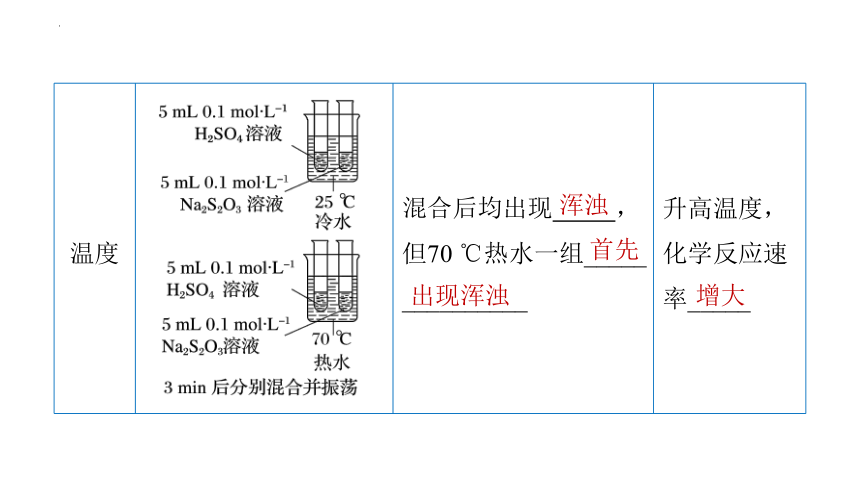
温度 混合后均出现 ,但70 ℃热水一组_____ __________ 升高温度,化学反应速率_____
浑浊
首先
出现浑浊
增大
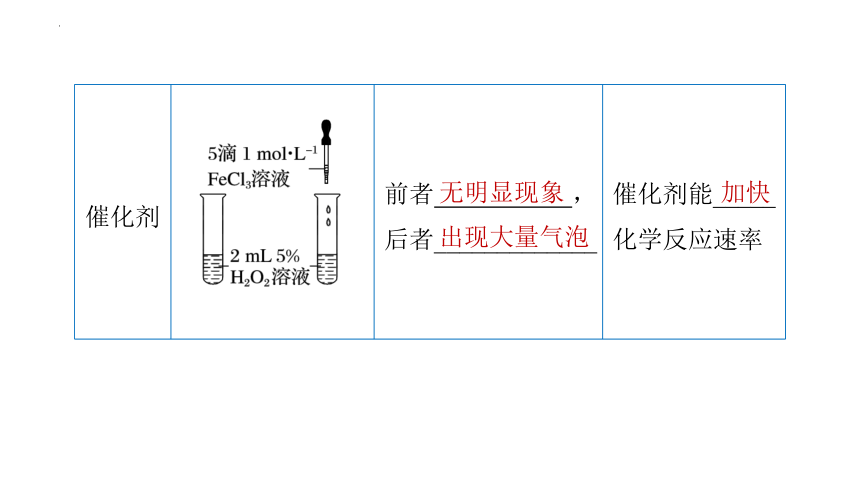
催化剂 前者 ,后者_____________ 催化剂能_____
化学反应速率
无明显现象
出现大量气泡
加快
Ⅱ、定量研究影响化学反应速率的因素
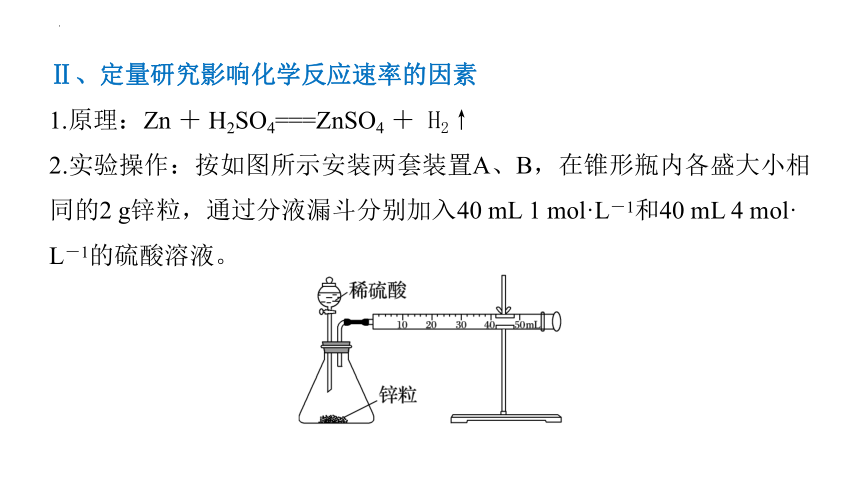
1.原理:Zn + H2SO4===ZnSO4 + H2↑
2.实验操作:按如图所示安装两套装置A、B,在锥形瓶内各盛大小相同的2 g锌粒,通过分液漏斗分别加入40 mL 1 mol·L-1和40 mL 4 mol·
L-1的硫酸溶液。
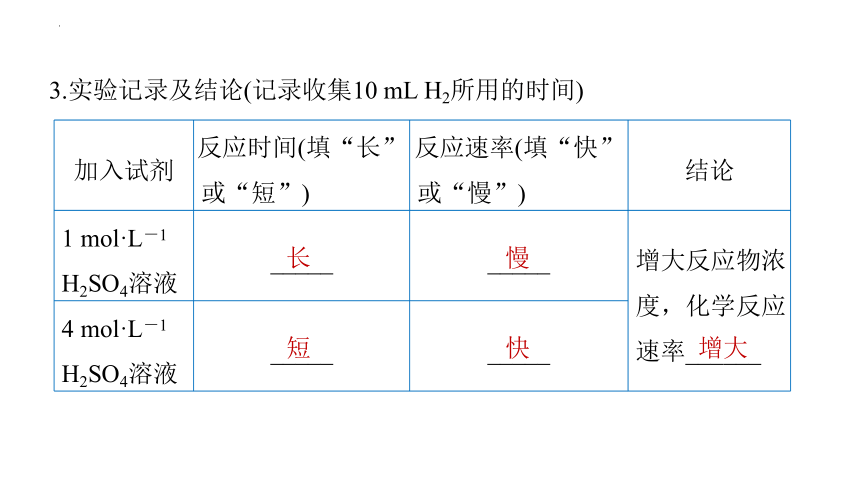
3.实验记录及结论(记录收集10 mL H2所用的时间)
加入试剂 反应时间(填“长” 或“短”) 反应速率(填“快” 或“慢”) 结论
1 mol·L-1 H2SO4溶液 _____ _____ 增大反应物浓度,化学反应速率______
4 mol·L-1 H2SO4溶液 _____ _____
增大
长
短
慢
快
4.实验拓展探究
在用上述实验测定锌与硫酸反应的速率时:
(1)为确保测定的准确性,应注意哪些事项?_____________________
_________________________________________________________________ 。
(2)用上述装置测定化学反应速率时,操作、药品无误,结果测定速率偏大,从装置缺陷的角度分析可能的原因是______________________
。
锌的颗粒(即比表面积)大小基本相同;稀硫酸要迅速加入;装置气密性良好,且计时要迅速准确
忽视加入稀硫酸排出气
体的体积
(3)除了测定氢气的体积外,你还能设计哪些方案测定锌与稀硫酸反应的速率?____________________________________________________
____________________________________________________________
在恒容反应装置中,测定一段时间内压强的变化;测定一段时间内H+的浓度变化;测定一段时间内锌粒的质量变化等。
(1)任何化学反应都可以通过反应现象判断化学反应的快慢
(2)测定化学反应速率,可以用比色的方法测定溶液颜色的深浅进行比较
正误判断
×
(3)可用装置 测定过氧化氢分解的化学反应速率
√
×
(4)锌与H2SO4反应,H2SO4的浓度越大,产生H2的速率越快
×
1.(1)亚氯酸盐(如NaClO2)可用作漂白剂,在常温,不见光时可保存一年,但在酸性溶液中因生成亚氯酸而发生分解:5HClO2===4ClO2↑+H++Cl-+2H2O,分解时刚加入硫酸反应缓慢,随后突然反应释放出大量ClO2,这是因为________________________。
溶液中的Cl- 起催化作用
(2)H2O2分解制O2的实验中,在10% H2O2溶液中未加催化剂,试管口带火星的木条没有明显变化。加入MnO2粉末,溶液中迅速产生大量气泡,木条立刻复燃;若加入1 mL 0.1 mol·L-1 FeCl3溶液,溶液中产生气泡比较快,木条复燃;若加入1 mL 0.1 mol·L-1 CuCl2溶液,溶液中产生气泡比较慢,一段时间后木条复燃。由此可知催化剂的催化效果___________________。
MnO2>Fe3+>Cu2+
2.控制变量法是化学实验的常用方法之一。某化学兴趣小组为探究外界条件对化学反应速率的影响,设计以下四组实验。
实验 方案 反应温 度/℃ Na2S2O3溶液 稀H2SO4 H2O
V/mL c/(mol·L-1) V/mL c/(mol·L-1) V/mL
① 25 5 0.1 10 0.1 5
② 25 V1 0.2 5 0.2 10
③ 35 5 0.1 10 0.1 5
④ 35 5 0.2 5 0.2 V2
回答下列问题:
(1)V1=____,V2=____。
实验 方案 反应温 度/℃ Na2S2O3溶液 稀H2SO4 H2O
V/mL c/(mol·L-1) V/mL c/(mol·L-1) V/mL
① 25 5 0.1 10 0.1 5
② 25 V1 0.2 5 0.2 10
③ 35 5 0.1 10 0.1 5
④ 35 5 0.2 5 0.2 V2
5
10
(2)设计实验方案①和②的目的是:______________________________
__________。
实验 方案 反应温 度/℃ Na2S2O3溶液 稀H2SO4 H2O
V/mL c/(mol·L-1) V/mL c/(mol·L-1) V/mL
① 25 5 0.1 10 0.1 5
② 25 V1 0.2 5 0.2 10
③ 35 5 0.1 10 0.1 5
④ 35 5 0.2 5 0.2 V2
探究Na2S2O3的浓度对化学反应速
率的影响
(3)设计实验方案②和④的目的是:______________________________。
实验 方案 反应温 度/℃ Na2S2O3溶液 稀H2SO4 H2O
V/mL c/(mol·L-1) V/mL c/(mol·L-1) V/mL
① 25 5 0.1 10 0.1 5
② 25 V1 0.2 5 0.2 10
③ 35 5 0.1 10 0.1 5
④ 35 5 0.2 5 0.2 V2
探究温度对化学反应速率的影响
(4)各实验方案中均需加入一定体积的水的原因:__________________
______________。
实验 方案 反应温 度/℃ Na2S2O3溶液 稀H2SO4 H2O
V/mL c/(mol·L-1) V/mL c/(mol·L-1) V/mL
① 25 5 0.1 10 0.1 5
② 25 V1 0.2 5 0.2 10
③ 35 5 0.1 10 0.1 5
④ 35 5 0.2 5 0.2 V2
各实验方案中混合液
的体积均相等
1.某实验小组以H2O2分解为例,研究浓度、催化剂对反应速率的影响。在常温下按照如下方案完成实验。实验②的反应物应为
A.5 mL 2% H2O2溶液 B.10 mL 2% H2O2溶液
C.10 mL 5% H2O2溶液 D.5 mL 10% H2O2溶液
实验编号 反应物 催化剂
① 10 mL 2% H2O2溶液 无
② 无
③ 10 mL 5% H2O2溶液 MnO2固体
√
2.草酸(H2C2O4)是一种重要的化学试剂。下面是利用草酸探究外界条件对反应速率影响的实验。
(1)该反应是溶液之间发生的不可逆反应,改变压强对其反应速率的影响是____(填字母)。
A.可能明显加快
B.可能明显减慢
C.几乎无影响,可以忽略
C
(2)用酸性KMnO4和H2C2O4反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如图1(KMnO4溶液已酸化):
实验序号 A溶液 B溶液
① 20 mL 0.1 mol·L-1H2C2O4溶液 30 mL 0.01 mol·L-1KMnO4溶液
② 20 mL 0.2 mol·L-1H2C2O4溶液 30 mL 0.01 mol·L-1KMnO4溶液
①该反应的离子方程式为___________________
_______________________________。
实验序号 A溶液 B溶液
① 20 mL 0.1 mol·L-1H2C2O4溶液 30 mL 0.01 mol·L-1KMnO4溶液
② 20 mL 0.2 mol·L-1H2C2O4溶液 30 mL 0.01 mol·L-1KMnO4溶液
6H+===2Mn2++10CO2↑+8H2O
②该实验探究的是__________对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是________(用实验序号填空)。
实验序号 A溶液 B溶液
① 20 mL 0.1 mol·L-1H2C2O4溶液 30 mL 0.01 mol·L-1KMnO4溶液
② 20 mL 0.2 mol·L-1H2C2O4溶液 30 mL 0.01 mol·L-1KMnO4溶液
草酸浓度
②>①
(3)若实验①在2 min末收集了4.48 mL CO2(标准状况下),则在2 min 末c( )=_______ mol·
L-1(假设混合液体积为50 mL)。
实验序号 A溶液 B溶液
① 20 mL 0.1 mol·L-1H2C2O4溶液 30 mL 0.01 mol·L-1KMnO4溶液
② 20 mL 0.2 mol·L-1H2C2O4溶液 30 mL 0.01 mol·L-1KMnO4溶液
0.005 2
(4)小组同学发现反应速率总是如图2,其中t1~t2时间内速率变快的主要原因可能是:
①___________________;
②___________________________________。
该反应为放热反应
产物Mn2+(或MnSO4)是反应的催化剂
1.实验探究的科学方法及思路
变量控制→对照实验→定性观察或定量测定→科学归纳
2.控制变量探究实验题的思维流程
返回
1.浓度
增大反应物的浓度,化学反应速率 ;减小反应物的浓度,化学反应速率 。
注意事项 ①浓度对速率的影响适用于气体或溶液参与的反应,固体和纯液体的浓度视为常数。②对于离子反应,实际参加反应的离子浓度发生变化,才会引起化学反应速率的改变。
加快
减慢
2.压强
增大压强,引起气体反应物浓度 ,化学反应速率 ;减小压强,引起气体反应物浓度 ,化学反应速率 。
注意事项 压强对速率的影响适用于有气体参与的反应,且通过浓度对反应速率的影响实现。
增大
减小
加快
减慢
3.温度
升高温度,化学反应速率 ;
降低温度,化学反应速率 。
注意事项 温度对反应速率的影响适用于除电化学反应外的绝大多数化学反应,如升高温度,不论吸热反应还是放热反应,不论正反应速率还是逆反应速率,均加快。
加快
减慢
4.催化剂
催化剂同等程度的影响正、逆反应速率,正催化剂 化学反应速率,逆催化剂 化学反应速率。
5.其他因素
接触面积、溶剂的性质、光、超声波、磁场、形成原电池等均能影响化学反应速率。
注意 实际生产生活中,影响一个化学反应速率的因素可能是多方面的。
加快
减慢
(1)增加少量固体反应物的质量,化学反应速率增大
(2)100 mL 2 mol·L-1的盐酸与锌片反应,加入适量的NaCl溶液,反应速率不变
(3)升高温度,吸热反应速率会加快而放热反应速率会减慢
正误判断
×
×
×
(4)恒容体系发生反应:2SO2+O2 2SO3 ΔH<0,升高温度,v正增大,v逆减小
×
(5)无论任何反应,若增大压强,反应速率一定增大
(6)恒温恒容密闭容器中发生的全为气体的反应,若容器内总压强增大,则反应速率一定增大
×
×
(1)恒温恒容条件下,向反应体系中充入氮气,反应速率________(填“增大”“减小”或“不变”,下同),原因是____________________
__________________。
(2)恒温恒容条件下,向反应体系中充入氦气,反应速率______,原因是__________________________________________________________
__________。
增大
增大反应物的浓度,
化学反应速率增大
不变
恒容条件下,充入氦气,反应物和生成物的浓度不变,化学反应速率不变
(3)恒温恒压条件下,向反应体系中充入氦气,反应速率______,原因是________________________________________________________
_________________。
减小
压强不变,充入氦气,容积增大,反应物和生成物的浓度减小,
化学反应速率减小
1.下列实验中将水、试剂1、试剂2混合后褪色最快的是
选项 温度 水 试剂1 试剂2
A 25 ℃ 4 mL 4 mL 0.01 mol·L-1 KMnO4 2 mL 0.1 mol·L-1 H2C2O4
B 25 ℃ 2 mL 4 mL 0.01 mol·L-1 KMnO4 4 mL 0.1 mol·L-1 H2C2O4
C 35 ℃ 2 mL 4 mL 0.01 mol·L-1 KMnO4 4 mL 0.1 mol·L-1 H2C2O4
D 35 ℃ 2 mL 4 mL 0.01 mol·L-1 KMnO4 4 mL 0.1 mol·L-1 H2C2O4、少量MnSO4固体
√
2.下列关于化学反应速率的说法中,正确的是
①反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g)在2 L的密闭容器中进行,1 min后,NH3减少了0.12 mol,则1 min末的化学反应速率为v(NO)=0.06 mol·L-1·
min-1 ②H2(g)+S(s) H2S(g)恒压条件下充入He,化学反应速率不变
③恒容条件下充入气体,增大压强,一定能加快化学反应速率 ④一定量的锌与过量的稀硫酸反应制取氢气,为减缓反应速率,可向其中加入CH3COONa溶液 ⑤煅烧黄铁矿时将矿石磨成粉末可以加快反应速率 ⑥用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率 ⑦光是影响某些化学反应速率的外界条件之一
A.①④⑤⑦ B.①②⑤ C.④⑤⑦ D.③④⑥
√
(1)温度对反应速率的影响具有一致性,升高温度,v正、v逆都增大,降低温度,v正、v逆都减小。
(2)在温度、浓度、催化剂等影响反应速率的因素中,各因素对反应速率的影响程度不同,催化剂为主要因素,其次是温度,最后是浓度。
(3)探究外界因素对化学反应速率的思维模型“实验现象——影响规律——理论解释”,解决实际问题时注意运用证据推理思路和思维认知模型。
影响化学反应速率的因素
1.通过实验,从宏观上认识外界因素影响化学反应速率的规律。
2.建立分析探究外界因素影响化学反应速率的思维模型。
3.通过定性与定量研究影响化学反应速率的因素,提高学生设计探究方案、进
行实验探究的能力。
学习目标
Ⅰ、定性研究影响化学反应速率的因素
1.科学研究的基本步骤
提出问题→收集化学事实与信息→提出假设→设计实验方案→实验探究→得出结论
化学事实和信息 提出假设——反应速率的影响因素
Na与水的反应比Mg与水的反应剧烈 _________________
食物真空保存变质慢 ______________
夏天食物变质快 ________
向H2O2中加入MnO2后会迅速分解产生气泡 ________
将等质量的铁片与铁粉放入稀硫酸中,铁粉产生气泡较快 _________
反应物本身的性质
反应物的浓度
温度
催化剂
接触面积
2.化学反应速率的定性描述
能体现化学反应速率的反应现象有:颜色 快慢,产生气泡 ,产生浑浊快慢,固体减少快慢等。
3.定性研究影响化学反应速率的因素
(1)实验原理
Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O
变化
快慢
影响因素 实验步骤 实验现象 实验结论
浓度 均出现 ,但后者_______ _______ 增大反应物浓度,化学反应速率_____
浑浊
出现浑
浊更快
增大
温度 混合后均出现 ,但70 ℃热水一组_____ __________ 升高温度,化学反应速率_____
浑浊
首先
出现浑浊
增大
催化剂 前者 ,后者_____________ 催化剂能_____
化学反应速率
无明显现象
出现大量气泡
加快
Ⅱ、定量研究影响化学反应速率的因素
1.原理:Zn + H2SO4===ZnSO4 + H2↑
2.实验操作:按如图所示安装两套装置A、B,在锥形瓶内各盛大小相同的2 g锌粒,通过分液漏斗分别加入40 mL 1 mol·L-1和40 mL 4 mol·
L-1的硫酸溶液。
3.实验记录及结论(记录收集10 mL H2所用的时间)
加入试剂 反应时间(填“长” 或“短”) 反应速率(填“快” 或“慢”) 结论
1 mol·L-1 H2SO4溶液 _____ _____ 增大反应物浓度,化学反应速率______
4 mol·L-1 H2SO4溶液 _____ _____
增大
长
短
慢
快
4.实验拓展探究
在用上述实验测定锌与硫酸反应的速率时:
(1)为确保测定的准确性,应注意哪些事项?_____________________
_________________________________________________________________ 。
(2)用上述装置测定化学反应速率时,操作、药品无误,结果测定速率偏大,从装置缺陷的角度分析可能的原因是______________________
。
锌的颗粒(即比表面积)大小基本相同;稀硫酸要迅速加入;装置气密性良好,且计时要迅速准确
忽视加入稀硫酸排出气
体的体积
(3)除了测定氢气的体积外,你还能设计哪些方案测定锌与稀硫酸反应的速率?____________________________________________________
____________________________________________________________
在恒容反应装置中,测定一段时间内压强的变化;测定一段时间内H+的浓度变化;测定一段时间内锌粒的质量变化等。
(1)任何化学反应都可以通过反应现象判断化学反应的快慢
(2)测定化学反应速率,可以用比色的方法测定溶液颜色的深浅进行比较
正误判断
×
(3)可用装置 测定过氧化氢分解的化学反应速率
√
×
(4)锌与H2SO4反应,H2SO4的浓度越大,产生H2的速率越快
×
1.(1)亚氯酸盐(如NaClO2)可用作漂白剂,在常温,不见光时可保存一年,但在酸性溶液中因生成亚氯酸而发生分解:5HClO2===4ClO2↑+H++Cl-+2H2O,分解时刚加入硫酸反应缓慢,随后突然反应释放出大量ClO2,这是因为________________________。
溶液中的Cl- 起催化作用
(2)H2O2分解制O2的实验中,在10% H2O2溶液中未加催化剂,试管口带火星的木条没有明显变化。加入MnO2粉末,溶液中迅速产生大量气泡,木条立刻复燃;若加入1 mL 0.1 mol·L-1 FeCl3溶液,溶液中产生气泡比较快,木条复燃;若加入1 mL 0.1 mol·L-1 CuCl2溶液,溶液中产生气泡比较慢,一段时间后木条复燃。由此可知催化剂的催化效果___________________。
MnO2>Fe3+>Cu2+
2.控制变量法是化学实验的常用方法之一。某化学兴趣小组为探究外界条件对化学反应速率的影响,设计以下四组实验。
实验 方案 反应温 度/℃ Na2S2O3溶液 稀H2SO4 H2O
V/mL c/(mol·L-1) V/mL c/(mol·L-1) V/mL
① 25 5 0.1 10 0.1 5
② 25 V1 0.2 5 0.2 10
③ 35 5 0.1 10 0.1 5
④ 35 5 0.2 5 0.2 V2
回答下列问题:
(1)V1=____,V2=____。
实验 方案 反应温 度/℃ Na2S2O3溶液 稀H2SO4 H2O
V/mL c/(mol·L-1) V/mL c/(mol·L-1) V/mL
① 25 5 0.1 10 0.1 5
② 25 V1 0.2 5 0.2 10
③ 35 5 0.1 10 0.1 5
④ 35 5 0.2 5 0.2 V2
5
10
(2)设计实验方案①和②的目的是:______________________________
__________。
实验 方案 反应温 度/℃ Na2S2O3溶液 稀H2SO4 H2O
V/mL c/(mol·L-1) V/mL c/(mol·L-1) V/mL
① 25 5 0.1 10 0.1 5
② 25 V1 0.2 5 0.2 10
③ 35 5 0.1 10 0.1 5
④ 35 5 0.2 5 0.2 V2
探究Na2S2O3的浓度对化学反应速
率的影响
(3)设计实验方案②和④的目的是:______________________________。
实验 方案 反应温 度/℃ Na2S2O3溶液 稀H2SO4 H2O
V/mL c/(mol·L-1) V/mL c/(mol·L-1) V/mL
① 25 5 0.1 10 0.1 5
② 25 V1 0.2 5 0.2 10
③ 35 5 0.1 10 0.1 5
④ 35 5 0.2 5 0.2 V2
探究温度对化学反应速率的影响
(4)各实验方案中均需加入一定体积的水的原因:__________________
______________。
实验 方案 反应温 度/℃ Na2S2O3溶液 稀H2SO4 H2O
V/mL c/(mol·L-1) V/mL c/(mol·L-1) V/mL
① 25 5 0.1 10 0.1 5
② 25 V1 0.2 5 0.2 10
③ 35 5 0.1 10 0.1 5
④ 35 5 0.2 5 0.2 V2
各实验方案中混合液
的体积均相等
1.某实验小组以H2O2分解为例,研究浓度、催化剂对反应速率的影响。在常温下按照如下方案完成实验。实验②的反应物应为
A.5 mL 2% H2O2溶液 B.10 mL 2% H2O2溶液
C.10 mL 5% H2O2溶液 D.5 mL 10% H2O2溶液
实验编号 反应物 催化剂
① 10 mL 2% H2O2溶液 无
② 无
③ 10 mL 5% H2O2溶液 MnO2固体
√
2.草酸(H2C2O4)是一种重要的化学试剂。下面是利用草酸探究外界条件对反应速率影响的实验。
(1)该反应是溶液之间发生的不可逆反应,改变压强对其反应速率的影响是____(填字母)。
A.可能明显加快
B.可能明显减慢
C.几乎无影响,可以忽略
C
(2)用酸性KMnO4和H2C2O4反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如图1(KMnO4溶液已酸化):
实验序号 A溶液 B溶液
① 20 mL 0.1 mol·L-1H2C2O4溶液 30 mL 0.01 mol·L-1KMnO4溶液
② 20 mL 0.2 mol·L-1H2C2O4溶液 30 mL 0.01 mol·L-1KMnO4溶液
①该反应的离子方程式为___________________
_______________________________。
实验序号 A溶液 B溶液
① 20 mL 0.1 mol·L-1H2C2O4溶液 30 mL 0.01 mol·L-1KMnO4溶液
② 20 mL 0.2 mol·L-1H2C2O4溶液 30 mL 0.01 mol·L-1KMnO4溶液
6H+===2Mn2++10CO2↑+8H2O
②该实验探究的是__________对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是________(用实验序号填空)。
实验序号 A溶液 B溶液
① 20 mL 0.1 mol·L-1H2C2O4溶液 30 mL 0.01 mol·L-1KMnO4溶液
② 20 mL 0.2 mol·L-1H2C2O4溶液 30 mL 0.01 mol·L-1KMnO4溶液
草酸浓度
②>①
(3)若实验①在2 min末收集了4.48 mL CO2(标准状况下),则在2 min 末c( )=_______ mol·
L-1(假设混合液体积为50 mL)。
实验序号 A溶液 B溶液
① 20 mL 0.1 mol·L-1H2C2O4溶液 30 mL 0.01 mol·L-1KMnO4溶液
② 20 mL 0.2 mol·L-1H2C2O4溶液 30 mL 0.01 mol·L-1KMnO4溶液
0.005 2
(4)小组同学发现反应速率总是如图2,其中t1~t2时间内速率变快的主要原因可能是:
①___________________;
②___________________________________。
该反应为放热反应
产物Mn2+(或MnSO4)是反应的催化剂
1.实验探究的科学方法及思路
变量控制→对照实验→定性观察或定量测定→科学归纳
2.控制变量探究实验题的思维流程
返回
1.浓度
增大反应物的浓度,化学反应速率 ;减小反应物的浓度,化学反应速率 。
注意事项 ①浓度对速率的影响适用于气体或溶液参与的反应,固体和纯液体的浓度视为常数。②对于离子反应,实际参加反应的离子浓度发生变化,才会引起化学反应速率的改变。
加快
减慢
2.压强
增大压强,引起气体反应物浓度 ,化学反应速率 ;减小压强,引起气体反应物浓度 ,化学反应速率 。
注意事项 压强对速率的影响适用于有气体参与的反应,且通过浓度对反应速率的影响实现。
增大
减小
加快
减慢
3.温度
升高温度,化学反应速率 ;
降低温度,化学反应速率 。
注意事项 温度对反应速率的影响适用于除电化学反应外的绝大多数化学反应,如升高温度,不论吸热反应还是放热反应,不论正反应速率还是逆反应速率,均加快。
加快
减慢
4.催化剂
催化剂同等程度的影响正、逆反应速率,正催化剂 化学反应速率,逆催化剂 化学反应速率。
5.其他因素
接触面积、溶剂的性质、光、超声波、磁场、形成原电池等均能影响化学反应速率。
注意 实际生产生活中,影响一个化学反应速率的因素可能是多方面的。
加快
减慢
(1)增加少量固体反应物的质量,化学反应速率增大
(2)100 mL 2 mol·L-1的盐酸与锌片反应,加入适量的NaCl溶液,反应速率不变
(3)升高温度,吸热反应速率会加快而放热反应速率会减慢
正误判断
×
×
×
(4)恒容体系发生反应:2SO2+O2 2SO3 ΔH<0,升高温度,v正增大,v逆减小
×
(5)无论任何反应,若增大压强,反应速率一定增大
(6)恒温恒容密闭容器中发生的全为气体的反应,若容器内总压强增大,则反应速率一定增大
×
×
(1)恒温恒容条件下,向反应体系中充入氮气,反应速率________(填“增大”“减小”或“不变”,下同),原因是____________________
__________________。
(2)恒温恒容条件下,向反应体系中充入氦气,反应速率______,原因是__________________________________________________________
__________。
增大
增大反应物的浓度,
化学反应速率增大
不变
恒容条件下,充入氦气,反应物和生成物的浓度不变,化学反应速率不变
(3)恒温恒压条件下,向反应体系中充入氦气,反应速率______,原因是________________________________________________________
_________________。
减小
压强不变,充入氦气,容积增大,反应物和生成物的浓度减小,
化学反应速率减小
1.下列实验中将水、试剂1、试剂2混合后褪色最快的是
选项 温度 水 试剂1 试剂2
A 25 ℃ 4 mL 4 mL 0.01 mol·L-1 KMnO4 2 mL 0.1 mol·L-1 H2C2O4
B 25 ℃ 2 mL 4 mL 0.01 mol·L-1 KMnO4 4 mL 0.1 mol·L-1 H2C2O4
C 35 ℃ 2 mL 4 mL 0.01 mol·L-1 KMnO4 4 mL 0.1 mol·L-1 H2C2O4
D 35 ℃ 2 mL 4 mL 0.01 mol·L-1 KMnO4 4 mL 0.1 mol·L-1 H2C2O4、少量MnSO4固体
√
2.下列关于化学反应速率的说法中,正确的是
①反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g)在2 L的密闭容器中进行,1 min后,NH3减少了0.12 mol,则1 min末的化学反应速率为v(NO)=0.06 mol·L-1·
min-1 ②H2(g)+S(s) H2S(g)恒压条件下充入He,化学反应速率不变
③恒容条件下充入气体,增大压强,一定能加快化学反应速率 ④一定量的锌与过量的稀硫酸反应制取氢气,为减缓反应速率,可向其中加入CH3COONa溶液 ⑤煅烧黄铁矿时将矿石磨成粉末可以加快反应速率 ⑥用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率 ⑦光是影响某些化学反应速率的外界条件之一
A.①④⑤⑦ B.①②⑤ C.④⑤⑦ D.③④⑥
√
(1)温度对反应速率的影响具有一致性,升高温度,v正、v逆都增大,降低温度,v正、v逆都减小。
(2)在温度、浓度、催化剂等影响反应速率的因素中,各因素对反应速率的影响程度不同,催化剂为主要因素,其次是温度,最后是浓度。
(3)探究外界因素对化学反应速率的思维模型“实验现象——影响规律——理论解释”,解决实际问题时注意运用证据推理思路和思维认知模型。
