4.3.2共价键 课件(共17张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 4.3.2共价键 课件(共17张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-18 20:46:04 | ||
图片预览


文档简介
(共17张PPT)
第四章 物质结构 元素周期律
第三节 化学键
第2 课时 共价键
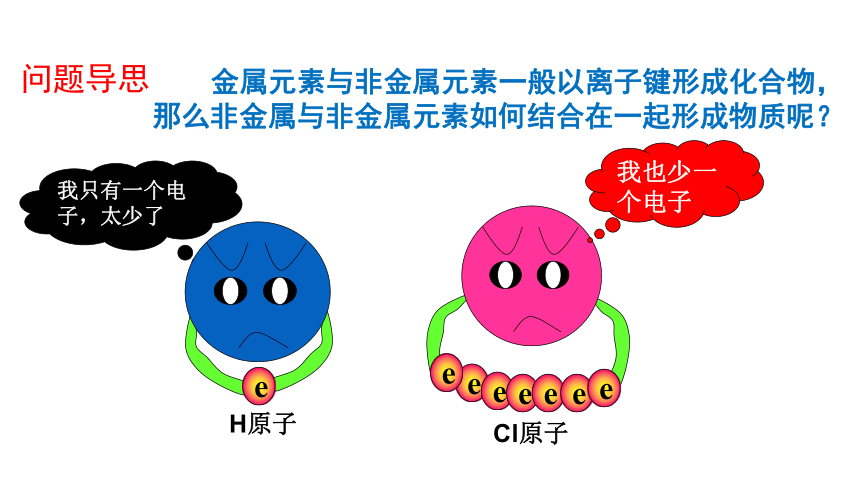
问题导思
金属元素与非金属元素一般以离子键形成化合物,那么非金属与非金属元素如何结合在一起形成物质呢?
我只有一个电子,太少了
我也少一个电子
e
H原子
Cl原子
e
e
e
e
e
e
e
+1
+17
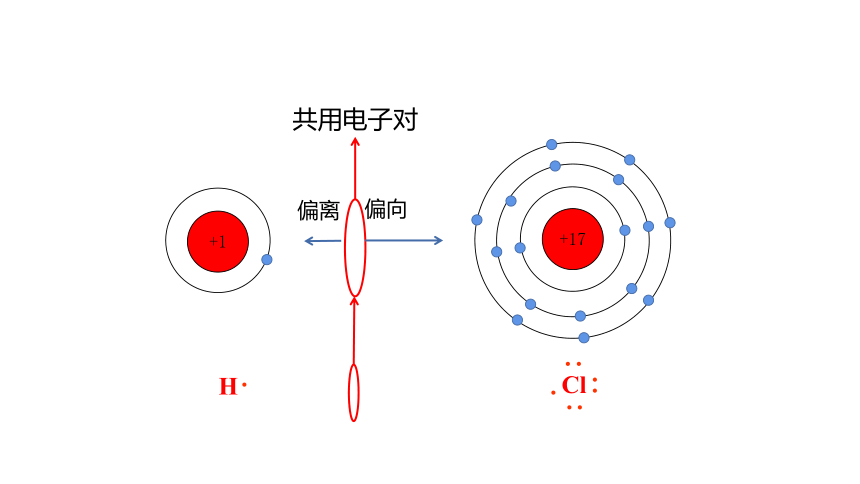
共用电子对
偏向
偏离
H
·
··
Cl
··
··
·
一、共价键
原子之间通过共用电子对所形成的强烈相互作用
原子
共用电子对
概念
成键粒子
成键本质
成键元素
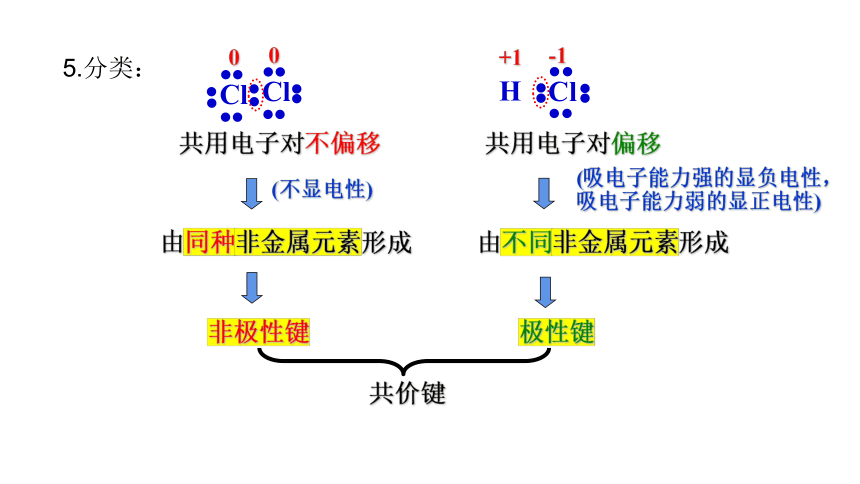
由非金属与非金属元素形成
共用电子对不偏移
共用电子对偏移
由不同非金属元素形成
由同种非金属元素形成
非极性键
极性键
共价键
Cl
Cl
H
Cl
(不显电性)
(吸电子能力强的显负电性,
吸电子能力弱的显正电性)
5.分类:
0
0
+1
-1
H + O + H → H O H
×
×
×
×
H2O
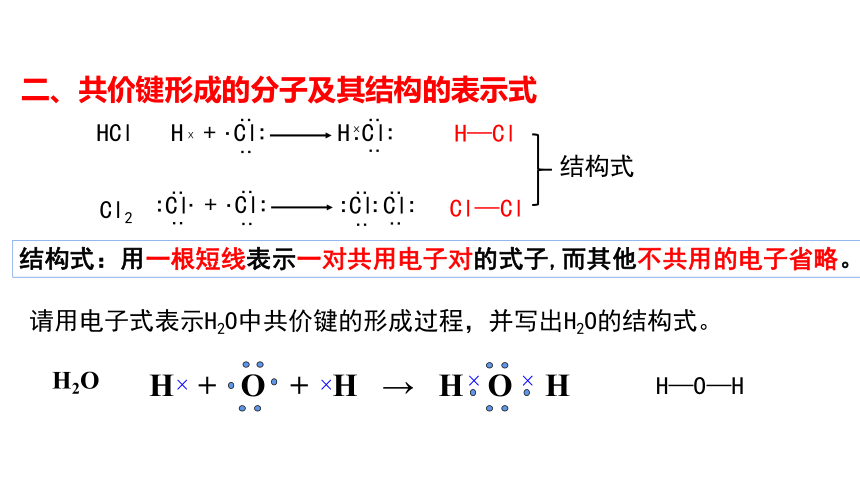
二、共价键形成的分子及其结构的表示式
H
ⅹ
+
Cl
∶
∶
∶
·
H
Cl
∶
∶
∶
·
ⅹ
+
Cl
∶
∶
∶
·
Cl
∶
∶
∶
·
Cl
∶
∶
∶
Cl
∶
∶
∶
∶
Cl—Cl
H—Cl
结构式
HCl
Cl2
H—O—H
结构式:用一根短线表示一对共用电子对的式子,而其他不共用的电子省略。
请用电子式表示H2O中共价键的形成过程,并写出H2O的结构式。
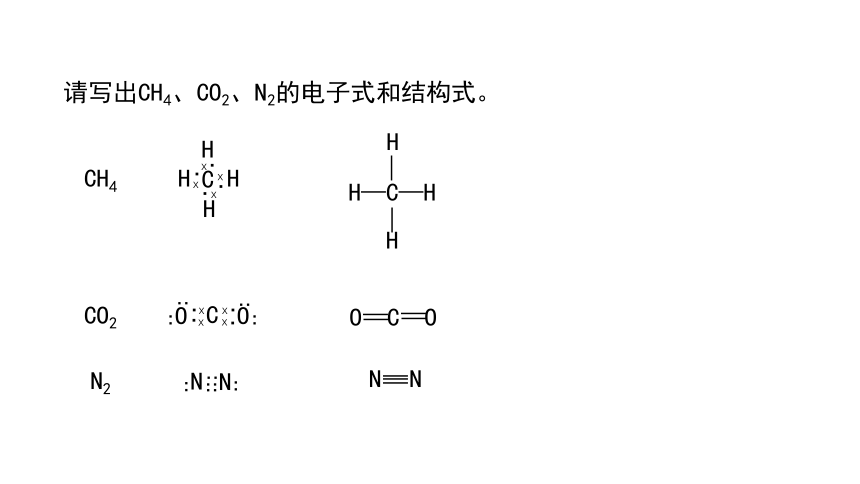
请写出CH4、CO2、N2的电子式和结构式。
C
H
ⅹ
H
ⅹ
H
ⅹ
H
ⅹ
·
·
·
·
CH4
C
ⅹ
ⅹ
ⅹ
ⅹ
·
·
·
O
∶
∶
·
O
∶
∶
N
∶
∶
∶
N
∶
∶
CO2
N2
H—C—H
—
—
H
H
O C O
—
—
—
—
N
—
—
—
N
1、请从化学键的角度分析NaCl、
HCl、Cl2、CO2中各元素的化合价。
2、从化学键的角度解释H2O2中O为-1价的原因。
+1 -1
+1
HCl
-1
Cl2
0
NaCl
H
ⅹ
H
ⅹ
·
O
∶
∶
·
·
O
∶
∶
·
无偏移
偏向氧,显负电性
呈-1价
CO2
C
ⅹ
ⅹ
ⅹ
ⅹ
·
·
·
O
∶
∶
·
O
∶
∶
-2 +2
偏向O,
偏离C
偏向O,
偏离C
+2 -2
-2 +4 -2
你能说出以上分子中H 、Cl 、C、O分别形成几个共价键吗?
H/F/Cl/Br/I O/S/Se/Te N/P/As C/Si
1
2
4
3
下列分子中各原子最外层均达到8电子稳定结构的是( )
A.BeCl2 PCl5 SF6 B.CS2 N2 CF2Cl2
C.BrF3 SCl2 BF3 D.XeF2 PCl3 CH4
B
原子所成共价键数目= 8-最外层电子数
1 1 4 2
(1) 化学键的分类
离子键
共价键
非极性键
极性键
相邻原子间强烈的相互作用
(2) 化学反应的实质
点燃
Cl2+2H2 == 2HCl
先破坏非极性键
后形成极性键
旧化学键的断裂和新化学键的形成过程
稀有气体没有化学键
三、化学键
做红烧排骨时需要炒糖色,捏糖人的手工艺人或者做糖葫芦时,都需要把蔗糖加热融化,在这个过程中,蔗糖分子由固态时的不能自由移动,变成液态可以流动,分子自由度增大。在蔗糖熔化过程中,加热克服的作用力称为分子间作用力。
分子间作用力
范德华力
氢键
如液态 、 和 中分子之间存在的一种比分子间作用力稍强的相互作用,叫氢键,氢键不是化学键,可看作一种_____________________。
一般说来,对于组成和结构相似的物质,相对分子质量_______,分子间作用力_______,物质的熔、沸点也就_______,如卤素单质的熔、沸点: 。
越大
越强
越高
较强的分子间作用力
四、分子间作用力
课堂练习
1.下列关于共价键的说法正确的是( )
A.分子内部一定存在共价键
B.由非金属元素组成的化合物,其内部一定全是共价键
C.非极性键只存在于双原子单质分子中
D.不同元素组成的多原子分子里一定存在极性键
D
课堂练习
2.下列各物质中,除氢原子外,每个原子最外层均达到8电子结构,则它们的结构式错误的是( )
A.氧分子:O=O B.S2Cl2:Cl—S—S—Cl
C.氢氰酸:H—C≡N D.光气(COCl2):Cl—C—O—Cl
D
次氯酸HClO的结构式
H—O—Cl
3.下面是同学们熟悉的物质:
①
回答下列问题:
(1) 这些物质中,只含有共价键的是_________(填序号,下同);只含有离子键的是_____;既含有共价键又含有离子键的是_____________;不存在化学键的是_____。
(2) 属于共价化合物的是_____;属于离子化合物的是_______________。
③
⑤⑥⑦⑨⑩
⑧
④
③⑤⑥⑦⑨⑩
①②④
4.下列物质的变化过程中,有共价键明显被破坏的是( @63@ )。
A.从 中闻到了刺激性气味 B. 颗粒被粉碎
C. 升华 D. 溶于水
A
课堂总结
THANKS
第四章 物质结构 元素周期律
第三节 化学键
第2 课时 共价键
问题导思
金属元素与非金属元素一般以离子键形成化合物,那么非金属与非金属元素如何结合在一起形成物质呢?
我只有一个电子,太少了
我也少一个电子
e
H原子
Cl原子
e
e
e
e
e
e
e
+1
+17
共用电子对
偏向
偏离
H
·
··
Cl
··
··
·
一、共价键
原子之间通过共用电子对所形成的强烈相互作用
原子
共用电子对
概念
成键粒子
成键本质
成键元素
由非金属与非金属元素形成
共用电子对不偏移
共用电子对偏移
由不同非金属元素形成
由同种非金属元素形成
非极性键
极性键
共价键
Cl
Cl
H
Cl
(不显电性)
(吸电子能力强的显负电性,
吸电子能力弱的显正电性)
5.分类:
0
0
+1
-1
H + O + H → H O H
×
×
×
×
H2O
二、共价键形成的分子及其结构的表示式
H
ⅹ
+
Cl
∶
∶
∶
·
H
Cl
∶
∶
∶
·
ⅹ
+
Cl
∶
∶
∶
·
Cl
∶
∶
∶
·
Cl
∶
∶
∶
Cl
∶
∶
∶
∶
Cl—Cl
H—Cl
结构式
HCl
Cl2
H—O—H
结构式:用一根短线表示一对共用电子对的式子,而其他不共用的电子省略。
请用电子式表示H2O中共价键的形成过程,并写出H2O的结构式。
请写出CH4、CO2、N2的电子式和结构式。
C
H
ⅹ
H
ⅹ
H
ⅹ
H
ⅹ
·
·
·
·
CH4
C
ⅹ
ⅹ
ⅹ
ⅹ
·
·
·
O
∶
∶
·
O
∶
∶
N
∶
∶
∶
N
∶
∶
CO2
N2
H—C—H
—
—
H
H
O C O
—
—
—
—
N
—
—
—
N
1、请从化学键的角度分析NaCl、
HCl、Cl2、CO2中各元素的化合价。
2、从化学键的角度解释H2O2中O为-1价的原因。
+1 -1
+1
HCl
-1
Cl2
0
NaCl
H
ⅹ
H
ⅹ
·
O
∶
∶
·
·
O
∶
∶
·
无偏移
偏向氧,显负电性
呈-1价
CO2
C
ⅹ
ⅹ
ⅹ
ⅹ
·
·
·
O
∶
∶
·
O
∶
∶
-2 +2
偏向O,
偏离C
偏向O,
偏离C
+2 -2
-2 +4 -2
你能说出以上分子中H 、Cl 、C、O分别形成几个共价键吗?
H/F/Cl/Br/I O/S/Se/Te N/P/As C/Si
1
2
4
3
下列分子中各原子最外层均达到8电子稳定结构的是( )
A.BeCl2 PCl5 SF6 B.CS2 N2 CF2Cl2
C.BrF3 SCl2 BF3 D.XeF2 PCl3 CH4
B
原子所成共价键数目= 8-最外层电子数
1 1 4 2
(1) 化学键的分类
离子键
共价键
非极性键
极性键
相邻原子间强烈的相互作用
(2) 化学反应的实质
点燃
Cl2+2H2 == 2HCl
先破坏非极性键
后形成极性键
旧化学键的断裂和新化学键的形成过程
稀有气体没有化学键
三、化学键
做红烧排骨时需要炒糖色,捏糖人的手工艺人或者做糖葫芦时,都需要把蔗糖加热融化,在这个过程中,蔗糖分子由固态时的不能自由移动,变成液态可以流动,分子自由度增大。在蔗糖熔化过程中,加热克服的作用力称为分子间作用力。
分子间作用力
范德华力
氢键
如液态 、 和 中分子之间存在的一种比分子间作用力稍强的相互作用,叫氢键,氢键不是化学键,可看作一种_____________________。
一般说来,对于组成和结构相似的物质,相对分子质量_______,分子间作用力_______,物质的熔、沸点也就_______,如卤素单质的熔、沸点: 。
越大
越强
越高
较强的分子间作用力
四、分子间作用力
课堂练习
1.下列关于共价键的说法正确的是( )
A.分子内部一定存在共价键
B.由非金属元素组成的化合物,其内部一定全是共价键
C.非极性键只存在于双原子单质分子中
D.不同元素组成的多原子分子里一定存在极性键
D
课堂练习
2.下列各物质中,除氢原子外,每个原子最外层均达到8电子结构,则它们的结构式错误的是( )
A.氧分子:O=O B.S2Cl2:Cl—S—S—Cl
C.氢氰酸:H—C≡N D.光气(COCl2):Cl—C—O—Cl
D
次氯酸HClO的结构式
H—O—Cl
3.下面是同学们熟悉的物质:
①
回答下列问题:
(1) 这些物质中,只含有共价键的是_________(填序号,下同);只含有离子键的是_____;既含有共价键又含有离子键的是_____________;不存在化学键的是_____。
(2) 属于共价化合物的是_____;属于离子化合物的是_______________。
③
⑤⑥⑦⑨⑩
⑧
④
③⑤⑥⑦⑨⑩
①②④
4.下列物质的变化过程中,有共价键明显被破坏的是( @63@ )。
A.从 中闻到了刺激性气味 B. 颗粒被粉碎
C. 升华 D. 溶于水
A
课堂总结
THANKS
