课题3利用化学方程式的简单计算第一课时 课件(共36张PPT内嵌视频)【2023秋人教九上化学高效实用备课】
文档属性
| 名称 | 课题3利用化学方程式的简单计算第一课时 课件(共36张PPT内嵌视频)【2023秋人教九上化学高效实用备课】 |

|
|
| 格式 | pptx | ||
| 文件大小 | 71.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-19 10:59:04 | ||
图片预览










文档简介
(共36张PPT)
人教九上化学同步精品课件
人教版九年级上册
课时1 利用化学方程式的
简单计算(一)
第五单元 化学方程式
课题3利用化学方程式的简单计算
学习目标
新课引入
新知学习
课堂小结
1
2
3
4
1.认识到化学变化中定量关系的重要性
2.理解化学变化中存在的固定质量比
3.掌握从化学方程式找质量比的方法
4 掌握利用化学方程式进行简单计算的步骤和书写格式
学习目标
难点
重点
新课引入
化学反应
宏观
微观
定性
定量
化学方程式
复习回顾:
新知学习
化学反应中的定量关系
微观
微粒个数比
物质质量比
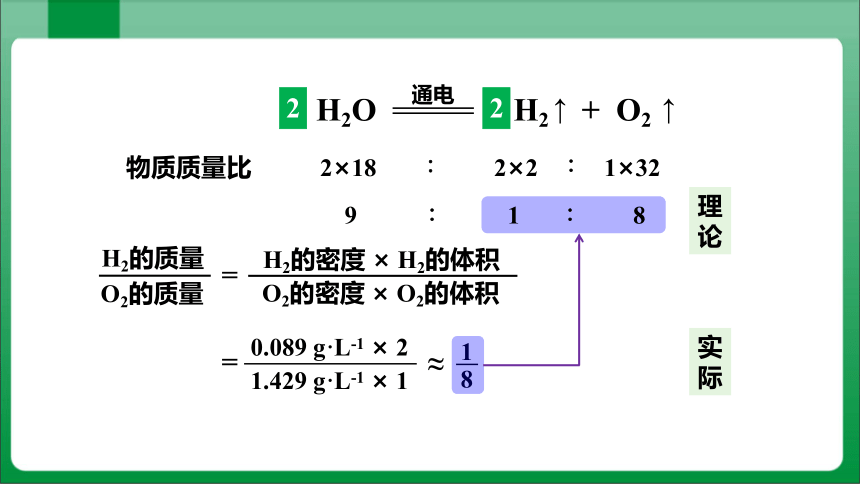
2 2 1
2×18
2×2
1×32
36 ∶ 4 ∶ 32
9 ∶ 1 ∶ 8
宏观
∶
∶
∶
∶
H2O H2 + O2
通电
2
2
↑
↑
相对原子质量 H 1 O 16
存在的疑惑
1. 在实际反应中,产生氢气和氧气的质量比与根据化学方程式
计算得出的质量比一致吗?
2. 在化学反应中各物质之间的质量比是固定不变的吗?
回顾实验 电解水
正、负两极均有气泡产生
V(正极气体):V(负极气体) = 1:2
实验结论
V(H2):V(O2)= 2:1
经验证 正极所产生的气体是氧气
负极所产生的气体是氢气
资料卡片
常温常压下 H2 的密度为0.089 g·L-1
O2 的密度为1.429 g·L-1
m =ρV
回顾实验 电解水
实际
H2的质量
O2的质量
=
0.089 g·L-1 × 2
1.429 g·L-1 × 1
≈
1
8
=
H2的密度 × H2的体积
O2的密度 × O2的体积
理论
∶
物质质量比
2×18
2×2
1×32
9 ∶ 1 ∶ 8
∶
H2O H2 + O2
通电
2
2
↑
↑
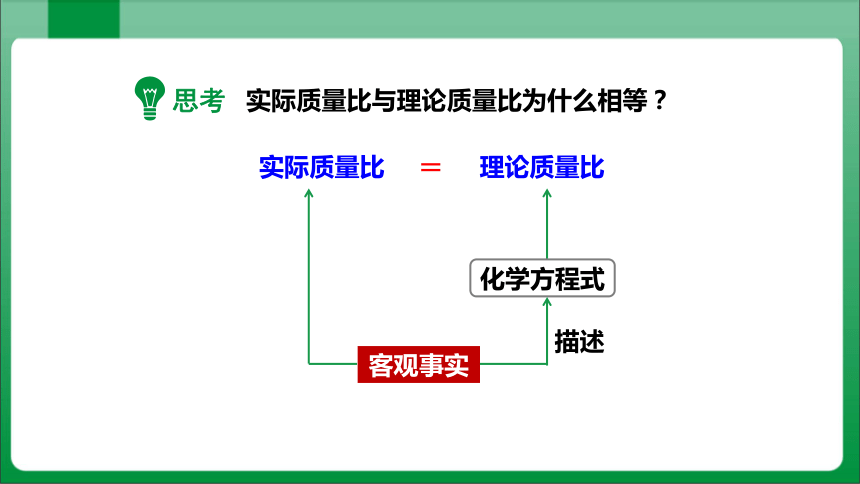
实际质量比与理论质量比为什么相等?
思考
实际质量比 VS 理论质量比
化学方程式
客观事实
=
描述
1. 在实际反应中,产生氢气和氧气的质量比与根据化学方程式
计算得出的质量比一致吗?
2. 在化学反应中各物质之间的质量比是固定不变的吗?
小结1
实际质量比与理论质量比一致。
从化学变化本身去寻找答案。
18
2
32
2×
2×
1×
化学反应中各物质的质量比是固定的吗?
分子 原子 新分子
分成
重新组合
2
2
↑
↑
H2O H2 + O2
通电
理论上固定
-
+
-
+
-
+
6.3
13.0
7.4
15.2
8.2
16.8
正极( O2 ) 负极( H2 )
第1组
第2组
第3组
6.3 mL
7.4 mL
8.2 mL
13.0 mL
15.2 mL
16.8 mL
常温常压下 H2 的密度为0.089 g·L-1
O2 的密度为1.429 g·L-1
氢气与氧气的质量比是多少?
正极( O2 ) 负极( H2 )
第1组 6.3 mL 13.0 mL
第2组 7.4 mL 15.2 mL
第3组 8.2 mL 16.8 mL
氢气与氧气的质量比基本保持不变
质量比
1 ∶ 7.78
1 ∶ 7.82
1 ∶ 7.84
1. 在实际反应中,产生氢气和氧气韵质量比与根据化学方程式
计算得出的质量比一致吗?
2. 在化学反应中各物质之间的质量比是固定不变的吗?
小结2
实际质量比与理论质量比一致。
化学反应中各物质之间存在固定的质量比。
化学史上第一个把数学与化学相结合,并取得重大成果的人。在他的名著《化学元素测量术》中,第一次提出了“化学计算”这一术语,并详尽地介绍了如何计算化学反应中各物质之间的质量比。
德国化学家 里希特(1762-1807)
化学史上的发现
练习1 测定空气中氧气含量实验中,为了使瓶内的氧气充分完全反应,应该加入足量的红磷。如何在实验开始前确认红磷是否足量?
应用质量比解决问题
相对原子质量 O 16 P 31
相对原子质量 O 16 P 31
4P + 5O2 2P2O5
点燃
4×31
5×32
124
160
1.6 g
1.24 g
恰好完全反应
2×142
284
124 g
160 g
2.84 g
284 g
+
+
=
=
1.寻找质量比的方法
已知任意某一物质质量,求出恰好完全反应时其他物质的质量
2.质量比的应用
化学方程式中,用化学计量数乘以相对分子质量
化学反应中的质量比
小结
练习2 实验室用加热高锰酸钾的方法制取2瓶氧气,根据体积和密度折合出氧气的总质量约为0.64 g。请计算实验前试管中至少需要加入高锰酸钾的质量是多少?
利用化学方程式的简单计算
相对原子质量 O 16 K 39 Mn 55
利用化学方程式进行计算的思路
实际质量比
找质量比
列比例式
化学方程式中
相关物质质量比
已知的物质质量
未知的物质质量
理论质量比
=
利用化学方程式的简单计算
相对原子质量 O 16 K 39 Mn 55
2KMnO4 K2MnO4 + MnO2 + O2
△
解:设需要高锰酸钾的质量为x。
↑
练习2
2×158
32
0.64 g
x
2×158
32
0.64 g
x
=
x = 6.32 g
答:至少需要加入6.32 g高锰酸钾。
设
写
列
解
答
理论质量比
实际质量比
练习3 若实验室用过氧化氢溶液制取2瓶氧气,根据体积和密度折合出氧气的总质量约为0.64 g。求反应中实际消耗的过氧化氢质量。
利用化学方程式的简单计算
相对原子质量 H 1 O 16
甲同学
相对原子质量 H 1 O 16
相对原子质量 H 1 O 16
乙同学
2×(2+32)
2×34
相对原子质量 H 1 O 16
先约分
后计算
丙同学
课堂小结
审题分析
找质量比
列比例式
解出未知
写出答案
设
写
列
解
答
1. 在反应2Mg+O2 2MgO中镁、氧气、氧化镁的质量比为( )
A.48:32:80
B.24:32:40
C.24:32:64
D.24:32:80
A
随堂检测
2. 2021年10月16号,神舟十三号搭载三名航天员成功发射。航天员在空间站内所需的氧气,一部分通过货运飞船或者补给飞船从地面运送上天,另一部分则在空间站上通过电解水来获取。请回答:
(1)工业上用分离液态空气的方法制取氧气,主要是利用了液氮、液氧的_____不同。
(2)用电解水制取96g氧气,理论上需要水的质量(写出计算过程)。
创新题 中国科技
沸点
解:设理论上需要水的质量为x
2H2O O2↑ + 2H2↑
36 32
x 96g
答:理论上需要水的质量为108g。
x = 108g
3. 测定空气中氧气含量的实验中,为了使瓶内的氧气完全反应,应该加入足量的红磷。若已知瓶内氧气体积约为44.8 mL,则实验前至少应在燃烧匙中加入红磷的质量是多少?计算结果保留一位小数。(已知常温常压下,氧气密度为1.429 g·L-1 )
解:根据质量 = 密度 × 体积得:
氧气质量 = 1.429 g·L-1 × 44.8×10-3 L
≈ 0.064g
设加入红磷的质量为x
4P + 5O2 2P2O5↑
124 160
x 0.064g
答:实验前至少应在燃烧匙中加入红磷的质量是0.0496g。
x = 0.0496g
4. 在反应A+3B 2C+2D中,已知A和B的相对分子质量之比为7︰8,当2.8g的A与一定量B恰好完全反应后,生成3.6g D,则生成C的质量为( )
A.9.6g B.8.8g C.6.8g D.4.4g
B
m(A):m(B) = (7×1):(8×3) = 7 : 24
当m(A) = 2.8g 时, m(B) = 9.6g
根据质量守恒定律,m(D) = 2.8g + 9.6g -3.6g = 8.8g
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
人教九上化学同步精品课件
人教版九年级上册
课时1 利用化学方程式的
简单计算(一)
第五单元 化学方程式
课题3利用化学方程式的简单计算
学习目标
新课引入
新知学习
课堂小结
1
2
3
4
1.认识到化学变化中定量关系的重要性
2.理解化学变化中存在的固定质量比
3.掌握从化学方程式找质量比的方法
4 掌握利用化学方程式进行简单计算的步骤和书写格式
学习目标
难点
重点
新课引入
化学反应
宏观
微观
定性
定量
化学方程式
复习回顾:
新知学习
化学反应中的定量关系
微观
微粒个数比
物质质量比
2 2 1
2×18
2×2
1×32
36 ∶ 4 ∶ 32
9 ∶ 1 ∶ 8
宏观
∶
∶
∶
∶
H2O H2 + O2
通电
2
2
↑
↑
相对原子质量 H 1 O 16
存在的疑惑
1. 在实际反应中,产生氢气和氧气的质量比与根据化学方程式
计算得出的质量比一致吗?
2. 在化学反应中各物质之间的质量比是固定不变的吗?
回顾实验 电解水
正、负两极均有气泡产生
V(正极气体):V(负极气体) = 1:2
实验结论
V(H2):V(O2)= 2:1
经验证 正极所产生的气体是氧气
负极所产生的气体是氢气
资料卡片
常温常压下 H2 的密度为0.089 g·L-1
O2 的密度为1.429 g·L-1
m =ρV
回顾实验 电解水
实际
H2的质量
O2的质量
=
0.089 g·L-1 × 2
1.429 g·L-1 × 1
≈
1
8
=
H2的密度 × H2的体积
O2的密度 × O2的体积
理论
∶
物质质量比
2×18
2×2
1×32
9 ∶ 1 ∶ 8
∶
H2O H2 + O2
通电
2
2
↑
↑
实际质量比与理论质量比为什么相等?
思考
实际质量比 VS 理论质量比
化学方程式
客观事实
=
描述
1. 在实际反应中,产生氢气和氧气的质量比与根据化学方程式
计算得出的质量比一致吗?
2. 在化学反应中各物质之间的质量比是固定不变的吗?
小结1
实际质量比与理论质量比一致。
从化学变化本身去寻找答案。
18
2
32
2×
2×
1×
化学反应中各物质的质量比是固定的吗?
分子 原子 新分子
分成
重新组合
2
2
↑
↑
H2O H2 + O2
通电
理论上固定
-
+
-
+
-
+
6.3
13.0
7.4
15.2
8.2
16.8
正极( O2 ) 负极( H2 )
第1组
第2组
第3组
6.3 mL
7.4 mL
8.2 mL
13.0 mL
15.2 mL
16.8 mL
常温常压下 H2 的密度为0.089 g·L-1
O2 的密度为1.429 g·L-1
氢气与氧气的质量比是多少?
正极( O2 ) 负极( H2 )
第1组 6.3 mL 13.0 mL
第2组 7.4 mL 15.2 mL
第3组 8.2 mL 16.8 mL
氢气与氧气的质量比基本保持不变
质量比
1 ∶ 7.78
1 ∶ 7.82
1 ∶ 7.84
1. 在实际反应中,产生氢气和氧气韵质量比与根据化学方程式
计算得出的质量比一致吗?
2. 在化学反应中各物质之间的质量比是固定不变的吗?
小结2
实际质量比与理论质量比一致。
化学反应中各物质之间存在固定的质量比。
化学史上第一个把数学与化学相结合,并取得重大成果的人。在他的名著《化学元素测量术》中,第一次提出了“化学计算”这一术语,并详尽地介绍了如何计算化学反应中各物质之间的质量比。
德国化学家 里希特(1762-1807)
化学史上的发现
练习1 测定空气中氧气含量实验中,为了使瓶内的氧气充分完全反应,应该加入足量的红磷。如何在实验开始前确认红磷是否足量?
应用质量比解决问题
相对原子质量 O 16 P 31
相对原子质量 O 16 P 31
4P + 5O2 2P2O5
点燃
4×31
5×32
124
160
1.6 g
1.24 g
恰好完全反应
2×142
284
124 g
160 g
2.84 g
284 g
+
+
=
=
1.寻找质量比的方法
已知任意某一物质质量,求出恰好完全反应时其他物质的质量
2.质量比的应用
化学方程式中,用化学计量数乘以相对分子质量
化学反应中的质量比
小结
练习2 实验室用加热高锰酸钾的方法制取2瓶氧气,根据体积和密度折合出氧气的总质量约为0.64 g。请计算实验前试管中至少需要加入高锰酸钾的质量是多少?
利用化学方程式的简单计算
相对原子质量 O 16 K 39 Mn 55
利用化学方程式进行计算的思路
实际质量比
找质量比
列比例式
化学方程式中
相关物质质量比
已知的物质质量
未知的物质质量
理论质量比
=
利用化学方程式的简单计算
相对原子质量 O 16 K 39 Mn 55
2KMnO4 K2MnO4 + MnO2 + O2
△
解:设需要高锰酸钾的质量为x。
↑
练习2
2×158
32
0.64 g
x
2×158
32
0.64 g
x
=
x = 6.32 g
答:至少需要加入6.32 g高锰酸钾。
设
写
列
解
答
理论质量比
实际质量比
练习3 若实验室用过氧化氢溶液制取2瓶氧气,根据体积和密度折合出氧气的总质量约为0.64 g。求反应中实际消耗的过氧化氢质量。
利用化学方程式的简单计算
相对原子质量 H 1 O 16
甲同学
相对原子质量 H 1 O 16
相对原子质量 H 1 O 16
乙同学
2×(2+32)
2×34
相对原子质量 H 1 O 16
先约分
后计算
丙同学
课堂小结
审题分析
找质量比
列比例式
解出未知
写出答案
设
写
列
解
答
1. 在反应2Mg+O2 2MgO中镁、氧气、氧化镁的质量比为( )
A.48:32:80
B.24:32:40
C.24:32:64
D.24:32:80
A
随堂检测
2. 2021年10月16号,神舟十三号搭载三名航天员成功发射。航天员在空间站内所需的氧气,一部分通过货运飞船或者补给飞船从地面运送上天,另一部分则在空间站上通过电解水来获取。请回答:
(1)工业上用分离液态空气的方法制取氧气,主要是利用了液氮、液氧的_____不同。
(2)用电解水制取96g氧气,理论上需要水的质量(写出计算过程)。
创新题 中国科技
沸点
解:设理论上需要水的质量为x
2H2O O2↑ + 2H2↑
36 32
x 96g
答:理论上需要水的质量为108g。
x = 108g
3. 测定空气中氧气含量的实验中,为了使瓶内的氧气完全反应,应该加入足量的红磷。若已知瓶内氧气体积约为44.8 mL,则实验前至少应在燃烧匙中加入红磷的质量是多少?计算结果保留一位小数。(已知常温常压下,氧气密度为1.429 g·L-1 )
解:根据质量 = 密度 × 体积得:
氧气质量 = 1.429 g·L-1 × 44.8×10-3 L
≈ 0.064g
设加入红磷的质量为x
4P + 5O2 2P2O5↑
124 160
x 0.064g
答:实验前至少应在燃烧匙中加入红磷的质量是0.0496g。
x = 0.0496g
4. 在反应A+3B 2C+2D中,已知A和B的相对分子质量之比为7︰8,当2.8g的A与一定量B恰好完全反应后,生成3.6g D,则生成C的质量为( )
A.9.6g B.8.8g C.6.8g D.4.4g
B
m(A):m(B) = (7×1):(8×3) = 7 : 24
当m(A) = 2.8g 时, m(B) = 9.6g
根据质量守恒定律,m(D) = 2.8g + 9.6g -3.6g = 8.8g
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
