课题1 质量守恒定律第三课时质量守恒定律的应用 课件(共39张PPT内嵌视频)【2023秋人教九上化学高效实用备课】
文档属性
| 名称 | 课题1 质量守恒定律第三课时质量守恒定律的应用 课件(共39张PPT内嵌视频)【2023秋人教九上化学高效实用备课】 |  | |
| 格式 | pptx | ||
| 文件大小 | 78.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-19 11:05:13 | ||
图片预览








文档简介
(共39张PPT)
人教九上化学同步精品课件
人教版九年级上册
课时3 质量守恒定律的应用
第五单元 化学方程式
课题1 质量守恒定律
学习目标
新课引入
新知学习
课堂小结
1
2
3
4
1. 能够依据实验原理设计简单的实验装置来验证质量守恒定律
2. 能够利用质量守恒定律判断未知反应中物质的“角色”
3. 能从宏观和微观两个角度认识化学反应,并运用质量守恒定律推测物质组成及构成
学习目标
难点
重点
重点
新课引入
质量守恒定律
实 质
含 义
参加化学反应的各物质的质量总和
等于反应后生成的各物质的质量总和
微观上:原子的种类、数目、质量不变
适
用
一切化学变化
温故知新
宏观上:元素种类、质量不变
应
用
?
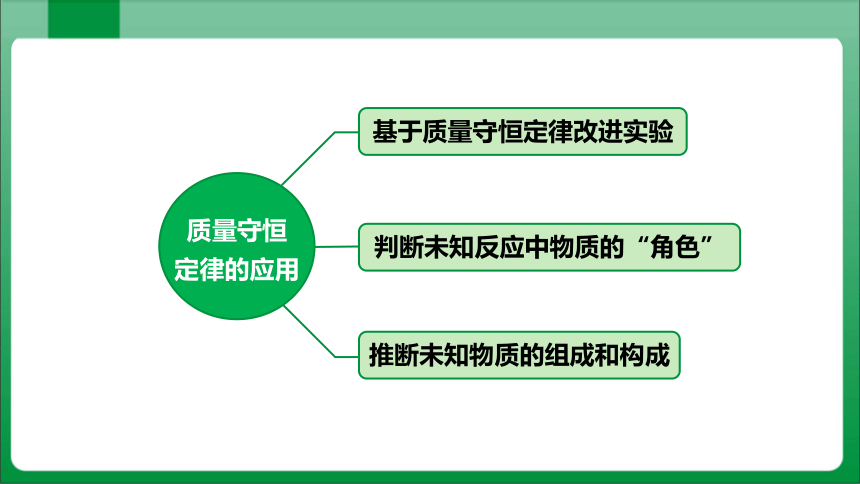
质量守恒
定律的应用
基于质量守恒定律改进实验
推断未知物质的组成和构成
判断未知反应中物质的“角色”
新知学习
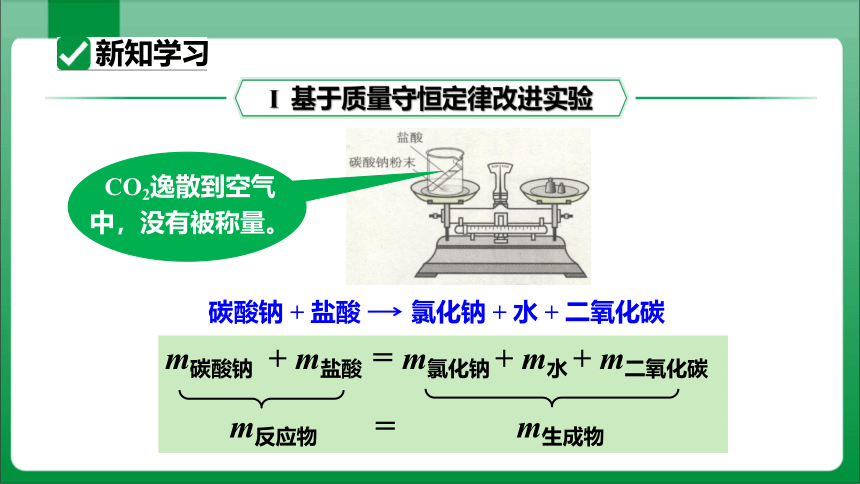
Ⅰ 基于质量守恒定律改进实验
碳酸钠 + 盐酸 氯化钠 + 水 + 二氧化碳
m碳酸钠 + m盐酸 = m氯化钠 + m水 + m二氧化碳
m反应物 = m生成物
CO2逸散到空气中,没有被称量。
改进
盐酸
碳酸钠
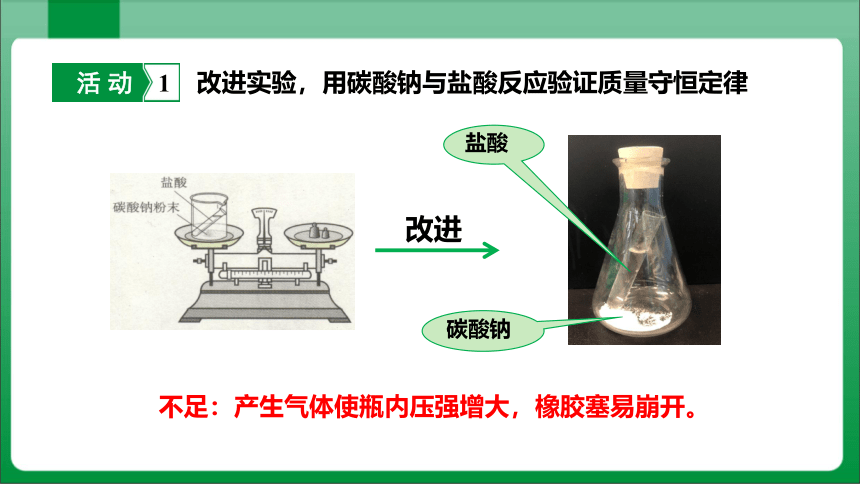
活 动 1
改进实验,用碳酸钠与盐酸反应验证质量守恒定律
不足:产生气体使瓶内压强增大,橡胶塞易崩开。
盐酸
碳酸钠
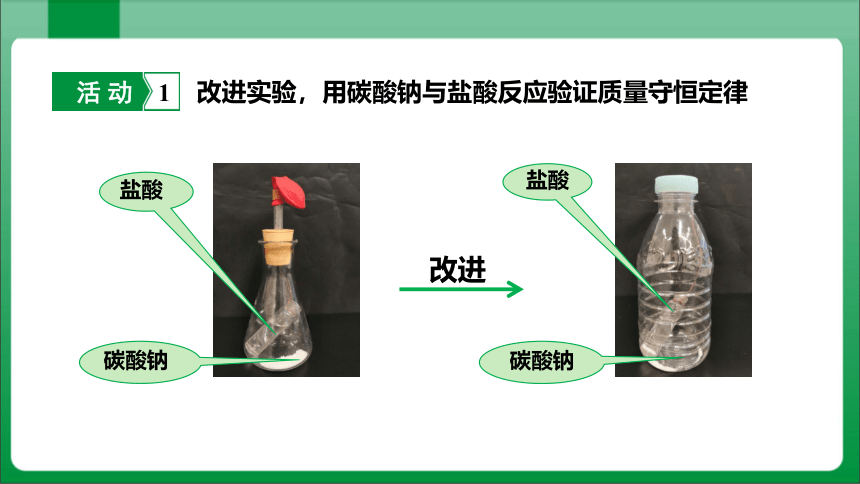
活 动 1
改进实验,用碳酸钠与盐酸反应验证质量守恒定律
改进
盐酸
碳酸钠
活 动 1
改进实验,用碳酸钠与盐酸反应验证质量守恒定律
反应前
反应后
不足:气球胀大后,有浮力干扰。
活 动 1
改进实验,用碳酸钠与盐酸反应验证质量守恒定律
改进
盐酸
碳酸钠
盐酸
碳酸钠
活 动 1
改进实验,用碳酸钠与盐酸反应验证质量守恒定律
归纳
设计实验,验证质量守恒定律的思路
m(A) + m(B)=m(C) + m(D)
列出正确的质量守恒的数学表达式
从实验原理上
找全反应物和生成物
从实验装置上
称量反应中所有物质;有气体参加或生成的反应,注意调节体积,克服浮力的干扰。
活 动 2
学以致用,探究镁在空气中燃烧前后质量为什么不相等
镁条燃烧后质量增加了
活 动 2
学以致用,探究镁在空气中燃烧前后质量为什么不相等
镁条燃烧后质量减小了
活 动 2
学以致用,探究镁在空气中燃烧前后质量为什么不相等
镁条燃烧产生大量白烟逸散到空气中,称量的并不是生成物的总质量。
镁 + 氧气
氧化镁
点燃
活 动 2
学以致用,探究镁在空气中燃烧前后质量为什么不相等
m(Mg) + m(O2) = m(MgO)
m(逸散白烟)
m(O2)
<
m(逸散白烟)
m(O2)
>
增加
减小
相等
m(逸散白烟)
m(O2)
=
m(Mg)+ m(O2)= m(白色粉末)+ m(逸散白烟)
反应的氧气质量和逸散白烟的质量共同决定会有三种结果
活 动 3
学以致用,利用镁燃烧的反应验证质量守恒定律
装置二
凸透镜
镁条
装置一
点燃镁条后迅速放入瓶中
橡胶塞易崩
生成物逸散
橡胶塞易崩
生成物逸散
装置三
气球
点燃镁条后迅速放入瓶中
活 动 3
学以致用,利用镁燃烧的反应验证质量守恒定律
气球可缓冲
装置内的压强
电加热(或凸透镜聚焦),避免生成物逸散
镁 + 氧气
氧化镁
点燃
小结
设计实验
验证质量守恒
定律注意事项
装置要密闭
装置体积不变
改进点燃方式
有缓冲气压装置
1. 某兴趣小组为验证质量守恒定律,做了镁带在空气中燃烧的实验。若反应后收集到的固体质量恰好等于原镁带质量,_______(填“能”或“不能”)据此验证质量守恒定律。理由是___________________________________
___________________________________
___________________________________
_____________。
不能
针对训练
该反应结束后的固体质量由反应的氧气质量和逸散白烟的质量共同决定。质量不变是因为反应的氧气质量恰好等于逸散白烟的质量
Ⅱ 判断未知反应中物质的“角色”
一个密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,测得数据见下表。
则这个反应的反应物是 ,生成物是 ,x值是 ,反应中各物质之间的质量比是 。
物质 甲 乙 丙 丁
反应前质量 8 g 35 g 5 g 8 g
反应后质量 2 g x 5 g 42 g
质量减少的物质是反应物
质量增加的物质是生成物
物质 甲 乙 丙 丁
反应前质量 8 g 35 g 5 g 8 g
反应后质量 2 g x 5 g 42 g
解出:x = 7 g
反应前各物质总质量 = 反应后各物质总质量
反应前各物质总质量:(8 g + 35 g + 5 g + 8 g)
反应后各物质总质量:(2 g + x + 5 g + 42 g)
物质 甲 乙 丙 丁
反应前质量 8 g 35 g 5 g 8 g
反应后质量 2 g 7 g 5 g 42 g
变化的质量
分析判断
反应物
反应物
既不是反应物也不是生成物
生成物
减少6 g
减少28 g
不变
增加34 g
物质 甲 乙 丙 丁
反应前质量 8 g 35 g 5 g 8 g
反应后质量 2 g x 5 g 42 g
在该反应中,各物质之间的质量比是多少?
甲 + 乙 丁
34 g
m(甲) : m(乙) : m(丁) = 6 g : 28 g : 34 g = 3 : 14 : 17
变化的质量是守恒的
6 g
28 g
=
+
物质 甲 乙 丙 丁
反应前质量 8 g 35 g 5 g 8 g
反应后质量 2 g x 5 g 42 g
在该反应中,丙物质一定做催化剂?
质量不变
丙: 从5 g 5 g
既不是反应物也不是生成物
丙可能是催化剂,也可能是不参与反应的其他物质。
小结
应用质量
守恒定律
判断未知反应
质量增加的物质是生成物
质量不变的物质可能是催化剂,也可能是杂质
物质变化的质量是守恒的
反应物质量最后不一定为0
生成物质量起始不一定为0
质量减小的物质是反应物
1. 将下列四种物质放入密闭容器中充分反应,测得反应前后各物质的质量如下表。下列说法正确的是( )
A. a的值是6
B. 丙物质一定是未参加反应的杂质
C. 该反应属于化合反应
D. 反应过程中乙、丁的质量比时5:1
C
针对训练
物质 甲 乙 丙 丁
反应前质量/g 30 20 5 0
反应后质量/g 14 a 5 20
(30+20+5)-(14+5+20)=16
也可能是催化剂
4g:20g=1:5
Ⅲ 推断未知物质的元素组成和微粒构成
分析: 葡萄糖 + 氧气 二氧化碳 + 水
酶
C O H
在人体组织里,葡萄糖在酶的催化下缓慢转变成二氧化碳和水,放出能量。这个过程可表示为:
葡萄糖 + 氧气 二氧化碳 + 水
C、H
O
判断:葡萄糖中一定含有 元素,可能含有 元素。
酶
O
一定有C、H
可能有O
Ⅲ 推断未知物质的元素组成和微粒构成
在人体组织里,葡萄糖在酶的催化下可缓慢转变成二氧化碳和水,同时放出能量。这个过程可简单表示为:
葡萄糖的化学式 。
反应前:12个O原子
反应后:18个O原子
6个C原子
12个H原子
差6个C原子 12个H原子
6个O原子
X + 6O2 6CO2 + 6H2O
酶
C6H12O6
分析:
X + 6O2 6CO2 + 6H2O
酶
小结
研究物质中元素组成和微粒构成的思路
质量守恒定律
从微观上
化学反应前后原子数目不变
从宏观上
化学反应前后元素种类不变
1. 某纯净物在氧气中完全燃烧后生成二氧化碳和水,下列关于该物质组成的判断中,正确的是( )
A.一定含有碳、氢、氧三种元素
B.一定含有碳、氢元素,肯定不含氧元素
C.一定含有碳、氢元素,可能含有氧元素
D.一定含有碳、氧元素,可能含有氢元素
C
针对训练
课堂小结
宏观
微观
会判断反应物和生成物
变化的质量是守恒的
实验原理
实验装置
质量守恒
定律的应用
基于质量守恒
定律改进实验
推断物质的元素
组成和微粒构成
判断未知反应
物质的“角色”
1.植物光合作用可表示为CO2+H2O 有机物+O2,下列说法中正确的是( )
A.有机物中一定含C、H两种元素
B.有机物中只含C、H两种元素
C.有机物中可能含有三种以上的元素
D.有机物可能是一种单质或一种化合物
A
随堂检测
光
叶绿体
2. 下列实验中不能用于验证质量守恒定律的是( )
A. ①②③⑥ B. ①②③⑤ C. ③④⑤⑥ D. ②③⑤⑥
D
3. (2022北京)载人航天器中处理 CO2的一种方法为
2Li2O2+2CO2==== 2X+O2,X的化学式为( )
A. Li B. Li2O C. Li2CO3 D. LiOH
C
4. (2022常德改编)一定条件下,密闭容器中发生了某一化学反应,涉及的物质为甲、乙、丙、丁,下图为各物质在反应前和反应后某时刻的质量关系。下列说法不正确的是( )
A. x 的值是31
B. 该反应可表示为甲+乙→丁
C. 丁可能为单质
D. 反应中消耗甲和乙的质量比为7∶4
C
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
人教九上化学同步精品课件
人教版九年级上册
课时3 质量守恒定律的应用
第五单元 化学方程式
课题1 质量守恒定律
学习目标
新课引入
新知学习
课堂小结
1
2
3
4
1. 能够依据实验原理设计简单的实验装置来验证质量守恒定律
2. 能够利用质量守恒定律判断未知反应中物质的“角色”
3. 能从宏观和微观两个角度认识化学反应,并运用质量守恒定律推测物质组成及构成
学习目标
难点
重点
重点
新课引入
质量守恒定律
实 质
含 义
参加化学反应的各物质的质量总和
等于反应后生成的各物质的质量总和
微观上:原子的种类、数目、质量不变
适
用
一切化学变化
温故知新
宏观上:元素种类、质量不变
应
用
?
质量守恒
定律的应用
基于质量守恒定律改进实验
推断未知物质的组成和构成
判断未知反应中物质的“角色”
新知学习
Ⅰ 基于质量守恒定律改进实验
碳酸钠 + 盐酸 氯化钠 + 水 + 二氧化碳
m碳酸钠 + m盐酸 = m氯化钠 + m水 + m二氧化碳
m反应物 = m生成物
CO2逸散到空气中,没有被称量。
改进
盐酸
碳酸钠
活 动 1
改进实验,用碳酸钠与盐酸反应验证质量守恒定律
不足:产生气体使瓶内压强增大,橡胶塞易崩开。
盐酸
碳酸钠
活 动 1
改进实验,用碳酸钠与盐酸反应验证质量守恒定律
改进
盐酸
碳酸钠
活 动 1
改进实验,用碳酸钠与盐酸反应验证质量守恒定律
反应前
反应后
不足:气球胀大后,有浮力干扰。
活 动 1
改进实验,用碳酸钠与盐酸反应验证质量守恒定律
改进
盐酸
碳酸钠
盐酸
碳酸钠
活 动 1
改进实验,用碳酸钠与盐酸反应验证质量守恒定律
归纳
设计实验,验证质量守恒定律的思路
m(A) + m(B)=m(C) + m(D)
列出正确的质量守恒的数学表达式
从实验原理上
找全反应物和生成物
从实验装置上
称量反应中所有物质;有气体参加或生成的反应,注意调节体积,克服浮力的干扰。
活 动 2
学以致用,探究镁在空气中燃烧前后质量为什么不相等
镁条燃烧后质量增加了
活 动 2
学以致用,探究镁在空气中燃烧前后质量为什么不相等
镁条燃烧后质量减小了
活 动 2
学以致用,探究镁在空气中燃烧前后质量为什么不相等
镁条燃烧产生大量白烟逸散到空气中,称量的并不是生成物的总质量。
镁 + 氧气
氧化镁
点燃
活 动 2
学以致用,探究镁在空气中燃烧前后质量为什么不相等
m(Mg) + m(O2) = m(MgO)
m(逸散白烟)
m(O2)
<
m(逸散白烟)
m(O2)
>
增加
减小
相等
m(逸散白烟)
m(O2)
=
m(Mg)+ m(O2)= m(白色粉末)+ m(逸散白烟)
反应的氧气质量和逸散白烟的质量共同决定会有三种结果
活 动 3
学以致用,利用镁燃烧的反应验证质量守恒定律
装置二
凸透镜
镁条
装置一
点燃镁条后迅速放入瓶中
橡胶塞易崩
生成物逸散
橡胶塞易崩
生成物逸散
装置三
气球
点燃镁条后迅速放入瓶中
活 动 3
学以致用,利用镁燃烧的反应验证质量守恒定律
气球可缓冲
装置内的压强
电加热(或凸透镜聚焦),避免生成物逸散
镁 + 氧气
氧化镁
点燃
小结
设计实验
验证质量守恒
定律注意事项
装置要密闭
装置体积不变
改进点燃方式
有缓冲气压装置
1. 某兴趣小组为验证质量守恒定律,做了镁带在空气中燃烧的实验。若反应后收集到的固体质量恰好等于原镁带质量,_______(填“能”或“不能”)据此验证质量守恒定律。理由是___________________________________
___________________________________
___________________________________
_____________。
不能
针对训练
该反应结束后的固体质量由反应的氧气质量和逸散白烟的质量共同决定。质量不变是因为反应的氧气质量恰好等于逸散白烟的质量
Ⅱ 判断未知反应中物质的“角色”
一个密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,测得数据见下表。
则这个反应的反应物是 ,生成物是 ,x值是 ,反应中各物质之间的质量比是 。
物质 甲 乙 丙 丁
反应前质量 8 g 35 g 5 g 8 g
反应后质量 2 g x 5 g 42 g
质量减少的物质是反应物
质量增加的物质是生成物
物质 甲 乙 丙 丁
反应前质量 8 g 35 g 5 g 8 g
反应后质量 2 g x 5 g 42 g
解出:x = 7 g
反应前各物质总质量 = 反应后各物质总质量
反应前各物质总质量:(8 g + 35 g + 5 g + 8 g)
反应后各物质总质量:(2 g + x + 5 g + 42 g)
物质 甲 乙 丙 丁
反应前质量 8 g 35 g 5 g 8 g
反应后质量 2 g 7 g 5 g 42 g
变化的质量
分析判断
反应物
反应物
既不是反应物也不是生成物
生成物
减少6 g
减少28 g
不变
增加34 g
物质 甲 乙 丙 丁
反应前质量 8 g 35 g 5 g 8 g
反应后质量 2 g x 5 g 42 g
在该反应中,各物质之间的质量比是多少?
甲 + 乙 丁
34 g
m(甲) : m(乙) : m(丁) = 6 g : 28 g : 34 g = 3 : 14 : 17
变化的质量是守恒的
6 g
28 g
=
+
物质 甲 乙 丙 丁
反应前质量 8 g 35 g 5 g 8 g
反应后质量 2 g x 5 g 42 g
在该反应中,丙物质一定做催化剂?
质量不变
丙: 从5 g 5 g
既不是反应物也不是生成物
丙可能是催化剂,也可能是不参与反应的其他物质。
小结
应用质量
守恒定律
判断未知反应
质量增加的物质是生成物
质量不变的物质可能是催化剂,也可能是杂质
物质变化的质量是守恒的
反应物质量最后不一定为0
生成物质量起始不一定为0
质量减小的物质是反应物
1. 将下列四种物质放入密闭容器中充分反应,测得反应前后各物质的质量如下表。下列说法正确的是( )
A. a的值是6
B. 丙物质一定是未参加反应的杂质
C. 该反应属于化合反应
D. 反应过程中乙、丁的质量比时5:1
C
针对训练
物质 甲 乙 丙 丁
反应前质量/g 30 20 5 0
反应后质量/g 14 a 5 20
(30+20+5)-(14+5+20)=16
也可能是催化剂
4g:20g=1:5
Ⅲ 推断未知物质的元素组成和微粒构成
分析: 葡萄糖 + 氧气 二氧化碳 + 水
酶
C O H
在人体组织里,葡萄糖在酶的催化下缓慢转变成二氧化碳和水,放出能量。这个过程可表示为:
葡萄糖 + 氧气 二氧化碳 + 水
C、H
O
判断:葡萄糖中一定含有 元素,可能含有 元素。
酶
O
一定有C、H
可能有O
Ⅲ 推断未知物质的元素组成和微粒构成
在人体组织里,葡萄糖在酶的催化下可缓慢转变成二氧化碳和水,同时放出能量。这个过程可简单表示为:
葡萄糖的化学式 。
反应前:12个O原子
反应后:18个O原子
6个C原子
12个H原子
差6个C原子 12个H原子
6个O原子
X + 6O2 6CO2 + 6H2O
酶
C6H12O6
分析:
X + 6O2 6CO2 + 6H2O
酶
小结
研究物质中元素组成和微粒构成的思路
质量守恒定律
从微观上
化学反应前后原子数目不变
从宏观上
化学反应前后元素种类不变
1. 某纯净物在氧气中完全燃烧后生成二氧化碳和水,下列关于该物质组成的判断中,正确的是( )
A.一定含有碳、氢、氧三种元素
B.一定含有碳、氢元素,肯定不含氧元素
C.一定含有碳、氢元素,可能含有氧元素
D.一定含有碳、氧元素,可能含有氢元素
C
针对训练
课堂小结
宏观
微观
会判断反应物和生成物
变化的质量是守恒的
实验原理
实验装置
质量守恒
定律的应用
基于质量守恒
定律改进实验
推断物质的元素
组成和微粒构成
判断未知反应
物质的“角色”
1.植物光合作用可表示为CO2+H2O 有机物+O2,下列说法中正确的是( )
A.有机物中一定含C、H两种元素
B.有机物中只含C、H两种元素
C.有机物中可能含有三种以上的元素
D.有机物可能是一种单质或一种化合物
A
随堂检测
光
叶绿体
2. 下列实验中不能用于验证质量守恒定律的是( )
A. ①②③⑥ B. ①②③⑤ C. ③④⑤⑥ D. ②③⑤⑥
D
3. (2022北京)载人航天器中处理 CO2的一种方法为
2Li2O2+2CO2==== 2X+O2,X的化学式为( )
A. Li B. Li2O C. Li2CO3 D. LiOH
C
4. (2022常德改编)一定条件下,密闭容器中发生了某一化学反应,涉及的物质为甲、乙、丙、丁,下图为各物质在反应前和反应后某时刻的质量关系。下列说法不正确的是( )
A. x 的值是31
B. 该反应可表示为甲+乙→丁
C. 丁可能为单质
D. 反应中消耗甲和乙的质量比为7∶4
C
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
