化学人教版(2019)必修第一册4.1.1原子结构 核素 课件(共20张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.1.1原子结构 核素 课件(共20张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 6.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-19 08:37:46 | ||
图片预览





文档简介
(共20张PPT)
第四章 物质结构 元素周期律
第一节 原子结构与元素周期表
第1 课时 原子结构 核素
原子的结构应该是什么样子呢?
1.原子的构成
原子
原子核
核外电子
质子
中子
构成原子的粒子有哪些?它们是怎样构成原子的?
( + )
( + )
( -)
(不带电)
1.原子的构成
核电荷数=质子数=核外电子数
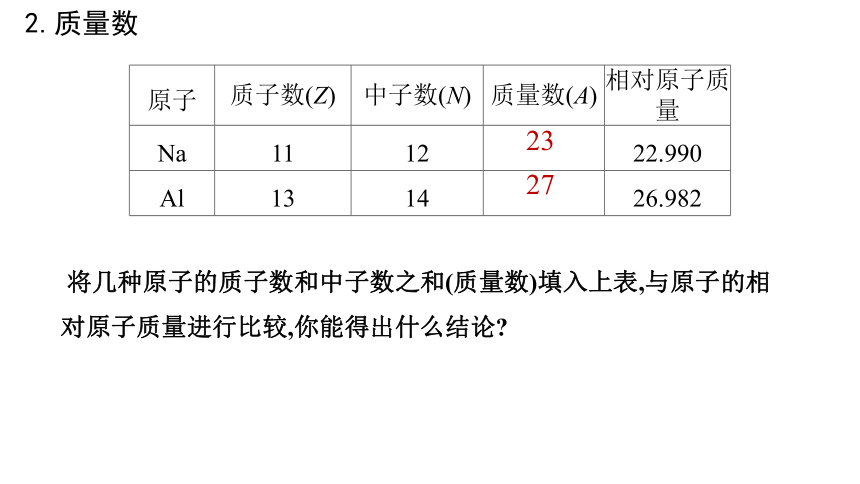
将几种原子的质子数和中子数之和(质量数)填入上表,与原子的相对原子质量进行比较,你能得出什么结论
原子 质子数(Z) 中子数(N) 质量数(A) 相对原子质量
Na 11 12 22.990
Al 13 14 26.982
23
27
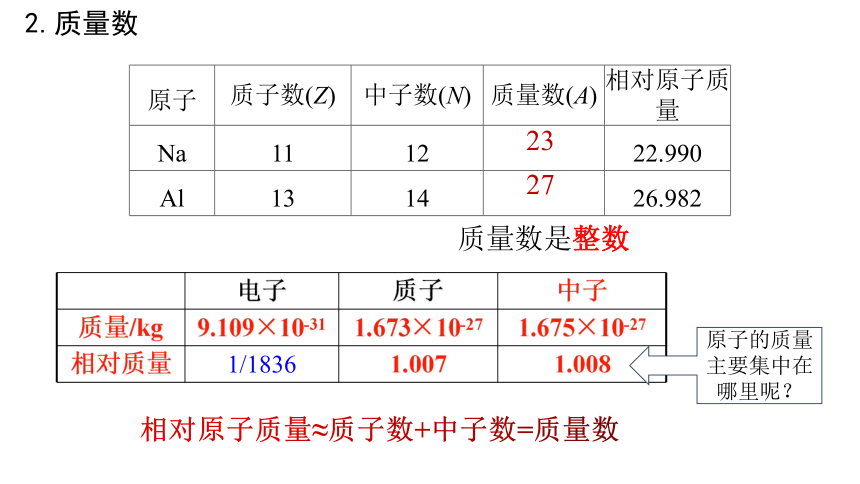
2.质量数
相对原子质量≈质子数+中子数=质量数
电子 质子 中子
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 1/1836 1.007 1.008
原子的质量主要集中在哪里呢?
2.质量数
原子 质子数(Z) 中子数(N) 质量数(A) 相对原子质量
Na 11 12 22.990
Al 13 14 26.982
23
27
质量数是整数
原子的质量主要集中在 上,质子和中子的相对质量都近似为1,如果忽略电子的质量,将原子核内所有质子和中子的相对质量取近似整数值相加,所得的数值即为 ,用符号 表示。
两个等式关系
①原子序数=核电荷数=质子数=核外电子数(原子中的数量关系)
②质量数(A)= + (质量关系)
原子核
质量数
A
质子数(Z)
中子数(N)
2.质量数
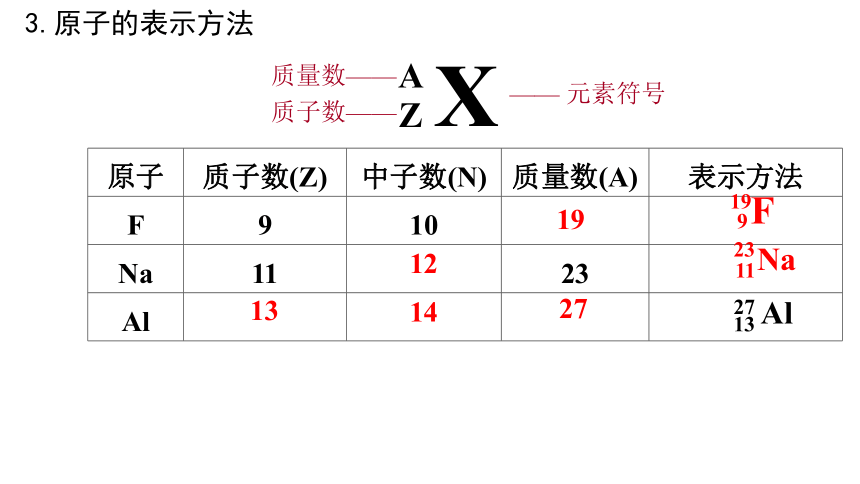
X
A
Z
—— 元素符号
质量数——
质子数——
原子 质子数(Z) 中子数(N) 质量数(A) 表示方法
F 9 10
Na 11 23
Al
F
19
9
Na
23
11
Al
27
13
3.原子的表示方法
19
12
13
14
27
【思考】符号 中各个字母的含义?
X
A
Z
m±
n
±c
元素化合价
微粒所带电荷数
原子个数
质子数
质量数
如果是离子,各微粒数如何变化?
粒子符号 质子数 (Z) 质量数(A) 中子数(N) 电荷数 核外电子数
10
11
23
12
17
37
20
1
1
18
23
11
Na
Cl
37
17
+
-
阳离子:核外电子数=质子数-电荷数
阴离子:核外电子数=质子数+电荷数
3.原子的表示方法
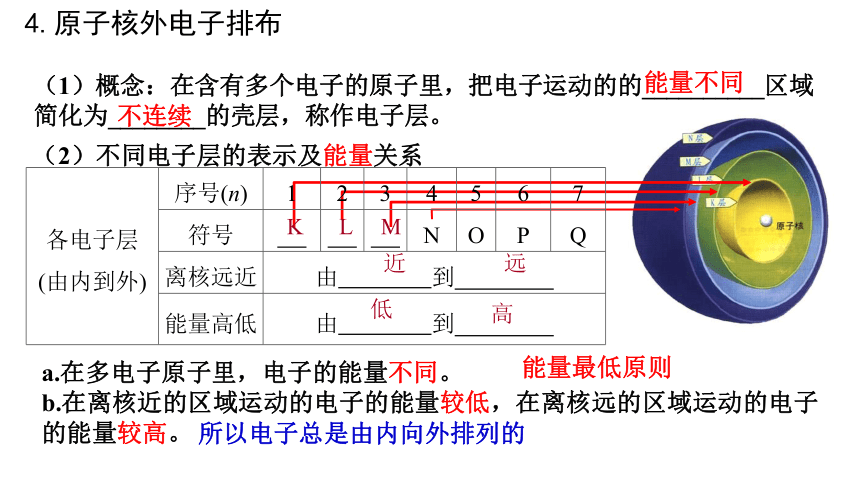
(1)概念:在含有多个电子的原子里,把电子运动的的__________区域简化为________的壳层,称作电子层。
能量不同
不连续
a.在多电子原子里,电子的能量不同。
b.在离核近的区域运动的电子的能量较低,在离核远的区域运动的电子的能量较高。
能量最低原则
所以电子总是由内向外排列的
(2)不同电子层的表示及能量关系
各电子层 (由内到外) 序号(n) 1 2 3 4 5 6 7
符号 N O P Q
离核远近 由 到 能量高低 由 到 K
L
M
近
远
低
高
4.原子核外电子排布
元素 各电子层的电子数 K L M N O P
2He(氦) 2
10Ne(氖) 2 8
18Ar(氩) 2 8 8
36Kr(氪) 2 8 18 8
54Xe(氙) 2 8 18 18 8
86Rn(氡) 2 8 18 32 18 8
① 各电子层最多容纳_______个电子
② 最外层电子数不超过_____个
(K层为最外层时不超过___个)
③ 次外层电子数不超过____个
(当K层为次外层时不超过___个)
(当L层为次外层时不超过___个)
④ 倒数第三层电子数不超过____个
2n2
8
2
18
2
8
32
【思考与讨论】教材P93
核外电子一般总是先从内层排起,当一层充满后再填充下一层。
4.原子核外电子排布
习题:某元素原子的原子核外有三个电子层,最外层有6个电子,该原子核内的质子数为
A.14 B.15 C.16 D.17
C
4.原子核外电子排布
第一第二层全部排满
质子数=核外电子数
各电子层最多容纳2n2个电子
原子核
核内质子数或核电荷数
粒子符号
M层电子数
电子层
钠原子的结构示意图
电子层的表示方法----粒子结构示意图
①原子结构示意图
画出钠原子结构示意图分析其意义
练习:画出34、37、53号元素的原子结构示意图
Rb
I
Se
5.原子结构示意图
注意:原子结构示意图中质子数等于核外电子数,而离子结构示意图中质子数与核外电子数不相等。
②离子结构示意图
画出Na+ 、Cl-的结构示意图
阴离子的核外电子数=质子数+电荷数
阳离子的核外电子数=质子数-电荷数
5.原子结构示意图
习题:某同学在画某种元素的一种单核
微粒的结构示意图时,忘记在圆圈内标出其质
子数,请你根据下面的提示作出自己的判断。
(1)该微粒是中性微粒,这种微粒的符号是_____。
Ne
(2)该微粒带两个单位的负电荷,画出其中性原子的结构示意图________。
5.原子结构示意图
二、核素
2.核素:具有一定数目的质子和一定数目的中子的一种原子叫核素。
氢元素的原子核 原子名称 原子符号
质子数(Z) 中子数(N) 1 0 氕
1 1 氘 或D
1 2 氚 或T
1.元素:具有相同核电荷数(即核内质子数)的同一类原子的总称。
思考1:同种元素原子的原子核中质子数是相同的。中子数是否一定相同呢?
H
H
H
中子数不一定相同
练习:14NH3D+所含质子、中子、电子数为?
二、核素
质子数 中子数 核外电子数
14N 7 7 7
H 1 0 1
D+ 1 1 0
14NH3D+ 11 8 10
(1) 定义:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
即同一元素的不同核素互称为同位素。
(2)特点
①同位素在周期表里占有同一位置。
②同位素的化学性质几乎相同,某些物理性质略有不同。
③天然存在的同位素,不论是游离态还是化合态,相互间保持一定的比率。
碳元素的同位素
6C、 6C、 6C
12 13 14
铀元素的同位素
92U、 92U、 92U
234 235 238
如: 氢元素的同位素
1H、1H、1H
1 2 3
1.同位素
①考古:在考古工作中用于测定一些文物的年代。
②核燃料:用于制造原子弹、核电站发电等。
③制造氢弹:、用于制造氢弹。
④育种、临床治癌:利用放射性同位素的射线杀伤癌细胞或阻止癌细胞分裂。
⑤示踪原子:可以了解到化学反应过程中,原子的去向。
1.同位素
思考:分析构成原子的各微粒与元素、核素间的关系?
分析元素、核素、同位素三者间的关系
2、元素、核素、同位素的区别
1H、1H、1H
1 2 3
练习:现有下列基本粒子:1H、2H、3H、1H+、234U、235U、238U、40K、40Ca、Cl2、14N、14C。请回答下列问题:
(1)它们分属__种元素,属于氢元素的核素有__种,属于铀元素的核素有__种,互为同位素的原子分别为___________、_______________。
7
3
3
1H、2H、3H
234U、235U、238U
2、元素、核素、同位素的区别
第四章 物质结构 元素周期律
第一节 原子结构与元素周期表
第1 课时 原子结构 核素
原子的结构应该是什么样子呢?
1.原子的构成
原子
原子核
核外电子
质子
中子
构成原子的粒子有哪些?它们是怎样构成原子的?
( + )
( + )
( -)
(不带电)
1.原子的构成
核电荷数=质子数=核外电子数
将几种原子的质子数和中子数之和(质量数)填入上表,与原子的相对原子质量进行比较,你能得出什么结论
原子 质子数(Z) 中子数(N) 质量数(A) 相对原子质量
Na 11 12 22.990
Al 13 14 26.982
23
27
2.质量数
相对原子质量≈质子数+中子数=质量数
电子 质子 中子
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 1/1836 1.007 1.008
原子的质量主要集中在哪里呢?
2.质量数
原子 质子数(Z) 中子数(N) 质量数(A) 相对原子质量
Na 11 12 22.990
Al 13 14 26.982
23
27
质量数是整数
原子的质量主要集中在 上,质子和中子的相对质量都近似为1,如果忽略电子的质量,将原子核内所有质子和中子的相对质量取近似整数值相加,所得的数值即为 ,用符号 表示。
两个等式关系
①原子序数=核电荷数=质子数=核外电子数(原子中的数量关系)
②质量数(A)= + (质量关系)
原子核
质量数
A
质子数(Z)
中子数(N)
2.质量数
X
A
Z
—— 元素符号
质量数——
质子数——
原子 质子数(Z) 中子数(N) 质量数(A) 表示方法
F 9 10
Na 11 23
Al
F
19
9
Na
23
11
Al
27
13
3.原子的表示方法
19
12
13
14
27
【思考】符号 中各个字母的含义?
X
A
Z
m±
n
±c
元素化合价
微粒所带电荷数
原子个数
质子数
质量数
如果是离子,各微粒数如何变化?
粒子符号 质子数 (Z) 质量数(A) 中子数(N) 电荷数 核外电子数
10
11
23
12
17
37
20
1
1
18
23
11
Na
Cl
37
17
+
-
阳离子:核外电子数=质子数-电荷数
阴离子:核外电子数=质子数+电荷数
3.原子的表示方法
(1)概念:在含有多个电子的原子里,把电子运动的的__________区域简化为________的壳层,称作电子层。
能量不同
不连续
a.在多电子原子里,电子的能量不同。
b.在离核近的区域运动的电子的能量较低,在离核远的区域运动的电子的能量较高。
能量最低原则
所以电子总是由内向外排列的
(2)不同电子层的表示及能量关系
各电子层 (由内到外) 序号(n) 1 2 3 4 5 6 7
符号 N O P Q
离核远近 由 到 能量高低 由 到 K
L
M
近
远
低
高
4.原子核外电子排布
元素 各电子层的电子数 K L M N O P
2He(氦) 2
10Ne(氖) 2 8
18Ar(氩) 2 8 8
36Kr(氪) 2 8 18 8
54Xe(氙) 2 8 18 18 8
86Rn(氡) 2 8 18 32 18 8
① 各电子层最多容纳_______个电子
② 最外层电子数不超过_____个
(K层为最外层时不超过___个)
③ 次外层电子数不超过____个
(当K层为次外层时不超过___个)
(当L层为次外层时不超过___个)
④ 倒数第三层电子数不超过____个
2n2
8
2
18
2
8
32
【思考与讨论】教材P93
核外电子一般总是先从内层排起,当一层充满后再填充下一层。
4.原子核外电子排布
习题:某元素原子的原子核外有三个电子层,最外层有6个电子,该原子核内的质子数为
A.14 B.15 C.16 D.17
C
4.原子核外电子排布
第一第二层全部排满
质子数=核外电子数
各电子层最多容纳2n2个电子
原子核
核内质子数或核电荷数
粒子符号
M层电子数
电子层
钠原子的结构示意图
电子层的表示方法----粒子结构示意图
①原子结构示意图
画出钠原子结构示意图分析其意义
练习:画出34、37、53号元素的原子结构示意图
Rb
I
Se
5.原子结构示意图
注意:原子结构示意图中质子数等于核外电子数,而离子结构示意图中质子数与核外电子数不相等。
②离子结构示意图
画出Na+ 、Cl-的结构示意图
阴离子的核外电子数=质子数+电荷数
阳离子的核外电子数=质子数-电荷数
5.原子结构示意图
习题:某同学在画某种元素的一种单核
微粒的结构示意图时,忘记在圆圈内标出其质
子数,请你根据下面的提示作出自己的判断。
(1)该微粒是中性微粒,这种微粒的符号是_____。
Ne
(2)该微粒带两个单位的负电荷,画出其中性原子的结构示意图________。
5.原子结构示意图
二、核素
2.核素:具有一定数目的质子和一定数目的中子的一种原子叫核素。
氢元素的原子核 原子名称 原子符号
质子数(Z) 中子数(N) 1 0 氕
1 1 氘 或D
1 2 氚 或T
1.元素:具有相同核电荷数(即核内质子数)的同一类原子的总称。
思考1:同种元素原子的原子核中质子数是相同的。中子数是否一定相同呢?
H
H
H
中子数不一定相同
练习:14NH3D+所含质子、中子、电子数为?
二、核素
质子数 中子数 核外电子数
14N 7 7 7
H 1 0 1
D+ 1 1 0
14NH3D+ 11 8 10
(1) 定义:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
即同一元素的不同核素互称为同位素。
(2)特点
①同位素在周期表里占有同一位置。
②同位素的化学性质几乎相同,某些物理性质略有不同。
③天然存在的同位素,不论是游离态还是化合态,相互间保持一定的比率。
碳元素的同位素
6C、 6C、 6C
12 13 14
铀元素的同位素
92U、 92U、 92U
234 235 238
如: 氢元素的同位素
1H、1H、1H
1 2 3
1.同位素
①考古:在考古工作中用于测定一些文物的年代。
②核燃料:用于制造原子弹、核电站发电等。
③制造氢弹:、用于制造氢弹。
④育种、临床治癌:利用放射性同位素的射线杀伤癌细胞或阻止癌细胞分裂。
⑤示踪原子:可以了解到化学反应过程中,原子的去向。
1.同位素
思考:分析构成原子的各微粒与元素、核素间的关系?
分析元素、核素、同位素三者间的关系
2、元素、核素、同位素的区别
1H、1H、1H
1 2 3
练习:现有下列基本粒子:1H、2H、3H、1H+、234U、235U、238U、40K、40Ca、Cl2、14N、14C。请回答下列问题:
(1)它们分属__种元素,属于氢元素的核素有__种,属于铀元素的核素有__种,互为同位素的原子分别为___________、_______________。
7
3
3
1H、2H、3H
234U、235U、238U
2、元素、核素、同位素的区别
