1.2.1电解质的电离 课件(共20张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.2.1电解质的电离 课件(共20张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 44.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-19 08:39:12 | ||
图片预览





文档简介
(共20张PPT)
新人教版 化学 必修一
第一章 物质的分类及其变化
第二节 离子反应
第1课时:电解质的电离
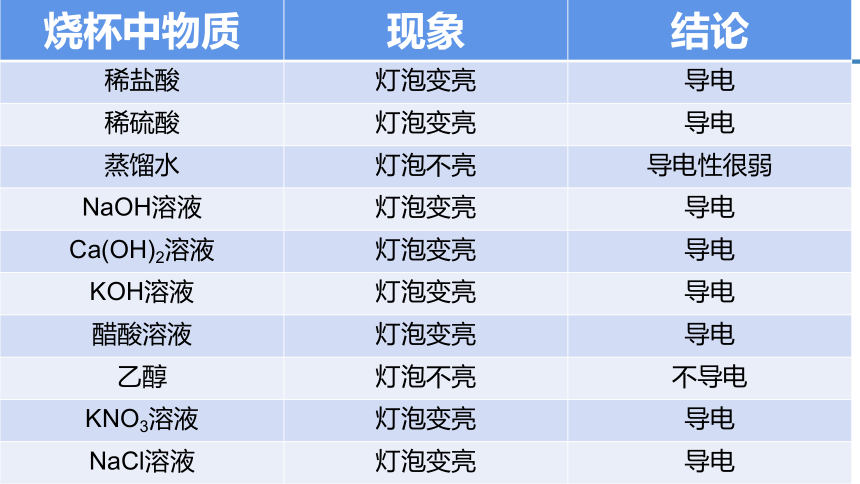
下列哪些物质可以导电?
稀盐酸 稀硫酸 蒸馏水 NaOH溶液 Ca(OH)2溶液
KOH溶液 醋酸溶液 乙醇 KNO3溶液 NaCl溶液
烧杯中物质 现象 结论
稀盐酸 灯泡变亮 导电
稀硫酸 灯泡变亮 导电
蒸馏水 灯泡不亮 导电性很弱
NaOH溶液 灯泡变亮 导电
Ca(OH)2溶液 灯泡变亮 导电
KOH溶液 灯泡变亮 导电
醋酸溶液 灯泡变亮 导电
乙醇 灯泡不亮 不导电
KNO3溶液 灯泡变亮 导电
NaCl溶液 灯泡变亮 导电
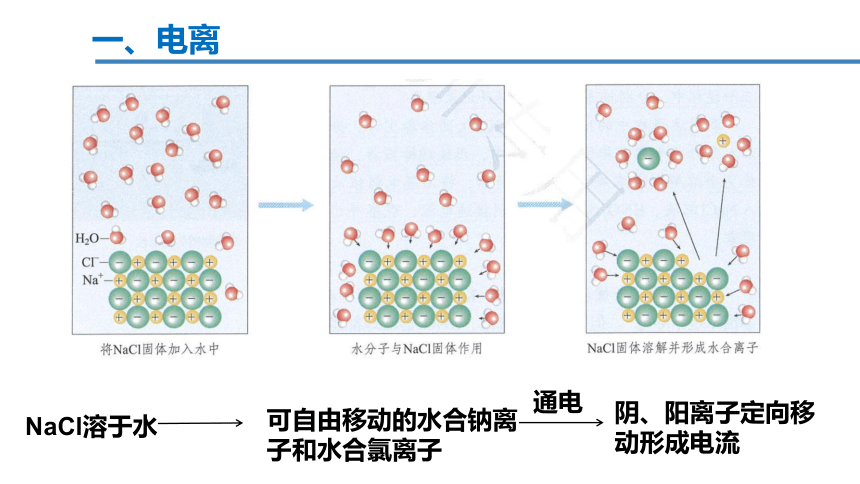
一、电离
一、电离
可自由移动的水合钠离子和水合氯离子
NaCl溶于水
阴、阳离子定向移动形成电流
通电
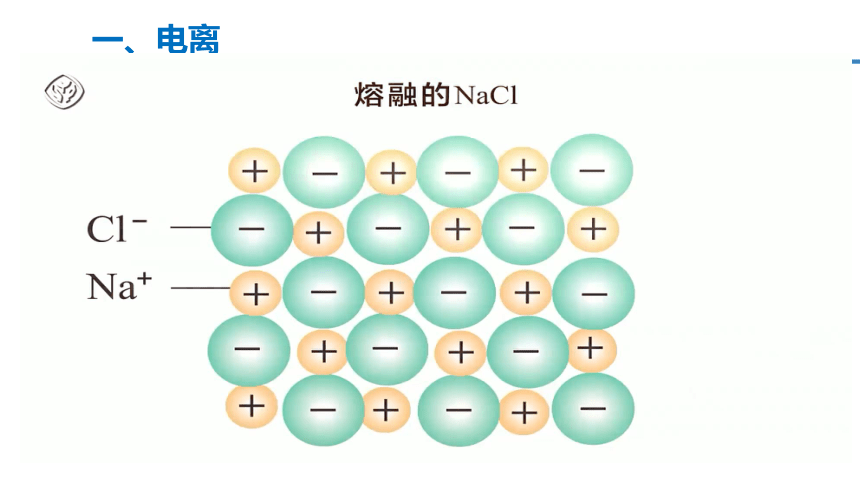
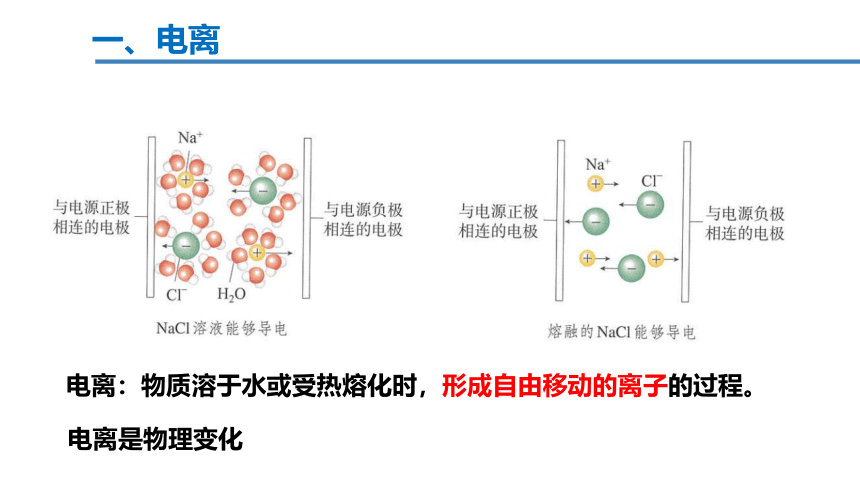
一、电离
一、电离
一、电离
一、电离
电离:物质溶于水或受热熔化时,形成自由移动的离子的过程。
电离是物理变化
二、电解质与非电解质
1.电解质:在_______或________下能够导电的化合物;
常见的电解质:酸、碱、盐、金属氧化物、水
2.非电解质:在水溶液里和熔融状态下都不导电的化合物。
常见的非电解质:CO2、SO2、NH3、蔗糖、酒精
注意
电解质和非电解质都是化合物,单质和混合物既不是电解质,也不是非电解质。
水溶液
熔融状态
二、电解质与非电解质
强电解质 弱电解质
定义
相同点 不同点
在水溶液或熔融状态下完全电离的电解质
在水溶液或熔融状态下部分电离的电解质
都能电离、都属于电解质、都是化合物
完全电离
过程不可逆,电离方程式用等号
只有阴阳离子
部分电离
过程可逆,电离方程式用可逆号
有阴阳离子和电解质分子
二、电解质与非电解质
强电解质
弱电解质
强酸
强碱
大多数盐
活泼金属氧化物
HCl、H2SO4、HNO3、HBr、HI、HClO4
KOH、NaOH、Ca(OH)2、Ba(OH)2
NaCl、 BaSO4、CaCO3、NaHCO3
电解质强弱与溶解性无关
弱酸
弱碱
H2O
H2CO3、CH3COOH、H2SiO3、HClO、H2C2O4
NH3 H2O、Fe(OH)3、Cu(OH)2、Al(OH)3
Na2O、CaO
少数盐
醋酸铅(CH3COO)2Pb
课堂练习1
判断正误
(1)铁丝、NaCl溶液和盐酸都能导电,所以三者都是电解质。( )
(2)液态H2SO4、固态NaCl均不导电,所以H2SO4、NaCl均不是电解质。( )
(3)蔗糖溶于水和熔融时都不导电,蔗糖是非电解质。( )
×
×
√
课堂练习2
下列物质中,属于电解质的是__________;属于非电解质的是________
A.水银 B.硝酸钾 C.盐酸 D.CuO
E.Cu F.CO2 G.MgCl2溶液
H.NaOH溶液
BD
F
课堂练习3
下列物质的分类组合正确的是
D
三,电离方程式
为了方便记录与表达电解质的电离过程的式子
(1)定义:
NaCl = Na+ + Cl-
(2)电解质的电离方程式书写
用化学符号表示电解质电离过程的式子
电离方程式书写原则:
⒈必须遵守质量守恒定律和电荷守恒;
⒉原子团通常不能拆。
如:NO3-、OH-、NH4+、CO32-、HCO3-等。
三,电离方程式
写出下列酸的电离方程式:HCl , HNO3 , H2SO4。
H2SO4 === 2H+ + SO42-
HCl === H+ + Cl-
HNO3 === H+ + NO3-
酸:电离时生成的阳离子全部是H+ 的化合物。
三,电离方程式
写出下列酸的电离方程式:HCl , HNO3 , H2SO4。
H2SO4 === 2H+ + SO42-
HCl === H+ + Cl-
HNO3 === H+ + NO3-
酸:电离时生成的阳离子全部是H+ 的化合物。
写出下列碱的电离方程式:NaOH , KOH , Ba(OH)2 。
NaOH === Na+ + OH-
Ba(OH)2 === Ba2+ + 2OH-
KOH === K+ + OH-
碱:电离时生成的阴离子全部是OH-的化合物。
三,电离方程式
盐:电离时能生成金属阳离子(或者NH4+)和酸根阴离子 的化合物。
写出下列盐的电离方程式:NaCl , NH4Cl , NaHSO4。
NaCl === Na+ + Cl-
NH4Cl === NH4+ + Cl-
NaHSO4 (水溶液)=== Na+ + H+ + SO42-
NaHSO4 (熔融态)=== Na+ + HSO4-
四,课堂小结
化合物
非电解质
电解质
水溶液里或熔融状态下能否导电
电解质导电原因
电解质分类
电解质电离方程式书写
从电离的角度认识酸碱盐
多数有机物、非金属氧化物(CO2、SO2等)、NH3等
弱电解质
强电解质
新人教版 化学 必修一
第一章 物质的分类及其变化
第二节 离子反应
第1课时:电解质的电离
下列哪些物质可以导电?
稀盐酸 稀硫酸 蒸馏水 NaOH溶液 Ca(OH)2溶液
KOH溶液 醋酸溶液 乙醇 KNO3溶液 NaCl溶液
烧杯中物质 现象 结论
稀盐酸 灯泡变亮 导电
稀硫酸 灯泡变亮 导电
蒸馏水 灯泡不亮 导电性很弱
NaOH溶液 灯泡变亮 导电
Ca(OH)2溶液 灯泡变亮 导电
KOH溶液 灯泡变亮 导电
醋酸溶液 灯泡变亮 导电
乙醇 灯泡不亮 不导电
KNO3溶液 灯泡变亮 导电
NaCl溶液 灯泡变亮 导电
一、电离
一、电离
可自由移动的水合钠离子和水合氯离子
NaCl溶于水
阴、阳离子定向移动形成电流
通电
一、电离
一、电离
一、电离
一、电离
电离:物质溶于水或受热熔化时,形成自由移动的离子的过程。
电离是物理变化
二、电解质与非电解质
1.电解质:在_______或________下能够导电的化合物;
常见的电解质:酸、碱、盐、金属氧化物、水
2.非电解质:在水溶液里和熔融状态下都不导电的化合物。
常见的非电解质:CO2、SO2、NH3、蔗糖、酒精
注意
电解质和非电解质都是化合物,单质和混合物既不是电解质,也不是非电解质。
水溶液
熔融状态
二、电解质与非电解质
强电解质 弱电解质
定义
相同点 不同点
在水溶液或熔融状态下完全电离的电解质
在水溶液或熔融状态下部分电离的电解质
都能电离、都属于电解质、都是化合物
完全电离
过程不可逆,电离方程式用等号
只有阴阳离子
部分电离
过程可逆,电离方程式用可逆号
有阴阳离子和电解质分子
二、电解质与非电解质
强电解质
弱电解质
强酸
强碱
大多数盐
活泼金属氧化物
HCl、H2SO4、HNO3、HBr、HI、HClO4
KOH、NaOH、Ca(OH)2、Ba(OH)2
NaCl、 BaSO4、CaCO3、NaHCO3
电解质强弱与溶解性无关
弱酸
弱碱
H2O
H2CO3、CH3COOH、H2SiO3、HClO、H2C2O4
NH3 H2O、Fe(OH)3、Cu(OH)2、Al(OH)3
Na2O、CaO
少数盐
醋酸铅(CH3COO)2Pb
课堂练习1
判断正误
(1)铁丝、NaCl溶液和盐酸都能导电,所以三者都是电解质。( )
(2)液态H2SO4、固态NaCl均不导电,所以H2SO4、NaCl均不是电解质。( )
(3)蔗糖溶于水和熔融时都不导电,蔗糖是非电解质。( )
×
×
√
课堂练习2
下列物质中,属于电解质的是__________;属于非电解质的是________
A.水银 B.硝酸钾 C.盐酸 D.CuO
E.Cu F.CO2 G.MgCl2溶液
H.NaOH溶液
BD
F
课堂练习3
下列物质的分类组合正确的是
D
三,电离方程式
为了方便记录与表达电解质的电离过程的式子
(1)定义:
NaCl = Na+ + Cl-
(2)电解质的电离方程式书写
用化学符号表示电解质电离过程的式子
电离方程式书写原则:
⒈必须遵守质量守恒定律和电荷守恒;
⒉原子团通常不能拆。
如:NO3-、OH-、NH4+、CO32-、HCO3-等。
三,电离方程式
写出下列酸的电离方程式:HCl , HNO3 , H2SO4。
H2SO4 === 2H+ + SO42-
HCl === H+ + Cl-
HNO3 === H+ + NO3-
酸:电离时生成的阳离子全部是H+ 的化合物。
三,电离方程式
写出下列酸的电离方程式:HCl , HNO3 , H2SO4。
H2SO4 === 2H+ + SO42-
HCl === H+ + Cl-
HNO3 === H+ + NO3-
酸:电离时生成的阳离子全部是H+ 的化合物。
写出下列碱的电离方程式:NaOH , KOH , Ba(OH)2 。
NaOH === Na+ + OH-
Ba(OH)2 === Ba2+ + 2OH-
KOH === K+ + OH-
碱:电离时生成的阴离子全部是OH-的化合物。
三,电离方程式
盐:电离时能生成金属阳离子(或者NH4+)和酸根阴离子 的化合物。
写出下列盐的电离方程式:NaCl , NH4Cl , NaHSO4。
NaCl === Na+ + Cl-
NH4Cl === NH4+ + Cl-
NaHSO4 (水溶液)=== Na+ + H+ + SO42-
NaHSO4 (熔融态)=== Na+ + HSO4-
四,课堂小结
化合物
非电解质
电解质
水溶液里或熔融状态下能否导电
电解质导电原因
电解质分类
电解质电离方程式书写
从电离的角度认识酸碱盐
多数有机物、非金属氧化物(CO2、SO2等)、NH3等
弱电解质
强电解质
