2.2.1氯气的性质 课件(共18张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 2.2.1氯气的性质 课件(共18张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 24.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-19 08:42:31 | ||
图片预览




文档简介
(共18张PPT)
高中化学必修一第二章
第二节 氯及其化合物
第一课时
NO.1
氯气的发现和物理性质
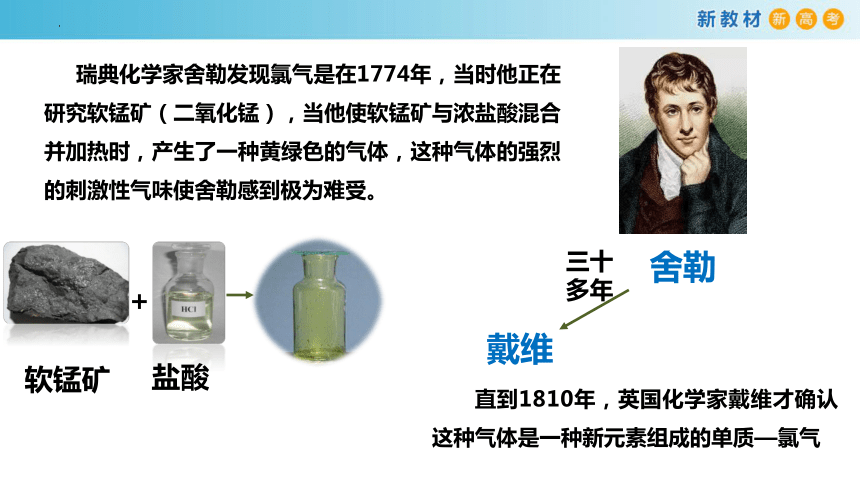
瑞典化学家舍勒发现氯气是在1774年,当时他正在研究软锰矿(二氧化锰),当他使软锰矿与浓盐酸混合并加热时,产生了一种黄绿色的气体,这种气体的强烈的刺激性气味使舍勒感到极为难受。
舍勒
戴维
+
盐酸
软锰矿
三十多年
直到1810年,英国化学家戴维才确认这种气体是一种新元素组成的单质—氯气
氯气的性质
【信息二】
问题1:从上述视频中,你能推测氯气有哪些物理性质?
有刺激性气味、有颜色(黄绿色)、溶于水
问题2:视频中,氯气是如何储存的?运用了氯气的哪种性质?
用铁罐装,易液化
问题3:结合41页的数据还有氯气哪些物理性质?
熔沸点低、密度比空气大
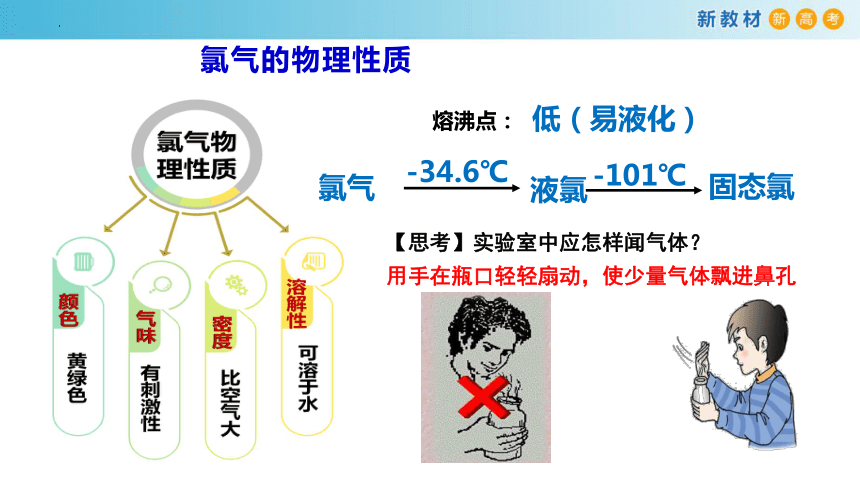
氯气的物理性质
熔沸点:
低(易液化)
氯气
液氯
固态氯
-101℃
-34.6℃
【思考】实验室中应怎样闻气体?
用手在瓶口轻轻扇动,使少量气体飘进鼻孔
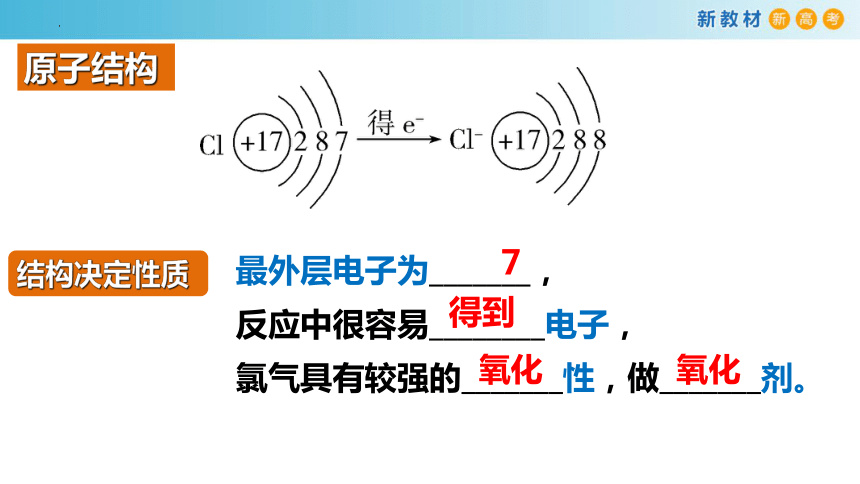
原子结构
结构决定性质
最外层电子为_______,
反应中很容易________电子,
氯气具有较强的_______性,做_______剂。
7
得到
氧化
氧化
NO.2
氯气的化学性质
1.与金属反应
1)与钠
:剧烈燃烧,有白烟生成
2Na+Cl2 = 2NaCl
▲
2)与铁
:剧烈燃烧,生成红棕色烟
2Fe+3Cl2= 2FeCl3
▲
3)与铜
:剧烈燃烧,生成棕黄色烟
Cu+Cl2 = CuCl2
▲
Cl2有强氧化性,
生成高价金属氯化物
氢气在氯气中点燃
现象
方程式
用途
工业上制盐酸
H2 + Cl2 2HCl
安静的燃烧发出苍白色火焰,集气瓶口有白雾
H2和Cl2混合气点燃火光照会发生爆炸
氯气与氢气的反应
2.与非金属单质氢气的反应 (实验2-7)
燃烧不一定要有氧气参加,物质并不是只有在氧气中才可以燃烧。燃烧的本质是氧化还原反应。
燃烧的定义:任何发光发热的剧烈的化学反应。
【思考与讨论1】
我们以前学习的燃烧,都是物质在氧气中的燃烧,现在通过氢气与氯气的燃烧实验,你有什么新的认识?
Cl2 + H2O HCl + HClO
次氯酸是一种弱酸
得到e-
0
-1
+1
失去e-
常温下,氯气的水溶液称为氯水,溶于水的部分氯气与水发生反应
氯水
氯气即做氧化剂也做还原剂
3.氯气与水反应
实验探究:氯水中具有漂白性的是不是Cl2
结论:干燥有色纸条不褪色,湿润有色纸条褪色。说明氯气本身没有漂白性,氯气与水反应生成的次氯酸才有漂白作用。
。
(2)将有色鲜花放入盛有干燥氣气的集气瓶中,盖上玻璃片,观察现象。
鲜花中也有水,因此鲜花也被HClO漂白了。
生活中,有时我们打开自来水龙头时,能闻到刺鼻的气味,为什么?
自来水厂常用氯气消毒杀菌,其原因也是次氯酸有强氧化性,能杀死自来水的病菌,起到消毒作用。
氯水的性质 氯水成分的多样性决定了其性质的多样性
具有强氧化性微粒:HClO、ClO-、Cl2
新制氯水
Cl
Cl
HClO
HClO
H
氧化性
生成沉淀
不稳定性
漂白性
酸性
能够氧化Fe 、Br 、I 等
加入AgNO 溶液产生白色沉淀
在强光照射下新制氯水中有气泡产生
使湿润的有色布条或品红溶液褪色
使紫色石蕊溶液先变红后褪色
加碳酸盐产生气泡
小 结:氯水的性质
思考与讨论3:氯水放久了会变质吗
2HClO 2HCl + O2↑
光照
有酸性物质生成
有Cl-生成
有O2生成
【科学 技术 社会】
验证次氯酸光照分解产物的数字化实验
总结
化学性质——强氧化性
Cl2
与除金、铂外大部分金属反应
与H2等非金属反应
与水的反应
氧化性
1.(教材P47练习与应用2)下列说法中,不正确的是( )。
A.燃烧一定伴有发光现象 B.燃烧一定是氧化还原反应
C.燃烧一定要有氧气参加 D.燃烧一定会放出热量
C
2.下列氯化物中,既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得的是( )。
A.CuCl2 B.FeCl2
C.AlCl3 D.FeCl3
3.设计罐车侧翻造成的氯气泄漏处理方案。
C
作业
高中化学必修一第二章
第二节 氯及其化合物
第一课时
NO.1
氯气的发现和物理性质
瑞典化学家舍勒发现氯气是在1774年,当时他正在研究软锰矿(二氧化锰),当他使软锰矿与浓盐酸混合并加热时,产生了一种黄绿色的气体,这种气体的强烈的刺激性气味使舍勒感到极为难受。
舍勒
戴维
+
盐酸
软锰矿
三十多年
直到1810年,英国化学家戴维才确认这种气体是一种新元素组成的单质—氯气
氯气的性质
【信息二】
问题1:从上述视频中,你能推测氯气有哪些物理性质?
有刺激性气味、有颜色(黄绿色)、溶于水
问题2:视频中,氯气是如何储存的?运用了氯气的哪种性质?
用铁罐装,易液化
问题3:结合41页的数据还有氯气哪些物理性质?
熔沸点低、密度比空气大
氯气的物理性质
熔沸点:
低(易液化)
氯气
液氯
固态氯
-101℃
-34.6℃
【思考】实验室中应怎样闻气体?
用手在瓶口轻轻扇动,使少量气体飘进鼻孔
原子结构
结构决定性质
最外层电子为_______,
反应中很容易________电子,
氯气具有较强的_______性,做_______剂。
7
得到
氧化
氧化
NO.2
氯气的化学性质
1.与金属反应
1)与钠
:剧烈燃烧,有白烟生成
2Na+Cl2 = 2NaCl
▲
2)与铁
:剧烈燃烧,生成红棕色烟
2Fe+3Cl2= 2FeCl3
▲
3)与铜
:剧烈燃烧,生成棕黄色烟
Cu+Cl2 = CuCl2
▲
Cl2有强氧化性,
生成高价金属氯化物
氢气在氯气中点燃
现象
方程式
用途
工业上制盐酸
H2 + Cl2 2HCl
安静的燃烧发出苍白色火焰,集气瓶口有白雾
H2和Cl2混合气点燃火光照会发生爆炸
氯气与氢气的反应
2.与非金属单质氢气的反应 (实验2-7)
燃烧不一定要有氧气参加,物质并不是只有在氧气中才可以燃烧。燃烧的本质是氧化还原反应。
燃烧的定义:任何发光发热的剧烈的化学反应。
【思考与讨论1】
我们以前学习的燃烧,都是物质在氧气中的燃烧,现在通过氢气与氯气的燃烧实验,你有什么新的认识?
Cl2 + H2O HCl + HClO
次氯酸是一种弱酸
得到e-
0
-1
+1
失去e-
常温下,氯气的水溶液称为氯水,溶于水的部分氯气与水发生反应
氯水
氯气即做氧化剂也做还原剂
3.氯气与水反应
实验探究:氯水中具有漂白性的是不是Cl2
结论:干燥有色纸条不褪色,湿润有色纸条褪色。说明氯气本身没有漂白性,氯气与水反应生成的次氯酸才有漂白作用。
。
(2)将有色鲜花放入盛有干燥氣气的集气瓶中,盖上玻璃片,观察现象。
鲜花中也有水,因此鲜花也被HClO漂白了。
生活中,有时我们打开自来水龙头时,能闻到刺鼻的气味,为什么?
自来水厂常用氯气消毒杀菌,其原因也是次氯酸有强氧化性,能杀死自来水的病菌,起到消毒作用。
氯水的性质 氯水成分的多样性决定了其性质的多样性
具有强氧化性微粒:HClO、ClO-、Cl2
新制氯水
Cl
Cl
HClO
HClO
H
氧化性
生成沉淀
不稳定性
漂白性
酸性
能够氧化Fe 、Br 、I 等
加入AgNO 溶液产生白色沉淀
在强光照射下新制氯水中有气泡产生
使湿润的有色布条或品红溶液褪色
使紫色石蕊溶液先变红后褪色
加碳酸盐产生气泡
小 结:氯水的性质
思考与讨论3:氯水放久了会变质吗
2HClO 2HCl + O2↑
光照
有酸性物质生成
有Cl-生成
有O2生成
【科学 技术 社会】
验证次氯酸光照分解产物的数字化实验
总结
化学性质——强氧化性
Cl2
与除金、铂外大部分金属反应
与H2等非金属反应
与水的反应
氧化性
1.(教材P47练习与应用2)下列说法中,不正确的是( )。
A.燃烧一定伴有发光现象 B.燃烧一定是氧化还原反应
C.燃烧一定要有氧气参加 D.燃烧一定会放出热量
C
2.下列氯化物中,既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得的是( )。
A.CuCl2 B.FeCl2
C.AlCl3 D.FeCl3
3.设计罐车侧翻造成的氯气泄漏处理方案。
C
作业
