3.1.2电离平衡常数 强酸与弱酸的比较 课件(共34张PPT)+2023—2024学年上学期高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 3.1.2电离平衡常数 强酸与弱酸的比较 课件(共34张PPT)+2023—2024学年上学期高二化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 255.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-19 08:57:59 | ||
图片预览









文档简介
(共34张PPT)
电离平衡常数 强酸与弱酸的比较
1.构建电离平衡常数模型,并能应用模型解释弱电解质在水中发生的变化。
2.利用电离平衡常数相对大小关系,建立判断强弱电解质和“强酸制弱酸”的
思维模型。
学习目标
1.概念
在一定条件下,当弱电解质的电离达到平衡时,溶液里各组分的浓度之间存在一定的关系。对于一元弱酸或一元弱碱来说,溶液中弱电解质电离所生成的 ,与溶液中 之比是一个常数,这个常数叫做电离平衡常数,简称电离常数,通常用Ka、Kb分别表示弱酸、弱碱的电离平衡常数。
各种离子浓度的乘积
未电离分子的浓度
2.电离平衡常数的表示方法
(1)一元弱酸、一元弱碱的电离平衡常数
Ka= ;
Kb= 。
(2)多元弱酸、多元弱碱的电离平衡常数
多元弱酸的电离是分步进行的,每一步电离都有电离平衡常数,通常用Ka1、Ka2等来分别表示。例如,
Ka1= ;
Ka2= 。
多元弱酸各步电离常数的大小比较:Ka1 Ka2,因此,多元弱酸的酸性主要由第一步电离决定。
注意 一般多元弱碱为难溶碱,不用电离平衡常数,以后要学到难溶物的溶度积常数。
3.意义
表示弱电解质的电离能力。一定温度下,K越大,弱电解质的电离程度越 ,酸(或碱)性越 。
4.电离常数的影响因素
(1)内因:同一温度下,不同弱电解质的电离常数 ,说明电离常数首先由弱电解质的 所决定。
(2)外因:对于同一弱电解质,电离平衡常数只与 有关,由于电离为 过程,所以电离平衡常数随温度 而增大。
大
强
不同
性质
温度
吸热
升高
(1)改变条件,电离平衡正向移动,电离平衡常数一定增大
(2)同一弱电解质,浓度大的电离平衡常数大
正误判断
×
×
×
1.已知T ℃时,CH3COOH的Ka=1.75×10-5。
(1)当向醋酸中加入一定量的盐酸时,CH3COOH的电离常数______(填“变大”或“变小”或“不变”),理由是______________________。
(2)T ℃时,将该溶液加水稀释10倍,则CH3COOH的Ka=__________。
不变
电离常数只与温度有关
1.75×10-5
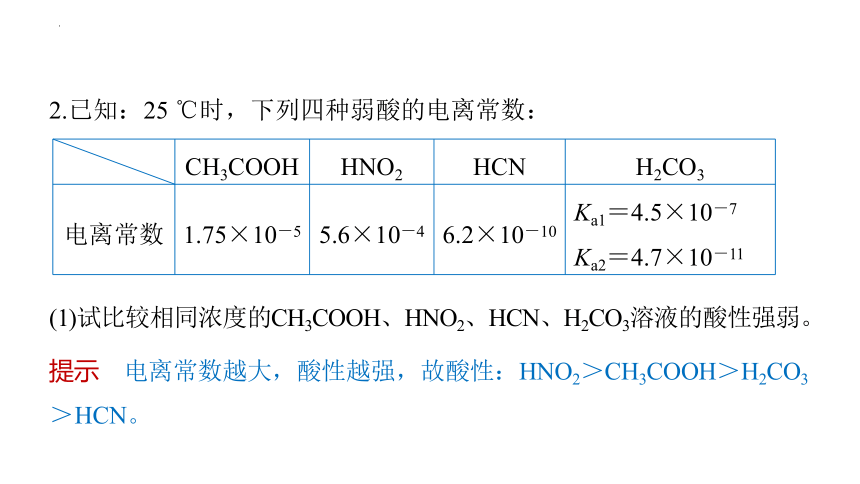
2.已知:25 ℃时,下列四种弱酸的电离常数:
提示 电离常数越大,酸性越强,故酸性:HNO2>CH3COOH>H2CO3
>HCN。
(1)试比较相同浓度的CH3COOH、HNO2、HCN、H2CO3溶液的酸性强弱。
CH3COOH HNO2 HCN H2CO3
电离常数 1.75×10-5 5.6×10-4 6.2×10-10 Ka1=4.5×10-7
Ka2=4.7×10-11
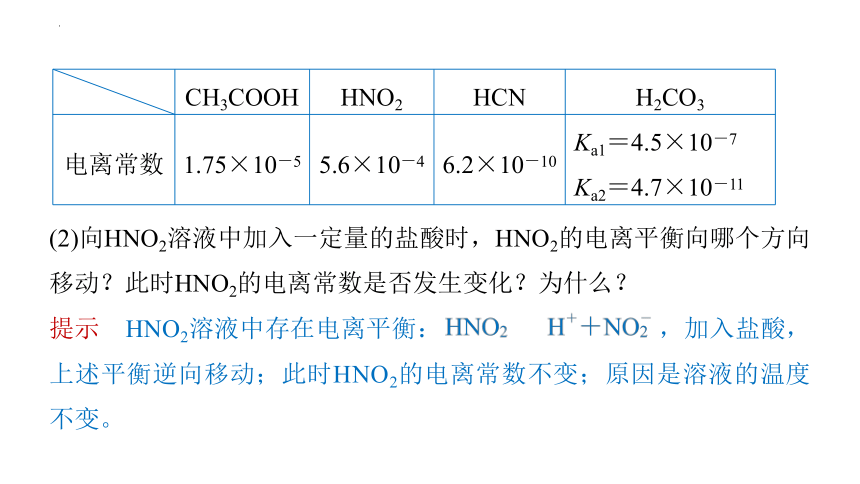
提示 HNO2溶液中存在电离平衡: ,加入盐酸,上述平衡逆向移动;此时HNO2的电离常数不变;原因是溶液的温度不变。
(2)向HNO2溶液中加入一定量的盐酸时,HNO2的电离平衡向哪个方向移动?此时HNO2的电离常数是否发生变化?为什么?
CH3COOH HNO2 HCN H2CO3
电离常数 1.75×10-5 5.6×10-4 6.2×10-10 Ka1=4.5×10-7
Ka2=4.7×10-11
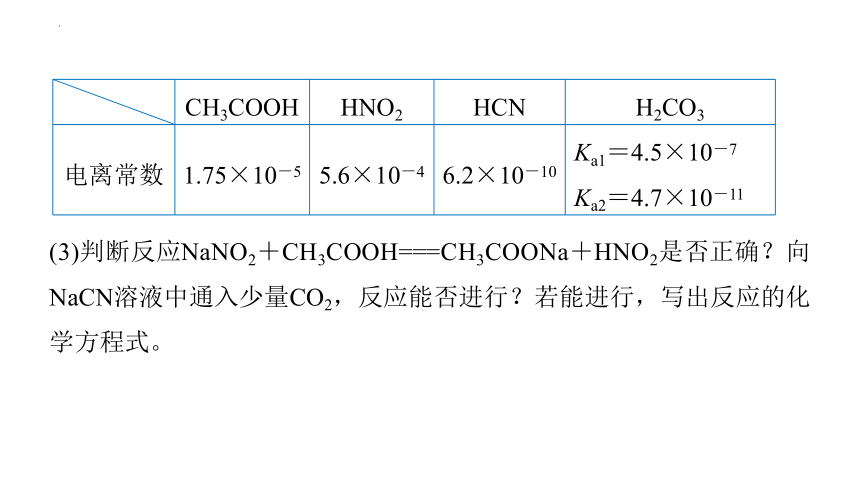
(3)判断反应NaNO2+CH3COOH===CH3COONa+HNO2是否正确?向NaCN溶液中通入少量CO2,反应能否进行?若能进行,写出反应的化学方程式。
CH3COOH HNO2 HCN H2CO3
电离常数 1.75×10-5 5.6×10-4 6.2×10-10 Ka1=4.5×10-7
Ka2=4.7×10-11
提示 不正确。原因是HNO2的酸性强于CH3COOH,故反应不能发生。因酸性:H2CO3>HCN> ,故向NaCN溶液中通入CO2,不论CO2是否过量,产物均为HCN和NaHCO3,反应的化学方程式为NaCN+H2O+CO2===HCN+NaHCO3。
1.相同温度下,根据三种酸的电离常数,下列判断正确的是
A.三种酸的强弱关系:HCN>CH3COOH>H3PO2
B.反应H3PO2+CH3COO-===CH3COOH+ 能够发生
C.由电离常数可以判断,H3PO2属于强酸,HCN和CH3COOH属于弱酸
D.相同温度下,1 mol·L-1 HCN溶液的电离常数大于0.1 mol·L-1HCN
溶液的电离常数
酸 HCN CH3COOH H3PO2
电离常数K 6.2×10-10 1.75×10-5 5.9×10-2
√
2.下列说法正确的是
B.浓度为0.1 mol·L-1 CH3COOH溶液,升高温度,平衡正向移动,醋
酸的电离程度增大
C.浓度为0.1 mol·L-1 H2SO3溶液,加水稀释,亚硫酸的电离程度增大,
浓度也增大
D.向浓度为0.1 mol·L-1 H2SO3溶液中通入少量氯气,pH会增大
√
1.电离常数的计算——三段式法
例:25 ℃ a mol·L-1的CH3COOH
CH3COOH CH3COO-+H+
起始浓度/(mol·L-1) a 0 0
变化浓度/(mol·L-1) x x x
平衡浓度/(mol·L-1) a-x x x
注意 由于弱电解质的电离程度比较小,平衡时弱电解质的浓度为
(a-x) mol·L-1,一般近似为a mol·L-1。
2.电离平衡常数的应用
(1)根据电离平衡常数可以判断弱酸(或弱碱)的相对强弱,相同条件下,电离平衡常数越大,酸性(或碱性)越强。
(2)根据电离平衡常数可以判断盐与酸(或碱)反应是否发生,相同条件下相对强的酸(或碱)可以制相对弱的酸(或碱)。
(3)根据浓度商Q与电离平衡常数K的相对大小判断电离平衡的移动方向。
(4)根据电离平衡常数判断溶液中微粒浓度比值的变化情况。
3.电离度(α)
(1)意义:表示弱电解质的 ,同一弱电解质电离度 ,电离程度 。
(2)电离度的影响因素
电离程度
越大
越大
增大
越大
越小
注意 电离度与化学平衡的转化率类似。
α= ×100%或α= ×100%
1.如何从定量的角度判断醋酸溶液中加水稀释一倍后,电离平衡移动的方向?
2.电离平衡常数与电离度的关系
在一定温度下,已知b mol·L-1的一元弱酸HA溶液中,电离度为α,电
离平衡常数为Ka,试推导b、α、Ka三者之间关系:____________。
1.弱酸、弱碱的电离程度可以分别用它们的电离常数(Ka、Kb)或电离度(α)表示,请根据下列情景列式计算。
(1)乙酰水杨酸是一种一元弱酸(可用HA表示),在一定温度下,0.1 mol·
L-1的乙酰水杨酸的水溶液中,乙酰水杨酸的电离常数Ka为3.4×10-4,求该酸的电离度为______。
5.8%
(2)已知在25 ℃时,1 mol·L-1氨水中NH3·H2O的电离度为0.42%,求NH3·H2O的电离常数Kb=____________。
1.77×10-5
2.在一定温度下,加水逐渐稀释1 mol·L-1氨水的过程中,随着水量的增加,请说明溶液中下列含量的变化:
(1)n(OH-)______(填“增大”“减小”或“不变”,下同)。
增大
增大
不变
1.相同体积、相同物质的量浓度的一元强酸(如盐酸)与一元弱酸(如醋酸)的比较
比较项目 酸 c(H+) 酸性 中和碱的能力 与足量活泼金属反应产生H2的总量 与同一金属反应时的起始反应速率
一元强酸 _____ _____ ______ _______ ____
一元弱酸 _____ _____ ____
大
强
小
弱
相同
相同
大
小
2.相同体积、相同c(H+)的一元强酸(如盐酸)与一元弱酸(如醋酸)的比较
比较项目 酸 c(H+) 酸性 中和碱的能力 与足量活泼金属反应产生H2的总量 与同一金属反应时的起始反应速率
一元强酸 _____ _____ _____ _____ ______
一元弱酸 _____ _____
相同
相同
小
大
少
多
相同
如何判断电解质的强弱?
提示 (1)从弱电解质电离特点分析,部分电离,离子浓度小
①在相同浓度、相同温度下,与强电解质溶液做导电性对比实验。
②在相同浓度、相同温度下,比较反应速率的快慢,如将锌粒投入等浓度的盐酸和醋酸溶液中,开始时反应速率前者比后者快。
(2)从影响电离平衡的外界因素分析
①采用实验证明电离平衡的存在,如醋酸溶液中滴入紫色石蕊溶液后溶液变为红色,再加入CH3COONa晶体,颜色变浅。
②相同c(H+)、相同体积的强酸和弱酸溶液与碱反应时,消耗碱多的为弱酸。
1.相同体积、相同c(H+)的某一元强酸溶液①和某一元弱酸溶液②分别与足量的锌粉发生反应,下列关于产生氢气的体积(V)随时间(t)变化的示意图正确的是
√
2.在a、b两支试管中分别装入形态相同、质量相等的一颗锌粒(锌足量),然后向两支试管中分别加入相同物质的量浓度、相同体积的稀盐酸和稀醋酸。填写下列空白:
(1)a、b两支试管中生成气体的速率v(a)______ (填“大于”“小于”或“等于”,下同) v(b),反应完毕后生成气体的总体积V(a)______V(b),原因是______________________________________________________
________________________。
大于
等于
反应开始时,盐酸中所含H+的浓度较大,但二者最终能电离出的H+的总物质的量相等
(2)若a、b两支试管中分别加入c(H+)相同、体积相同的稀盐酸和稀醋酸,则a、b两支试管中开始生成气体的速率v(a)________(填“大于”“小于”或“等于”,下同)v(b),反应完毕后生成气体的总体积V(a)______V(b),原因是_______________________________________
________________________________________。
等于
开始时c(H+)相同,所以速率相等,醋酸是弱电解质,最终电离出的H+的总物质的量大
小于
3.25 ℃时,几种弱酸的电离平衡常数如下:
CH3COOH:Ka=1.75×10-5
H2CO3:Ka1=4.5×10-7,Ka2=4.7×10-11
HClO:Ka=4.0×10-8
(1)CH3COOH、H2CO3、 、HClO的酸性由强到弱的顺序:_________
_______________________。
CH3COOH
(2) 结合H+的能力由强到弱的顺序:
______________________________。
(3)写出向NaClO和CH3COONa的混合溶液中通入少量CO2的化学方程式:____________________________________。
NaClO+CO2+H2O===HClO+NaHCO3
电离平衡常数 强酸与弱酸的比较
1.构建电离平衡常数模型,并能应用模型解释弱电解质在水中发生的变化。
2.利用电离平衡常数相对大小关系,建立判断强弱电解质和“强酸制弱酸”的
思维模型。
学习目标
1.概念
在一定条件下,当弱电解质的电离达到平衡时,溶液里各组分的浓度之间存在一定的关系。对于一元弱酸或一元弱碱来说,溶液中弱电解质电离所生成的 ,与溶液中 之比是一个常数,这个常数叫做电离平衡常数,简称电离常数,通常用Ka、Kb分别表示弱酸、弱碱的电离平衡常数。
各种离子浓度的乘积
未电离分子的浓度
2.电离平衡常数的表示方法
(1)一元弱酸、一元弱碱的电离平衡常数
Ka= ;
Kb= 。
(2)多元弱酸、多元弱碱的电离平衡常数
多元弱酸的电离是分步进行的,每一步电离都有电离平衡常数,通常用Ka1、Ka2等来分别表示。例如,
Ka1= ;
Ka2= 。
多元弱酸各步电离常数的大小比较:Ka1 Ka2,因此,多元弱酸的酸性主要由第一步电离决定。
注意 一般多元弱碱为难溶碱,不用电离平衡常数,以后要学到难溶物的溶度积常数。
3.意义
表示弱电解质的电离能力。一定温度下,K越大,弱电解质的电离程度越 ,酸(或碱)性越 。
4.电离常数的影响因素
(1)内因:同一温度下,不同弱电解质的电离常数 ,说明电离常数首先由弱电解质的 所决定。
(2)外因:对于同一弱电解质,电离平衡常数只与 有关,由于电离为 过程,所以电离平衡常数随温度 而增大。
大
强
不同
性质
温度
吸热
升高
(1)改变条件,电离平衡正向移动,电离平衡常数一定增大
(2)同一弱电解质,浓度大的电离平衡常数大
正误判断
×
×
×
1.已知T ℃时,CH3COOH的Ka=1.75×10-5。
(1)当向醋酸中加入一定量的盐酸时,CH3COOH的电离常数______(填“变大”或“变小”或“不变”),理由是______________________。
(2)T ℃时,将该溶液加水稀释10倍,则CH3COOH的Ka=__________。
不变
电离常数只与温度有关
1.75×10-5
2.已知:25 ℃时,下列四种弱酸的电离常数:
提示 电离常数越大,酸性越强,故酸性:HNO2>CH3COOH>H2CO3
>HCN。
(1)试比较相同浓度的CH3COOH、HNO2、HCN、H2CO3溶液的酸性强弱。
CH3COOH HNO2 HCN H2CO3
电离常数 1.75×10-5 5.6×10-4 6.2×10-10 Ka1=4.5×10-7
Ka2=4.7×10-11
提示 HNO2溶液中存在电离平衡: ,加入盐酸,上述平衡逆向移动;此时HNO2的电离常数不变;原因是溶液的温度不变。
(2)向HNO2溶液中加入一定量的盐酸时,HNO2的电离平衡向哪个方向移动?此时HNO2的电离常数是否发生变化?为什么?
CH3COOH HNO2 HCN H2CO3
电离常数 1.75×10-5 5.6×10-4 6.2×10-10 Ka1=4.5×10-7
Ka2=4.7×10-11
(3)判断反应NaNO2+CH3COOH===CH3COONa+HNO2是否正确?向NaCN溶液中通入少量CO2,反应能否进行?若能进行,写出反应的化学方程式。
CH3COOH HNO2 HCN H2CO3
电离常数 1.75×10-5 5.6×10-4 6.2×10-10 Ka1=4.5×10-7
Ka2=4.7×10-11
提示 不正确。原因是HNO2的酸性强于CH3COOH,故反应不能发生。因酸性:H2CO3>HCN> ,故向NaCN溶液中通入CO2,不论CO2是否过量,产物均为HCN和NaHCO3,反应的化学方程式为NaCN+H2O+CO2===HCN+NaHCO3。
1.相同温度下,根据三种酸的电离常数,下列判断正确的是
A.三种酸的强弱关系:HCN>CH3COOH>H3PO2
B.反应H3PO2+CH3COO-===CH3COOH+ 能够发生
C.由电离常数可以判断,H3PO2属于强酸,HCN和CH3COOH属于弱酸
D.相同温度下,1 mol·L-1 HCN溶液的电离常数大于0.1 mol·L-1HCN
溶液的电离常数
酸 HCN CH3COOH H3PO2
电离常数K 6.2×10-10 1.75×10-5 5.9×10-2
√
2.下列说法正确的是
B.浓度为0.1 mol·L-1 CH3COOH溶液,升高温度,平衡正向移动,醋
酸的电离程度增大
C.浓度为0.1 mol·L-1 H2SO3溶液,加水稀释,亚硫酸的电离程度增大,
浓度也增大
D.向浓度为0.1 mol·L-1 H2SO3溶液中通入少量氯气,pH会增大
√
1.电离常数的计算——三段式法
例:25 ℃ a mol·L-1的CH3COOH
CH3COOH CH3COO-+H+
起始浓度/(mol·L-1) a 0 0
变化浓度/(mol·L-1) x x x
平衡浓度/(mol·L-1) a-x x x
注意 由于弱电解质的电离程度比较小,平衡时弱电解质的浓度为
(a-x) mol·L-1,一般近似为a mol·L-1。
2.电离平衡常数的应用
(1)根据电离平衡常数可以判断弱酸(或弱碱)的相对强弱,相同条件下,电离平衡常数越大,酸性(或碱性)越强。
(2)根据电离平衡常数可以判断盐与酸(或碱)反应是否发生,相同条件下相对强的酸(或碱)可以制相对弱的酸(或碱)。
(3)根据浓度商Q与电离平衡常数K的相对大小判断电离平衡的移动方向。
(4)根据电离平衡常数判断溶液中微粒浓度比值的变化情况。
3.电离度(α)
(1)意义:表示弱电解质的 ,同一弱电解质电离度 ,电离程度 。
(2)电离度的影响因素
电离程度
越大
越大
增大
越大
越小
注意 电离度与化学平衡的转化率类似。
α= ×100%或α= ×100%
1.如何从定量的角度判断醋酸溶液中加水稀释一倍后,电离平衡移动的方向?
2.电离平衡常数与电离度的关系
在一定温度下,已知b mol·L-1的一元弱酸HA溶液中,电离度为α,电
离平衡常数为Ka,试推导b、α、Ka三者之间关系:____________。
1.弱酸、弱碱的电离程度可以分别用它们的电离常数(Ka、Kb)或电离度(α)表示,请根据下列情景列式计算。
(1)乙酰水杨酸是一种一元弱酸(可用HA表示),在一定温度下,0.1 mol·
L-1的乙酰水杨酸的水溶液中,乙酰水杨酸的电离常数Ka为3.4×10-4,求该酸的电离度为______。
5.8%
(2)已知在25 ℃时,1 mol·L-1氨水中NH3·H2O的电离度为0.42%,求NH3·H2O的电离常数Kb=____________。
1.77×10-5
2.在一定温度下,加水逐渐稀释1 mol·L-1氨水的过程中,随着水量的增加,请说明溶液中下列含量的变化:
(1)n(OH-)______(填“增大”“减小”或“不变”,下同)。
增大
增大
不变
1.相同体积、相同物质的量浓度的一元强酸(如盐酸)与一元弱酸(如醋酸)的比较
比较项目 酸 c(H+) 酸性 中和碱的能力 与足量活泼金属反应产生H2的总量 与同一金属反应时的起始反应速率
一元强酸 _____ _____ ______ _______ ____
一元弱酸 _____ _____ ____
大
强
小
弱
相同
相同
大
小
2.相同体积、相同c(H+)的一元强酸(如盐酸)与一元弱酸(如醋酸)的比较
比较项目 酸 c(H+) 酸性 中和碱的能力 与足量活泼金属反应产生H2的总量 与同一金属反应时的起始反应速率
一元强酸 _____ _____ _____ _____ ______
一元弱酸 _____ _____
相同
相同
小
大
少
多
相同
如何判断电解质的强弱?
提示 (1)从弱电解质电离特点分析,部分电离,离子浓度小
①在相同浓度、相同温度下,与强电解质溶液做导电性对比实验。
②在相同浓度、相同温度下,比较反应速率的快慢,如将锌粒投入等浓度的盐酸和醋酸溶液中,开始时反应速率前者比后者快。
(2)从影响电离平衡的外界因素分析
①采用实验证明电离平衡的存在,如醋酸溶液中滴入紫色石蕊溶液后溶液变为红色,再加入CH3COONa晶体,颜色变浅。
②相同c(H+)、相同体积的强酸和弱酸溶液与碱反应时,消耗碱多的为弱酸。
1.相同体积、相同c(H+)的某一元强酸溶液①和某一元弱酸溶液②分别与足量的锌粉发生反应,下列关于产生氢气的体积(V)随时间(t)变化的示意图正确的是
√
2.在a、b两支试管中分别装入形态相同、质量相等的一颗锌粒(锌足量),然后向两支试管中分别加入相同物质的量浓度、相同体积的稀盐酸和稀醋酸。填写下列空白:
(1)a、b两支试管中生成气体的速率v(a)______ (填“大于”“小于”或“等于”,下同) v(b),反应完毕后生成气体的总体积V(a)______V(b),原因是______________________________________________________
________________________。
大于
等于
反应开始时,盐酸中所含H+的浓度较大,但二者最终能电离出的H+的总物质的量相等
(2)若a、b两支试管中分别加入c(H+)相同、体积相同的稀盐酸和稀醋酸,则a、b两支试管中开始生成气体的速率v(a)________(填“大于”“小于”或“等于”,下同)v(b),反应完毕后生成气体的总体积V(a)______V(b),原因是_______________________________________
________________________________________。
等于
开始时c(H+)相同,所以速率相等,醋酸是弱电解质,最终电离出的H+的总物质的量大
小于
3.25 ℃时,几种弱酸的电离平衡常数如下:
CH3COOH:Ka=1.75×10-5
H2CO3:Ka1=4.5×10-7,Ka2=4.7×10-11
HClO:Ka=4.0×10-8
(1)CH3COOH、H2CO3、 、HClO的酸性由强到弱的顺序:_________
_______________________。
CH3COOH
(2) 结合H+的能力由强到弱的顺序:
______________________________。
(3)写出向NaClO和CH3COONa的混合溶液中通入少量CO2的化学方程式:____________________________________。
NaClO+CO2+H2O===HClO+NaHCO3
