2.3.1物质的量的单位——摩尔 课件(共30张PPT)2023-2024学年上学期高一化学人教版(2019)必修第一册
文档属性
| 名称 | 2.3.1物质的量的单位——摩尔 课件(共30张PPT)2023-2024学年上学期高一化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-19 21:42:07 | ||
图片预览








文档简介
(共30张PPT)
第二章 海水中的重要元素--钠和氯
第三节 物质的量
第一课时 物质的量的单位——摩尔
人教版(2019)化学 必修一
摩尔日——在北美化学家之间流传的节日
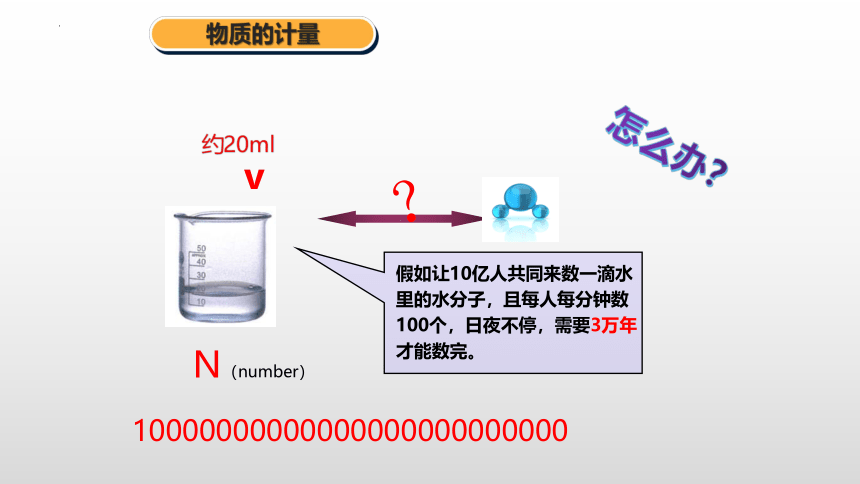
物质的计量
v
N(number)
约20ml
10000000000000000000000000
假如让10亿人共同来数一滴水里的水分子,且每人每分钟数100个,日夜不停,需要3万年才能数完。
怎么办?
?
导入新课
议一议
古时有一个勇敢的小伙子想娶国王美丽的公主,国王出题刁难,
其中一个问题是:10kg小米是多少粒?同学们你们能不能帮帮他?
称一两小米,数其数目,再推算
数50或100粒小米,称其质量,再推算
生活经验告诉我们:
对于微小物质,扩大倍数形成一定数目的集合体,更方便计量
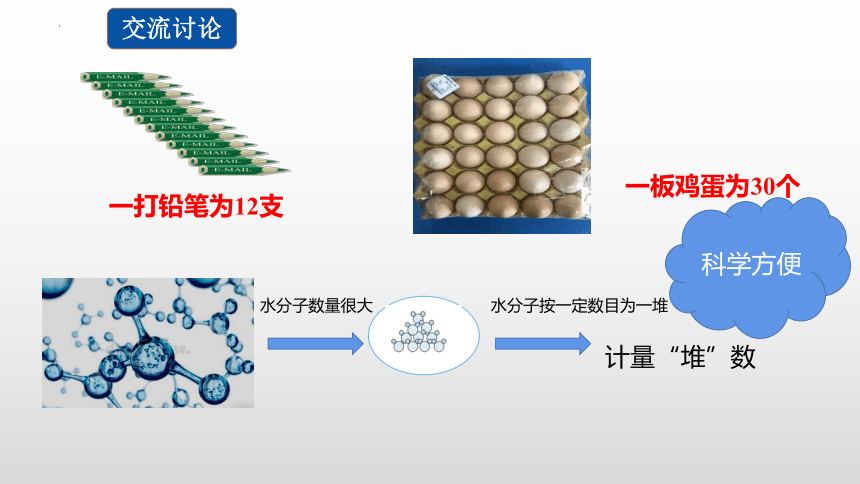
一打铅笔为12支
一板鸡蛋为30个
水分子数量很大
水分子按一定数目为一堆
计量“堆”数
科学方便
交流讨论
想办法在水分子数和水的质量之间找到一个桥梁。
物质的量
宏 观
微 观
国际上,为了研究一定数目的微观粒子集体,提出了一个新的物理量——物质的量!
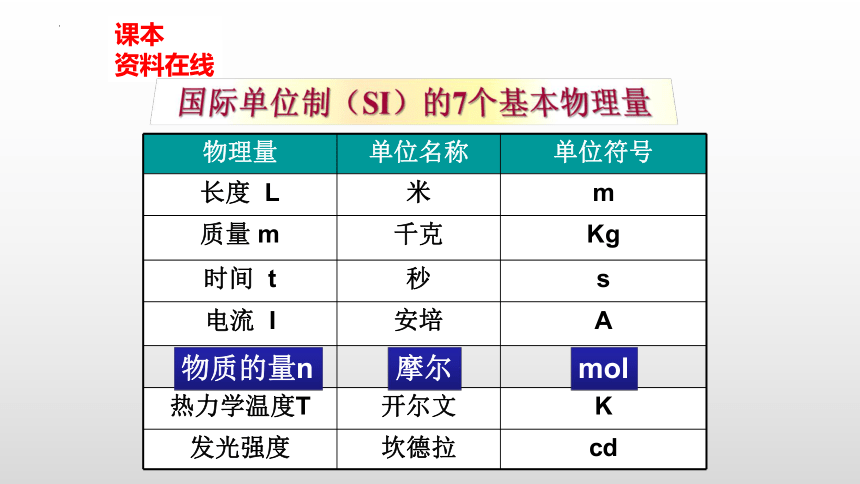
课本
资料在线
物理量 单位名称 单位符号
长度 L 米 m
质量 m 千克 Kg
时间 t 秒 s
电流 I 安培 A
热力学温度T 开尔文 K
发光强度 坎德拉 cd
物质的量n
摩尔
mol
1、物质的量
概念:
一、物质的量及其单位--摩尔
是表示含有一定数目微观粒子的集合体。
{
分子、原子、离子、电子、质子等
单位:摩尔,简称摩。符号为mol。
规范表示:1 摩尔(mol) H2O
数值
单位
用化学式或微粒符号指明具体的微观粒子
国际单位制七个基本物理量之一,符号:n
课本P53
讲授新课
判断下列说法是否正确
(1)1 摩尔氧
(2)1 摩尔Fe
(3)2 摩尔大米
(4)摩尔是7个基本物理量之一
(5)1 mol e-
(6)1.5 mol OH-
(7)物质的量可以写成“物质的质量”
必须指明微粒的种类,是氧原子、氧分子还是氧离子,改为 1mol O
×
√
×
物质的量及其单位摩尔的使用范围是微观粒子,大米是宏观物质
×
摩尔是物质的量的单位,物质的量才是七个基本物理量之一
√
√
×
物质的量是一个专有名词,不可分割,也不能增减。
物质的量的单位——摩尔
集体化 物质的量表示多个微粒集合体,数值可以是整数,也可以是小数。
注意事项
专有化“物质的量”是一个物理量的全称,是一个专有名词;不能拆开也不能添字。不能当成物质量或物质的质量来理解。
微观化“物质的量”只能描述原子、分子、离子、质子、中子和电子等微观粒子,不能描述宏观物质。
具体化 用摩尔为单位表示某物质的物质的量时,必须指明物质微粒的名称种类、或用符号或化学式表示。如:1 mol H、1 mol H+、 1 mol H2 ,不能用 “1 mol 氢”这样含糊无意义的表示。
1双筷子是2支,1 打鸡蛋是12个,1 箱啤酒是24听,那么,1 mol微观粒子是多少个呢?
数目标准
?个
1mol 微观粒子
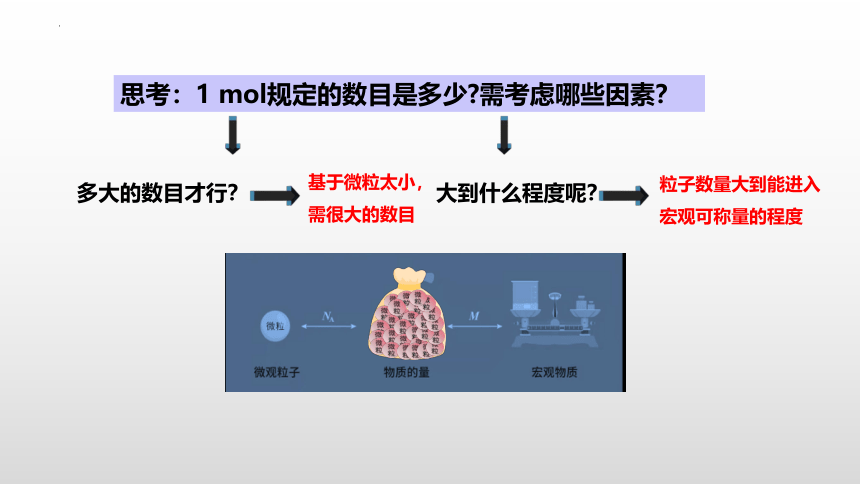
思考:1 mol规定的数目是多少 需考虑哪些因素?
多大的数目才行?
大到什么程度呢?
粒子数量大到能进入宏观可称量的程度
基于微粒太小,需很大的数目
国际上规定,1 mol粒子集合体所含的粒子数约为6.02×1023。1 mol任何粒子的粒子数叫做阿伏加德罗常数,符号为NA,通常用6.02×1023 mol-1表示。
一、物质的量的单位——摩尔
1 摩尔的标准:1 mol粒子集体所含的粒子数
= 0.012kg12C中所含的碳原子数
课本P53
物质的量的基准:阿伏加德罗常数
规定:即1mol任何微粒所含的粒子数为阿伏加德罗常数。
单位是:mol-1
近似数值:6.02 1023
注意: a.阿伏加德罗常数是一个物理量,单位是mol-1,
而不是纯数。
b.不能误认为:NA就是6.02×1023或 6.02×1023就是阿伏加德罗常数,也不能误认为1mol粒子=6.02×1023个
2、阿伏加德罗常数 符号:NA
表达式:NA≈6.02×1023mol-1
如果把 6.02×1023 粒米分给60亿人吃,每人每天吃一斤,要吃14万年。
假想把1摩尔(6.02×1023个)水分子(分子直径2×10-10 m)一个挨一个地摆在地球赤道上(周长为4万千米),可以绕地球赤道300万周!
感受阿伏加德罗常数大小
数据
转化
阿伏加德罗 常数
1 mol任何粒子所含的粒子数
NA、mol -1
含义
符号、单位
N、NA 、n的关系?
近似值:约为6.02×1023 mol -1
1 mol任何粒子的粒子数
=
阿伏加德罗常数(NA)
≈
6.02×1023
1 摩尔微粒
约为 6.02×1023个
约为6.02×1023
1mol粒子的粒子数
12克12C 所含的原子数
阿伏加德罗常数
小结
1摩尔
物质的量
微粒
个数(N)
1堆的量
堆数(n)
1 mol指含有NA个微观粒子
讲授新课
议一议
物质的量(n)、阿伏加德罗常数(NA)、微粒数(N )之间的关系
n(物质的量)
N(粒子总数)
1mol H
NA个H
2mol H
2×NA个H
3mol H
3×NA个H
……
n mol H
……
n×NA个H
规律:
N = n×NA
物质的量(n)
(单位:mol)
微粒数(单位:个)
阿伏加德罗常数
(单位: mol-1)
n
=
N
NA
微观粒子
宏观质量
2.阿伏加德罗常数
物质的量(n) 粒子数目(N)
三、以n 为中心的转换关系
①2 mol Al中含有多少个铝原子?
N(Al) = 2 mol × 6.02 × 1023 mol-1 = 1.204 × 1024
②3.01×1023个H2O的物质的量是多少?
3.01 × 1023
6.02 × 1023 mol-1
n(H2O) =
=
0.5 mol
1、N、NA 、n 的转换
3、以n 为中心的转换关系
①1.5 mol O2含有氧气分子的数目是多少?
②含有3.01 × 1023 个氧原子的H2O的物质的量是多少?
课堂练习1
N = n﹒NA 或 n=
N
NA
①1.5 mol O2含有氧气分子的数目是多少?
②含有3.01 × 1023 个氧原子的H2O的物质的量是多少?
解:N(O2) = n(O2) × NA = 1.5 mol × 6.02 × 1023 mol-1
= 9.03 × 1023
n(O) =
NA
=
6.02 × 1023 mol-1
= 0.5 mol
解:
N(O)
3.01 × 1023
课堂练习1
n(H2O) = n(O) = 0.5 mol
参考答案
÷NA
×NA
n
N
微粒数
三、物质的量(n)、物质的质量(m)和摩尔质量(M)、粒子数(N)和阿伏加德罗常数(NA)之间的关系
物质的量
1molH2O中含多少摩尔的H 多少摩尔的O
解:1个水分子中有2个氢原子和1个氧原子,当同时扩大6.02×1023倍之后,有如下关系:
1×6.02×1023
2×6.02×1023
1×6.02×1023
H2O-----2H-----O
1 2 1
1mol
1mol
2mol
例题:
答:1molH2O中含有2molH,1molO
随堂训练
注意:若只从数值上看:
方程式中的系数既表示微观分子的个数,又表示宏观物质的摩尔数.
化学式中的角码既表示微观分子中的原子数,又表示1mol该物质中该原子的摩尔数.
任何化学式量既表示该粒子的微观式量,又表示宏观上该元素的摩尔质量.但单位是不同的.
随堂练习:
1、1molO2约含有____________个O2,
_____mol O,约含有__________个O
2、3molH2SO4中约含有________ 个H2SO4,可电离出_______mol H+ ,约为 ________ 个H+
3、2mol NH4+中含有_________mol H,约含有
__________个N。
4、2mol H2O 含有 ________ 个H,含有________个O。
6.02×1023
2
2×6.02×1023
3×6.02×1023
6
6×6.02×1023
8
2×6.02×1023
4NA
2NA
在0.5 mol O2中含有的氧分子数目约是多少?
解:
N(O2) = n(O2) × NA
= 3.01 × 1023
答:0.5 mol O2的氧分子数约为3.01 × 1023个。
[例题]
注意解题格式
先公式、后数字;标明每一个量的所属;带单位计算。
=0.5 mol× 6.02 ×1023 mol-1
在0.5molO2中含有的电子数目是多少?
解:O2的电子数为
N = n × NA
= 4.816 × 1024
答: 0.5molO2的电子数为4.816 × 1024个。
[例题三]
=0.5 mol×16× 6.02 ×1023mol-1
意义
物质的量是把微观粒子和宏观物质联系起来的 一座桥梁。
(难见、难称量)
微观粒子
宏观物质
(可见、可称量)
物质的量
微粒数
(N)
×NA
÷ NA
物质的量(n)
第二章 海水中的重要元素--钠和氯
第三节 物质的量
第一课时 物质的量的单位——摩尔
人教版(2019)化学 必修一
摩尔日——在北美化学家之间流传的节日
物质的计量
v
N(number)
约20ml
10000000000000000000000000
假如让10亿人共同来数一滴水里的水分子,且每人每分钟数100个,日夜不停,需要3万年才能数完。
怎么办?
?
导入新课
议一议
古时有一个勇敢的小伙子想娶国王美丽的公主,国王出题刁难,
其中一个问题是:10kg小米是多少粒?同学们你们能不能帮帮他?
称一两小米,数其数目,再推算
数50或100粒小米,称其质量,再推算
生活经验告诉我们:
对于微小物质,扩大倍数形成一定数目的集合体,更方便计量
一打铅笔为12支
一板鸡蛋为30个
水分子数量很大
水分子按一定数目为一堆
计量“堆”数
科学方便
交流讨论
想办法在水分子数和水的质量之间找到一个桥梁。
物质的量
宏 观
微 观
国际上,为了研究一定数目的微观粒子集体,提出了一个新的物理量——物质的量!
课本
资料在线
物理量 单位名称 单位符号
长度 L 米 m
质量 m 千克 Kg
时间 t 秒 s
电流 I 安培 A
热力学温度T 开尔文 K
发光强度 坎德拉 cd
物质的量n
摩尔
mol
1、物质的量
概念:
一、物质的量及其单位--摩尔
是表示含有一定数目微观粒子的集合体。
{
分子、原子、离子、电子、质子等
单位:摩尔,简称摩。符号为mol。
规范表示:1 摩尔(mol) H2O
数值
单位
用化学式或微粒符号指明具体的微观粒子
国际单位制七个基本物理量之一,符号:n
课本P53
讲授新课
判断下列说法是否正确
(1)1 摩尔氧
(2)1 摩尔Fe
(3)2 摩尔大米
(4)摩尔是7个基本物理量之一
(5)1 mol e-
(6)1.5 mol OH-
(7)物质的量可以写成“物质的质量”
必须指明微粒的种类,是氧原子、氧分子还是氧离子,改为 1mol O
×
√
×
物质的量及其单位摩尔的使用范围是微观粒子,大米是宏观物质
×
摩尔是物质的量的单位,物质的量才是七个基本物理量之一
√
√
×
物质的量是一个专有名词,不可分割,也不能增减。
物质的量的单位——摩尔
集体化 物质的量表示多个微粒集合体,数值可以是整数,也可以是小数。
注意事项
专有化“物质的量”是一个物理量的全称,是一个专有名词;不能拆开也不能添字。不能当成物质量或物质的质量来理解。
微观化“物质的量”只能描述原子、分子、离子、质子、中子和电子等微观粒子,不能描述宏观物质。
具体化 用摩尔为单位表示某物质的物质的量时,必须指明物质微粒的名称种类、或用符号或化学式表示。如:1 mol H、1 mol H+、 1 mol H2 ,不能用 “1 mol 氢”这样含糊无意义的表示。
1双筷子是2支,1 打鸡蛋是12个,1 箱啤酒是24听,那么,1 mol微观粒子是多少个呢?
数目标准
?个
1mol 微观粒子
思考:1 mol规定的数目是多少 需考虑哪些因素?
多大的数目才行?
大到什么程度呢?
粒子数量大到能进入宏观可称量的程度
基于微粒太小,需很大的数目
国际上规定,1 mol粒子集合体所含的粒子数约为6.02×1023。1 mol任何粒子的粒子数叫做阿伏加德罗常数,符号为NA,通常用6.02×1023 mol-1表示。
一、物质的量的单位——摩尔
1 摩尔的标准:1 mol粒子集体所含的粒子数
= 0.012kg12C中所含的碳原子数
课本P53
物质的量的基准:阿伏加德罗常数
规定:即1mol任何微粒所含的粒子数为阿伏加德罗常数。
单位是:mol-1
近似数值:6.02 1023
注意: a.阿伏加德罗常数是一个物理量,单位是mol-1,
而不是纯数。
b.不能误认为:NA就是6.02×1023或 6.02×1023就是阿伏加德罗常数,也不能误认为1mol粒子=6.02×1023个
2、阿伏加德罗常数 符号:NA
表达式:NA≈6.02×1023mol-1
如果把 6.02×1023 粒米分给60亿人吃,每人每天吃一斤,要吃14万年。
假想把1摩尔(6.02×1023个)水分子(分子直径2×10-10 m)一个挨一个地摆在地球赤道上(周长为4万千米),可以绕地球赤道300万周!
感受阿伏加德罗常数大小
数据
转化
阿伏加德罗 常数
1 mol任何粒子所含的粒子数
NA、mol -1
含义
符号、单位
N、NA 、n的关系?
近似值:约为6.02×1023 mol -1
1 mol任何粒子的粒子数
=
阿伏加德罗常数(NA)
≈
6.02×1023
1 摩尔微粒
约为 6.02×1023个
约为6.02×1023
1mol粒子的粒子数
12克12C 所含的原子数
阿伏加德罗常数
小结
1摩尔
物质的量
微粒
个数(N)
1堆的量
堆数(n)
1 mol指含有NA个微观粒子
讲授新课
议一议
物质的量(n)、阿伏加德罗常数(NA)、微粒数(N )之间的关系
n(物质的量)
N(粒子总数)
1mol H
NA个H
2mol H
2×NA个H
3mol H
3×NA个H
……
n mol H
……
n×NA个H
规律:
N = n×NA
物质的量(n)
(单位:mol)
微粒数(单位:个)
阿伏加德罗常数
(单位: mol-1)
n
=
N
NA
微观粒子
宏观质量
2.阿伏加德罗常数
物质的量(n) 粒子数目(N)
三、以n 为中心的转换关系
①2 mol Al中含有多少个铝原子?
N(Al) = 2 mol × 6.02 × 1023 mol-1 = 1.204 × 1024
②3.01×1023个H2O的物质的量是多少?
3.01 × 1023
6.02 × 1023 mol-1
n(H2O) =
=
0.5 mol
1、N、NA 、n 的转换
3、以n 为中心的转换关系
①1.5 mol O2含有氧气分子的数目是多少?
②含有3.01 × 1023 个氧原子的H2O的物质的量是多少?
课堂练习1
N = n﹒NA 或 n=
N
NA
①1.5 mol O2含有氧气分子的数目是多少?
②含有3.01 × 1023 个氧原子的H2O的物质的量是多少?
解:N(O2) = n(O2) × NA = 1.5 mol × 6.02 × 1023 mol-1
= 9.03 × 1023
n(O) =
NA
=
6.02 × 1023 mol-1
= 0.5 mol
解:
N(O)
3.01 × 1023
课堂练习1
n(H2O) = n(O) = 0.5 mol
参考答案
÷NA
×NA
n
N
微粒数
三、物质的量(n)、物质的质量(m)和摩尔质量(M)、粒子数(N)和阿伏加德罗常数(NA)之间的关系
物质的量
1molH2O中含多少摩尔的H 多少摩尔的O
解:1个水分子中有2个氢原子和1个氧原子,当同时扩大6.02×1023倍之后,有如下关系:
1×6.02×1023
2×6.02×1023
1×6.02×1023
H2O-----2H-----O
1 2 1
1mol
1mol
2mol
例题:
答:1molH2O中含有2molH,1molO
随堂训练
注意:若只从数值上看:
方程式中的系数既表示微观分子的个数,又表示宏观物质的摩尔数.
化学式中的角码既表示微观分子中的原子数,又表示1mol该物质中该原子的摩尔数.
任何化学式量既表示该粒子的微观式量,又表示宏观上该元素的摩尔质量.但单位是不同的.
随堂练习:
1、1molO2约含有____________个O2,
_____mol O,约含有__________个O
2、3molH2SO4中约含有________ 个H2SO4,可电离出_______mol H+ ,约为 ________ 个H+
3、2mol NH4+中含有_________mol H,约含有
__________个N。
4、2mol H2O 含有 ________ 个H,含有________个O。
6.02×1023
2
2×6.02×1023
3×6.02×1023
6
6×6.02×1023
8
2×6.02×1023
4NA
2NA
在0.5 mol O2中含有的氧分子数目约是多少?
解:
N(O2) = n(O2) × NA
= 3.01 × 1023
答:0.5 mol O2的氧分子数约为3.01 × 1023个。
[例题]
注意解题格式
先公式、后数字;标明每一个量的所属;带单位计算。
=0.5 mol× 6.02 ×1023 mol-1
在0.5molO2中含有的电子数目是多少?
解:O2的电子数为
N = n × NA
= 4.816 × 1024
答: 0.5molO2的电子数为4.816 × 1024个。
[例题三]
=0.5 mol×16× 6.02 ×1023mol-1
意义
物质的量是把微观粒子和宏观物质联系起来的 一座桥梁。
(难见、难称量)
微观粒子
宏观物质
(可见、可称量)
物质的量
微粒数
(N)
×NA
÷ NA
物质的量(n)
