2.2.1化学平衡状态 课件(共25张PPT)2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.2.1化学平衡状态 课件(共25张PPT)2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 7.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-19 21:45:47 | ||
图片预览








文档简介
(共25张PPT)
1、了解可逆反应的含义及其特点。
2、了解化学平衡的建立过程,掌握化学平衡状态的特征。
3、学会平衡状态的判断方法。
化学平衡状态的判断。
化学平衡状态的判断。
导入:在工业生产中,必须考虑的两个问题?
(1)反应进行的快慢——化学反应速率
(2)反应进行的完全程度—化学反应的限度即
N2+3H2 2NH3 ; 2SO2+O2 2SO3
高温、高压催化剂
催化剂
△
使反应物既快又多地转变成产物
化学平衡
1、定义:在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应。
2、特点:
注意:任何反应都有可逆性,通常把可逆程度大的反应叫可逆反应
3、表示:
一、可逆反应
双向性
可逆反应分为正反应方向和逆反应方向
双同性
正、逆反应在同一条件下同时进行
共存性
反应物不能全部转化为生成物,即反应物的转化率小于100%
创新设计:
P29面课堂达标第1题
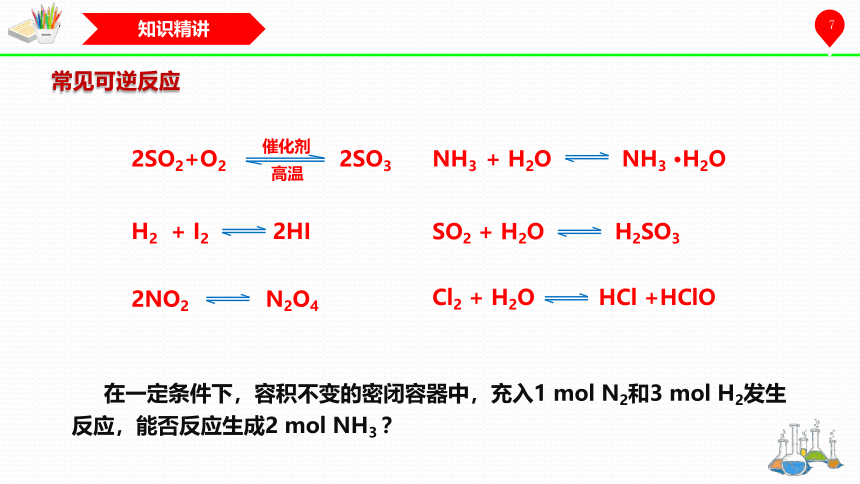
常见可逆反应
在一定条件下,容积不变的密闭容器中,充入1 mol N2和3 mol H2发生反应,能否反应生成2 mol NH3 ?
H2 + I2 2HI
NH3 + H2O NH3 ·H2O
SO2 + H2O H2SO3
Cl2 + H2O HCl +HClO
2NO2 N2O4
2SO2+O2 2SO3
催化剂
高温
二、化学平衡状态
1.化学平衡状态
(1)平衡建立:
正向: N2 + 3H2 2NH3
某温度下,容积不变的密闭容器中的合成氨反应
反应开始
c(反应物)最大,v正最大;
c(生成物)=0, v逆为0。
反应过程
c(反应物)逐渐减小,v正逐渐减小;
c(生成物)逐渐增大, v逆逐渐增大。
达到平衡
v正=v逆;
c(反应物)、c(生成物)均不再改变。
N2+3H2 2NH3
高温、高压催化剂
1.化学平衡状态
(2)定义
一定条件下的可逆反应中,当v正=v逆时,c(反应物)和c(生成物)均保持不变,即体系的组成不随时间而改变,这表明该反应中物质的转化达到了“限度”,这时的状态称之为化学平衡状态,简称化学平衡。
可逆反应在一定条件下达到限度时,反应就停止了吗?
当v正=v逆时,达到看似不变的“表面静止”状态,但实际反应并未停止,一直在进行中。
2、化学平衡状态的特点:
思考:如何判断一个化学反应是否已达到平衡状态呢?
逆
化学平衡状态的研究对象是_______反应
等
各组分浓度/物质的量/百分含量__________
动
υ正 ____ υ逆 ____ 0,是一个动态平衡
定
变
外界条件改变时,原平衡状态被破坏,在新条件下建立平衡
可逆
= ≠
保持不变
“表现”
“本质”
三、化学平衡状态的标志
标志一
看速率
“等”——v正=v逆。
①同一种物质:v生成=v消耗。
②不同的物质:“各物质v之比”=“化学计量数之比” ,必须不同方向。
例:恒温恒容时,可逆反应N2(g)+3H2(g) 2NH3(g)达到平衡状态的标志是______
① 单位时间内消耗1 mol N2 ,同时生成1 mol N2
② 单位时间内消耗1 mol N2 ,同时生成2 mol NH3
③ 单位时间内消耗1 mol N2 ,同时生成3 mol H2
④ 断裂3 mol H-H键 ,同时生成6 mol N-H键
⑤ v正(N2)=v逆(H2)
①③
一看有无正逆,二看是否等于系数之比。 有正有逆 符合比例
解题方法:
a、各物质的质量、物质的量、分子数目保持不变。
b、各物质的物质的量浓度、质量分数保持不变。
c、反应物的转化率、生成物的产率保持不变。
三、化学平衡状态的标志
一定是变量的物理量——单一物质
标志二:看含量
a、混合气体的n总、V总(恒T、P下)、P总(恒T、V下),一切只看n总是否为变量。
b、混合气体的M= ,要根据气体的m总、n总来确定混合气体的M是否为变量。
c、混合气体的ρ= ,要根据气体的m总和V总来确定混合气体的ρ是否为变量。
m总
n总
m总
V总
三、化学平衡状态的标志
不一定是变量的物理量——混合气体
“变量”——“不变”即平衡
标志三:找变量
以mA(g)+nB(g) pC(g)+qD(g)为例
a. 对于纯气体参加的可逆反应
平衡
不一定平衡
压强
①m+n≠p+q时,总压强一定 (其他条件一定)
②m+n=p+q时,总压强一定 (其他条件一定)
混合气体平均摩尔质量
① 当m+n ≠ p+q时, 一定时
温度
当体系温度一定时
平衡
颜色
反应体系内有色物质的颜色一定
平衡
不一定平衡
恒温恒压时,m+n≠p+q,则密度一定时
平衡
②当 m+n=p+q 时 , 一定时
平衡
不一定平衡
恒温恒容时,密度一定
密度
以mA(s)+nB(g) pC(g)+qD(g)为例
不一定平衡
①n≠p+q时,总压强一定 (其他条件一定)
平衡
②n=p+q时,总压强一定 (其他条件一定)
平衡
平衡
恒温恒容时,密度一定
平衡
混合气体平均摩尔质量
① 一定时,只有当n≠p+q时
② 一定时,但n=p+q时
体系密度
b. 对于非纯气体参加的可逆反应
以mA(s)+nB(g) pC(g)+qD(g)为例
压强
与平衡无关的说法
①各组分的浓度相等。
②各组分的浓度之比等于计量系数之比。
③各组分的分子个数之比等于计量系数之比。
三、化学平衡状态的标志
标志三
A.N2O4和NO2的分子数比为1:2
B.N2O4和NO2的浓度相等
C.平衡体系的颜色一定不再改变
D.单位时间有1 mol N2O4变为NO2的同时,有2 mol NO2变为N2O4
例、在2NO2 N2O4的可逆反应中,下列状态一定属于平衡状态的是( )
CD
【深入研究】
例如:A(s) B(g)+C(g)
当投入一定量的A时,随着反应的不断进行,B、C的体积分数始终为1/2,不是变量,不能作为判断平衡的依据。
反应体系中的某种气体的体积分数(即物质的量分数)不变时,是否一定可以判断反应已达到平衡状态?
当按系数比投入一定量的B、C时,随着反应的不断进行,B、C的体积分数始终为1/2,不是变量,不能作为判断平衡的依据。
化学
平衡
状态
可逆反应
概念
逆、等、动、定、变
判断依据
1、等—
2、变—“变量”不变
研究对象
特征:
=系数之比
υ正
υ逆
a、恒温条件下,气体的n总、m总、V总、P总一定变吗?如何判断?
化学反应 n总 m总 V总 P总
恒V 恒P 恒V 恒P
2SO2(g)+O2(g) 2SO3(g)
H2(g)+I2(g) 2HI(g)
C(s)+H2O(g) CO(g)+H2(g)
变
不变
不变
不变
变
不变
不变
不变
变
变
变
不变
【深入研究】
变
不变
变
不变
不变
不变
混合气体的平均摩尔质量M,不再变化时,要具体分析:
m总
M=
n总
看气体系数
找固体
分子、分母只要有一个是变量,
M 即可作为判断平衡的依据
A(g)+B(g) 2C(g)
A(g)+B(g) C(g)
A(s)+B(g) C(g)
m总
n总
M
不变
不变
不变
不变
变
变
变
不变
变
b、混合气体的平均相对分子质量
【深入研究】
例如:A(s) B(g)+C(g)
当投入一定量的A时,随着反应的不断进行,B、C的物质的量始终为1:1,平均相对分子质量不是变量,不能作为判断平衡的依据。
反应体系中的混合气体的平均相对分子质量不变时,是否一定可以判断反应已达到平衡状态?
恒温恒容时,气体的密度ρ不再变化时,要具体分析:
m总
ρ =
V
不会变
找固体,若方程式中有固体,则气体总质量会变化
对于反应:A(s)+B(g)=C(g)
mA + mB + mC
不变
(质量守恒)
质量减少
质量增加
恒容时,凡是有固体参与的反应,其气体密度都会变
c、混合气体的密度
例2、 恒温恒容时,可逆反应N2(g)+3H2(g) 2NH3(g)达到平衡状态的标志是_________
① N2 、H2 、 NH3 的浓度比为1:3:2
② N2的浓度不随时间变化
③ NH3的百分含量不再发生变化
④ 混合气体的颜色不再发生变化
⑤ H2的转化率不再发生变化
②③⑤
判断这个物理量是否为变量
解题方法:
例3、恒温恒容时,可逆反应N2(g)+3H2(g) 2NH3(g)达到平衡状态的标志是_________
① 混合气体总的物质的量不再发生变化
② 气体的总压强不再发生变化
③ 混合气体的平均相对分子质量不再发生变化
④ 混合气体的密度不再发生变化
①②③
思考:对于可逆反应: H2(g)+I2(g) 2HI(g)呢 ?
都不行
1、了解可逆反应的含义及其特点。
2、了解化学平衡的建立过程,掌握化学平衡状态的特征。
3、学会平衡状态的判断方法。
化学平衡状态的判断。
化学平衡状态的判断。
导入:在工业生产中,必须考虑的两个问题?
(1)反应进行的快慢——化学反应速率
(2)反应进行的完全程度—化学反应的限度即
N2+3H2 2NH3 ; 2SO2+O2 2SO3
高温、高压催化剂
催化剂
△
使反应物既快又多地转变成产物
化学平衡
1、定义:在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应。
2、特点:
注意:任何反应都有可逆性,通常把可逆程度大的反应叫可逆反应
3、表示:
一、可逆反应
双向性
可逆反应分为正反应方向和逆反应方向
双同性
正、逆反应在同一条件下同时进行
共存性
反应物不能全部转化为生成物,即反应物的转化率小于100%
创新设计:
P29面课堂达标第1题
常见可逆反应
在一定条件下,容积不变的密闭容器中,充入1 mol N2和3 mol H2发生反应,能否反应生成2 mol NH3 ?
H2 + I2 2HI
NH3 + H2O NH3 ·H2O
SO2 + H2O H2SO3
Cl2 + H2O HCl +HClO
2NO2 N2O4
2SO2+O2 2SO3
催化剂
高温
二、化学平衡状态
1.化学平衡状态
(1)平衡建立:
正向: N2 + 3H2 2NH3
某温度下,容积不变的密闭容器中的合成氨反应
反应开始
c(反应物)最大,v正最大;
c(生成物)=0, v逆为0。
反应过程
c(反应物)逐渐减小,v正逐渐减小;
c(生成物)逐渐增大, v逆逐渐增大。
达到平衡
v正=v逆;
c(反应物)、c(生成物)均不再改变。
N2+3H2 2NH3
高温、高压催化剂
1.化学平衡状态
(2)定义
一定条件下的可逆反应中,当v正=v逆时,c(反应物)和c(生成物)均保持不变,即体系的组成不随时间而改变,这表明该反应中物质的转化达到了“限度”,这时的状态称之为化学平衡状态,简称化学平衡。
可逆反应在一定条件下达到限度时,反应就停止了吗?
当v正=v逆时,达到看似不变的“表面静止”状态,但实际反应并未停止,一直在进行中。
2、化学平衡状态的特点:
思考:如何判断一个化学反应是否已达到平衡状态呢?
逆
化学平衡状态的研究对象是_______反应
等
各组分浓度/物质的量/百分含量__________
动
υ正 ____ υ逆 ____ 0,是一个动态平衡
定
变
外界条件改变时,原平衡状态被破坏,在新条件下建立平衡
可逆
= ≠
保持不变
“表现”
“本质”
三、化学平衡状态的标志
标志一
看速率
“等”——v正=v逆。
①同一种物质:v生成=v消耗。
②不同的物质:“各物质v之比”=“化学计量数之比” ,必须不同方向。
例:恒温恒容时,可逆反应N2(g)+3H2(g) 2NH3(g)达到平衡状态的标志是______
① 单位时间内消耗1 mol N2 ,同时生成1 mol N2
② 单位时间内消耗1 mol N2 ,同时生成2 mol NH3
③ 单位时间内消耗1 mol N2 ,同时生成3 mol H2
④ 断裂3 mol H-H键 ,同时生成6 mol N-H键
⑤ v正(N2)=v逆(H2)
①③
一看有无正逆,二看是否等于系数之比。 有正有逆 符合比例
解题方法:
a、各物质的质量、物质的量、分子数目保持不变。
b、各物质的物质的量浓度、质量分数保持不变。
c、反应物的转化率、生成物的产率保持不变。
三、化学平衡状态的标志
一定是变量的物理量——单一物质
标志二:看含量
a、混合气体的n总、V总(恒T、P下)、P总(恒T、V下),一切只看n总是否为变量。
b、混合气体的M= ,要根据气体的m总、n总来确定混合气体的M是否为变量。
c、混合气体的ρ= ,要根据气体的m总和V总来确定混合气体的ρ是否为变量。
m总
n总
m总
V总
三、化学平衡状态的标志
不一定是变量的物理量——混合气体
“变量”——“不变”即平衡
标志三:找变量
以mA(g)+nB(g) pC(g)+qD(g)为例
a. 对于纯气体参加的可逆反应
平衡
不一定平衡
压强
①m+n≠p+q时,总压强一定 (其他条件一定)
②m+n=p+q时,总压强一定 (其他条件一定)
混合气体平均摩尔质量
① 当m+n ≠ p+q时, 一定时
温度
当体系温度一定时
平衡
颜色
反应体系内有色物质的颜色一定
平衡
不一定平衡
恒温恒压时,m+n≠p+q,则密度一定时
平衡
②当 m+n=p+q 时 , 一定时
平衡
不一定平衡
恒温恒容时,密度一定
密度
以mA(s)+nB(g) pC(g)+qD(g)为例
不一定平衡
①n≠p+q时,总压强一定 (其他条件一定)
平衡
②n=p+q时,总压强一定 (其他条件一定)
平衡
平衡
恒温恒容时,密度一定
平衡
混合气体平均摩尔质量
① 一定时,只有当n≠p+q时
② 一定时,但n=p+q时
体系密度
b. 对于非纯气体参加的可逆反应
以mA(s)+nB(g) pC(g)+qD(g)为例
压强
与平衡无关的说法
①各组分的浓度相等。
②各组分的浓度之比等于计量系数之比。
③各组分的分子个数之比等于计量系数之比。
三、化学平衡状态的标志
标志三
A.N2O4和NO2的分子数比为1:2
B.N2O4和NO2的浓度相等
C.平衡体系的颜色一定不再改变
D.单位时间有1 mol N2O4变为NO2的同时,有2 mol NO2变为N2O4
例、在2NO2 N2O4的可逆反应中,下列状态一定属于平衡状态的是( )
CD
【深入研究】
例如:A(s) B(g)+C(g)
当投入一定量的A时,随着反应的不断进行,B、C的体积分数始终为1/2,不是变量,不能作为判断平衡的依据。
反应体系中的某种气体的体积分数(即物质的量分数)不变时,是否一定可以判断反应已达到平衡状态?
当按系数比投入一定量的B、C时,随着反应的不断进行,B、C的体积分数始终为1/2,不是变量,不能作为判断平衡的依据。
化学
平衡
状态
可逆反应
概念
逆、等、动、定、变
判断依据
1、等—
2、变—“变量”不变
研究对象
特征:
=系数之比
υ正
υ逆
a、恒温条件下,气体的n总、m总、V总、P总一定变吗?如何判断?
化学反应 n总 m总 V总 P总
恒V 恒P 恒V 恒P
2SO2(g)+O2(g) 2SO3(g)
H2(g)+I2(g) 2HI(g)
C(s)+H2O(g) CO(g)+H2(g)
变
不变
不变
不变
变
不变
不变
不变
变
变
变
不变
【深入研究】
变
不变
变
不变
不变
不变
混合气体的平均摩尔质量M,不再变化时,要具体分析:
m总
M=
n总
看气体系数
找固体
分子、分母只要有一个是变量,
M 即可作为判断平衡的依据
A(g)+B(g) 2C(g)
A(g)+B(g) C(g)
A(s)+B(g) C(g)
m总
n总
M
不变
不变
不变
不变
变
变
变
不变
变
b、混合气体的平均相对分子质量
【深入研究】
例如:A(s) B(g)+C(g)
当投入一定量的A时,随着反应的不断进行,B、C的物质的量始终为1:1,平均相对分子质量不是变量,不能作为判断平衡的依据。
反应体系中的混合气体的平均相对分子质量不变时,是否一定可以判断反应已达到平衡状态?
恒温恒容时,气体的密度ρ不再变化时,要具体分析:
m总
ρ =
V
不会变
找固体,若方程式中有固体,则气体总质量会变化
对于反应:A(s)+B(g)=C(g)
mA + mB + mC
不变
(质量守恒)
质量减少
质量增加
恒容时,凡是有固体参与的反应,其气体密度都会变
c、混合气体的密度
例2、 恒温恒容时,可逆反应N2(g)+3H2(g) 2NH3(g)达到平衡状态的标志是_________
① N2 、H2 、 NH3 的浓度比为1:3:2
② N2的浓度不随时间变化
③ NH3的百分含量不再发生变化
④ 混合气体的颜色不再发生变化
⑤ H2的转化率不再发生变化
②③⑤
判断这个物理量是否为变量
解题方法:
例3、恒温恒容时,可逆反应N2(g)+3H2(g) 2NH3(g)达到平衡状态的标志是_________
① 混合气体总的物质的量不再发生变化
② 气体的总压强不再发生变化
③ 混合气体的平均相对分子质量不再发生变化
④ 混合气体的密度不再发生变化
①②③
思考:对于可逆反应: H2(g)+I2(g) 2HI(g)呢 ?
都不行
