浙教版 初科 八上 第一章 章节复习
图片预览

文档简介
中小学教育资源及组卷应用平台
八上 第一章 章节复习(1.4-1.7)
一.选择题(共15小题)
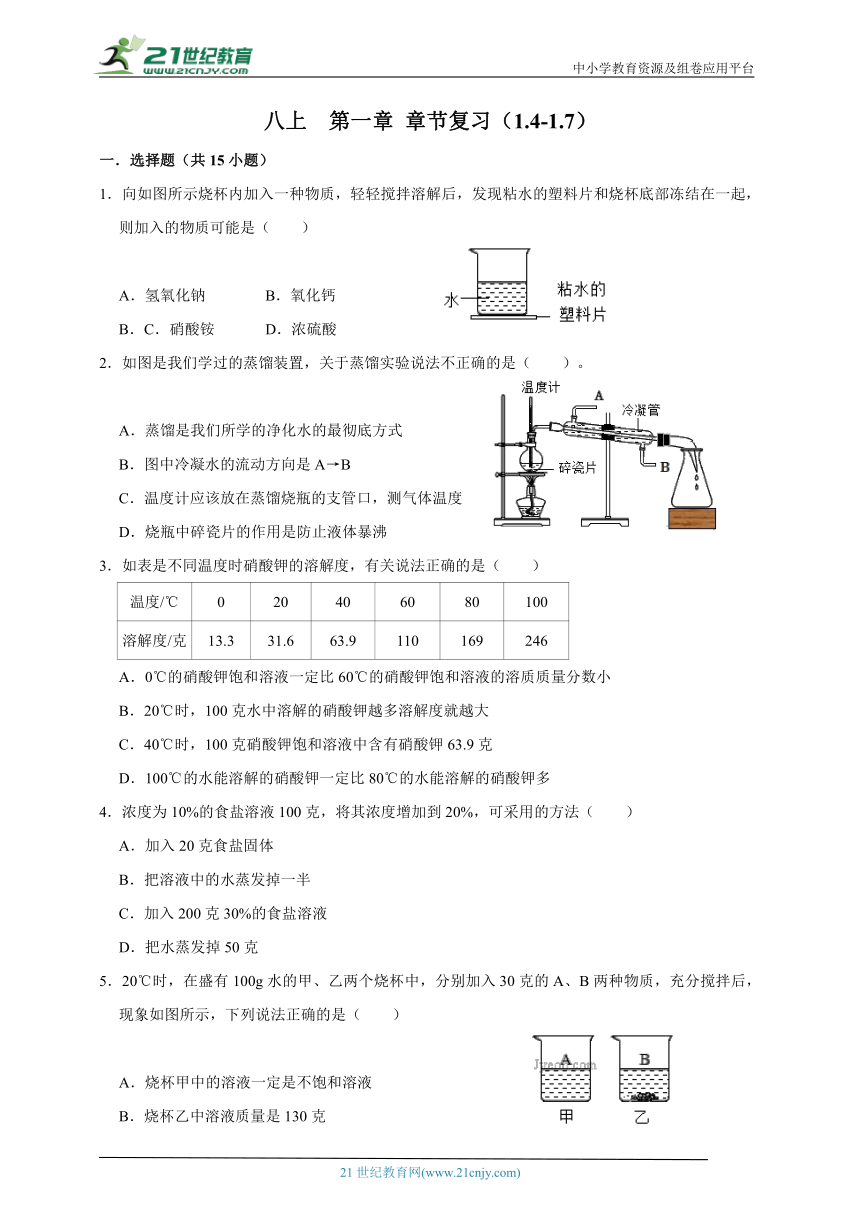
1.向如图所示烧杯内加入一种物质,轻轻搅拌溶解后,发现粘水的塑料片和烧杯底部冻结在一起,则加入的物质可能是( )
氢氧化钠 B.氧化钙
C.硝酸铵 D.浓硫酸
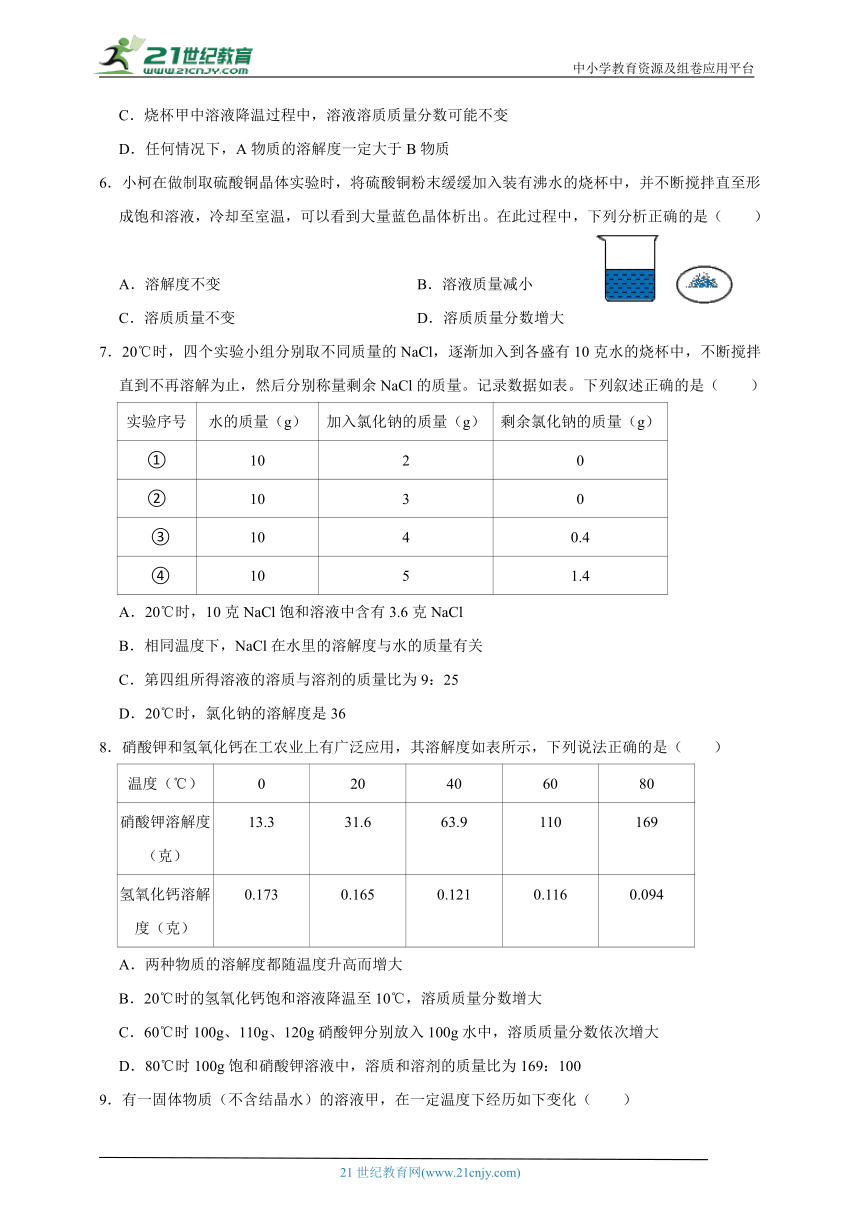
2.如图是我们学过的蒸馏装置,关于蒸馏实验说法不正确的是( )。
A.蒸馏是我们所学的净化水的最彻底方式
B.图中冷凝水的流动方向是A→B
C.温度计应该放在蒸馏烧瓶的支管口,测气体温度
D.烧瓶中碎瓷片的作用是防止液体暴沸
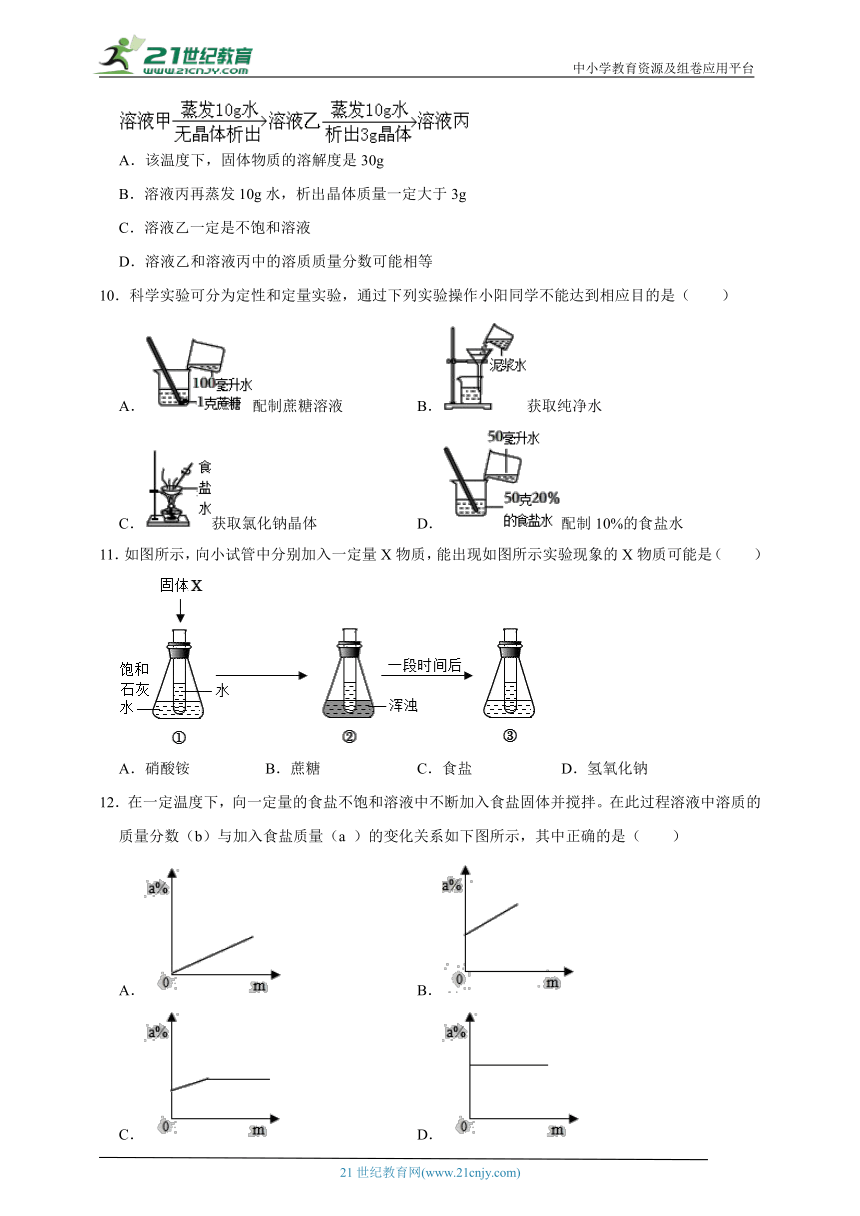
3.如表是不同温度时硝酸钾的溶解度,有关说法正确的是( )
温度/℃ 0 20 40 60 80 100
溶解度/克 13.3 31.6 63.9 110 169 246
A.0℃的硝酸钾饱和溶液一定比60℃的硝酸钾饱和溶液的溶质质量分数小
B.20℃时,100克水中溶解的硝酸钾越多溶解度就越大
C.40℃时,100克硝酸钾饱和溶液中含有硝酸钾63.9克
D.100℃的水能溶解的硝酸钾一定比80℃的水能溶解的硝酸钾多
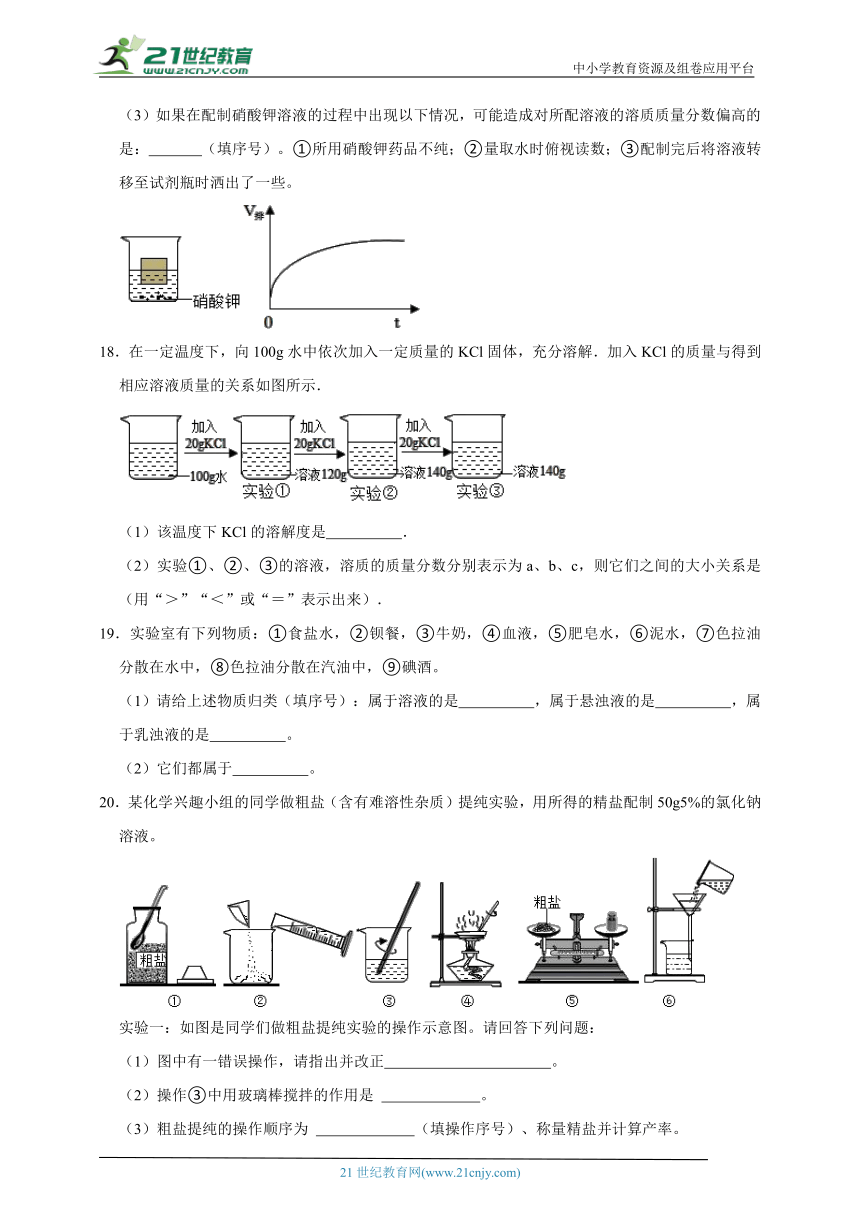
4.浓度为10%的食盐溶液100克,将其浓度增加到20%,可采用的方法( )
A.加入20克食盐固体
B.把溶液中的水蒸发掉一半
C.加入200克30%的食盐溶液
D.把水蒸发掉50克
5.20℃时,在盛有100g水的甲、乙两个烧杯中,分别加入30克的A、B两种物质,充分搅拌后,现象如图所示,下列说法正确的是( )
A.烧杯甲中的溶液一定是不饱和溶液
B.烧杯乙中溶液质量是130克
C.烧杯甲中溶液降温过程中,溶液溶质质量分数可能不变
D.任何情况下,A物质的溶解度一定大于B物质
6.小柯在做制取硫酸铜晶体实验时,将硫酸铜粉末缓缓加入装有沸水的烧杯中,并不断搅拌直至形成饱和溶液,冷却至室温,可以看到大量蓝色晶体析出。在此过程中,下列分析正确的是( )
A.溶解度不变 B.溶液质量减小
C.溶质质量不变 D.溶质质量分数增大
7.20℃时,四个实验小组分别取不同质量的NaCl,逐渐加入到各盛有10克水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。记录数据如表。下列叙述正确的是( )
实验序号 水的质量(g) 加入氯化钠的质量(g) 剩余氯化钠的质量(g)
① 10 2 0
② 10 3 0
③ 10 4 0.4
④ 10 5 1.4
A.20℃时,10克NaCl饱和溶液中含有3.6克NaCl
B.相同温度下,NaCl在水里的溶解度与水的质量有关
C.第四组所得溶液的溶质与溶剂的质量比为9:25
D.20℃时,氯化钠的溶解度是36
8.硝酸钾和氢氧化钙在工农业上有广泛应用,其溶解度如表所示,下列说法正确的是( )
温度(℃) 0 20 40 60 80
硝酸钾溶解度(克) 13.3 31.6 63.9 110 169
氢氧化钙溶解度(克) 0.173 0.165 0.121 0.116 0.094
A.两种物质的溶解度都随温度升高而增大
B.20℃时的氢氧化钙饱和溶液降温至10℃,溶质质量分数增大
C.60℃时100g、110g、120g硝酸钾分别放入100g水中,溶质质量分数依次增大
D.80℃时100g饱和硝酸钾溶液中,溶质和溶剂的质量比为169:100
9.有一固体物质(不含结晶水)的溶液甲,在一定温度下经历如下变化( )
A.该温度下,固体物质的溶解度是30g
B.溶液丙再蒸发10g水,析出晶体质量一定大于3g
C.溶液乙一定是不饱和溶液
D.溶液乙和溶液丙中的溶质质量分数可能相等
10.科学实验可分为定性和定量实验,通过下列实验操作小阳同学不能达到相应目的是( )
A.配制蔗糖溶液 B.获取纯净水
C.获取氯化钠晶体 D.配制10%的食盐水
11.如图所示,向小试管中分别加入一定量X物质,能出现如图所示实验现象的X物质可能是( )
A.硝酸铵 B.蔗糖 C.食盐 D.氢氧化钠
12.在一定温度下,向一定量的食盐不饱和溶液中不断加入食盐固体并搅拌。在此过程溶液中溶质的质量分数(b)与加入食盐质量(a )的变化关系如下图所示,其中正确的是( )
A. B.
C. D.
13.下列因素与固体物质的溶解度有关的是( )
①溶质的多少 ②溶质的性质 ③溶剂的多少 ④溶剂的性质 ⑤溶液是否饱和 ⑥是否搅拌 ⑦温度.
A.全部 B.②④⑦ C.②④⑤⑦ D.②③④⑤⑥
14.如图所示为蒸发氯化钠溶液的实验,②中溶液恰好饱和。下列判断正确的是( )
A.在①→②过程中,氯化钠的质量分数保持不变
B.在②→③过程中,氯化钠的溶解度不断增大
C.在②→④过程中,氯化钠的质量分数先不变后增大
D.在③→④过程中,结晶的氯化钠质量一定变大
15.20℃时,某物质的饱和溶液中,溶质和溶液的质量比为2:7,则20℃时其溶解度为( )
A.28.6克 B.28.6% C.40克 D.40%
二.填空题(共11小题)
16.如图是甲、乙固体的溶解度曲线。甲、乙溶解度相等时的温度为 ℃;将a1℃时等质量甲、乙饱和溶液升温到a2℃,溶质的质量为甲 乙(填“大于”“小于”或“等于”); a2℃时,65g甲饱和溶液稀释到20%,需加水 g。
17.硝酸钾在不同温度下的溶解度如表:
温度/℃ 0 10 20 30 40 50
溶解度/g 13.3 20.9 31.6 45.8 63.9 85.8
(1)30℃时,把15.8g硝酸钾完全溶解在50g水中,所得硝酸钾溶液的质量分数为 ;判断是否是饱和溶液 (选填“是”或“否”)。
(2)一木块漂浮于50℃的硝酸钾饱和溶液中,木块排开液体的体积V排随时间t发生了如图所示的变化。由此推测出温度的改变方式是 (选填“升温”或“降温”)。
(3)如果在配制硝酸钾溶液的过程中出现以下情况,可能造成对所配溶液的溶质质量分数偏高的是: (填序号)。①所用硝酸钾药品不纯;②量取水时俯视读数;③配制完后将溶液转移至试剂瓶时洒出了一些。
18.在一定温度下,向100g水中依次加入一定质量的KCl固体,充分溶解.加入KCl的质量与得到相应溶液质量的关系如图所示.
(1)该温度下KCl的溶解度是 .
(2)实验①、②、③的溶液,溶质的质量分数分别表示为a、b、c,则它们之间的大小关系是 (用“>”“<”或“=”表示出来).
19.实验室有下列物质:①食盐水,②钡餐,③牛奶,④血液,⑤肥皂水,⑥泥水,⑦色拉油分散在水中,⑧色拉油分散在汽油中,⑨碘酒。
(1)请给上述物质归类(填序号):属于溶液的是 ,属于悬浊液的是 ,属于乳浊液的是 。
(2)它们都属于 。
20.某化学兴趣小组的同学做粗盐(含有难溶性杂质)提纯实验,用所得的精盐配制50g5%的氯化钠溶液。
实验一:如图是同学们做粗盐提纯实验的操作示意图。请回答下列问题:
(1)图中有一错误操作,请指出并改正 。
(2)操作③中用玻璃棒搅拌的作用是 。
(3)粗盐提纯的操作顺序为 (填操作序号)、称量精盐并计算产率。
(4)操作④中,当观察到 时,停止加热。
实验二:用提纯得到的精盐配制了50g5%的氯化钠溶液。经检测,溶质质量分数偏小,其原因可能有 (填序号)。
①氯化钠固体仍然不纯
②称量时所用砝码生锈(实际质量比所标要大)
③量取水时,仰视读数
④装瓶时,有少量溶液洒出
21.已知甲物质的溶解度与温度的关系如下表所示:
温度/℃ 10 20 30 40
溶解度/g 10.0 18.0 36.0 56.0
按如图步骤进行操作:
(1)在A﹣E的溶液中,属于不饱和溶液的是 (填序号,下同),与B溶液的溶质质量分数相同的是 。
(2)要使E中未溶的甲物质全部溶解,至少需要加入30℃的水 g。
22.向100g水中不断加入固体A或改变温度,得到相应的溶液①~⑤。
如表为A在不同温度下的溶解度,则在编号为①~⑤的溶液中(下列小题均填序号):
(1)属于饱和溶液的是溶液 。
(2)溶液的溶质质量分数从大到小的顺序是 。
温度/℃ 20 30 40 50 60
溶解度/g 37.2 41.4 45.8 50.4 55.2
23.20℃时,在盛有50g水的烧杯中加入15g固体X(不含杂质),充分溶解后,逐渐升温,并测定不同温度时析出固体X的质量。测定结果记录如表:
溶液的温度/℃ 20 35 50 65 75
析出固体X的质量/g 10.4 8.0 5.0 0 0
若不考虑水蒸发对实验的影响,请回答下列问题。
(1)35℃时,该溶液的质量是 g;
(2)65℃时,该溶液是 (选填编号);
Ⅰ.饱和溶液Ⅱ.不饱和溶液Ⅲ.无法判断
(3)根据下表溶解度与溶解性的关系,可知X属于 物质;
溶解性 易溶 可溶 微溶 难溶(或不溶)
溶解度(20℃) >10 1﹣10 0.01﹣1 <0.01
(4)50℃时,使烧杯中析出的5g固体X全部溶解,至少加入 g水。
三.实验探究题(共3小题)
24.如图所示是“探究浮力的大小跟哪些因素有关”的实验装置和过程,其中弹簧测力计所挂的是同一金属块。
(1)金属块浸没在水中时,受到的浮力是 N。
(2)分析 两图可知,浸在液体中的物体所受浮力大小跟液体密度有关。
(3)根据上述实验过程,可得戊图中盐水的密度是 kg/m3。如果在实验中不小心使戊图中的金属块接触了容器底且与容器底有力的作用,此时测量出的盐水密度值将 (填“变小”、“变大”或“不变”)。
25.氯化钠是生活必需品,也是重要的化工原料。下表是氯化钠和硝酸钾在不同温度时的溶解度,根据此表回答问题。
温度/℃ 20 30 40 50 60
溶解度/g 氯化钠 36.0 36.3 36.6 37.0 37.3
硝酸钾 31.6 45.8 63.9 85.5 110
(1)要把硝酸钾从含有少量氯化钠的溶液中提出,最好采用的方法是 。提纯含少量泥沙的粗盐,一般经过以下操作流程:
(2)在做过滤实验后,发现得到的滤液仍然浑浊,其可能的原因是 (写出一种)
(3)操作⑤的名称是 ,玻璃棒的作用是 。
(4)实验结束后称量获得的精盐,发现精盐含量较低,其可能原因是 (可多选)。
A.食盐没有全部溶解即过滤
B.蒸发时食盐飞溅剧烈
C.蒸发后,所得精盐有点潮湿
D.器皿上沾有的精盐没全部转移到称量纸上
26.如图是A、B、C(均不含结晶水)三种物质的溶解度曲线,请据图回答下列问题。
(1)在40℃时,A、B、C三种物质的溶解度由大到小的关系是 (物质间用“>”连接);
(2)将30℃的三种物质的饱和溶液冷却到20℃后,所得溶液中溶质的质量分数由小到大的关系是: (物质间用“<”连接);
(3)现有一定质量的B溶液,将该溶液在50℃下恒温蒸发40克水后析出了2克B晶体,再恒温蒸发5克水后,又析出了2克B晶体,则B物质在50℃时的溶解度是 。
四.计算题(共3小题)
27.医生给病人输液时,常用葡萄糖注射液。如图为葡萄糖注射液的部分标签图,根据图回答下列问题:
(1)从该溶液中取出10mL,则取出溶液中溶质的质量分数为 。
(2)某病人一天共输入该葡萄糖注射液1500mL,此病人这一天共补充葡萄糖 g。
(3)某铅酸蓄电池使用的酸溶液是溶质质量分数为20%的稀硫酸。若用100g质量分数为98%的浓硫酸配制该稀硫酸时,需要蒸馏水多少g(精确到0.1)(写出计算过程)。
28.(2022秋 温州月考)某同学在实验室进行有关浓硫酸的实验,观察到瓶上的标签如表所示。他从瓶中倒出200毫升用于配制稀硫酸。
浓硫酸(H2SO4)500毫升
溶质的质量分数 98%
密度 1.84克/厘米3
强腐蚀性,阴冷,密封储藏
(1)这200毫升浓硫酸的质量是 克,其中含溶质 克。
(2)欲配制1000克质量分数为20%的稀硫酸,需要多少克这种浓硫酸和多少克水?
29.(2022秋 杭州月考)舟山海鲜闻名全国,但是有一些不法商贩为了获取暴利,会用福尔马林浸泡海鲜,以延长其保鲜时间,这对食用者的健康有很大损害。查阅资料发现福尔马林是浓度为35%﹣40%的甲醛溶液。在医学上,常用来浸泡病理切片及生物标本,请根据要求回答下列问题:
(1)实验室中,如果要配制100g质量分数为40%的福尔马林溶液,需要甲醛的质量为多少?
(2)如果将该溶液稀释为35%的溶液,需要加入多少毫升的水?(结果保留一位小数)
30.(2022秋 拱墅区校级月考)某同学在实验室进行有关配制稀硫酸的实验时观察瓶上的标签,试分析并回答下列问题。
浓硫酸(H2SO4) 300mL 密度1.80g/cm3 质量分数98%
(1)这瓶浓硫酸溶液的质量为多少?
(2)这瓶浓硫酸含溶质硫酸的质量为多少?
(3)该同学利用这瓶浓硫酸欲配制溶质质量分数为 10%的稀硫酸 600 克,则他需要这种浓硫酸多少毫升?
一.选择题
1.C 2.B 3.A 4.D 5.C 6.B 7.C 8.D 9.D 10.B 11.D 12.C 13.B 14.D 15.C
二.填空题(共11小题)
16.(2022秋 西湖区校级月考)如图是甲、乙固体的溶解度曲线。甲、乙溶解度相等时的温度为 a1 ℃;将a1℃时等质量甲、乙饱和溶液升温到a2℃,溶质的质量为甲 等于 乙(填“大于”“小于”或“等于”); a2℃时,65g甲饱和溶液稀释到20%,需加水 10 g。
17.(1)24.0%;否。(2)降温。(3)②。
18.(2022秋 杭州月考)在一定温度下,向100g水中依次加入一定质量的KCl固体,充分溶解.加入KCl的质量与得到相应溶液质量的关系如图所示.
(1)该温度下KCl的溶解度是 40g .
(2)实验①、②、③的溶液,溶质的质量分数分别表示为a、b、c,则它们之间的大小关系是 b=c>a (用“>”“<”或“=”表示出来).
19.(2022秋 拱墅区校级月考)实验室有下列物质:①食盐水,②钡餐,③牛奶,④血液,⑤肥皂水,⑥泥水,⑦色拉油分散在水中,⑧色拉油分散在汽油中,⑨碘酒。
(1)请给上述物质归类(填序号):属于溶液的是 ①⑧⑨ ,属于悬浊液的是 ②④⑥ ,属于乳浊液的是 ③⑤⑦ 。
(2)它们都属于 混合物 。
20.(1)⑥中错误之处:没有利用玻璃棒引流;改正方法:利用玻璃棒引流。
(2)加快溶解速率。
(3)①⑤②③⑥④。
(4)出现较多固体。①③。
21.(2021秋 义乌市月考)已知甲物质的溶解度与温度的关系如下表所示:
温度/℃ 10 20 30 40
溶解度/g 10.0 18.0 36.0 56.0
按如图步骤进行操作:
(1)在A﹣E的溶液中,属于不饱和溶液的是 CD (填序号,下同),与B溶液的溶质质量分数相同的是 A 。
(2)要使E中未溶的甲物质全部溶解,至少需要加入30℃的水 50 g。
22.(1)②⑤;
(2)⑤=④>③>②>①。
23.(2022秋 拱墅区校级月考)20℃时,在盛有50g水的烧杯中加入15g固体X(不含杂质),充分溶解后,逐渐升温,并测定不同温度时析出固体X的质量。测定结果记录如表:
溶液的温度/℃ 20 35 50 65 75
析出固体X的质量/g 10.4 8.0 5.0 0 0
若不考虑水蒸发对实验的影响,请回答下列问题。
(1)35℃时,该溶液的质量是 57 g;
(2)65℃时,该溶液是 Ⅲ (选填编号);
Ⅰ.饱和溶液Ⅱ.不饱和溶液Ⅲ.无法判断
(3)根据下表溶解度与溶解性的关系,可知X属于 可溶 物质;
溶解性 易溶 可溶 微溶 难溶(或不溶)
溶解度(20℃) >10 1﹣10 0.01﹣1 <0.01
(4)50℃时,使烧杯中析出的5g固体X全部溶解,至少加入 25 g水。
三.实验探究题
24.(1)2;(2)丁、戊;(3)1.2×103;变大。
25.(1)冷却结晶;
(2)滤纸破损(合理即可);
(3)蒸发结晶;搅拌,防止局部温度过高,液体飞溅;
(4)ABD。
26.(1)A>B>C。(2)C<A<B。(3)40克。
四.计算题
27.(2022秋 西湖区校级月考)医生给病人输液时,常用葡萄糖注射液。如图为葡萄糖注射液的部分标签图,根据图回答下列问题:
(1)从该溶液中取出10mL,则取出溶液中溶质的质量分数为 5% 。
(2)某病人一天共输入该葡萄糖注射液1500mL,此病人这一天共补充葡萄糖 75 g。
(3)某铅酸蓄电池使用的酸溶液是溶质质量分数为20%的稀硫酸。若用100g质量分数为98%的浓硫酸配制该稀硫酸时,需要蒸馏水多少g(精确到0.1)(写出计算过程)。
28.(1)368;360.64;
(2)需要这种浓硫酸和水分别为204g和796g。
29.(1)40g;(2)14.3毫升。
30.(1)552;(2)540.96g;
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
八上 第一章 章节复习(1.4-1.7)
一.选择题(共15小题)
1.向如图所示烧杯内加入一种物质,轻轻搅拌溶解后,发现粘水的塑料片和烧杯底部冻结在一起,则加入的物质可能是( )
氢氧化钠 B.氧化钙
C.硝酸铵 D.浓硫酸
2.如图是我们学过的蒸馏装置,关于蒸馏实验说法不正确的是( )。
A.蒸馏是我们所学的净化水的最彻底方式
B.图中冷凝水的流动方向是A→B
C.温度计应该放在蒸馏烧瓶的支管口,测气体温度
D.烧瓶中碎瓷片的作用是防止液体暴沸
3.如表是不同温度时硝酸钾的溶解度,有关说法正确的是( )
温度/℃ 0 20 40 60 80 100
溶解度/克 13.3 31.6 63.9 110 169 246
A.0℃的硝酸钾饱和溶液一定比60℃的硝酸钾饱和溶液的溶质质量分数小
B.20℃时,100克水中溶解的硝酸钾越多溶解度就越大
C.40℃时,100克硝酸钾饱和溶液中含有硝酸钾63.9克
D.100℃的水能溶解的硝酸钾一定比80℃的水能溶解的硝酸钾多
4.浓度为10%的食盐溶液100克,将其浓度增加到20%,可采用的方法( )
A.加入20克食盐固体
B.把溶液中的水蒸发掉一半
C.加入200克30%的食盐溶液
D.把水蒸发掉50克
5.20℃时,在盛有100g水的甲、乙两个烧杯中,分别加入30克的A、B两种物质,充分搅拌后,现象如图所示,下列说法正确的是( )
A.烧杯甲中的溶液一定是不饱和溶液
B.烧杯乙中溶液质量是130克
C.烧杯甲中溶液降温过程中,溶液溶质质量分数可能不变
D.任何情况下,A物质的溶解度一定大于B物质
6.小柯在做制取硫酸铜晶体实验时,将硫酸铜粉末缓缓加入装有沸水的烧杯中,并不断搅拌直至形成饱和溶液,冷却至室温,可以看到大量蓝色晶体析出。在此过程中,下列分析正确的是( )
A.溶解度不变 B.溶液质量减小
C.溶质质量不变 D.溶质质量分数增大
7.20℃时,四个实验小组分别取不同质量的NaCl,逐渐加入到各盛有10克水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。记录数据如表。下列叙述正确的是( )
实验序号 水的质量(g) 加入氯化钠的质量(g) 剩余氯化钠的质量(g)
① 10 2 0
② 10 3 0
③ 10 4 0.4
④ 10 5 1.4
A.20℃时,10克NaCl饱和溶液中含有3.6克NaCl
B.相同温度下,NaCl在水里的溶解度与水的质量有关
C.第四组所得溶液的溶质与溶剂的质量比为9:25
D.20℃时,氯化钠的溶解度是36
8.硝酸钾和氢氧化钙在工农业上有广泛应用,其溶解度如表所示,下列说法正确的是( )
温度(℃) 0 20 40 60 80
硝酸钾溶解度(克) 13.3 31.6 63.9 110 169
氢氧化钙溶解度(克) 0.173 0.165 0.121 0.116 0.094
A.两种物质的溶解度都随温度升高而增大
B.20℃时的氢氧化钙饱和溶液降温至10℃,溶质质量分数增大
C.60℃时100g、110g、120g硝酸钾分别放入100g水中,溶质质量分数依次增大
D.80℃时100g饱和硝酸钾溶液中,溶质和溶剂的质量比为169:100
9.有一固体物质(不含结晶水)的溶液甲,在一定温度下经历如下变化( )
A.该温度下,固体物质的溶解度是30g
B.溶液丙再蒸发10g水,析出晶体质量一定大于3g
C.溶液乙一定是不饱和溶液
D.溶液乙和溶液丙中的溶质质量分数可能相等
10.科学实验可分为定性和定量实验,通过下列实验操作小阳同学不能达到相应目的是( )
A.配制蔗糖溶液 B.获取纯净水
C.获取氯化钠晶体 D.配制10%的食盐水
11.如图所示,向小试管中分别加入一定量X物质,能出现如图所示实验现象的X物质可能是( )
A.硝酸铵 B.蔗糖 C.食盐 D.氢氧化钠
12.在一定温度下,向一定量的食盐不饱和溶液中不断加入食盐固体并搅拌。在此过程溶液中溶质的质量分数(b)与加入食盐质量(a )的变化关系如下图所示,其中正确的是( )
A. B.
C. D.
13.下列因素与固体物质的溶解度有关的是( )
①溶质的多少 ②溶质的性质 ③溶剂的多少 ④溶剂的性质 ⑤溶液是否饱和 ⑥是否搅拌 ⑦温度.
A.全部 B.②④⑦ C.②④⑤⑦ D.②③④⑤⑥
14.如图所示为蒸发氯化钠溶液的实验,②中溶液恰好饱和。下列判断正确的是( )
A.在①→②过程中,氯化钠的质量分数保持不变
B.在②→③过程中,氯化钠的溶解度不断增大
C.在②→④过程中,氯化钠的质量分数先不变后增大
D.在③→④过程中,结晶的氯化钠质量一定变大
15.20℃时,某物质的饱和溶液中,溶质和溶液的质量比为2:7,则20℃时其溶解度为( )
A.28.6克 B.28.6% C.40克 D.40%
二.填空题(共11小题)
16.如图是甲、乙固体的溶解度曲线。甲、乙溶解度相等时的温度为 ℃;将a1℃时等质量甲、乙饱和溶液升温到a2℃,溶质的质量为甲 乙(填“大于”“小于”或“等于”); a2℃时,65g甲饱和溶液稀释到20%,需加水 g。
17.硝酸钾在不同温度下的溶解度如表:
温度/℃ 0 10 20 30 40 50
溶解度/g 13.3 20.9 31.6 45.8 63.9 85.8
(1)30℃时,把15.8g硝酸钾完全溶解在50g水中,所得硝酸钾溶液的质量分数为 ;判断是否是饱和溶液 (选填“是”或“否”)。
(2)一木块漂浮于50℃的硝酸钾饱和溶液中,木块排开液体的体积V排随时间t发生了如图所示的变化。由此推测出温度的改变方式是 (选填“升温”或“降温”)。
(3)如果在配制硝酸钾溶液的过程中出现以下情况,可能造成对所配溶液的溶质质量分数偏高的是: (填序号)。①所用硝酸钾药品不纯;②量取水时俯视读数;③配制完后将溶液转移至试剂瓶时洒出了一些。
18.在一定温度下,向100g水中依次加入一定质量的KCl固体,充分溶解.加入KCl的质量与得到相应溶液质量的关系如图所示.
(1)该温度下KCl的溶解度是 .
(2)实验①、②、③的溶液,溶质的质量分数分别表示为a、b、c,则它们之间的大小关系是 (用“>”“<”或“=”表示出来).
19.实验室有下列物质:①食盐水,②钡餐,③牛奶,④血液,⑤肥皂水,⑥泥水,⑦色拉油分散在水中,⑧色拉油分散在汽油中,⑨碘酒。
(1)请给上述物质归类(填序号):属于溶液的是 ,属于悬浊液的是 ,属于乳浊液的是 。
(2)它们都属于 。
20.某化学兴趣小组的同学做粗盐(含有难溶性杂质)提纯实验,用所得的精盐配制50g5%的氯化钠溶液。
实验一:如图是同学们做粗盐提纯实验的操作示意图。请回答下列问题:
(1)图中有一错误操作,请指出并改正 。
(2)操作③中用玻璃棒搅拌的作用是 。
(3)粗盐提纯的操作顺序为 (填操作序号)、称量精盐并计算产率。
(4)操作④中,当观察到 时,停止加热。
实验二:用提纯得到的精盐配制了50g5%的氯化钠溶液。经检测,溶质质量分数偏小,其原因可能有 (填序号)。
①氯化钠固体仍然不纯
②称量时所用砝码生锈(实际质量比所标要大)
③量取水时,仰视读数
④装瓶时,有少量溶液洒出
21.已知甲物质的溶解度与温度的关系如下表所示:
温度/℃ 10 20 30 40
溶解度/g 10.0 18.0 36.0 56.0
按如图步骤进行操作:
(1)在A﹣E的溶液中,属于不饱和溶液的是 (填序号,下同),与B溶液的溶质质量分数相同的是 。
(2)要使E中未溶的甲物质全部溶解,至少需要加入30℃的水 g。
22.向100g水中不断加入固体A或改变温度,得到相应的溶液①~⑤。
如表为A在不同温度下的溶解度,则在编号为①~⑤的溶液中(下列小题均填序号):
(1)属于饱和溶液的是溶液 。
(2)溶液的溶质质量分数从大到小的顺序是 。
温度/℃ 20 30 40 50 60
溶解度/g 37.2 41.4 45.8 50.4 55.2
23.20℃时,在盛有50g水的烧杯中加入15g固体X(不含杂质),充分溶解后,逐渐升温,并测定不同温度时析出固体X的质量。测定结果记录如表:
溶液的温度/℃ 20 35 50 65 75
析出固体X的质量/g 10.4 8.0 5.0 0 0
若不考虑水蒸发对实验的影响,请回答下列问题。
(1)35℃时,该溶液的质量是 g;
(2)65℃时,该溶液是 (选填编号);
Ⅰ.饱和溶液Ⅱ.不饱和溶液Ⅲ.无法判断
(3)根据下表溶解度与溶解性的关系,可知X属于 物质;
溶解性 易溶 可溶 微溶 难溶(或不溶)
溶解度(20℃) >10 1﹣10 0.01﹣1 <0.01
(4)50℃时,使烧杯中析出的5g固体X全部溶解,至少加入 g水。
三.实验探究题(共3小题)
24.如图所示是“探究浮力的大小跟哪些因素有关”的实验装置和过程,其中弹簧测力计所挂的是同一金属块。
(1)金属块浸没在水中时,受到的浮力是 N。
(2)分析 两图可知,浸在液体中的物体所受浮力大小跟液体密度有关。
(3)根据上述实验过程,可得戊图中盐水的密度是 kg/m3。如果在实验中不小心使戊图中的金属块接触了容器底且与容器底有力的作用,此时测量出的盐水密度值将 (填“变小”、“变大”或“不变”)。
25.氯化钠是生活必需品,也是重要的化工原料。下表是氯化钠和硝酸钾在不同温度时的溶解度,根据此表回答问题。
温度/℃ 20 30 40 50 60
溶解度/g 氯化钠 36.0 36.3 36.6 37.0 37.3
硝酸钾 31.6 45.8 63.9 85.5 110
(1)要把硝酸钾从含有少量氯化钠的溶液中提出,最好采用的方法是 。提纯含少量泥沙的粗盐,一般经过以下操作流程:
(2)在做过滤实验后,发现得到的滤液仍然浑浊,其可能的原因是 (写出一种)
(3)操作⑤的名称是 ,玻璃棒的作用是 。
(4)实验结束后称量获得的精盐,发现精盐含量较低,其可能原因是 (可多选)。
A.食盐没有全部溶解即过滤
B.蒸发时食盐飞溅剧烈
C.蒸发后,所得精盐有点潮湿
D.器皿上沾有的精盐没全部转移到称量纸上
26.如图是A、B、C(均不含结晶水)三种物质的溶解度曲线,请据图回答下列问题。
(1)在40℃时,A、B、C三种物质的溶解度由大到小的关系是 (物质间用“>”连接);
(2)将30℃的三种物质的饱和溶液冷却到20℃后,所得溶液中溶质的质量分数由小到大的关系是: (物质间用“<”连接);
(3)现有一定质量的B溶液,将该溶液在50℃下恒温蒸发40克水后析出了2克B晶体,再恒温蒸发5克水后,又析出了2克B晶体,则B物质在50℃时的溶解度是 。
四.计算题(共3小题)
27.医生给病人输液时,常用葡萄糖注射液。如图为葡萄糖注射液的部分标签图,根据图回答下列问题:
(1)从该溶液中取出10mL,则取出溶液中溶质的质量分数为 。
(2)某病人一天共输入该葡萄糖注射液1500mL,此病人这一天共补充葡萄糖 g。
(3)某铅酸蓄电池使用的酸溶液是溶质质量分数为20%的稀硫酸。若用100g质量分数为98%的浓硫酸配制该稀硫酸时,需要蒸馏水多少g(精确到0.1)(写出计算过程)。
28.(2022秋 温州月考)某同学在实验室进行有关浓硫酸的实验,观察到瓶上的标签如表所示。他从瓶中倒出200毫升用于配制稀硫酸。
浓硫酸(H2SO4)500毫升
溶质的质量分数 98%
密度 1.84克/厘米3
强腐蚀性,阴冷,密封储藏
(1)这200毫升浓硫酸的质量是 克,其中含溶质 克。
(2)欲配制1000克质量分数为20%的稀硫酸,需要多少克这种浓硫酸和多少克水?
29.(2022秋 杭州月考)舟山海鲜闻名全国,但是有一些不法商贩为了获取暴利,会用福尔马林浸泡海鲜,以延长其保鲜时间,这对食用者的健康有很大损害。查阅资料发现福尔马林是浓度为35%﹣40%的甲醛溶液。在医学上,常用来浸泡病理切片及生物标本,请根据要求回答下列问题:
(1)实验室中,如果要配制100g质量分数为40%的福尔马林溶液,需要甲醛的质量为多少?
(2)如果将该溶液稀释为35%的溶液,需要加入多少毫升的水?(结果保留一位小数)
30.(2022秋 拱墅区校级月考)某同学在实验室进行有关配制稀硫酸的实验时观察瓶上的标签,试分析并回答下列问题。
浓硫酸(H2SO4) 300mL 密度1.80g/cm3 质量分数98%
(1)这瓶浓硫酸溶液的质量为多少?
(2)这瓶浓硫酸含溶质硫酸的质量为多少?
(3)该同学利用这瓶浓硫酸欲配制溶质质量分数为 10%的稀硫酸 600 克,则他需要这种浓硫酸多少毫升?
一.选择题
1.C 2.B 3.A 4.D 5.C 6.B 7.C 8.D 9.D 10.B 11.D 12.C 13.B 14.D 15.C
二.填空题(共11小题)
16.(2022秋 西湖区校级月考)如图是甲、乙固体的溶解度曲线。甲、乙溶解度相等时的温度为 a1 ℃;将a1℃时等质量甲、乙饱和溶液升温到a2℃,溶质的质量为甲 等于 乙(填“大于”“小于”或“等于”); a2℃时,65g甲饱和溶液稀释到20%,需加水 10 g。
17.(1)24.0%;否。(2)降温。(3)②。
18.(2022秋 杭州月考)在一定温度下,向100g水中依次加入一定质量的KCl固体,充分溶解.加入KCl的质量与得到相应溶液质量的关系如图所示.
(1)该温度下KCl的溶解度是 40g .
(2)实验①、②、③的溶液,溶质的质量分数分别表示为a、b、c,则它们之间的大小关系是 b=c>a (用“>”“<”或“=”表示出来).
19.(2022秋 拱墅区校级月考)实验室有下列物质:①食盐水,②钡餐,③牛奶,④血液,⑤肥皂水,⑥泥水,⑦色拉油分散在水中,⑧色拉油分散在汽油中,⑨碘酒。
(1)请给上述物质归类(填序号):属于溶液的是 ①⑧⑨ ,属于悬浊液的是 ②④⑥ ,属于乳浊液的是 ③⑤⑦ 。
(2)它们都属于 混合物 。
20.(1)⑥中错误之处:没有利用玻璃棒引流;改正方法:利用玻璃棒引流。
(2)加快溶解速率。
(3)①⑤②③⑥④。
(4)出现较多固体。①③。
21.(2021秋 义乌市月考)已知甲物质的溶解度与温度的关系如下表所示:
温度/℃ 10 20 30 40
溶解度/g 10.0 18.0 36.0 56.0
按如图步骤进行操作:
(1)在A﹣E的溶液中,属于不饱和溶液的是 CD (填序号,下同),与B溶液的溶质质量分数相同的是 A 。
(2)要使E中未溶的甲物质全部溶解,至少需要加入30℃的水 50 g。
22.(1)②⑤;
(2)⑤=④>③>②>①。
23.(2022秋 拱墅区校级月考)20℃时,在盛有50g水的烧杯中加入15g固体X(不含杂质),充分溶解后,逐渐升温,并测定不同温度时析出固体X的质量。测定结果记录如表:
溶液的温度/℃ 20 35 50 65 75
析出固体X的质量/g 10.4 8.0 5.0 0 0
若不考虑水蒸发对实验的影响,请回答下列问题。
(1)35℃时,该溶液的质量是 57 g;
(2)65℃时,该溶液是 Ⅲ (选填编号);
Ⅰ.饱和溶液Ⅱ.不饱和溶液Ⅲ.无法判断
(3)根据下表溶解度与溶解性的关系,可知X属于 可溶 物质;
溶解性 易溶 可溶 微溶 难溶(或不溶)
溶解度(20℃) >10 1﹣10 0.01﹣1 <0.01
(4)50℃时,使烧杯中析出的5g固体X全部溶解,至少加入 25 g水。
三.实验探究题
24.(1)2;(2)丁、戊;(3)1.2×103;变大。
25.(1)冷却结晶;
(2)滤纸破损(合理即可);
(3)蒸发结晶;搅拌,防止局部温度过高,液体飞溅;
(4)ABD。
26.(1)A>B>C。(2)C<A<B。(3)40克。
四.计算题
27.(2022秋 西湖区校级月考)医生给病人输液时,常用葡萄糖注射液。如图为葡萄糖注射液的部分标签图,根据图回答下列问题:
(1)从该溶液中取出10mL,则取出溶液中溶质的质量分数为 5% 。
(2)某病人一天共输入该葡萄糖注射液1500mL,此病人这一天共补充葡萄糖 75 g。
(3)某铅酸蓄电池使用的酸溶液是溶质质量分数为20%的稀硫酸。若用100g质量分数为98%的浓硫酸配制该稀硫酸时,需要蒸馏水多少g(精确到0.1)(写出计算过程)。
28.(1)368;360.64;
(2)需要这种浓硫酸和水分别为204g和796g。
29.(1)40g;(2)14.3毫升。
30.(1)552;(2)540.96g;
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
- 第1章 水和水的溶液
- 第1节 地球上的水
- 第2节 水的组成
- 第3节 水的浮力
- 第4节 物质在水中的分散状况
- 第5节 物质的溶解
- 第6节 物质的分离
- 第7节 水资源的利用、开发和保护
- 第2章 天气与气候
- 第1节 大气层
- 第2节 气温
- 第3节 大气的压强
- 第4节 风和降水
- 第5节 天气预报
- 第6节 气候和影响气候的因素
- 第7节 我国的气候特征与主要气象灾害
- 第3章 生命活动的调节
- 第1节 植物生命活动的调节
- 第2节 人体的激素调节
- 第3节 神经调节
- 第4节 动物的行为
- 第5节 体温的控制
- 第4章 电路探秘
- 第1节 电荷与电流
- 第2节 电流的测量
- 第3节 物质的导电性与电阻
- 第4节 变阻器
- 第5节 电压的测量
- 第6节 电流与电压、电阻的关系
- 第7节 电路分析与应用
- 研究性学习课题
- 一 测定本地区的“酸雨”情况及分析原因
- 二 太阳黑子活动与本地区降水的关系
- 三 训练小动物建立某种条件反射
- 四 调查在自然界或生命活动中的电现象
