福建省泉州市第六中学2022-2023学年高二下学期期中模块考试化学试题(PDF版含答案)
文档属性
| 名称 | 福建省泉州市第六中学2022-2023学年高二下学期期中模块考试化学试题(PDF版含答案) |

|
|
| 格式 | |||
| 文件大小 | 491.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-19 19:36:20 | ||
图片预览



文档简介
泉州六中 2022-2023学年下学期高二年级化学科期中模块测试
考试时间:90 分钟
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请将答案正确填写在答题卡上
第 I卷(选择题)
相对原子质量 H1 C12 N 14 O 16 Na 23 Al 27 Ga 70
一、单选题(共 20题,共 40分)
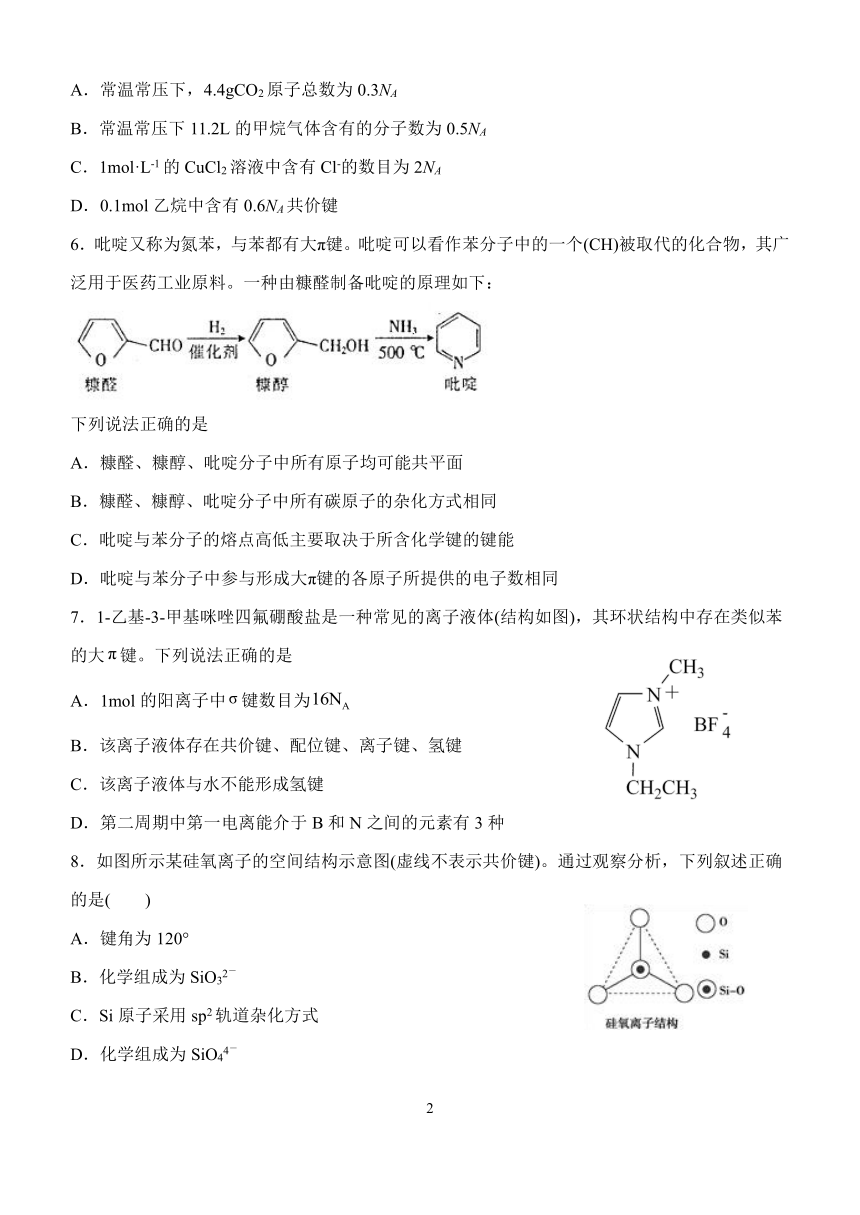
1.下列比较关系错误的是
A.原子半径: F O B.热稳定性: NH3 PH3
C.非金属性: N Si D.碱性: NaOH Mg(OH)2
2.下列有关化学用语不.正.确.的是
A.HCl分子的结构式H Cl B.CO2分子的电子式:
C.F- 37结构示意图: D.中子数为 20 的氯原子: 17 Cl
3.下列说法正确的是
A.在所有元素中,氟的第一电离能最大
B.金属离子的电荷越多、半径越大,金属晶体的硬度越高
C.石墨转化为金刚石既有共价键的断裂和生成,也有分子间作用力的破坏
D.基态铜原子的价电子排布图:
4.类比推理是化学中常用的思维方法,下列推理正确的是
A.氯化钠晶体的阳离子配位数是 6,推测氯化铯晶体的阳离子的配位数也是 6
B.金刚石是共价晶体,推测晶体硅也是共价晶体
C.CO2是直线型分子,推测 SiO2也是直线型分子
D.SiH4 的沸点高于 CH4,推测 HCl 的沸点高于 HF
5.设 NA为阿伏伽德罗常数的值。下列说法正确的是
1
{#{QQABbQKAogAAAAIAAQgCEQGwCEKQkAGACAoOxBAAIAAAARFABCA=}#}
A.常温常压下,4.4gCO2原子总数为 0.3NA
B.常温常压下 11.2L 的甲烷气体含有的分子数为 0.5NA
C.1mol·L-1 的 CuCl2 溶液中含有 Cl-的数目为 2NA
D.0.1mol 乙烷中含有 0.6NA共价键
6.吡啶又称为氮苯,与苯都有大π键。吡啶可以看作苯分子中的一个(CH)被取代的化合物,其广
泛用于医药工业原料。一种由糠醛制备吡啶的原理如下:
下列说法正确的是
A.糠醛、糠醇、吡啶分子中所有原子均可能共平面
B.糠醛、糠醇、吡啶分子中所有碳原子的杂化方式相同
C.吡啶与苯分子的熔点高低主要取决于所含化学键的键能
D.吡啶与苯分子中参与形成大π键的各原子所提供的电子数相同
7.1-乙基-3-甲基咪唑四氟硼酸盐是一种常见的离子液体(结构如图),其环状结构中存在类似苯
的大 π键。下列说法正确的是
A.1mol 的阳离子中σ 键数目为16NA
B.该离子液体存在共价键、配位键、离子键、氢键
C.该离子液体与水不能形成氢键
D.第二周期中第一电离能介于 B 和 N 之间的元素有 3 种
8.如图所示某硅氧离子的空间结构示意图(虚线不表示共价键)。通过观察分析,下列叙述正确
的是( )
A.键角为 120°
B.化学组成为 SiO 2-3
C.Si 原子采用 sp2轨道杂化方式
D -.化学组成为 SiO44
2
{#{QQABbQKAogAAAAIAAQgCEQGwCEKQkAGACAoOxBAAIAAAARFABCA=}#}
9.已知:①Cu2O 的晶胞如下图所示:②Cu2O 固体溶于稀硫酸,能得到 CuSO4 溶液和一种紫红
色单质;③向 CuSO4溶液中加入一定量 NaOH 溶液,能得到一种浅蓝绿色沉淀,该沉淀能溶于
氨水。下列说法不.正确的是
A.一个 Cu2O 晶胞中,Cu 原子的数目为 4
B.②中的反应为Cu2O H2SO4 =CuSO4 Cu H2O
C.③中的浅蓝绿色沉淀为 CuOH
D.③中沉淀溶解是因为生成了铜氨配合物
10. NaAlH4 晶胞结构如图所示,它由两个正六面体叠加而成,已知正六面体的棱长 a nm。下列
说法错误的是
A. NaAlH 4 晶体中,与AlH 4 紧邻且等距的 Na 有 8 个
N 1.08 10
23
B.设阿伏伽德罗常数的值为 A ,则晶体的密度为 3 g cm
-3
a NA
C.制备 NaAlH4 的反应选择在乙醚( CH3CH2OCH2CH3 )中进行,也
可以在水中进行
D.AlH 4 的空间构型为正四面体形
11.氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性能,其结构如图所示。下列叙述不正
确的是
A.氮化铝晶体中距离铝原子最近且距离相等的氨原子数目为 4
B.由于 AlN 中共价键键长比立方 BN 中的共价键键长长,所以
熔、沸点 AlN 比 BN 低
C.AlN 中 Al 杂化方式为 sp2,N 杂化方式为 sp3
D.氮化铝晶体中含有配位键
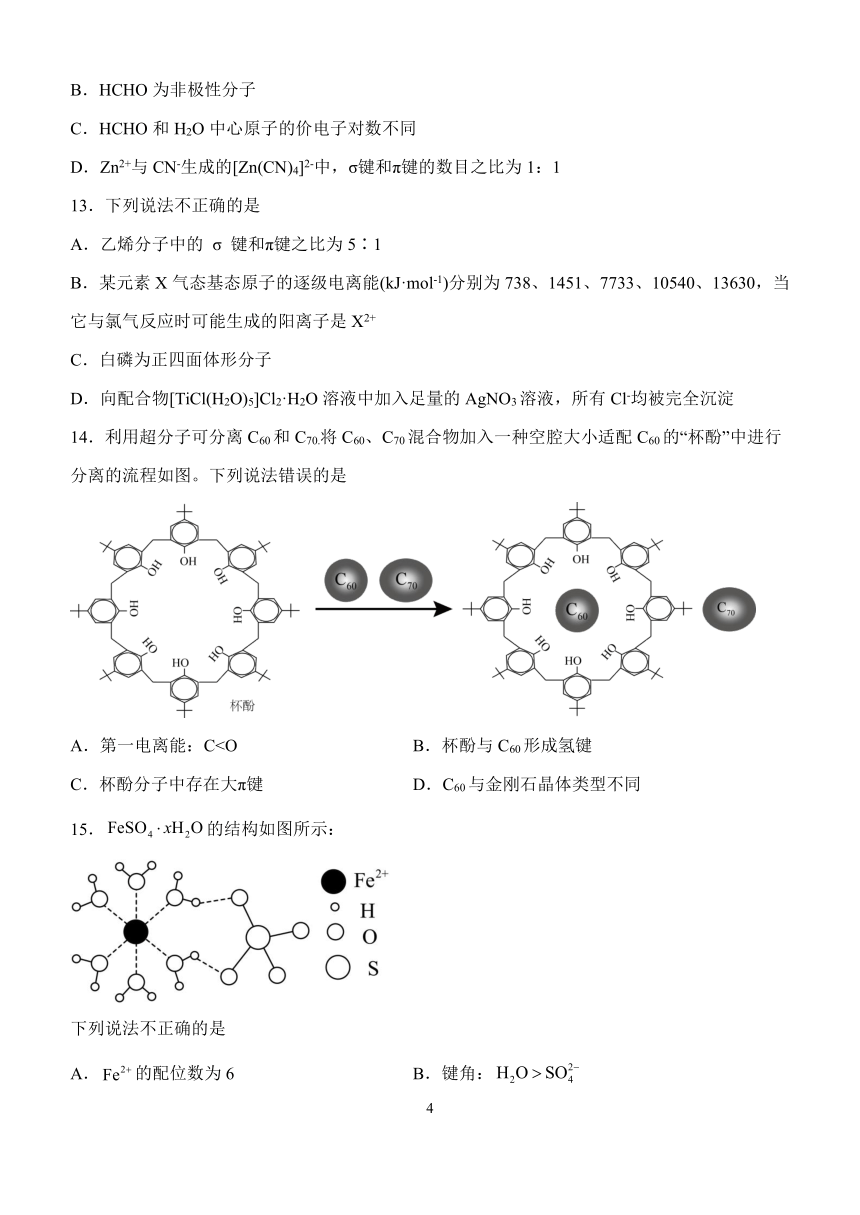
12.HCHO 与[Zn(CN)4]2-在水溶液中发生反应:
4HCHO+[Zn(CN)4]2-+4H++4H2O=[Zn(H2O)4]2-+4HOCH2CN,下列说法错误的是
A.反应中 HCHO 发生了加成反应
3
{#{QQABbQKAogAAAAIAAQgCEQGwCEKQkAGACAoOxBAAIAAAARFABCA=}#}
B.HCHO 为非极性分子
C.HCHO 和 H2O 中心原子的价电子对数不同
D.Zn2+与 CN-生成的[Zn(CN)4]2-中,σ键和π键的数目之比为 1:1
13.下列说法不正确的是
A.乙烯分子中的 σ 键和π键之比为 5∶1
B.某元素 X 气态基态原子的逐级电离能(kJ·mol-1)分别为 738、1451、7733、10540、13630,当
它与氯气反应时可能生成的阳离子是 X2+
C.白磷为正四面体形分子
D.向配合物[TiCl(H2O)5]Cl2·H2O 溶液中加入足量的 AgNO3溶液,所有 Cl-均被完全沉淀
14.利用超分子可分离 C60和 C70.将 C60、C70混合物加入一种空腔大小适配 C60的“杯酚”中进行
分离的流程如图。下列说法错误的是
A.第一电离能:CC.杯酚分子中存在大π键 D.C60与金刚石晶体类型不同
15.FeSO4 xH2O 的结构如图所示:
下列说法不正确的是
A Fe2 6 B H O SO2 . 的配位数为 .键角: 2 4
4
{#{QQABbQKAogAAAAIAAQgCEQGwCEKQkAGACAoOxBAAIAAAARFABCA=}#}
C.H2O与SO2 4 之间形成了氢键 D.SO2 4 中心原子价层电子对数为 4
16.冠醚是一种超分子,它能否适配碱金属离子与其空腔直径和离子直径有关。二苯并-18-冠-6
与K 形成的鳖合离子的结构如图所示。下列说法错误的是
A.冠醚可以用来识别碱金属离子 B.二苯并-18-冠-6 也能适配Li
C.该冠醚分子中碳原子杂化方式有 2 种 D.一个鳌合离子中配位键的数目为 6
17.把 CoCl2 溶于水后加氨水先生成的 Co(OH)2 沉淀后溶解,再加氨水,生成了[Co(NH3)6]Cl2,
此时向溶液中通入空气,得到的产物中有一种其组成可以用 CoCl3·5NH3表示,Co 的配位数是 6,
把分离出的 CoCl3·5NH3 溶于水后立即加硝酸银溶液,则析出氯化银沉淀。经测定,每
1molCoCl3·5NH3只生成 2molAgCl。下列说法错误的是
A.[Co(NH3)6]Cl2中心离子的价电子排布式为 3d6
B.通入空气后得到的溶液中含有[Co(NH3)5Cl]2+
C.产物中 CoCl3·5NH3 的配位体为氨分子和氯离子
D.[Co(NH3)6]Cl2中含有配位键、极性共价键、离子键,1mol 该物质含有 24molσ键
18.X、Y、Z 和 W 为原子序数依次增大的四种短周期主族元素。X 的一种核素可用于测定文物
的年代,基态 Y 原子的电子总数是其最高能级电子数的 2 倍,Z 是短周期中金属性最强的元素,
W 的单质为黄绿色气体。下列说法正确的是
A.第一电离能:W>X>Y>Z B.原子半径:r(Z)>r(W)>r(Y)>r(X)
C.Z 可与 Y 形成化合物 Z2Y2 D.X 的氢化物中不存在非极性共价键
19.某多孔储氢材料前驱体结构如图,M、W、X、Y、Z 五种短周期元素的原子序数依次增大,
基态 Z 原子的电子填充了 3 个能级,其中有 2 个未成对电子。下列叙述错误的是
5
{#{QQABbQKAogAAAAIAAQgCEQGwCEKQkAGACAoOxBAAIAAAARFABCA=}#}
A.简单氢化物的沸点:X>Y
B.该化合物阴、阳离子中均有配位键
C.第一电离能:Y>Z>X>W
D.该化合物中 Z 元素的杂化方式为 sp3
20.短周期元素 R、X、Y、Z 的原子核外 L 层上的电子数之和为 32,它们的最高价氧化物分别
与水反应可得四种溶液,浓度均为 0.01mol L 1的上述四种溶液的 pH 与对应元素原子半径的关系
如图所示。(Y 元素最高价氧化物对应的水化物的 pH 值为 2)下列说法错误的是
A.X、Y 形成的化合物均满足 8 电子结构
B.R 元素与氢元素形成的化合物具有强还原性
C.Z、R 组成的化合物R 2Z8 中,含有离子键和非极性共价键
D.简单气态氢化物的热稳定性:Y>Z>X
6
{#{QQABbQKAogAAAAIAAQgCEQGwCEKQkAGACAoOxBAAIAAAARFABCA=}#}
第 II卷(非选择题)
二、填空题(共 5题,共 60分)
21.(10 分)I. 2020 年 12 月 17 日,我国“嫦娥五号”返回器携月壤成功着陆。研究发现,月壤中
存在天然的铁、金、银、铅、锌、铜、锑、铼等矿物颗粒。
(1)第四周期的元素原子中最外层电子数与铜原子的相同的元素有___________(填元素符号)。
(2) Fe 在周期表中位于___________周期___________族,属于___________区。
II. (3)s 轨道呈___________形,每个 s 能级有___________个原子轨道;p 轨道呈___________形,
每个 p 能级有___________个原子轨道。
(4) 基态铝原子核外共有___________种不同能级的电子,有___________种不同运动状态的电子。
22.(12 分)H5O2Ge(BH4)3是钙钛矿型化合物(ABX3 型),量子化学计算结果显示,其具有良好
的光电化学性能。请回答下列问题:
(1)基态 Ge 的价电子轨道表示式___________。
(2) -根据杂化轨道理论,BH4 由 B 的 4 个___________(填杂化轨道类型)杂化轨道与 4 个 H 的 1s
-
轨道重叠而成,请画出BH4 的结构式___________。
(3)CsPbI3是 H5O2Ge(BH4)3的量子化学计算模型,CsPbI3 的晶体结构如图所示:
1
①原子 1 的坐标为( ,0,0),则原子 2 和 3 的坐标分别为___________、___________。
2
②I-位于该晶体晶胞的___________(填“棱心”、“体心”或“顶角”)。
23.(14 分)A、B、C、D、E、F、G、H 是元素周期表前四周期常见元素,且原子序数依次增
大,相关信息如下表:
7
{#{QQABbQKAogAAAAIAAQgCEQGwCEKQkAGACAoOxBAAIAAAARFABCA=}#}
元素 元素相关信息
A 原子核外有 6 种不同运动状态的电子
C 基态原子中 s 电子总数与 p 电子总数相等
D 原子半径在同周期元素中最大
E 2 1基态原子最外层电子排布式为3s 3p
F 基态原子的最外层 p 轨道有两个电子的自旋方向与其他电子的自旋方向相反
G 基态原子核外有 7 个能级且能量最高的能级上有 6 个电子
H 是我国使用最早的合金中的最主要元素
请用化学用语填空:
(1)A 元素在元素周期表中的位置_______;C 元素和 F 元素的电负性比较,较小的是_______(填
元素符号)。
(2)B 元素与宇宙中含量最丰富的元素形成的最简单化合物的分子构型为_______,B 元素所形成
的单质分子中σ键与π键数目之比为_______。
(3)F 元素原子的价电子排布式是_______;G 的高价阳离子的溶液与 H 单质反应的离子方程式为
_______;元素 X 与元素 E 在周期表中呈对角线关系,且元素 X 的最高价氧化物的水化物也具有
两性。试写出 X 元素的最高价氧化物的水化物与 D 元素的最高价氧化物的水化物反应的化学方
程式_______。
24.(16 分)氮化镓(GaN)材料是第三代半导体的代表,通常以 GaCl3为镓源,NH3为氮源制备,
具有出色的抗击穿能力,能耐受更高的电子密度。
(1)Ga -、N 和 O 的第一电离能由小到大的顺序为___________,NO 3的空间构型为___________,
与其互为等电子体的分子有___________(任写一种)
(2)GaCl3 熔点为 77.9℃,气体在 270℃左右以二聚物存在,GaF3熔点 1000℃,GaCl3 二聚体的结
8
{#{QQABbQKAogAAAAIAAQgCEQGwCEKQkAGACAoOxBAAIAAAARFABCA=}#}
构式为___________,其熔点低于 GaF3的原因为___________。
(3)与镓同主族的 B 具有缺电子性,硼砂(四硼酸钠 Na2B4O7·10H2O) 2-中 B4O 7 是由两个 H3BO3和两
个[B(OH)4]-缩合而成的双六元环,应写成[B4O5(OH)4]2-的形式,结构如图所示,则该离子内部存
在的作用力有___________,B 原子的杂化方式为___________。
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢 F.配位键
(4)氮化镓的晶胞如上图所示,Ga 原子与 N 原子半径分别为 a pm 和 b pm,阿伏加德罗常数的值
为 NA,晶胞密度为 c g/cm3,则该晶胞的空间利用率为___________(已知空间利用率为晶胞内原
子体积占晶胞体积的百分比)。
25.(8 分)回答下列问题:
(1)利用价层电子对互斥模型推测分子或离子的空间结构。
ClO 4 ;___________;AlBr3 (共价分子):___________。
(2)有两种活性反应中间体,它们的粒子中均含有 1 个碳原子和 3 个氢原子。请依据下面给出的
这两种粒子的结构,写出相应的化学式。
; 。
9
{#{QQABbQKAogAAAAIAAQgCEQGwCEKQkAGACAoOxBAAIAAAARFABCA=}#}
参考答案:
1.A 2.C 3.C 4.B 5.A 6.D 7.D 8.D 9.C 10.C
11.C 12.B 13.D 14.B 15.B 16.B 17.A 18.C 19.A 20.A
21. (1)K、Cr (2) 4 VⅢ d (3)球 1 哑铃 3 (4) 5 13
22.(1) (2) sp3
1 1
(3)(0,0, ) ( ,1,1) 棱心
2 2
23.(1) 第 2 周期 IVA 族 Cl
(2) 三角锥形 1∶2
(3) 3s23p5 2Fe3+ +Cu=2Fe2+ +Cu2+ Be OH +2NaOH=Na 2BeO 2+2H 2O2
24.(1) Ga(2) GaCl3 为分子晶体,熔化时破坏分子间作用力,GaF3 为离子晶
体,熔化时破坏离子键,离子键强于分子间无偶用力,所以 GaCl3的熔点低于 GaF3
(3) B、F sp2、sp3
4
π(a3+b3 -30(4) ) 10 cN3 A ×100%
(70+14)
25.(1) 正四面体形 平面三角形
(2) CH+ -3 CH3
10
{#{QQABbQKAogAAAAIAAQgCEQGwCEKQkAGACAoOxBAAIAAAARFABCA=}#}
考试时间:90 分钟
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请将答案正确填写在答题卡上
第 I卷(选择题)
相对原子质量 H1 C12 N 14 O 16 Na 23 Al 27 Ga 70
一、单选题(共 20题,共 40分)
1.下列比较关系错误的是
A.原子半径: F O B.热稳定性: NH3 PH3
C.非金属性: N Si D.碱性: NaOH Mg(OH)2
2.下列有关化学用语不.正.确.的是
A.HCl分子的结构式H Cl B.CO2分子的电子式:
C.F- 37结构示意图: D.中子数为 20 的氯原子: 17 Cl
3.下列说法正确的是
A.在所有元素中,氟的第一电离能最大
B.金属离子的电荷越多、半径越大,金属晶体的硬度越高
C.石墨转化为金刚石既有共价键的断裂和生成,也有分子间作用力的破坏
D.基态铜原子的价电子排布图:
4.类比推理是化学中常用的思维方法,下列推理正确的是
A.氯化钠晶体的阳离子配位数是 6,推测氯化铯晶体的阳离子的配位数也是 6
B.金刚石是共价晶体,推测晶体硅也是共价晶体
C.CO2是直线型分子,推测 SiO2也是直线型分子
D.SiH4 的沸点高于 CH4,推测 HCl 的沸点高于 HF
5.设 NA为阿伏伽德罗常数的值。下列说法正确的是
1
{#{QQABbQKAogAAAAIAAQgCEQGwCEKQkAGACAoOxBAAIAAAARFABCA=}#}
A.常温常压下,4.4gCO2原子总数为 0.3NA
B.常温常压下 11.2L 的甲烷气体含有的分子数为 0.5NA
C.1mol·L-1 的 CuCl2 溶液中含有 Cl-的数目为 2NA
D.0.1mol 乙烷中含有 0.6NA共价键
6.吡啶又称为氮苯,与苯都有大π键。吡啶可以看作苯分子中的一个(CH)被取代的化合物,其广
泛用于医药工业原料。一种由糠醛制备吡啶的原理如下:
下列说法正确的是
A.糠醛、糠醇、吡啶分子中所有原子均可能共平面
B.糠醛、糠醇、吡啶分子中所有碳原子的杂化方式相同
C.吡啶与苯分子的熔点高低主要取决于所含化学键的键能
D.吡啶与苯分子中参与形成大π键的各原子所提供的电子数相同
7.1-乙基-3-甲基咪唑四氟硼酸盐是一种常见的离子液体(结构如图),其环状结构中存在类似苯
的大 π键。下列说法正确的是
A.1mol 的阳离子中σ 键数目为16NA
B.该离子液体存在共价键、配位键、离子键、氢键
C.该离子液体与水不能形成氢键
D.第二周期中第一电离能介于 B 和 N 之间的元素有 3 种
8.如图所示某硅氧离子的空间结构示意图(虚线不表示共价键)。通过观察分析,下列叙述正确
的是( )
A.键角为 120°
B.化学组成为 SiO 2-3
C.Si 原子采用 sp2轨道杂化方式
D -.化学组成为 SiO44
2
{#{QQABbQKAogAAAAIAAQgCEQGwCEKQkAGACAoOxBAAIAAAARFABCA=}#}
9.已知:①Cu2O 的晶胞如下图所示:②Cu2O 固体溶于稀硫酸,能得到 CuSO4 溶液和一种紫红
色单质;③向 CuSO4溶液中加入一定量 NaOH 溶液,能得到一种浅蓝绿色沉淀,该沉淀能溶于
氨水。下列说法不.正确的是
A.一个 Cu2O 晶胞中,Cu 原子的数目为 4
B.②中的反应为Cu2O H2SO4 =CuSO4 Cu H2O
C.③中的浅蓝绿色沉淀为 CuOH
D.③中沉淀溶解是因为生成了铜氨配合物
10. NaAlH4 晶胞结构如图所示,它由两个正六面体叠加而成,已知正六面体的棱长 a nm。下列
说法错误的是
A. NaAlH 4 晶体中,与AlH 4 紧邻且等距的 Na 有 8 个
N 1.08 10
23
B.设阿伏伽德罗常数的值为 A ,则晶体的密度为 3 g cm
-3
a NA
C.制备 NaAlH4 的反应选择在乙醚( CH3CH2OCH2CH3 )中进行,也
可以在水中进行
D.AlH 4 的空间构型为正四面体形
11.氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性能,其结构如图所示。下列叙述不正
确的是
A.氮化铝晶体中距离铝原子最近且距离相等的氨原子数目为 4
B.由于 AlN 中共价键键长比立方 BN 中的共价键键长长,所以
熔、沸点 AlN 比 BN 低
C.AlN 中 Al 杂化方式为 sp2,N 杂化方式为 sp3
D.氮化铝晶体中含有配位键
12.HCHO 与[Zn(CN)4]2-在水溶液中发生反应:
4HCHO+[Zn(CN)4]2-+4H++4H2O=[Zn(H2O)4]2-+4HOCH2CN,下列说法错误的是
A.反应中 HCHO 发生了加成反应
3
{#{QQABbQKAogAAAAIAAQgCEQGwCEKQkAGACAoOxBAAIAAAARFABCA=}#}
B.HCHO 为非极性分子
C.HCHO 和 H2O 中心原子的价电子对数不同
D.Zn2+与 CN-生成的[Zn(CN)4]2-中,σ键和π键的数目之比为 1:1
13.下列说法不正确的是
A.乙烯分子中的 σ 键和π键之比为 5∶1
B.某元素 X 气态基态原子的逐级电离能(kJ·mol-1)分别为 738、1451、7733、10540、13630,当
它与氯气反应时可能生成的阳离子是 X2+
C.白磷为正四面体形分子
D.向配合物[TiCl(H2O)5]Cl2·H2O 溶液中加入足量的 AgNO3溶液,所有 Cl-均被完全沉淀
14.利用超分子可分离 C60和 C70.将 C60、C70混合物加入一种空腔大小适配 C60的“杯酚”中进行
分离的流程如图。下列说法错误的是
A.第一电离能:C
15.FeSO4 xH2O 的结构如图所示:
下列说法不正确的是
A Fe2 6 B H O SO2 . 的配位数为 .键角: 2 4
4
{#{QQABbQKAogAAAAIAAQgCEQGwCEKQkAGACAoOxBAAIAAAARFABCA=}#}
C.H2O与SO2 4 之间形成了氢键 D.SO2 4 中心原子价层电子对数为 4
16.冠醚是一种超分子,它能否适配碱金属离子与其空腔直径和离子直径有关。二苯并-18-冠-6
与K 形成的鳖合离子的结构如图所示。下列说法错误的是
A.冠醚可以用来识别碱金属离子 B.二苯并-18-冠-6 也能适配Li
C.该冠醚分子中碳原子杂化方式有 2 种 D.一个鳌合离子中配位键的数目为 6
17.把 CoCl2 溶于水后加氨水先生成的 Co(OH)2 沉淀后溶解,再加氨水,生成了[Co(NH3)6]Cl2,
此时向溶液中通入空气,得到的产物中有一种其组成可以用 CoCl3·5NH3表示,Co 的配位数是 6,
把分离出的 CoCl3·5NH3 溶于水后立即加硝酸银溶液,则析出氯化银沉淀。经测定,每
1molCoCl3·5NH3只生成 2molAgCl。下列说法错误的是
A.[Co(NH3)6]Cl2中心离子的价电子排布式为 3d6
B.通入空气后得到的溶液中含有[Co(NH3)5Cl]2+
C.产物中 CoCl3·5NH3 的配位体为氨分子和氯离子
D.[Co(NH3)6]Cl2中含有配位键、极性共价键、离子键,1mol 该物质含有 24molσ键
18.X、Y、Z 和 W 为原子序数依次增大的四种短周期主族元素。X 的一种核素可用于测定文物
的年代,基态 Y 原子的电子总数是其最高能级电子数的 2 倍,Z 是短周期中金属性最强的元素,
W 的单质为黄绿色气体。下列说法正确的是
A.第一电离能:W>X>Y>Z B.原子半径:r(Z)>r(W)>r(Y)>r(X)
C.Z 可与 Y 形成化合物 Z2Y2 D.X 的氢化物中不存在非极性共价键
19.某多孔储氢材料前驱体结构如图,M、W、X、Y、Z 五种短周期元素的原子序数依次增大,
基态 Z 原子的电子填充了 3 个能级,其中有 2 个未成对电子。下列叙述错误的是
5
{#{QQABbQKAogAAAAIAAQgCEQGwCEKQkAGACAoOxBAAIAAAARFABCA=}#}
A.简单氢化物的沸点:X>Y
B.该化合物阴、阳离子中均有配位键
C.第一电离能:Y>Z>X>W
D.该化合物中 Z 元素的杂化方式为 sp3
20.短周期元素 R、X、Y、Z 的原子核外 L 层上的电子数之和为 32,它们的最高价氧化物分别
与水反应可得四种溶液,浓度均为 0.01mol L 1的上述四种溶液的 pH 与对应元素原子半径的关系
如图所示。(Y 元素最高价氧化物对应的水化物的 pH 值为 2)下列说法错误的是
A.X、Y 形成的化合物均满足 8 电子结构
B.R 元素与氢元素形成的化合物具有强还原性
C.Z、R 组成的化合物R 2Z8 中,含有离子键和非极性共价键
D.简单气态氢化物的热稳定性:Y>Z>X
6
{#{QQABbQKAogAAAAIAAQgCEQGwCEKQkAGACAoOxBAAIAAAARFABCA=}#}
第 II卷(非选择题)
二、填空题(共 5题,共 60分)
21.(10 分)I. 2020 年 12 月 17 日,我国“嫦娥五号”返回器携月壤成功着陆。研究发现,月壤中
存在天然的铁、金、银、铅、锌、铜、锑、铼等矿物颗粒。
(1)第四周期的元素原子中最外层电子数与铜原子的相同的元素有___________(填元素符号)。
(2) Fe 在周期表中位于___________周期___________族,属于___________区。
II. (3)s 轨道呈___________形,每个 s 能级有___________个原子轨道;p 轨道呈___________形,
每个 p 能级有___________个原子轨道。
(4) 基态铝原子核外共有___________种不同能级的电子,有___________种不同运动状态的电子。
22.(12 分)H5O2Ge(BH4)3是钙钛矿型化合物(ABX3 型),量子化学计算结果显示,其具有良好
的光电化学性能。请回答下列问题:
(1)基态 Ge 的价电子轨道表示式___________。
(2) -根据杂化轨道理论,BH4 由 B 的 4 个___________(填杂化轨道类型)杂化轨道与 4 个 H 的 1s
-
轨道重叠而成,请画出BH4 的结构式___________。
(3)CsPbI3是 H5O2Ge(BH4)3的量子化学计算模型,CsPbI3 的晶体结构如图所示:
1
①原子 1 的坐标为( ,0,0),则原子 2 和 3 的坐标分别为___________、___________。
2
②I-位于该晶体晶胞的___________(填“棱心”、“体心”或“顶角”)。
23.(14 分)A、B、C、D、E、F、G、H 是元素周期表前四周期常见元素,且原子序数依次增
大,相关信息如下表:
7
{#{QQABbQKAogAAAAIAAQgCEQGwCEKQkAGACAoOxBAAIAAAARFABCA=}#}
元素 元素相关信息
A 原子核外有 6 种不同运动状态的电子
C 基态原子中 s 电子总数与 p 电子总数相等
D 原子半径在同周期元素中最大
E 2 1基态原子最外层电子排布式为3s 3p
F 基态原子的最外层 p 轨道有两个电子的自旋方向与其他电子的自旋方向相反
G 基态原子核外有 7 个能级且能量最高的能级上有 6 个电子
H 是我国使用最早的合金中的最主要元素
请用化学用语填空:
(1)A 元素在元素周期表中的位置_______;C 元素和 F 元素的电负性比较,较小的是_______(填
元素符号)。
(2)B 元素与宇宙中含量最丰富的元素形成的最简单化合物的分子构型为_______,B 元素所形成
的单质分子中σ键与π键数目之比为_______。
(3)F 元素原子的价电子排布式是_______;G 的高价阳离子的溶液与 H 单质反应的离子方程式为
_______;元素 X 与元素 E 在周期表中呈对角线关系,且元素 X 的最高价氧化物的水化物也具有
两性。试写出 X 元素的最高价氧化物的水化物与 D 元素的最高价氧化物的水化物反应的化学方
程式_______。
24.(16 分)氮化镓(GaN)材料是第三代半导体的代表,通常以 GaCl3为镓源,NH3为氮源制备,
具有出色的抗击穿能力,能耐受更高的电子密度。
(1)Ga -、N 和 O 的第一电离能由小到大的顺序为___________,NO 3的空间构型为___________,
与其互为等电子体的分子有___________(任写一种)
(2)GaCl3 熔点为 77.9℃,气体在 270℃左右以二聚物存在,GaF3熔点 1000℃,GaCl3 二聚体的结
8
{#{QQABbQKAogAAAAIAAQgCEQGwCEKQkAGACAoOxBAAIAAAARFABCA=}#}
构式为___________,其熔点低于 GaF3的原因为___________。
(3)与镓同主族的 B 具有缺电子性,硼砂(四硼酸钠 Na2B4O7·10H2O) 2-中 B4O 7 是由两个 H3BO3和两
个[B(OH)4]-缩合而成的双六元环,应写成[B4O5(OH)4]2-的形式,结构如图所示,则该离子内部存
在的作用力有___________,B 原子的杂化方式为___________。
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢 F.配位键
(4)氮化镓的晶胞如上图所示,Ga 原子与 N 原子半径分别为 a pm 和 b pm,阿伏加德罗常数的值
为 NA,晶胞密度为 c g/cm3,则该晶胞的空间利用率为___________(已知空间利用率为晶胞内原
子体积占晶胞体积的百分比)。
25.(8 分)回答下列问题:
(1)利用价层电子对互斥模型推测分子或离子的空间结构。
ClO 4 ;___________;AlBr3 (共价分子):___________。
(2)有两种活性反应中间体,它们的粒子中均含有 1 个碳原子和 3 个氢原子。请依据下面给出的
这两种粒子的结构,写出相应的化学式。
; 。
9
{#{QQABbQKAogAAAAIAAQgCEQGwCEKQkAGACAoOxBAAIAAAARFABCA=}#}
参考答案:
1.A 2.C 3.C 4.B 5.A 6.D 7.D 8.D 9.C 10.C
11.C 12.B 13.D 14.B 15.B 16.B 17.A 18.C 19.A 20.A
21. (1)K、Cr (2) 4 VⅢ d (3)球 1 哑铃 3 (4) 5 13
22.(1) (2) sp3
1 1
(3)(0,0, ) ( ,1,1) 棱心
2 2
23.(1) 第 2 周期 IVA 族 Cl
(2) 三角锥形 1∶2
(3) 3s23p5 2Fe3+ +Cu=2Fe2+ +Cu2+ Be OH +2NaOH=Na 2BeO 2+2H 2O2
24.(1) Ga
体,熔化时破坏离子键,离子键强于分子间无偶用力,所以 GaCl3的熔点低于 GaF3
(3) B、F sp2、sp3
4
π(a3+b3 -30(4) ) 10 cN3 A ×100%
(70+14)
25.(1) 正四面体形 平面三角形
(2) CH+ -3 CH3
10
{#{QQABbQKAogAAAAIAAQgCEQGwCEKQkAGACAoOxBAAIAAAARFABCA=}#}
同课章节目录
