1.1.2构造原理泡利原理原子核外电子排布(人教版2019选择性必修2)(共62张PPT)
文档属性
| 名称 | 1.1.2构造原理泡利原理原子核外电子排布(人教版2019选择性必修2)(共62张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 14.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-20 08:44:02 | ||
图片预览








文档简介
(共62张PPT)
对于不屈不挠的人来说,没有失败这回事。
——俾斯麦
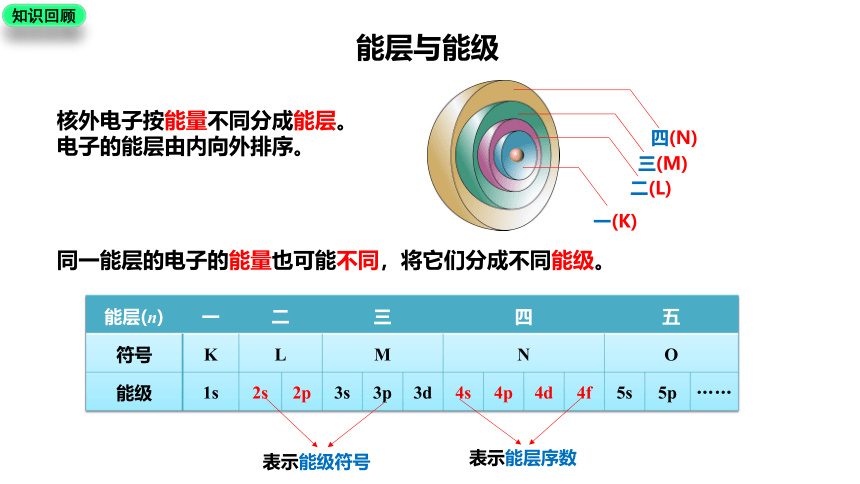
能层与能级
一(K)
二(L)
三(M)
四(N)
核外电子按能量不同分成能层。电子的能层由内向外排序。
同一能层的电子的能量也可能不同,将它们分成不同能级。
能层(n) 一 二 三 四 五
符号 K L M N O
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p ……
知识回顾
表示能级符号
表示能层序数
下列有关原子轨道和电子云的说法正确的是
A. s轨道呈球形,随电子层数的增加,s轨道数也增加
B. p轨道呈哑铃形,p轨道电子绕核做“∞”形运动
C. 电子云是笼罩在原子核外的云雾
D. 电子云图中小点的疏密程度表示电子在原子核外空间出现概 率的大小
考考你自己
第三电子层含有的轨道数为
A.3
B.5
C.7
D.9
考考你自己
基态原子是处于最低能量状态的原子。
电子如何填入核外的不同能级以保证原子处于基态呢?
问题解决
有可遵循的填入顺序吗?
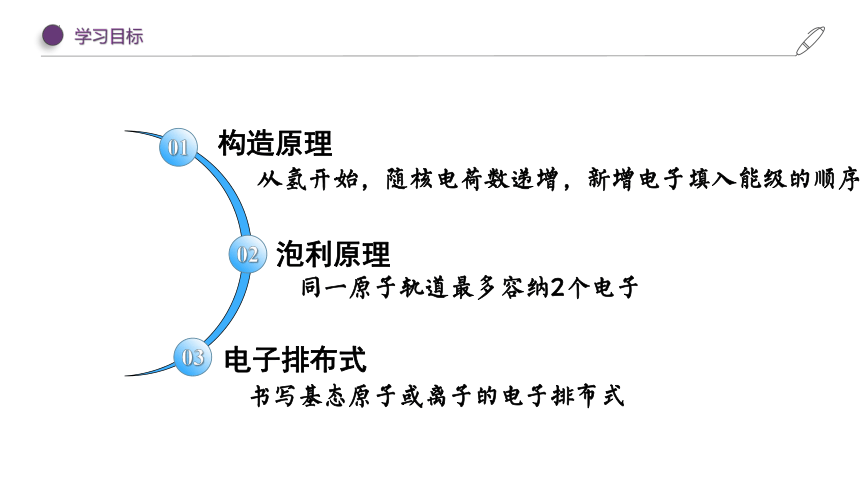
构造原理 泡利原理 电子排布式
学习目标
01
02
03
构造原理
泡利原理
电子排布式
从氢开始,随核电荷数递增,新增电子填入能级的顺序
同一原子轨道最多容纳2个电子
书写基态原子或离子的电子排布式
问题探究
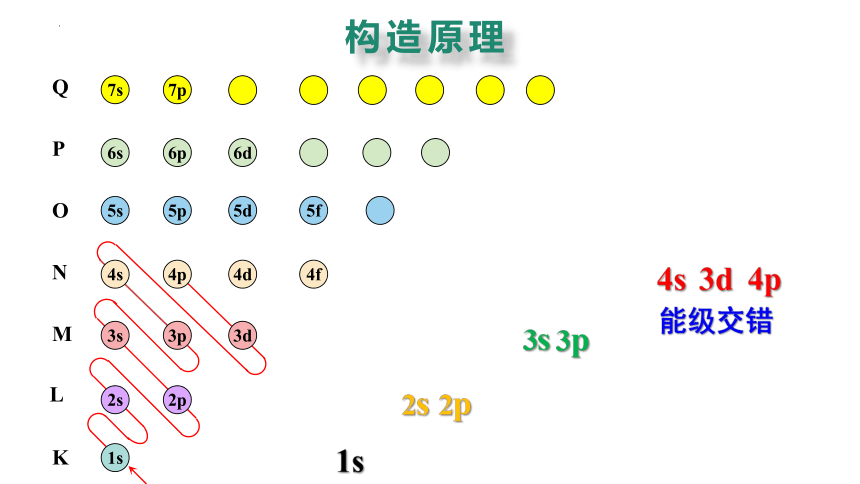
电子是怎样进入各能层和能级的?
1936 年,德国科学家马德隆发表了以原子光谱事实为依据的完整的构造原理。
从氢开始,随核电荷数递增,新增电子填入能级的顺序
K
1s
L
2s
2p
M
3s
3p
3d
N
4s
4p
4d
4f
O
5s
5p
5d
5f
P
6s
6p
6d
Q
7s
7p
1s
2s
2p
3s
3p
4s
3d
4p
能级交错
构造原理
能级交错是指电子层数较大的某些轨道的能量反而低于电子层数较小的某些轨道的能量的现象。
能级交错
K
1s
L
2s
2p
M
3s
3p
3d
N
4s
4p
4d
4f
O
5s
5p
5d
5f
P
6s
6p
6d
Q
7s
7p
1s
2s
2p
3s
3p
4s
3d
4p
能级交错
5s
4d
5p
6s 4f 5d 6p
7s 5f 6d 7p
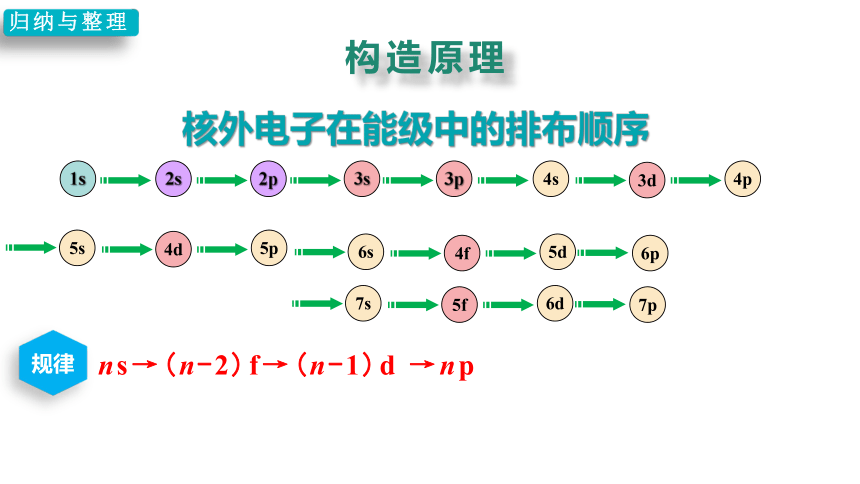
构造原理
核外电子在能级中的排布顺序
归纳与整理
1s
2s
2p
3s
3p
4s
4p
3d
ns→(n-2)f→(n-1)d →np
5s
5p
4d
6s
5d
4f
6p
7s
6d
5f
7p
规律
构造原理
构造原理
1
6s4f5d6p
1s
2s2p
3s3p
4s3d4p
5s4d5p
7s5f6d7p
第三能层中能量最高的轨道是
A.3S
B.3p
C.3d
D.3f
你学会了吗?
解析:电子能量的高低主要由能层和能级决定。当能级符号相同时,能层序数越大,能量越高,例如E1s牛刀小试
按能量由低到高的顺序排列,正确的一组是
A. 1s、2p、3d、4s B. 1s、2s、3s、2p
C. 2s、2p、3s、3p D. 3p、3d、4s、4p
A.E(5s)>E(4f)>E(4s)>E(3d)
B.E(3d)>E(4s)>E(3p)>E(3s)
C.E(4s)<E(3s)<E(2s)<E(1s)
D.E(5s)>E(4s)>E(4f)>E(3d)
构造原理揭示的电子排布能级顺序,实质是各能级能量高低。若以E(nl)表示某能级的能量,以下各式中正确的是
看我七十二变
6s4f5d6p
1s
2s2p
3s3p
4s3d4p
5s4d5p
7s5f6d7p
1个s轨道或1个p轨道,最多能容纳几个电子?
问题解决
一个电子的运动状态要从 4 个方面来进行描述, 即它所处的能层、 能级、 电子云的伸展方向以及电子的自旋方向。
在同一个原子中有没有运动状态完全相同的电子?
问题解决
若1个s轨道容纳2个电子,这2个电子的自旋方向如何?
1个s轨道能否容纳3个或更多的电子?
泡利不相容原理
2
在一个原子轨道里,最多只能容纳2个电子,它们的自旋相反
第一则笑话是,因为有泡利效应,大名鼎鼎的实验物理学家施特恩一看到泡利要来,就会关上实验室的大门。即便有问题要讨论,他们也是隔着实验室的门进行。
另一则笑话是,欧洲某著名的实验物理学家正在做实验,突然实验数据毫无理由地出现异常,对此查不出任何原因。后来才发现,原来是那天泡利坐火车从镇上经过。
泡利发现了著名的“不相容原理”。有人说,生活中的泡利也是与他人“不相容的”。坊间甚至还流传着一个所谓的“泡利效应”(这可不是什么正规的物理效应)
化学趣史
那就是:“只要泡利一进实验室,实验室的仪器设备一定非出毛病不可。”
有两则关于“泡利效应”的笑话不妨在这里简单叙述一下。
01
02
03
1918年中学毕业后就成为慕尼黑大学的研究生。 1921年以一篇关于氢分子模型的论文获得博士学位。1922年在格丁根大学任M.玻恩的助教,结识了来该校讲学的N.玻尔。
学习
1923~1928年,在汉堡大学任讲师;1928年到瑞士苏黎世的联邦工业大学任理论物理学教授。1935年为躲避法西斯迫害而到美国,1940年受聘为普林斯顿高级研究院的理论物理学访问教授。
工作
由于发现“不相容原理”(后称泡利不相容原理),获得1945年诺贝尔物理学奖,时年25岁。
成就
化学趣史
1927年10月,第五届索尔维会议,泡利是年龄最小的顶级科学家
1927年10月,第五届索尔维会议,泡利是年龄最小的顶级科学家
泡利
泡利与中国籍科学家吴健雄
解析:不同能层中英文字母相同的能级最多容纳的电子数相同,B项错误;从M层开始有d能级,即3d能级,L层不存在2d能级,故C项错误;从N层开始有f能级,即4f,M层不存在3f能级,故D项错误。
下列能级表示正确(实际存在的)且最多容纳的电子数按照从少到多的顺序排列的是
A. 1s、2p、3d
B. 1s、2s、3s
C. 2s、2p、2d
D. 3p、3d、3f
考考你自己
交流讨论
原子核外电子的排布表示
原子结构示意图
P
电子式
P
1s
2s
2p
3s
3p
构造原理
1s 2s 2p 3s 3p
2
2
6
2
3
能层
能级
电子
电子排布式
电子排布的表示
3
3.1 电子排布式
将能级上所容纳的电子数标在该能级符号右上角,并按照能层从左到右的顺序排列的式子。
H
1s1
能层
能级
容纳电子数
He
1s2
小试身手
写出3至10号元素的电子排布式
Li
Be
B
C
N
O
F
Ne
1s22s1
1s22s2
1s22s22p1
1s22s22p2
1s22s22p3
1s22s22p4
1s22s22p5
1s22s22p6
小试身手
写出11至18号元素的电子排布式
Na
Mg
Al
Si
P
S
Cl
Ar
1s22s22p63s1
1s22s22p63s2
1s22s22p63s23p1
1s22s22p63s23p2
1s22s22p63s23p3
1s22s22p63s23p4
1s22s22p63s23p5
1s22s22p63s23p6
Ne 1s22s22p6
[Ne]3s1
1s22s22p63s1
简化
[Ne]3s23p5
表示内层电子已经达到稀有气体结构的部分
3.2 简化电子排布式
电子排布式中的内层电子排布可用相应的稀有气体的元素符号加方括号来表示,以简化电子排布式。
以稀有气体的元素符号加方括号的部分称为“原子实”。
1s22s22p63s23p5
[Ne]3s23p5
电子排布的表示
3
原子实表示的电子称为内层电子,通常不参与成键。
原子实外的电子称为价层电子,决定元素的化学性质。
小试身手
下列各原子的基态电子排布正确的是
A. Be 1s22s12p1
B. C 1s22s22p2
C. He 1s12s1
D. Cl 1s22s22p63s23p5
某基态原子的电子排布式为1s22s22p63s23p63d54s2,下列说法不正确的是
A.该元素原子中共有25个电子
B.该元素原子核外有4个能层
C.该元素原子最外层共有2个电子
D.该元素原子M能层共有8个电子
考考你自己
感受 理解
能层 K L M N
最多电子数 2 8 18 32
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
填充电子数 2 2 6 2 6
能层 K L M N
最多电子数 2 8 18 32
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
填充电子数 2 2 6 2 6
当4s能级填满后,下一个电子应该填充在哪个能级?
1
1
能级交错
1s
2s
2p
3s
3p
4s
4p
3d
随核电荷数增大,电子并不总是填满一个能层后再填入下一个能层,这种现象称为能级交错
看我七十二变
写出下列离子的电子排布式
Na+
K+
O2-
Cl-
1s22s22p63s23p63s1
1s22s22p63s1
1s22s22p6
1s22s22p63s23p6
1s22s22p4
1s22s22p6
1s22s22p63s23p5
1s22s22p63s23p6
下列各原子或离子的电子排列式正确的是
A.Na:1s22s22p7
B.Al:1s12s22p63s3
C.O2 :1s22s22p4
D.F :1s22s22p6
看谁做得既准又快
请你试一试
请根据构造原理分析25Mn的核外电子在能级中的排布。
第一步 根据构造原理列出能级排布的顺序
能级排布顺序 1s 2s 2p 3s 3p 4s 3d 4p
填充电子数
第二步 将核外电子依次填入其中
能级排布顺序 1s 2s 2p 3s 3p 4s 3d 4p
填充电子数 2 2 6 2 6 2 5
构造原理告诉我们,随着核电荷数的递增,电子是按能级填充,电子排布式按能层顺序书写。
1s22s22p33s23p63d54s2
归纳与整理
电子排布式书写三步曲
1. 写出电子填入能级的顺序
1s 2s2p 3s3p 4s3d4p 5s4d5p
2. 根据各能级容纳的电子数填入电子
3. 去掉空能级,并按能层顺序排列
1s 2s2p 3s3p3d 4s4p4d 5s5p
钠和镁的基态原子的电子排布式分别为[Ne]3s1和[Ne]3s2,请找出与它们的化合价相关的电子。
钠:[Ne]3s1
镁:[Ne]3s2
与化合价有关
在化学反应中可能发生电子变动的能级
感受﹒ 理解
价电子层:
1s22s22p6 3s1
3s1
价电子排布式
1s22s22p6 3s23p5
3s23p5
价电子排布式
原子在参与化学反应时能够用于成键的电子,是原子核外跟元素化合价有关的电子。
价电子
主族元素,价电子数就是最外层电子数
铁
[Ar]3d64s2
3d64s2
副族元素,价电子除最外层电子外,还可包括次外层电子。
3.3 价电子排布式
表示用于成键的最外层(或次外层)电子
电子排布的表示
3
1s
2s
2p
3s
3p
2
2
6
2
3
简化电子排布式
原子结构示意图
电子排布式
[Ne]
3s
3p
2
3
能层
能级
能级上电子数
3s
3p
2
3
价电子排布式
归纳与整理
H
1s1
交流 研讨
1s
电子排布式
轨道表示式
原子轨道
自旋状态的电子
He
1s2
1s
1s
1s
3.3 轨道表示式
电子排布的表示
3
在一个方框、圆圈中,用箭头“↑”或“↓”来表示不同电子排布
(电子排布图)
①用□或○代表一个原子轨道,能量相同的原子轨道(简并轨道)要相连。
深化理解
2s
1s
2p
简并轨道
不同能级中的□或○要相互分开,同一能级中的□或○要相互连接。
1s
2p
②整个电子排布图中各能级的排列顺序要与相应的电子排布式一致。
1s 2s2p 3s3p3d 4s4p
深化理解
1s
2s
2p
3s
3p
3d
4s
4p
③通常在方框下方或者上方标记能级符号。
④箭头表示一种自旋状态的电子,一个箭头表示一个电子,“↓↑”称电子对,“↓”或“↑”表示单电子。
1s 2s 2p
B
电子对
单电子
未成对电子
电子排布的轨道表示式
铝原子核外电子排布式
铝原子中成对电子对的对数为6,有一个单电子。
1s22s22p63s1
Na
看谁做得既准又快
简化电子排布式
原子结构示意图
电子排布式
价电子排布式
轨道排布式
[Ne]3s1
3s1
1s 2s 2p 3s
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
构造原理
以光谱学事实为基础,从氢开始,随核电荷数递增,新增电子填入能级的顺序被称为构造原理。
电子排布式
按照构造原理,写出基态原子核外电子排布的表示式。
价电子排布式
成键电子的电子排布式。
简化电子排布式
用原子实加括号,写出外层电子排布
轨道表示式
用方框表示轨道,用箭头写出轨道中的电子
课堂小结
电子填充的先后顺序——构造原理
课堂小结
原子核外电子排布的多种表达方式
电子排布式与轨道表示式的比较
电子排布式 含义 用数字在能级符号右上角标明该能级上排布的电子数,这就是电子排布式
意义 能直观反映出核外的电子层、能级及各能级上的电子数
实例 K:1s22s22p63s23p64s1
简化电子排布式 含义 为了避免电子排布式书写过于繁琐,把内层电子达到稀有气体原子结构的部分以相应稀有气体元素符号外加方括号表示
意义 避免书写电子排布式过于繁琐
实例 K:[Ar]4s1
轨道表 示式 含义 每个方框代表一个原子轨道,每个箭头代表一个电子
意义 能直观反映出电子的排布情况及电子的自旋状态
实例 Al:
课堂小结
以下表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是
A.He
B.
C.1s2
D.
考考你自己
1s
下列说法中正确的是
A.同一原子中,1s、2s、3s电子的能量逐渐减小
B.同一原子中,2p、3p、4p能级中的轨道数依次增多
C.3p2表示3p能级有两个原子轨道
D. 1s22s12p1表示的是激发态原子的核外电子排布
考考你自己
以下电子排布式是基态原子的电子排布的是
①1s12s1 ②1s22s12p1 ③1s22s22p63s2 ④1s22s22p63s23p1
A.①②
B.①③
C.②③
D.③④
看谁做得既准又快
分别写出O、Na、23V、26Fe的电子填充顺序和电子排布式。
问题解决
元素 O Na 23V 26Fe
电子填充顺序
电子 排布式
分别写出O、Na、23V、26Fe的电子填充顺序和电子排布式。
问题解决
元素 O Na 23V 26Fe
电子填充顺序 1s22s22p4 1s22s22p63s1 1s22s22p63s23p64s23d3 1s22s22p63s23p64s23d6
电子 排布式 1s22s22p4 1s22s22p63s1 1s22s22p63s23p63d34s2 1s22s22p63s23p63d64s2
某元素X的原子最外层电子排布为nsn-1npn+2 ,则X元素的原子序数为
A.9 B.10
C.17 D.18
看谁做得既准又快
以构造原理为抓手
依据泡利原理
书写核外电子排布
对于不屈不挠的人来说,没有失败这回事。
——俾斯麦
能层与能级
一(K)
二(L)
三(M)
四(N)
核外电子按能量不同分成能层。电子的能层由内向外排序。
同一能层的电子的能量也可能不同,将它们分成不同能级。
能层(n) 一 二 三 四 五
符号 K L M N O
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p ……
知识回顾
表示能级符号
表示能层序数
下列有关原子轨道和电子云的说法正确的是
A. s轨道呈球形,随电子层数的增加,s轨道数也增加
B. p轨道呈哑铃形,p轨道电子绕核做“∞”形运动
C. 电子云是笼罩在原子核外的云雾
D. 电子云图中小点的疏密程度表示电子在原子核外空间出现概 率的大小
考考你自己
第三电子层含有的轨道数为
A.3
B.5
C.7
D.9
考考你自己
基态原子是处于最低能量状态的原子。
电子如何填入核外的不同能级以保证原子处于基态呢?
问题解决
有可遵循的填入顺序吗?
构造原理 泡利原理 电子排布式
学习目标
01
02
03
构造原理
泡利原理
电子排布式
从氢开始,随核电荷数递增,新增电子填入能级的顺序
同一原子轨道最多容纳2个电子
书写基态原子或离子的电子排布式
问题探究
电子是怎样进入各能层和能级的?
1936 年,德国科学家马德隆发表了以原子光谱事实为依据的完整的构造原理。
从氢开始,随核电荷数递增,新增电子填入能级的顺序
K
1s
L
2s
2p
M
3s
3p
3d
N
4s
4p
4d
4f
O
5s
5p
5d
5f
P
6s
6p
6d
Q
7s
7p
1s
2s
2p
3s
3p
4s
3d
4p
能级交错
构造原理
能级交错是指电子层数较大的某些轨道的能量反而低于电子层数较小的某些轨道的能量的现象。
能级交错
K
1s
L
2s
2p
M
3s
3p
3d
N
4s
4p
4d
4f
O
5s
5p
5d
5f
P
6s
6p
6d
Q
7s
7p
1s
2s
2p
3s
3p
4s
3d
4p
能级交错
5s
4d
5p
6s 4f 5d 6p
7s 5f 6d 7p
构造原理
核外电子在能级中的排布顺序
归纳与整理
1s
2s
2p
3s
3p
4s
4p
3d
ns→(n-2)f→(n-1)d →np
5s
5p
4d
6s
5d
4f
6p
7s
6d
5f
7p
规律
构造原理
构造原理
1
6s4f5d6p
1s
2s2p
3s3p
4s3d4p
5s4d5p
7s5f6d7p
第三能层中能量最高的轨道是
A.3S
B.3p
C.3d
D.3f
你学会了吗?
解析:电子能量的高低主要由能层和能级决定。当能级符号相同时,能层序数越大,能量越高,例如E1s
按能量由低到高的顺序排列,正确的一组是
A. 1s、2p、3d、4s B. 1s、2s、3s、2p
C. 2s、2p、3s、3p D. 3p、3d、4s、4p
A.E(5s)>E(4f)>E(4s)>E(3d)
B.E(3d)>E(4s)>E(3p)>E(3s)
C.E(4s)<E(3s)<E(2s)<E(1s)
D.E(5s)>E(4s)>E(4f)>E(3d)
构造原理揭示的电子排布能级顺序,实质是各能级能量高低。若以E(nl)表示某能级的能量,以下各式中正确的是
看我七十二变
6s4f5d6p
1s
2s2p
3s3p
4s3d4p
5s4d5p
7s5f6d7p
1个s轨道或1个p轨道,最多能容纳几个电子?
问题解决
一个电子的运动状态要从 4 个方面来进行描述, 即它所处的能层、 能级、 电子云的伸展方向以及电子的自旋方向。
在同一个原子中有没有运动状态完全相同的电子?
问题解决
若1个s轨道容纳2个电子,这2个电子的自旋方向如何?
1个s轨道能否容纳3个或更多的电子?
泡利不相容原理
2
在一个原子轨道里,最多只能容纳2个电子,它们的自旋相反
第一则笑话是,因为有泡利效应,大名鼎鼎的实验物理学家施特恩一看到泡利要来,就会关上实验室的大门。即便有问题要讨论,他们也是隔着实验室的门进行。
另一则笑话是,欧洲某著名的实验物理学家正在做实验,突然实验数据毫无理由地出现异常,对此查不出任何原因。后来才发现,原来是那天泡利坐火车从镇上经过。
泡利发现了著名的“不相容原理”。有人说,生活中的泡利也是与他人“不相容的”。坊间甚至还流传着一个所谓的“泡利效应”(这可不是什么正规的物理效应)
化学趣史
那就是:“只要泡利一进实验室,实验室的仪器设备一定非出毛病不可。”
有两则关于“泡利效应”的笑话不妨在这里简单叙述一下。
01
02
03
1918年中学毕业后就成为慕尼黑大学的研究生。 1921年以一篇关于氢分子模型的论文获得博士学位。1922年在格丁根大学任M.玻恩的助教,结识了来该校讲学的N.玻尔。
学习
1923~1928年,在汉堡大学任讲师;1928年到瑞士苏黎世的联邦工业大学任理论物理学教授。1935年为躲避法西斯迫害而到美国,1940年受聘为普林斯顿高级研究院的理论物理学访问教授。
工作
由于发现“不相容原理”(后称泡利不相容原理),获得1945年诺贝尔物理学奖,时年25岁。
成就
化学趣史
1927年10月,第五届索尔维会议,泡利是年龄最小的顶级科学家
1927年10月,第五届索尔维会议,泡利是年龄最小的顶级科学家
泡利
泡利与中国籍科学家吴健雄
解析:不同能层中英文字母相同的能级最多容纳的电子数相同,B项错误;从M层开始有d能级,即3d能级,L层不存在2d能级,故C项错误;从N层开始有f能级,即4f,M层不存在3f能级,故D项错误。
下列能级表示正确(实际存在的)且最多容纳的电子数按照从少到多的顺序排列的是
A. 1s、2p、3d
B. 1s、2s、3s
C. 2s、2p、2d
D. 3p、3d、3f
考考你自己
交流讨论
原子核外电子的排布表示
原子结构示意图
P
电子式
P
1s
2s
2p
3s
3p
构造原理
1s 2s 2p 3s 3p
2
2
6
2
3
能层
能级
电子
电子排布式
电子排布的表示
3
3.1 电子排布式
将能级上所容纳的电子数标在该能级符号右上角,并按照能层从左到右的顺序排列的式子。
H
1s1
能层
能级
容纳电子数
He
1s2
小试身手
写出3至10号元素的电子排布式
Li
Be
B
C
N
O
F
Ne
1s22s1
1s22s2
1s22s22p1
1s22s22p2
1s22s22p3
1s22s22p4
1s22s22p5
1s22s22p6
小试身手
写出11至18号元素的电子排布式
Na
Mg
Al
Si
P
S
Cl
Ar
1s22s22p63s1
1s22s22p63s2
1s22s22p63s23p1
1s22s22p63s23p2
1s22s22p63s23p3
1s22s22p63s23p4
1s22s22p63s23p5
1s22s22p63s23p6
Ne 1s22s22p6
[Ne]3s1
1s22s22p63s1
简化
[Ne]3s23p5
表示内层电子已经达到稀有气体结构的部分
3.2 简化电子排布式
电子排布式中的内层电子排布可用相应的稀有气体的元素符号加方括号来表示,以简化电子排布式。
以稀有气体的元素符号加方括号的部分称为“原子实”。
1s22s22p63s23p5
[Ne]3s23p5
电子排布的表示
3
原子实表示的电子称为内层电子,通常不参与成键。
原子实外的电子称为价层电子,决定元素的化学性质。
小试身手
下列各原子的基态电子排布正确的是
A. Be 1s22s12p1
B. C 1s22s22p2
C. He 1s12s1
D. Cl 1s22s22p63s23p5
某基态原子的电子排布式为1s22s22p63s23p63d54s2,下列说法不正确的是
A.该元素原子中共有25个电子
B.该元素原子核外有4个能层
C.该元素原子最外层共有2个电子
D.该元素原子M能层共有8个电子
考考你自己
感受 理解
能层 K L M N
最多电子数 2 8 18 32
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
填充电子数 2 2 6 2 6
能层 K L M N
最多电子数 2 8 18 32
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
填充电子数 2 2 6 2 6
当4s能级填满后,下一个电子应该填充在哪个能级?
1
1
能级交错
1s
2s
2p
3s
3p
4s
4p
3d
随核电荷数增大,电子并不总是填满一个能层后再填入下一个能层,这种现象称为能级交错
看我七十二变
写出下列离子的电子排布式
Na+
K+
O2-
Cl-
1s22s22p63s23p63s1
1s22s22p63s1
1s22s22p6
1s22s22p63s23p6
1s22s22p4
1s22s22p6
1s22s22p63s23p5
1s22s22p63s23p6
下列各原子或离子的电子排列式正确的是
A.Na:1s22s22p7
B.Al:1s12s22p63s3
C.O2 :1s22s22p4
D.F :1s22s22p6
看谁做得既准又快
请你试一试
请根据构造原理分析25Mn的核外电子在能级中的排布。
第一步 根据构造原理列出能级排布的顺序
能级排布顺序 1s 2s 2p 3s 3p 4s 3d 4p
填充电子数
第二步 将核外电子依次填入其中
能级排布顺序 1s 2s 2p 3s 3p 4s 3d 4p
填充电子数 2 2 6 2 6 2 5
构造原理告诉我们,随着核电荷数的递增,电子是按能级填充,电子排布式按能层顺序书写。
1s22s22p33s23p63d54s2
归纳与整理
电子排布式书写三步曲
1. 写出电子填入能级的顺序
1s 2s2p 3s3p 4s3d4p 5s4d5p
2. 根据各能级容纳的电子数填入电子
3. 去掉空能级,并按能层顺序排列
1s 2s2p 3s3p3d 4s4p4d 5s5p
钠和镁的基态原子的电子排布式分别为[Ne]3s1和[Ne]3s2,请找出与它们的化合价相关的电子。
钠:[Ne]3s1
镁:[Ne]3s2
与化合价有关
在化学反应中可能发生电子变动的能级
感受﹒ 理解
价电子层:
1s22s22p6 3s1
3s1
价电子排布式
1s22s22p6 3s23p5
3s23p5
价电子排布式
原子在参与化学反应时能够用于成键的电子,是原子核外跟元素化合价有关的电子。
价电子
主族元素,价电子数就是最外层电子数
铁
[Ar]3d64s2
3d64s2
副族元素,价电子除最外层电子外,还可包括次外层电子。
3.3 价电子排布式
表示用于成键的最外层(或次外层)电子
电子排布的表示
3
1s
2s
2p
3s
3p
2
2
6
2
3
简化电子排布式
原子结构示意图
电子排布式
[Ne]
3s
3p
2
3
能层
能级
能级上电子数
3s
3p
2
3
价电子排布式
归纳与整理
H
1s1
交流 研讨
1s
电子排布式
轨道表示式
原子轨道
自旋状态的电子
He
1s2
1s
1s
1s
3.3 轨道表示式
电子排布的表示
3
在一个方框、圆圈中,用箭头“↑”或“↓”来表示不同电子排布
(电子排布图)
①用□或○代表一个原子轨道,能量相同的原子轨道(简并轨道)要相连。
深化理解
2s
1s
2p
简并轨道
不同能级中的□或○要相互分开,同一能级中的□或○要相互连接。
1s
2p
②整个电子排布图中各能级的排列顺序要与相应的电子排布式一致。
1s 2s2p 3s3p3d 4s4p
深化理解
1s
2s
2p
3s
3p
3d
4s
4p
③通常在方框下方或者上方标记能级符号。
④箭头表示一种自旋状态的电子,一个箭头表示一个电子,“↓↑”称电子对,“↓”或“↑”表示单电子。
1s 2s 2p
B
电子对
单电子
未成对电子
电子排布的轨道表示式
铝原子核外电子排布式
铝原子中成对电子对的对数为6,有一个单电子。
1s22s22p63s1
Na
看谁做得既准又快
简化电子排布式
原子结构示意图
电子排布式
价电子排布式
轨道排布式
[Ne]3s1
3s1
1s 2s 2p 3s
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
构造原理
以光谱学事实为基础,从氢开始,随核电荷数递增,新增电子填入能级的顺序被称为构造原理。
电子排布式
按照构造原理,写出基态原子核外电子排布的表示式。
价电子排布式
成键电子的电子排布式。
简化电子排布式
用原子实加括号,写出外层电子排布
轨道表示式
用方框表示轨道,用箭头写出轨道中的电子
课堂小结
电子填充的先后顺序——构造原理
课堂小结
原子核外电子排布的多种表达方式
电子排布式与轨道表示式的比较
电子排布式 含义 用数字在能级符号右上角标明该能级上排布的电子数,这就是电子排布式
意义 能直观反映出核外的电子层、能级及各能级上的电子数
实例 K:1s22s22p63s23p64s1
简化电子排布式 含义 为了避免电子排布式书写过于繁琐,把内层电子达到稀有气体原子结构的部分以相应稀有气体元素符号外加方括号表示
意义 避免书写电子排布式过于繁琐
实例 K:[Ar]4s1
轨道表 示式 含义 每个方框代表一个原子轨道,每个箭头代表一个电子
意义 能直观反映出电子的排布情况及电子的自旋状态
实例 Al:
课堂小结
以下表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是
A.He
B.
C.1s2
D.
考考你自己
1s
下列说法中正确的是
A.同一原子中,1s、2s、3s电子的能量逐渐减小
B.同一原子中,2p、3p、4p能级中的轨道数依次增多
C.3p2表示3p能级有两个原子轨道
D. 1s22s12p1表示的是激发态原子的核外电子排布
考考你自己
以下电子排布式是基态原子的电子排布的是
①1s12s1 ②1s22s12p1 ③1s22s22p63s2 ④1s22s22p63s23p1
A.①②
B.①③
C.②③
D.③④
看谁做得既准又快
分别写出O、Na、23V、26Fe的电子填充顺序和电子排布式。
问题解决
元素 O Na 23V 26Fe
电子填充顺序
电子 排布式
分别写出O、Na、23V、26Fe的电子填充顺序和电子排布式。
问题解决
元素 O Na 23V 26Fe
电子填充顺序 1s22s22p4 1s22s22p63s1 1s22s22p63s23p64s23d3 1s22s22p63s23p64s23d6
电子 排布式 1s22s22p4 1s22s22p63s1 1s22s22p63s23p63d34s2 1s22s22p63s23p63d64s2
某元素X的原子最外层电子排布为nsn-1npn+2 ,则X元素的原子序数为
A.9 B.10
C.17 D.18
看谁做得既准又快
以构造原理为抓手
依据泡利原理
书写核外电子排布
