3.2溶液 课件(共72张PPT内嵌视频)-【生动课堂】2023-2024学年九年级化学第一学期同步备课系列(沪教版·上海)
文档属性
| 名称 | 3.2溶液 课件(共72张PPT内嵌视频)-【生动课堂】2023-2024学年九年级化学第一学期同步备课系列(沪教版·上海) |

|
|
| 格式 | pptx | ||
| 文件大小 | 141.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-21 00:00:00 | ||
图片预览











文档简介
(共72张PPT)
3.2溶液
第3章 走进溶液世界
教师
xxx
沪教版(上海) 九年级第一学期
溶液
饱和溶液和不饱和溶液
悬浊液和乳浊液
01
03
02
04
CONTANTS
目 录
溶解度
05
溶质的质量分数
溶液
01
地球的表面大部分被海水覆盖着,但海水是又苦又咸的,
这是为什么呢?
海水中溶解了氯化钠等物质,它是一种混合物。
说一说你生活中接触到的液体物质有哪些?
说一说你生活中接触到的液体物质有哪些?
操作:在 20 mL 中加入一匙蔗糖,用玻璃棒搅拌,观察现象。
现象:蔗糖“消失”在水中
结论:蔗糖可以溶解在水中,形成蔗糖溶液
操作:在 20 mL 中加入一匙氯化钠,用玻璃棒搅拌,观察现象。
现象:氯化钠“消失”在水中
结论:氯化钠可以溶解在水中,形成氯化钠溶液
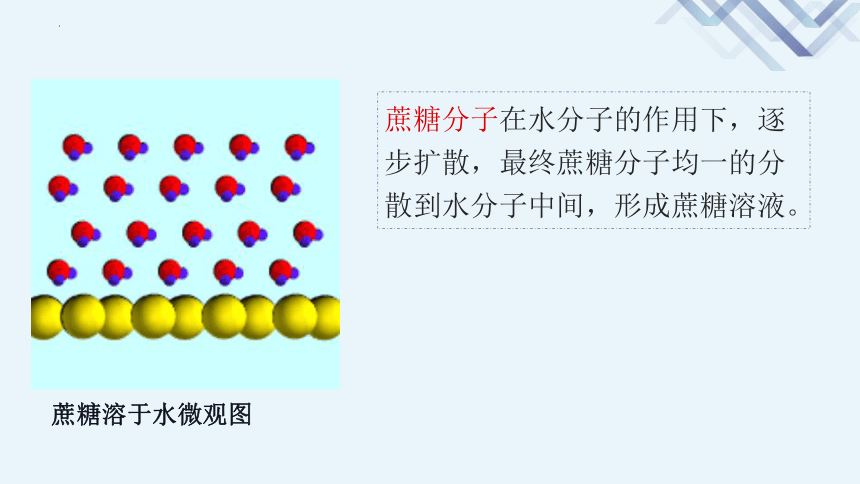
蔗糖溶于水微观图
蔗糖分子在水分子的作用下,逐步扩散,最终蔗糖分子均一的分散到水分子中间,形成蔗糖溶液。
溶液
定义:一种或几种物质分散到另一种物质里,形成均一的、
稳定的混合物。
均一性:溶液各部分组成、性质完全相同 (颜色、密度、浓度等)
溶液的特征:
稳定性:只要温度不改变、水份不蒸发,溶剂与溶质不会分离。
混合物:所有的溶液均为混合物
溶液的组成:
溶剂:能溶解其他物质的物质叫做溶剂,如:水。
溶质:被溶解的物质叫做溶质,如:蔗糖、食盐。
溶质
溶剂
溶液
+
溶液的命名
A(溶质)的B(溶剂)溶液
注:溶剂为水时,可以简称为某溶液
溶质 溶剂 溶液名称
蔗糖
氯化钠
水
水
高锰酸钾
水
碘
酒精
蔗糖的水溶液
食盐的水溶液
高锰酸钾的水溶液
食盐溶液
蔗糖溶液
高锰酸钾溶液
碘的酒精溶液
1.均一、稳定的液体一定是溶液吗?
不一定,如酒精、水等。溶液是均一、稳定的混合物。
2.将蔗糖溶液和氯化钠溶液混合,还是溶液吗?
是,氯化钠和蔗糖都是溶质。溶液中的溶质可以有多种,如海水。
3.溶液一定是液体吗?
不一定。也可以是气体或固体。
实验方案
1.用量筒分别量取50mL水倒人三个烧杯中,用温度计分别测量水的温度并记录数据。
2.用天平分别称量10g固体倒入烧杯中,用玻璃棒搅拌,待固体全部溶解。
3.分别读取温度计的温度。
4.比较温度变化数值。
溶解时的吸热或放热现象
视频:溶解时的吸热或放热现象
结论:
1.氯化钠溶于水温度几乎不变,
说明氯化钠溶于水既不放热也不吸热;
2.硝酸铵溶于水温度降低,说明硝酸铵溶于水吸热;
3.氢氧化钠溶于水温度升高,说明氢氧化钠溶于水放热.
溶解前后
温度变化情况
水中加入的溶质
温度基本不变
温度降低
温度升高
NaCl
NH4NO3
NaOH
乳浊液和悬浊液
02
小液滴分散到液体里形成的混合物
一、乳浊液和悬浊液
不均一、 不稳定、 静置后分层
共同特征:
固体小颗粒分散到液体里形成的混合物
乳浊液:
悬浊液:
二、乳化现象
在两支试管中各加入5mL水和几滴植物油,
观察是否分层。
静置几分钟,再观察现象。
两支试管中都分层。
都得到乳状浑浊的液体,加过洗涤剂的有泡沫。
向其中一支试管中滴入几滴洗涤剂,分别振荡,观察现象。
没加洗涤剂的分层,加过洗涤剂的不分层。
清洗,观察现象
试管内加入的物质 现象 把液体倒掉后试管是否干净
振荡前 振荡后 静置后
水和植物油
水和植物油和洗涤剂
实验现象观察实验现象观察
分层
分层
不干净
干净
分层
不分层
浑浊
浑浊
洗涤剂能使植物油在水中分散成无数细小的液滴,而不聚集成大的油珠,从而使油和水不再分层,所形成的乳浊液稳定性增强。这种现象称为乳化。
乳化在生活中的应用
(1)洗涤:用乳化剂(洗涤剂)可以将衣服、餐具上的油污洗掉。
(2)农药的使用:将农药加入一定量的乳化剂后,再溶解在有机溶剂里,混合均匀后制成的透明液体叫乳油。
(3)生活中常用的乳化剂有肥皂、洗洁精、沐浴露、洗发水、洗面奶等。
讨论:
修汽车的工人,当他的手上沾满油污时,他常用汽油洗去手上的油污。这说明汽油与洗涤剂一样能去油污,那么二者去油污的原理是否相同 若不同,汽油去油污的原理是什么
汽油去油污的原理是:
将油污溶解在汽油中,形成溶液,从而除去油污。
定义 特征 类别 举例
溶液
悬浊液
乳浊液
溶液、悬浊液和乳浊液的区别
液体小液滴分散到另一种液体里形成不均一、不稳定的混合物
固体小颗粒分散到液体里形成不均一、不稳定的混合物。
一种或几种物质分散到另一种物质里形成均一、稳定的混合物
均一
稳定
不均一
不稳定
不均一
不稳定
混
合
物
混
合
物
混
合
物
食盐水
糖水
稀盐酸
石灰水
泥浆水
洪水
油水
饱和溶液和不饱和溶液
03
饱和溶液与不饱和溶液
实验 1 氯化钠在水中的溶解
实验结论:
氯化钠在一定量水中不能无限溶解。
思考与讨论
1.物质溶解受什么的影响?
溶剂的量
饱和溶液与不饱和溶液
饱和溶液与不饱和溶液
实验 2 硝酸钾在水中的溶解
饱和溶液与不饱和溶液
实验结论:
在一定温度下,硝酸钾不能无限制地溶解在一定量的水中
思考与讨论
2.物质溶解受什么的影响?
温度
四要素
1.定义:在一定的温度下,在一定量的溶剂里,不能再溶解某种物质的溶液叫做这种溶质的饱和溶液。
还能继续溶解某种物质的溶液叫做这种溶质的不饱和溶液。
①一定的温度
一定量的溶剂
③这种溶质
④溶不溶解
饱和溶液与不饱和溶液
饱和溶液与不饱和溶液
2.饱和溶液与不饱和溶液的判断——“1看2加”
(1)观察溶液底部是否有_____________。
(2)若溶液底部没有未溶解的溶质,可以向该溶液中加入少量_________,若______________,则该溶液是饱和溶液。
未溶解的溶质
同种溶质
溶质不再溶解
思考与讨论
判断甲、乙溶液是否为饱和溶液?
1.判断一下烧杯中的溶液是否为饱和溶液?
思考与讨论
饱和溶液
不饱和溶液
不饱和溶液
饱和溶液
饱和溶液
3.饱和溶液和不饱和溶液之间的转化
加溶剂、升高温度
加入溶质、蒸发溶剂、
降低温度
饱和
溶液
不饱和
溶液
结晶
饱和
1.定义(选学)
溶解在溶液中的溶质以晶体的形式析出,这一过程叫结晶。析出晶体后的溶液叫母液。母液是 (饱和/不饱和)溶液。
2.结晶的方法
蒸发溶剂
降温结晶
例:海水晒盐
例:冷却热KNO3溶液
溶解度
04
1.溶解度:指在一定温度下,某物质在100克溶剂(通常是水)中达到饱和状态时所溶解的质量。
符号:S
单位:g/100g水
条件 —— 一定温度
标准 —— 100克溶剂 (水)
状态 —— 饱和溶液
单位 —— g/100g水
物质的溶解度
四要素
例如:20℃时,食盐的溶解度是36克/100克水
注意:说溶解度时一定要指明温度。
含义是什么?
m质:m剂:m液 = 36:100: 136
20°C,食盐在100克水里达到饱和所溶解的克数为36克。或者说 20°C ,100克水里最多可以溶解36克食盐。
含义一
含义二
某温度下的溶解度还可表示出该温度下该
饱和溶液中溶质的质量质量分数:
C%
=
m溶质
m溶液
×100℅
=
S
S+100g
×100℅
含义三
思考讨论:下列说法是否正确,为什么?
A.20℃时,10克食盐溶解在100克水中,所以20℃时食盐的溶解
度为10克/100克水。
B.20℃时,100克食盐饱和溶液里含有26.4克食盐,所以20℃时
食盐的溶解度为26.4克/100克水。
C.100g水中达到饱和状态时能溶解食盐的质量为36g,所以食盐
的溶解度为36克/100水
D.20℃时,100g水中最多能溶解36g 食盐,所以食盐的溶解度为36
没注明溶液是否饱和
100克是溶液的质量而非溶剂的质量
没注明温度
没注明单位
部分物质在20℃时溶解度表
物质 溶解度
(g/100g水)
AgCl 0.00015
Ca(OH)2 0.165
KClO3 7.4
NaCl 36
NaNO3 83
AgNO3 222
2.物质溶解性的分类
20℃时:溶解度与溶解性的对应关系:
易溶
可溶
微溶
难溶
溶解是绝对的,不溶解是相对的!
(“难溶”习惯称为“不溶”物质)
结论:______,_______,_______是易溶物质;
______ 是可溶物质; _______是微溶物质,_____ 是难溶物质。
氯化钠
硝酸钠
硝酸银
氯酸钾
氢氧化钙
氯化银
对于微溶物质:若作为反应物,则当可溶;若作为生成物,则作为不溶物
3.溶解度的计算
注意: (1) 温度改变,物质的溶解度随之改变
(2) 溶解度只适用于饱和溶液
m(溶液) = m(溶质) + m(溶剂)
m(溶质) S
m(溶剂) 100
m(溶液) 100+S
(1)
(2)
①计算溶解度
[例题1] 把55克50℃时的硼酸饱和溶液蒸干,得到5克硼酸固体。
求硼酸在50℃时的溶解度。
m(溶质) + m(溶剂) = m(溶液)
方法一
m(H2O) = 55-5 = 50 (g)
5
50
=
S
100
S = 10 (g/100g水)
方法二
5
55
=
S
100 + S
答:50℃时,硼酸的溶解度为10 g/100g水。
解:
S = 10 (g/100g水)
如果上题中去掉“饱和”两字,结果还正确吗,为什么?
计算条件和公式同上。
例:已知氯化钾在20 C时的溶解度为34g/100g水,配制20 C时500g氯化钾饱和溶液需氯化钾和水各多少克?
练习:已知20 C时,硝酸钾的溶解度为31.6g/100g水,24g硝酸钾溶解在多少克水里才能配成20 C时的饱和溶液
75.9g/100g水
②计算饱和溶液中的溶质或者溶剂的质量
训练:
1.30℃时,500g水中最多能溶解330g硝酸钾,求30℃时硝酸钾的溶解度?
2.20℃时,将256g饱和食盐水蒸干,得到56g食盐,求20℃时食盐的溶解度。
3.已知10℃时,硝酸钾的溶解度是25g/100g水。问400g水中最多能溶解多少克硝酸钾?
4.已知20℃时,溴化钾的溶解度是88g/100g水。问20℃时,22g溴化钾最多可以配制成多少克溴化钾饱和溶液?
66g/100g水
28g/100g水
100g
47g
5.已知20℃时,硝酸钾的溶解度是32g/100g水。在20℃时,要配制528g硝酸钾饱和溶液,应将多少克硝酸钾溶解在多少克水中?
6.在30℃时,将27gA物质加入80g水中,有2g未溶解,则在30℃时A物质的溶解度是多少?
7.50℃时,200g硝酸钾饱和溶液中含硝酸钾120g,则50℃时硝酸钾的溶解度多少?若温度保持不变,蒸发掉20g水之后,其溶解度为多少?
128g 400g
31.25g/100g水
150g/100g水
150g/100g水
s c%
意义
温度
溶剂量
饱和
单位
表达式
关系
溶解度与溶质的质量分数的比较
表示溶解性强弱的度量,
受外界t、P影响
表示溶液浓稀程度,
不受外界条件限制.
一定
不定
不定
不定
无
100克
g/100g水
一定
100w
饱和溶液中:
c%=
S
100+S
S=
100-w
或
固体的溶解度
溶解度/g <0.01 0.01~1 1~10 >10
一般称为 难溶 微溶 可溶 易溶
溶解度的相对大小(20℃)
Ca(OH)2
CaCO3
固体物质溶解度的表示法——列表法
几种物质在不同温度时的溶解度
温度 / ℃ 0 10 20 30 40 50 60 70 80 90 100
溶 解 度 / g NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3 37.8 38.4 39.0 39.8
KCl 27.6 31.0 34.0 37.0 40.0 42.6 45.5 48.3 51.1 54.0 56.7
NH4Cl 29.4 33.3 37.2 41.4 45.8 50.4 55.2 60.2 65.6 71.3 77.3
KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110 138 169 202 246
200
100
60
70
50
10
20
30
40
80
90
100
110
180
170
160
150
140
130
120
190
50
10
20
30
40
0
90
60
70
80
.
.
.
.
硝酸钾
.
.
.
.
硝酸钾在不同温度时的溶解度:
溶解度曲线
用纵坐标表示溶解度,
用横坐标表示温度。
固体物质溶解度的表示法——作图法:溶解度曲线
温度 / ℃ 0 10 20 30 40 50 60 70 80 90 100
溶解度/g 13.3 20.9 31.6 45.8 63.9 85.5 110 138 169 202 246
溶解度/g
温度/℃
.
①多数物质溶解度随温度升高而增大
( 如KNO3 ) ;
此类物质的结晶方法选择:
②少数物质溶解度随温度升高变化不大
( 如NaCl ) ;
此类物质的结晶方法选择:
降温结晶
蒸发结晶
③极少数物质溶解度随温度升高而减小 如:Ca(OH)2
此类物质的结晶方法选择:
升温结晶
氢氧化钙
2:表示某物质的溶解度随温度变化的趋势
1:表示某物质在不同温度下的溶解度
曲线越陡,说明该物质的溶解度受温度影响越大
溶解度曲线的意义
溶解度/g
温度/℃
硝
酸
钾
3、溶解度曲线上的A点表示:
600C时,KNO3的饱和溶液。
600C时,KNO3的不饱和溶液
4、溶解度曲线下方的B点表示:
A
B
溶解度/g
温度/℃
硝
酸
钾
氯化钠
5、两条曲线的交叉点表示:
在该温度下,两种物质的溶解度相等。
讨论交流
温度 / ℃ 0 10 20 30 40 50 60
溶 解 度 / g NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3
KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110
根据表格中的数据判断
1. NaCl 和 KNO3溶解度相等的温度范围是:
2. NaCl 和 KNO3溶解度相等的溶解度范围是:
20℃~30℃
36.0~36.3
溶解度/g
温度/℃
溶解度曲线的应用
硝酸钠
比较硝酸钠和硝酸钾的溶解度大小
硝酸钾
在70℃时,NaNO3与KNO3的溶解度相等
温度大于70℃时, KNO3的溶解度大于NaNO3
温度小于70℃时,NaNO3的溶解度大于KNO3
溶解度/g
温度/℃
硝
酸
钾
氯化钠
比较50℃时,硝酸钾、氯化铵、氯化钠的溶解度大小。
氯化铵
500C时,三种物质的溶解度大小为:硝酸钾>氯化铵>氯化钠
联系生活实际:天气闷热时,鱼儿为什么总爱在水面上进行呼吸?
气体的溶解度
思考1:打开汽水盖时,汽水会自动喷出来。这说明气体在水中的溶解度与什么有关?
思考2:喝了汽水以后,常常会打嗝。这说明气体的溶解度还与什么有关?
气体溶解度:气体在压强为101kPa和一定温度时溶解在1体积水里达到饱和状态时的气体体积。
气体溶解度随温度升高而降低,随压强的增大而增大。
溶质的质量分数
05
例1:在农业生产中,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150kg这种溶液,需要氯化钠和水的质量各是多少?
解:
溶质质量
溶液质量
溶质的质量分数=
100%
溶质质量
=溶液质量
×溶质的质量分数
=150kg
×16%
=24kg
溶剂质量
=溶液质量
-溶质质量
=150kg
-24kg
=126kg
或= 150kg ×(1-16% )=126kg。
答:略。
×
溶液质量分数的简单计算
例2: 化学实验室现在有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水?
分析:解决这道题的关键是什么?
解:
溶液稀释前后溶质的质量不变
设稀释后溶液的质量为x。
50g× 98%= x × 20%
x=245g
需要水的质量=245g-50g=195g
答:需要水的质量为195g。
有关溶液稀释问题的计算
解题依据:溶液稀释前后,溶质的质量不变。
若有某溶液Ag,其溶质的质量分数为a%,稀释后得到溶质质量分数为b%的溶液Bg。则有:
Ag×a% = Bg×b%
(稀释前 (稀释后)
小结
① 溶质的质量分数表示溶质质量与溶液质量之比,并不是溶质质量与溶剂质量之比。
②溶质的质量分数一般用百分数表示。
③溶质的质量分数计算式中溶质质量与溶液质量的单位必须统一。
④计算式中溶质质量是指被溶解的那部分溶质的质量,没有被溶解的那部分溶质质量不能计算在内。
注意
饱和溶液的
溶质质量分数=
溶解度
100g+溶解度
溶质的质量分数36% 是指:每 100g溶液中含有36g溶质。
溶质t 0C时溶解度36g是指: 在t 0C 时,100g水最多溶解该溶质36g。
溶质质量分数与溶解度的联系和区别
×100%
【例3】将1 g食盐放入烧杯中,再加入9 mL水,用玻璃棒搅拌,至溶解。再向上述烧杯中加入10 mL水搅拌。(水的密度为1 g/cm3)
1.试分别写出稀释前后溶质质量、溶液质量、溶质质量分数。
2.分析各量的变化情况。溶液稀释问题解题的关键是什么
1.稀释前溶质质量是1 g,溶剂质量是9 g,溶质质量分数为10%;稀释后溶质的质量是1 g,溶液质量是20 g,溶质质量分数是5%。
2.稀释后溶液质量增加,溶质质量分数减小,溶质质量不变。
溶液稀释和配制问题的计算
【例4】化学实验室现有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50 g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水
解法1:设需加水的质量为x。
50 g×98%=(50 g+x)×20%,
x=195 g。
答:把50 g质量分数为98%的浓硫酸稀释成质量分数为20%的硫酸溶液需加水
195 g。
解法2:设稀释后溶液的质量为x。
50 g×98%=x×20%,
x=245 g,
245 g-50 g=195 g。
答:把50 g质量分数为98%的浓硫酸稀释成质量分数为20%的硫酸溶液需加水195 g。
【例5】某工厂化验室配制5000 g 20%的盐酸,需38%的盐酸(密度为1.19 g/cm3)多少毫升
提问:此题与上述练习题有何异同?能否用体积直接带入公式进行计算
【归纳】溶质质量=溶液体积×溶液密度×溶质的质量分数。
解:设需38%的盐酸的体积为x。
5000 g×20%=1.19 g/cm3×x×38%,x≈2211 mL。
答:需38%的盐酸2211 mL。
【例6】把50 g质量分数为98%的浓硫酸稀释成质量分数为20%的硫酸溶液。需要多少克水
加水后稀溶液质量50克+x
50克98%的浓硫酸 20%的稀硫酸
加水质量为x
解法1:设稀释后溶液的质量为x。
50 g×98%=x×20%,x=245 g。
245 g-50 g=195 g。
答:把50克98%的浓硫酸稀释成20%的硫酸需要加水195克。
解法2:设把50g 98%的浓硫酸稀释成20%的稀硫酸需要加水的质量为x,则稀释后溶液的质量为(50g+x),根据稀释前后溶液中溶质的质量不变,得:50g×98%=(50g+x)×20%
解得:x=195g。
【例7】把50 g质量分数为98%的浓硫酸稀释成质量分数为20%的硫酸溶液。需要多少克水
加水后稀溶液质量50克+x
50克98%的浓硫酸 20%的稀硫酸
加水质量为x
答:把50克98%的浓硫酸稀释成20%的硫酸需要加水195克。
【例8】配制500 mL质量分数为20%的稀硫酸溶液,需要质量分数为98%的浓硫酸多少毫升 (质量分数为20%的硫酸溶液密度为1.14 g/mL,质量分数为98%的浓硫酸密度为1.84 g/mL)。
解:设配制500 mL质量分数为20%的稀硫酸溶液,需要质量分数为98%的浓硫酸的体积为x,根据稀释前后溶液中溶质的质量不变,得:
500 mL×1.14 g/mL×20%=x×1.84 g/mL×98%。
解得:x≈63.2 mL。
答:配制500 mL质量分数为20%的稀硫酸溶液,需要质量分数为98%的浓硫酸63.2 mL。
感谢观看
3.2溶液
第3章 走进溶液世界
教师
xxx
沪教版(上海) 九年级第一学期
溶液
饱和溶液和不饱和溶液
悬浊液和乳浊液
01
03
02
04
CONTANTS
目 录
溶解度
05
溶质的质量分数
溶液
01
地球的表面大部分被海水覆盖着,但海水是又苦又咸的,
这是为什么呢?
海水中溶解了氯化钠等物质,它是一种混合物。
说一说你生活中接触到的液体物质有哪些?
说一说你生活中接触到的液体物质有哪些?
操作:在 20 mL 中加入一匙蔗糖,用玻璃棒搅拌,观察现象。
现象:蔗糖“消失”在水中
结论:蔗糖可以溶解在水中,形成蔗糖溶液
操作:在 20 mL 中加入一匙氯化钠,用玻璃棒搅拌,观察现象。
现象:氯化钠“消失”在水中
结论:氯化钠可以溶解在水中,形成氯化钠溶液
蔗糖溶于水微观图
蔗糖分子在水分子的作用下,逐步扩散,最终蔗糖分子均一的分散到水分子中间,形成蔗糖溶液。
溶液
定义:一种或几种物质分散到另一种物质里,形成均一的、
稳定的混合物。
均一性:溶液各部分组成、性质完全相同 (颜色、密度、浓度等)
溶液的特征:
稳定性:只要温度不改变、水份不蒸发,溶剂与溶质不会分离。
混合物:所有的溶液均为混合物
溶液的组成:
溶剂:能溶解其他物质的物质叫做溶剂,如:水。
溶质:被溶解的物质叫做溶质,如:蔗糖、食盐。
溶质
溶剂
溶液
+
溶液的命名
A(溶质)的B(溶剂)溶液
注:溶剂为水时,可以简称为某溶液
溶质 溶剂 溶液名称
蔗糖
氯化钠
水
水
高锰酸钾
水
碘
酒精
蔗糖的水溶液
食盐的水溶液
高锰酸钾的水溶液
食盐溶液
蔗糖溶液
高锰酸钾溶液
碘的酒精溶液
1.均一、稳定的液体一定是溶液吗?
不一定,如酒精、水等。溶液是均一、稳定的混合物。
2.将蔗糖溶液和氯化钠溶液混合,还是溶液吗?
是,氯化钠和蔗糖都是溶质。溶液中的溶质可以有多种,如海水。
3.溶液一定是液体吗?
不一定。也可以是气体或固体。
实验方案
1.用量筒分别量取50mL水倒人三个烧杯中,用温度计分别测量水的温度并记录数据。
2.用天平分别称量10g固体倒入烧杯中,用玻璃棒搅拌,待固体全部溶解。
3.分别读取温度计的温度。
4.比较温度变化数值。
溶解时的吸热或放热现象
视频:溶解时的吸热或放热现象
结论:
1.氯化钠溶于水温度几乎不变,
说明氯化钠溶于水既不放热也不吸热;
2.硝酸铵溶于水温度降低,说明硝酸铵溶于水吸热;
3.氢氧化钠溶于水温度升高,说明氢氧化钠溶于水放热.
溶解前后
温度变化情况
水中加入的溶质
温度基本不变
温度降低
温度升高
NaCl
NH4NO3
NaOH
乳浊液和悬浊液
02
小液滴分散到液体里形成的混合物
一、乳浊液和悬浊液
不均一、 不稳定、 静置后分层
共同特征:
固体小颗粒分散到液体里形成的混合物
乳浊液:
悬浊液:
二、乳化现象
在两支试管中各加入5mL水和几滴植物油,
观察是否分层。
静置几分钟,再观察现象。
两支试管中都分层。
都得到乳状浑浊的液体,加过洗涤剂的有泡沫。
向其中一支试管中滴入几滴洗涤剂,分别振荡,观察现象。
没加洗涤剂的分层,加过洗涤剂的不分层。
清洗,观察现象
试管内加入的物质 现象 把液体倒掉后试管是否干净
振荡前 振荡后 静置后
水和植物油
水和植物油和洗涤剂
实验现象观察实验现象观察
分层
分层
不干净
干净
分层
不分层
浑浊
浑浊
洗涤剂能使植物油在水中分散成无数细小的液滴,而不聚集成大的油珠,从而使油和水不再分层,所形成的乳浊液稳定性增强。这种现象称为乳化。
乳化在生活中的应用
(1)洗涤:用乳化剂(洗涤剂)可以将衣服、餐具上的油污洗掉。
(2)农药的使用:将农药加入一定量的乳化剂后,再溶解在有机溶剂里,混合均匀后制成的透明液体叫乳油。
(3)生活中常用的乳化剂有肥皂、洗洁精、沐浴露、洗发水、洗面奶等。
讨论:
修汽车的工人,当他的手上沾满油污时,他常用汽油洗去手上的油污。这说明汽油与洗涤剂一样能去油污,那么二者去油污的原理是否相同 若不同,汽油去油污的原理是什么
汽油去油污的原理是:
将油污溶解在汽油中,形成溶液,从而除去油污。
定义 特征 类别 举例
溶液
悬浊液
乳浊液
溶液、悬浊液和乳浊液的区别
液体小液滴分散到另一种液体里形成不均一、不稳定的混合物
固体小颗粒分散到液体里形成不均一、不稳定的混合物。
一种或几种物质分散到另一种物质里形成均一、稳定的混合物
均一
稳定
不均一
不稳定
不均一
不稳定
混
合
物
混
合
物
混
合
物
食盐水
糖水
稀盐酸
石灰水
泥浆水
洪水
油水
饱和溶液和不饱和溶液
03
饱和溶液与不饱和溶液
实验 1 氯化钠在水中的溶解
实验结论:
氯化钠在一定量水中不能无限溶解。
思考与讨论
1.物质溶解受什么的影响?
溶剂的量
饱和溶液与不饱和溶液
饱和溶液与不饱和溶液
实验 2 硝酸钾在水中的溶解
饱和溶液与不饱和溶液
实验结论:
在一定温度下,硝酸钾不能无限制地溶解在一定量的水中
思考与讨论
2.物质溶解受什么的影响?
温度
四要素
1.定义:在一定的温度下,在一定量的溶剂里,不能再溶解某种物质的溶液叫做这种溶质的饱和溶液。
还能继续溶解某种物质的溶液叫做这种溶质的不饱和溶液。
①一定的温度
一定量的溶剂
③这种溶质
④溶不溶解
饱和溶液与不饱和溶液
饱和溶液与不饱和溶液
2.饱和溶液与不饱和溶液的判断——“1看2加”
(1)观察溶液底部是否有_____________。
(2)若溶液底部没有未溶解的溶质,可以向该溶液中加入少量_________,若______________,则该溶液是饱和溶液。
未溶解的溶质
同种溶质
溶质不再溶解
思考与讨论
判断甲、乙溶液是否为饱和溶液?
1.判断一下烧杯中的溶液是否为饱和溶液?
思考与讨论
饱和溶液
不饱和溶液
不饱和溶液
饱和溶液
饱和溶液
3.饱和溶液和不饱和溶液之间的转化
加溶剂、升高温度
加入溶质、蒸发溶剂、
降低温度
饱和
溶液
不饱和
溶液
结晶
饱和
1.定义(选学)
溶解在溶液中的溶质以晶体的形式析出,这一过程叫结晶。析出晶体后的溶液叫母液。母液是 (饱和/不饱和)溶液。
2.结晶的方法
蒸发溶剂
降温结晶
例:海水晒盐
例:冷却热KNO3溶液
溶解度
04
1.溶解度:指在一定温度下,某物质在100克溶剂(通常是水)中达到饱和状态时所溶解的质量。
符号:S
单位:g/100g水
条件 —— 一定温度
标准 —— 100克溶剂 (水)
状态 —— 饱和溶液
单位 —— g/100g水
物质的溶解度
四要素
例如:20℃时,食盐的溶解度是36克/100克水
注意:说溶解度时一定要指明温度。
含义是什么?
m质:m剂:m液 = 36:100: 136
20°C,食盐在100克水里达到饱和所溶解的克数为36克。或者说 20°C ,100克水里最多可以溶解36克食盐。
含义一
含义二
某温度下的溶解度还可表示出该温度下该
饱和溶液中溶质的质量质量分数:
C%
=
m溶质
m溶液
×100℅
=
S
S+100g
×100℅
含义三
思考讨论:下列说法是否正确,为什么?
A.20℃时,10克食盐溶解在100克水中,所以20℃时食盐的溶解
度为10克/100克水。
B.20℃时,100克食盐饱和溶液里含有26.4克食盐,所以20℃时
食盐的溶解度为26.4克/100克水。
C.100g水中达到饱和状态时能溶解食盐的质量为36g,所以食盐
的溶解度为36克/100水
D.20℃时,100g水中最多能溶解36g 食盐,所以食盐的溶解度为36
没注明溶液是否饱和
100克是溶液的质量而非溶剂的质量
没注明温度
没注明单位
部分物质在20℃时溶解度表
物质 溶解度
(g/100g水)
AgCl 0.00015
Ca(OH)2 0.165
KClO3 7.4
NaCl 36
NaNO3 83
AgNO3 222
2.物质溶解性的分类
20℃时:溶解度与溶解性的对应关系:
易溶
可溶
微溶
难溶
溶解是绝对的,不溶解是相对的!
(“难溶”习惯称为“不溶”物质)
结论:______,_______,_______是易溶物质;
______ 是可溶物质; _______是微溶物质,_____ 是难溶物质。
氯化钠
硝酸钠
硝酸银
氯酸钾
氢氧化钙
氯化银
对于微溶物质:若作为反应物,则当可溶;若作为生成物,则作为不溶物
3.溶解度的计算
注意: (1) 温度改变,物质的溶解度随之改变
(2) 溶解度只适用于饱和溶液
m(溶液) = m(溶质) + m(溶剂)
m(溶质) S
m(溶剂) 100
m(溶液) 100+S
(1)
(2)
①计算溶解度
[例题1] 把55克50℃时的硼酸饱和溶液蒸干,得到5克硼酸固体。
求硼酸在50℃时的溶解度。
m(溶质) + m(溶剂) = m(溶液)
方法一
m(H2O) = 55-5 = 50 (g)
5
50
=
S
100
S = 10 (g/100g水)
方法二
5
55
=
S
100 + S
答:50℃时,硼酸的溶解度为10 g/100g水。
解:
S = 10 (g/100g水)
如果上题中去掉“饱和”两字,结果还正确吗,为什么?
计算条件和公式同上。
例:已知氯化钾在20 C时的溶解度为34g/100g水,配制20 C时500g氯化钾饱和溶液需氯化钾和水各多少克?
练习:已知20 C时,硝酸钾的溶解度为31.6g/100g水,24g硝酸钾溶解在多少克水里才能配成20 C时的饱和溶液
75.9g/100g水
②计算饱和溶液中的溶质或者溶剂的质量
训练:
1.30℃时,500g水中最多能溶解330g硝酸钾,求30℃时硝酸钾的溶解度?
2.20℃时,将256g饱和食盐水蒸干,得到56g食盐,求20℃时食盐的溶解度。
3.已知10℃时,硝酸钾的溶解度是25g/100g水。问400g水中最多能溶解多少克硝酸钾?
4.已知20℃时,溴化钾的溶解度是88g/100g水。问20℃时,22g溴化钾最多可以配制成多少克溴化钾饱和溶液?
66g/100g水
28g/100g水
100g
47g
5.已知20℃时,硝酸钾的溶解度是32g/100g水。在20℃时,要配制528g硝酸钾饱和溶液,应将多少克硝酸钾溶解在多少克水中?
6.在30℃时,将27gA物质加入80g水中,有2g未溶解,则在30℃时A物质的溶解度是多少?
7.50℃时,200g硝酸钾饱和溶液中含硝酸钾120g,则50℃时硝酸钾的溶解度多少?若温度保持不变,蒸发掉20g水之后,其溶解度为多少?
128g 400g
31.25g/100g水
150g/100g水
150g/100g水
s c%
意义
温度
溶剂量
饱和
单位
表达式
关系
溶解度与溶质的质量分数的比较
表示溶解性强弱的度量,
受外界t、P影响
表示溶液浓稀程度,
不受外界条件限制.
一定
不定
不定
不定
无
100克
g/100g水
一定
100w
饱和溶液中:
c%=
S
100+S
S=
100-w
或
固体的溶解度
溶解度/g <0.01 0.01~1 1~10 >10
一般称为 难溶 微溶 可溶 易溶
溶解度的相对大小(20℃)
Ca(OH)2
CaCO3
固体物质溶解度的表示法——列表法
几种物质在不同温度时的溶解度
温度 / ℃ 0 10 20 30 40 50 60 70 80 90 100
溶 解 度 / g NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3 37.8 38.4 39.0 39.8
KCl 27.6 31.0 34.0 37.0 40.0 42.6 45.5 48.3 51.1 54.0 56.7
NH4Cl 29.4 33.3 37.2 41.4 45.8 50.4 55.2 60.2 65.6 71.3 77.3
KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110 138 169 202 246
200
100
60
70
50
10
20
30
40
80
90
100
110
180
170
160
150
140
130
120
190
50
10
20
30
40
0
90
60
70
80
.
.
.
.
硝酸钾
.
.
.
.
硝酸钾在不同温度时的溶解度:
溶解度曲线
用纵坐标表示溶解度,
用横坐标表示温度。
固体物质溶解度的表示法——作图法:溶解度曲线
温度 / ℃ 0 10 20 30 40 50 60 70 80 90 100
溶解度/g 13.3 20.9 31.6 45.8 63.9 85.5 110 138 169 202 246
溶解度/g
温度/℃
.
①多数物质溶解度随温度升高而增大
( 如KNO3 ) ;
此类物质的结晶方法选择:
②少数物质溶解度随温度升高变化不大
( 如NaCl ) ;
此类物质的结晶方法选择:
降温结晶
蒸发结晶
③极少数物质溶解度随温度升高而减小 如:Ca(OH)2
此类物质的结晶方法选择:
升温结晶
氢氧化钙
2:表示某物质的溶解度随温度变化的趋势
1:表示某物质在不同温度下的溶解度
曲线越陡,说明该物质的溶解度受温度影响越大
溶解度曲线的意义
溶解度/g
温度/℃
硝
酸
钾
3、溶解度曲线上的A点表示:
600C时,KNO3的饱和溶液。
600C时,KNO3的不饱和溶液
4、溶解度曲线下方的B点表示:
A
B
溶解度/g
温度/℃
硝
酸
钾
氯化钠
5、两条曲线的交叉点表示:
在该温度下,两种物质的溶解度相等。
讨论交流
温度 / ℃ 0 10 20 30 40 50 60
溶 解 度 / g NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3
KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110
根据表格中的数据判断
1. NaCl 和 KNO3溶解度相等的温度范围是:
2. NaCl 和 KNO3溶解度相等的溶解度范围是:
20℃~30℃
36.0~36.3
溶解度/g
温度/℃
溶解度曲线的应用
硝酸钠
比较硝酸钠和硝酸钾的溶解度大小
硝酸钾
在70℃时,NaNO3与KNO3的溶解度相等
温度大于70℃时, KNO3的溶解度大于NaNO3
温度小于70℃时,NaNO3的溶解度大于KNO3
溶解度/g
温度/℃
硝
酸
钾
氯化钠
比较50℃时,硝酸钾、氯化铵、氯化钠的溶解度大小。
氯化铵
500C时,三种物质的溶解度大小为:硝酸钾>氯化铵>氯化钠
联系生活实际:天气闷热时,鱼儿为什么总爱在水面上进行呼吸?
气体的溶解度
思考1:打开汽水盖时,汽水会自动喷出来。这说明气体在水中的溶解度与什么有关?
思考2:喝了汽水以后,常常会打嗝。这说明气体的溶解度还与什么有关?
气体溶解度:气体在压强为101kPa和一定温度时溶解在1体积水里达到饱和状态时的气体体积。
气体溶解度随温度升高而降低,随压强的增大而增大。
溶质的质量分数
05
例1:在农业生产中,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150kg这种溶液,需要氯化钠和水的质量各是多少?
解:
溶质质量
溶液质量
溶质的质量分数=
100%
溶质质量
=溶液质量
×溶质的质量分数
=150kg
×16%
=24kg
溶剂质量
=溶液质量
-溶质质量
=150kg
-24kg
=126kg
或= 150kg ×(1-16% )=126kg。
答:略。
×
溶液质量分数的简单计算
例2: 化学实验室现在有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水?
分析:解决这道题的关键是什么?
解:
溶液稀释前后溶质的质量不变
设稀释后溶液的质量为x。
50g× 98%= x × 20%
x=245g
需要水的质量=245g-50g=195g
答:需要水的质量为195g。
有关溶液稀释问题的计算
解题依据:溶液稀释前后,溶质的质量不变。
若有某溶液Ag,其溶质的质量分数为a%,稀释后得到溶质质量分数为b%的溶液Bg。则有:
Ag×a% = Bg×b%
(稀释前 (稀释后)
小结
① 溶质的质量分数表示溶质质量与溶液质量之比,并不是溶质质量与溶剂质量之比。
②溶质的质量分数一般用百分数表示。
③溶质的质量分数计算式中溶质质量与溶液质量的单位必须统一。
④计算式中溶质质量是指被溶解的那部分溶质的质量,没有被溶解的那部分溶质质量不能计算在内。
注意
饱和溶液的
溶质质量分数=
溶解度
100g+溶解度
溶质的质量分数36% 是指:每 100g溶液中含有36g溶质。
溶质t 0C时溶解度36g是指: 在t 0C 时,100g水最多溶解该溶质36g。
溶质质量分数与溶解度的联系和区别
×100%
【例3】将1 g食盐放入烧杯中,再加入9 mL水,用玻璃棒搅拌,至溶解。再向上述烧杯中加入10 mL水搅拌。(水的密度为1 g/cm3)
1.试分别写出稀释前后溶质质量、溶液质量、溶质质量分数。
2.分析各量的变化情况。溶液稀释问题解题的关键是什么
1.稀释前溶质质量是1 g,溶剂质量是9 g,溶质质量分数为10%;稀释后溶质的质量是1 g,溶液质量是20 g,溶质质量分数是5%。
2.稀释后溶液质量增加,溶质质量分数减小,溶质质量不变。
溶液稀释和配制问题的计算
【例4】化学实验室现有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50 g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水
解法1:设需加水的质量为x。
50 g×98%=(50 g+x)×20%,
x=195 g。
答:把50 g质量分数为98%的浓硫酸稀释成质量分数为20%的硫酸溶液需加水
195 g。
解法2:设稀释后溶液的质量为x。
50 g×98%=x×20%,
x=245 g,
245 g-50 g=195 g。
答:把50 g质量分数为98%的浓硫酸稀释成质量分数为20%的硫酸溶液需加水195 g。
【例5】某工厂化验室配制5000 g 20%的盐酸,需38%的盐酸(密度为1.19 g/cm3)多少毫升
提问:此题与上述练习题有何异同?能否用体积直接带入公式进行计算
【归纳】溶质质量=溶液体积×溶液密度×溶质的质量分数。
解:设需38%的盐酸的体积为x。
5000 g×20%=1.19 g/cm3×x×38%,x≈2211 mL。
答:需38%的盐酸2211 mL。
【例6】把50 g质量分数为98%的浓硫酸稀释成质量分数为20%的硫酸溶液。需要多少克水
加水后稀溶液质量50克+x
50克98%的浓硫酸 20%的稀硫酸
加水质量为x
解法1:设稀释后溶液的质量为x。
50 g×98%=x×20%,x=245 g。
245 g-50 g=195 g。
答:把50克98%的浓硫酸稀释成20%的硫酸需要加水195克。
解法2:设把50g 98%的浓硫酸稀释成20%的稀硫酸需要加水的质量为x,则稀释后溶液的质量为(50g+x),根据稀释前后溶液中溶质的质量不变,得:50g×98%=(50g+x)×20%
解得:x=195g。
【例7】把50 g质量分数为98%的浓硫酸稀释成质量分数为20%的硫酸溶液。需要多少克水
加水后稀溶液质量50克+x
50克98%的浓硫酸 20%的稀硫酸
加水质量为x
答:把50克98%的浓硫酸稀释成20%的硫酸需要加水195克。
【例8】配制500 mL质量分数为20%的稀硫酸溶液,需要质量分数为98%的浓硫酸多少毫升 (质量分数为20%的硫酸溶液密度为1.14 g/mL,质量分数为98%的浓硫酸密度为1.84 g/mL)。
解:设配制500 mL质量分数为20%的稀硫酸溶液,需要质量分数为98%的浓硫酸的体积为x,根据稀释前后溶液中溶质的质量不变,得:
500 mL×1.14 g/mL×20%=x×1.84 g/mL×98%。
解得:x≈63.2 mL。
答:配制500 mL质量分数为20%的稀硫酸溶液,需要质量分数为98%的浓硫酸63.2 mL。
感谢观看
