1.6 几种常见的盐 4课时(课件 69张ppt)
文档属性
| 名称 | 1.6 几种常见的盐 4课时(课件 69张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 6.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-09-20 09:46:55 | ||
图片预览










文档简介
(共69张PPT)
1
1.6 几种重要的盐
(一)什么是盐
2
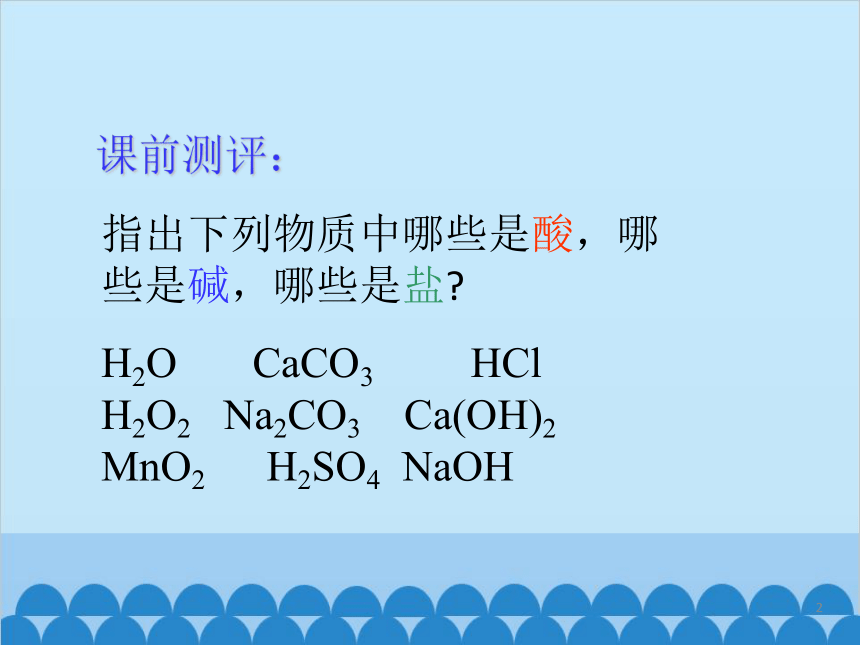
指出下列物质中哪些是酸,哪些是碱,哪些是盐
H2O CaCO3 HCl H2O2 Na2CO3 Ca(OH)2 MnO2 H2SO4 NaOH
课前测评:
3
思考:有人讲,盐就是食盐,你认为对吗?
答:这种说法是错误的。食盐是盐,但盐是一类数量很大的化合物,食盐只是其中的一种。科学上盐是指能电离出金属阳离子(或铵根离子)和酸根阴离子的化合物,如硫酸铜、碳酸钠、硝酸铵。
4
盐:电离时能产生金属阳离子(或铵根离子)和酸根阴离子的化合物,叫做盐。
判断:1、凡是盐物质里一定含有金属元素。
2、盐就是食盐,食盐就是盐。
盐:酸和碱反应生成物质(除水外)都可叫做盐。
什么是盐?
×
×
5
思考:
除了食盐,你还见过其他盐的晶体
硫酸铜 晶体
碳酸钙矿地
硫酸亚铁 晶体
碳酸钠晶体
6
自然界中的盐晶体非常美丽
绿矾
硝酸钾
明矾
锆 石
7
氯化钠晶体
硫酸铜晶体
绿柱石
橄榄石:含硅酸盐
8
练习:
9
10
11
1.6 几种重要的盐
(二)几种盐的性质
12
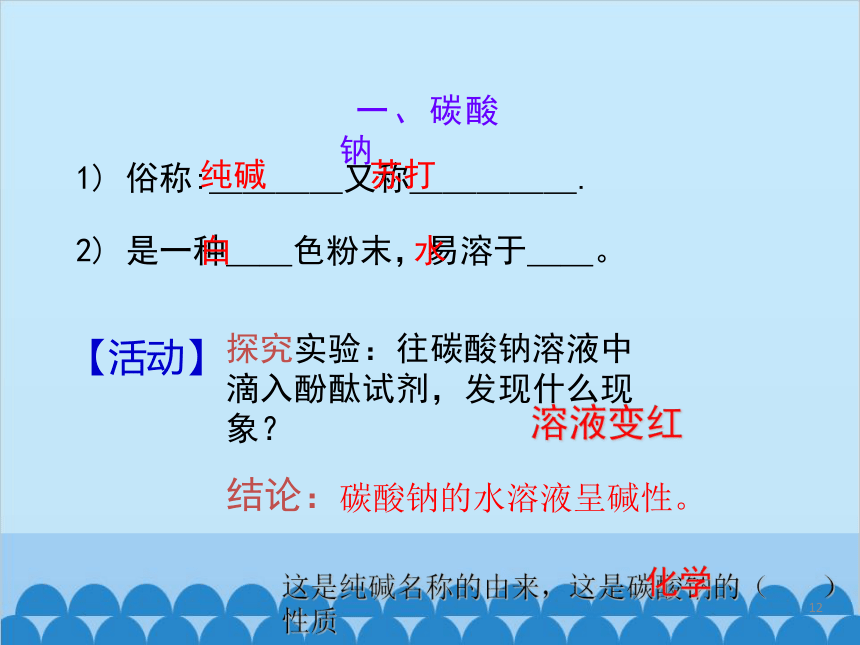
一、碳酸钠
1) 俗称:____又称_____.
2) 是一种__色粉末,易溶于__。
纯碱
苏打
白
水
【活动】
探究实验:往碳酸钠溶液中滴入酚酞试剂,发现什么现象?
溶液变红
结论:
碳酸钠的水溶液呈碱性。
这是纯碱名称的由来,这是碳酸钠的( )性质
化学
13
碳酸钠≠碳酸钠晶体
碳酸钠(Na2CO3)俗称纯碱、苏打;碳酸钠晶体(Na2CO3 10H2O)俗称晶碱、天然碱;它们都是白色固体,易溶于水,水溶液呈碱性;广泛用于化工、玻璃、纺织、制药和食品。
同样的道理,CuSO4≠CuSO4.5H2O
14
碳酸钠(Na2CO3)俗称纯碱.苏打,白色粉末,它从溶液里结晶析出时,结合一定数目的结晶水分子而成为Na2CO3·10H2O(碳酸钠晶体)
碳酸钠晶体Na2CO3·10H2O俗称晶碱.天然碱,在干燥空气里,碳酸钠晶体能逐渐失去结晶水而成为碳酸钠粉末,此现象叫做风化.
15
溶液中
结晶析出
干燥空
气中风化
思考:结晶水合物是混合物吗?使结晶水合物失去结晶水的现象是否属于化学变化?
16
CuSO4.5H2O Na2CO3 10H2O
结晶水
常见的结晶水合物
说明:结晶水合物是纯净物,化学式中的“·”表示化合.
17
Na2CO3 10H2O == Na2CO3+10H2O
硫酸铜晶体不易风化,加热才分解.
碳酸钠晶体在干燥空气中易风化
露置空气中质量减少且变质
CuSO4.5H2O == CuSO4 + 5H2O
△
18
钟乳石
大理石
贝壳
珍珠
鸡蛋壳
它们的主要成分都含有( )
锅炉里的水垢
水壶里的水垢
水垢
碳酸钙
19
二、碳酸钙:CaCO3
用途:
Ca(OH)2+H2CO3 = CaCO3↓ +2H2O
建筑材料、制水泥和玻璃的原料等
碳酸钙是一种难溶的盐,是Ca(OH)2 和H2CO3的中和产物
20
思考:1、长期盛放石灰水的试剂瓶会有一层白色物质,请问这是什么物质?怎么形成的?如何除去?
这是碳酸钙。
形成:CO2+Ca(OH)2==CaCO3↓+H2O
可以用稀盐酸除去
21
2.如何除去热水瓶中的水垢(CaCO3、MgCO3)?(用化学方程式表示)
CaCO3+2HCl=CaCl2+H2O+CO2↑
MgCO3+2HCl=MgCl2+H2O+CO2↑
22
都含有碳酸根
CO32-
统 称
碳酸盐
碳 酸 钠:
碳 酸 钾:
碳 酸 钙:
碳 酸 镁:
Na2 CO3
K2 CO3
Ca CO3
Mg CO3
碳酸盐
观察下列化学式,分析它们有什么共同点?
23
思考:怎样证明一块岩石是碳酸盐
盐酸
澄清石灰水
冒气泡
CaCO3+2HCl=CaCl2+CO2↑+H2O
变浑浊
写出上述反应的方程式:
CO2+Ca(OH)2=CaCO3↓+H2O
24
碳酸盐(CO32-)检验方法:
加入盐酸产生能使澄清石灰水变浑浊的气体(CO2),则原物质含有碳酸盐(即含有碳酸根离子)
25
井盐
海盐
湖盐
岩盐
自然界中的食盐
26
食盐在自然中分布广,但主要存在于海水中。
海水
粗盐
蒸发
溶解、过滤、蒸发
精盐
27
探究汗液里有什么:
收集一些汗液盛放在试管中,滴入几滴硝酸
银溶液,有什么现象产生
反应的化学方程式:
产生白色沉淀
NaCl+AgNO3=AgCl↓+NaNO3
实验:食盐溶液盛放在试管中,滴入几滴硝酸银溶液,有什么现象产生 写出化学方程式。
NaCl+AgNO3=AgCl↓+NaNO3
28
检验氯离子的方法
滴加AgNO3溶液,如果产生一种不溶于稀HNO3的白色沉淀,则该物质中含有Cl-。
29
氯化钠
碳酸钠
碳酸钙
NaCl == Na+ + Cl-
Na2CO3==2Na+ + CO32-
CaCO3 == Ca2+ + CO32-
金属
阳离子
酸根
阴离子
盐
=
+
盐
30
练习:
31
32
33
1.6 几种重要的盐
(三)盐的制取
34
1.盐的分类
(1).根据盐的溶解性的不同可将盐分为________盐和_______盐。
常见盐的溶解性表:
可溶性
不溶性
35
碱溶 钾钠钡钙氨
大多酸溶水中间
钾钠铵盐均易溶
硝酸 盐遇水影无踪
氯化物不溶 氯化银
硫酸 盐不 溶 硫酸 钡
碳酸 盐只溶 钾钠铵
硫酸 盐微溶 是银钙
36
(2).记忆规律:
可溶性盐:钾盐(含K+)、钠盐(含Na+)
大部分碳酸盐如CaCO3、BaCO3、MgCO3等
铵盐(含NH4+)、硝酸盐(含NO3-)
硫酸钡BaSO4、 氯化银AgCI
不可溶性盐:
不溶性碱:
Fe(OH)3、Cu(OH)2、Mg(OH)2等
可溶性碱:
KOH 、NaOH 、Ba(OH)2Ca(OH)2 、NH3.H2O
37
(3).溶解性口诀:
钾钠铵盐都可溶, 硝酸盐遇水无踪;
盐酸盐不溶氯化银,硫酸盐不溶硫酸钡;
碳酸盐只溶钾钠铵,碱类只溶钾钠钡钙。
38
根据溶解性口诀,判断下列物质的溶解性。
1. Zn(OH)2:______ 2. AgCl:________
3. NaNO3:________ 4. K2CO3:_______
5. BaSO4:________ 6. BaCl2:________
7. CaCO3:________ 8. Na2CO3:______
9. CuCl2:________ 10. AgNO3:_______
11. BaCO3:_______ 12. Mg(OH)2:______
13. H2SO4:_______ 14. H3PO4:________
不溶
不溶
不溶
不溶
不溶
不溶
溶
溶
溶
溶
溶
溶
溶
溶
39
2.盐的制取
(1)、有些盐是天然存在的。如:食盐、纯碱等,但有些是用化学方法制取。
课本P23活动:在盛有碳酸钠溶液的试管中加入氯化钙溶液,可发现: 。
试管中产生白色沉淀
40
Na2CO3 溶液中含有的离子
CaCl2溶液中含有的离子
2Na
+
CO3
2-
Ca
2+
2Cl
-
2NaCl
CaCO3↓
+
Na2CO3
CaCl2
=
+
碳酸钠溶液和氯化钙溶液反应生成两种新盐:氯化钠和碳酸钙,其反应的原理是:
41
(1)复分解反应概念:由两种化合物相互交换成分生成新的化合物的反应称为复分解反应。
3.复分解反应
为什么KNO3和NaCl不发生复分解反应?
KNO3溶液中含有离子
K+
NO3-
NaCl溶液中含有离子
Na+
Cl-
K+ + NO3- + Na+ + Cl- = Na+ + NO3- + K+ + Cl-
KNO3
NaCl
=
+
KCl
NaNO3
+
AB + CD = AD + CB
42
A发生范围:酸.碱.盐.金属氧化物四大类物质之间
B反应进行的环境:大多数在水溶液中进行
生成沉
淀或气
体或水
盐可以不溶
酸应是强酸
碱可以不溶
金氧可以不溶
两者均可溶
两者均可溶
(2)复分解反应发生的条件是:
43
思考:中和反应是否是复分解反应?
(3)复分解反应口诀:
复分解,两头顾; 先顾头,后顾尾;
顾头要看溶解性, 盐碱盐盐均可溶;
可以反应再顾尾, 产生气体沉淀水;
交换离子写反应, 气体沉淀标符号。
中和反应是复分解反应(它是复分解反应的一个特例,它要求参加反应的化合物必须是酸和碱)。
44
根据酸的共性和碱的共性,以及盐的有关性质,小结能够获得盐的途径有多少?比一比,谁想的多!
制取盐的可能途经:
(8)盐+盐——新盐+新盐
(7)金属+盐——新金属+新盐
(6)碱+酸性氧化物——盐+水
(5)碱+盐——新碱+新盐
(4)酸+盐——新酸+新盐
(2)酸+碱——盐+水
(3)酸+金属氧化物——盐+水
(1)金属+酸——盐+氢气
45
实例1 制硝酸钡:
(1)酸+碱:
(2)酸+盐:
(4)盐+盐:
(3)碱+盐:
HNO3 +Ba(OH)2
== Ba(NO3 )2+2H2O
HNO3 +BaCO3
== Ba(NO3 )2+ H2O + CO2↑
Ba(OH)2 + Cu(NO3 )2
== Ba(NO3 )2 + Cu(OH)2↓
BaCl 2 + Ag NO3
== Ba(NO3) 2 + AgCl↓
46
实例2 侯氏联合制碱法:
我国著名化学家候德榜,发明了候氏制碱法。
向浓氨水中通入足量的二氧化碳生成碳铵,再加入食盐粉未充分搅拌,由于碳酸氢钠在该状态下的溶解度较其他物质要少得多,便呈晶体析出;最后将析出的碳酸氢钠加热便制得了纯碱;请写出该过程的化学方程式并注明反应类型;指出该过程中反应的起始原料和最终产物.
47
思考:你能写出获得ZnCI2的途经有多少?用化学方程式表示。
(1)锌跟氯气反应: Zn + Cl2 === ZnCl2
(2)锌跟盐酸反应 : Zn + 2HCl == ZnCl2 + H2↑
(3)锌跟氯化铜溶液反应: Zn + CuCl2 == ZnCl2 + Cu
(4)氧化锌跟盐酸反应 : ZnO + 2HCl == ZnCl2 + H2O
(5)氢氧化锌跟盐酸反应:
Zn(OH)2 + 2HCl == ZnCl2 + 2H2O
(6)碳酸锌跟盐酸反应:
ZnCO3 + 2HCl == ZnCl2 + H2O + CO2↑
(7)硫酸锌跟氯化钡反应:
ZnSO4 + BaCl2 == ZnCl2 + BaSO4↓
点燃
48
练习:
49
50
51
52
1.6 几种重要的盐
(四)盐与化肥
53
1.什么是化肥
是用矿物、空气、水等做原料,经过化学加工精制而成的肥料。
54
2.化肥类型
① 氮肥:
② 钾肥:
③ 磷肥:
④ 复合肥:
主要含有氮元素的化肥
主要含有钾元素的化肥
主要含有磷元素的化肥
含有两种或两种以上元素的化肥
55
以下各属于哪一类肥料?用线条将它们连起来。
56
3.各种化肥
①氮肥:
常见的氮肥有:
尿素CO(NH2)2
NH4+(铵盐)
NO3-(硝酸盐)
能促使农作物的茎叶生长茂盛,含有组成叶绿素的重要元素。
主要作用有:
氮肥(铵盐)的制取:
常用酸与氨气反应制取
NH3+H2O+CO2 = NH4HCO3(碳铵)
2NH3+H2SO4 = (NH4)2SO4(硫铵)
57
4.铵盐的性质
⑴向硫酸铵浓溶液中滴加氢氧化钠溶液,发生了什么变化?
⑵把湿润的红色石蕊试纸放在试管口,试纸颜色是否发生变化?变化的原因是什么?
58
1.如何检验氮肥(铵盐)?
2.在农村,人们常取少量白色粉末状的化肥和消石灰一起放在手掌心搓,通过闻气味来检验是否是氮肥,这是根据什么原理?
59
②磷肥:
常见的磷肥有:
过磷酸钙 [CaSO4和Ca(H2PO4)的混合物]
重过磷酸钙Ca(H2PO4)2
主要作用有:
能促进农作物根系发达,增强吸收养分和抗寒抗旱能力,促进作物穗数增多、籽粒饱满。
60
③钾肥:
常见的钾肥有:
草木灰(K2CO3)
氯化钾(KCl)
硫酸钾(K2SO4)
主要作用有:
能促使农作物生长旺盛,茎秆粗壮,增强抗病虫害能力,促进糖和淀粉的生成。
61
氮肥(铵盐)是否可以与草木灰混合使用?
化肥有助于植物生长,长期使用化肥好吗?
使用化肥注意:长期使用会造成土壤板结,破坏土壤结构,所以需要施一些农家肥料(有机肥),有利于改良土壤结构,提高土壤肥力。
62
5. 农家肥料(有机肥)
农家肥料中含有大量有机物和多种营养元素(如微量元素硼、锌、铜、锰、钼等)
主要作用有:
有利于改良土壤结构,提高土壤肥力。使作物吸收多种营养元素。
63
练习:
64
65
66
67
68
69
1
1.6 几种重要的盐
(一)什么是盐
2
指出下列物质中哪些是酸,哪些是碱,哪些是盐
H2O CaCO3 HCl H2O2 Na2CO3 Ca(OH)2 MnO2 H2SO4 NaOH
课前测评:
3
思考:有人讲,盐就是食盐,你认为对吗?
答:这种说法是错误的。食盐是盐,但盐是一类数量很大的化合物,食盐只是其中的一种。科学上盐是指能电离出金属阳离子(或铵根离子)和酸根阴离子的化合物,如硫酸铜、碳酸钠、硝酸铵。
4
盐:电离时能产生金属阳离子(或铵根离子)和酸根阴离子的化合物,叫做盐。
判断:1、凡是盐物质里一定含有金属元素。
2、盐就是食盐,食盐就是盐。
盐:酸和碱反应生成物质(除水外)都可叫做盐。
什么是盐?
×
×
5
思考:
除了食盐,你还见过其他盐的晶体
硫酸铜 晶体
碳酸钙矿地
硫酸亚铁 晶体
碳酸钠晶体
6
自然界中的盐晶体非常美丽
绿矾
硝酸钾
明矾
锆 石
7
氯化钠晶体
硫酸铜晶体
绿柱石
橄榄石:含硅酸盐
8
练习:
9
10
11
1.6 几种重要的盐
(二)几种盐的性质
12
一、碳酸钠
1) 俗称:____又称_____.
2) 是一种__色粉末,易溶于__。
纯碱
苏打
白
水
【活动】
探究实验:往碳酸钠溶液中滴入酚酞试剂,发现什么现象?
溶液变红
结论:
碳酸钠的水溶液呈碱性。
这是纯碱名称的由来,这是碳酸钠的( )性质
化学
13
碳酸钠≠碳酸钠晶体
碳酸钠(Na2CO3)俗称纯碱、苏打;碳酸钠晶体(Na2CO3 10H2O)俗称晶碱、天然碱;它们都是白色固体,易溶于水,水溶液呈碱性;广泛用于化工、玻璃、纺织、制药和食品。
同样的道理,CuSO4≠CuSO4.5H2O
14
碳酸钠(Na2CO3)俗称纯碱.苏打,白色粉末,它从溶液里结晶析出时,结合一定数目的结晶水分子而成为Na2CO3·10H2O(碳酸钠晶体)
碳酸钠晶体Na2CO3·10H2O俗称晶碱.天然碱,在干燥空气里,碳酸钠晶体能逐渐失去结晶水而成为碳酸钠粉末,此现象叫做风化.
15
溶液中
结晶析出
干燥空
气中风化
思考:结晶水合物是混合物吗?使结晶水合物失去结晶水的现象是否属于化学变化?
16
CuSO4.5H2O Na2CO3 10H2O
结晶水
常见的结晶水合物
说明:结晶水合物是纯净物,化学式中的“·”表示化合.
17
Na2CO3 10H2O == Na2CO3+10H2O
硫酸铜晶体不易风化,加热才分解.
碳酸钠晶体在干燥空气中易风化
露置空气中质量减少且变质
CuSO4.5H2O == CuSO4 + 5H2O
△
18
钟乳石
大理石
贝壳
珍珠
鸡蛋壳
它们的主要成分都含有( )
锅炉里的水垢
水壶里的水垢
水垢
碳酸钙
19
二、碳酸钙:CaCO3
用途:
Ca(OH)2+H2CO3 = CaCO3↓ +2H2O
建筑材料、制水泥和玻璃的原料等
碳酸钙是一种难溶的盐,是Ca(OH)2 和H2CO3的中和产物
20
思考:1、长期盛放石灰水的试剂瓶会有一层白色物质,请问这是什么物质?怎么形成的?如何除去?
这是碳酸钙。
形成:CO2+Ca(OH)2==CaCO3↓+H2O
可以用稀盐酸除去
21
2.如何除去热水瓶中的水垢(CaCO3、MgCO3)?(用化学方程式表示)
CaCO3+2HCl=CaCl2+H2O+CO2↑
MgCO3+2HCl=MgCl2+H2O+CO2↑
22
都含有碳酸根
CO32-
统 称
碳酸盐
碳 酸 钠:
碳 酸 钾:
碳 酸 钙:
碳 酸 镁:
Na2 CO3
K2 CO3
Ca CO3
Mg CO3
碳酸盐
观察下列化学式,分析它们有什么共同点?
23
思考:怎样证明一块岩石是碳酸盐
盐酸
澄清石灰水
冒气泡
CaCO3+2HCl=CaCl2+CO2↑+H2O
变浑浊
写出上述反应的方程式:
CO2+Ca(OH)2=CaCO3↓+H2O
24
碳酸盐(CO32-)检验方法:
加入盐酸产生能使澄清石灰水变浑浊的气体(CO2),则原物质含有碳酸盐(即含有碳酸根离子)
25
井盐
海盐
湖盐
岩盐
自然界中的食盐
26
食盐在自然中分布广,但主要存在于海水中。
海水
粗盐
蒸发
溶解、过滤、蒸发
精盐
27
探究汗液里有什么:
收集一些汗液盛放在试管中,滴入几滴硝酸
银溶液,有什么现象产生
反应的化学方程式:
产生白色沉淀
NaCl+AgNO3=AgCl↓+NaNO3
实验:食盐溶液盛放在试管中,滴入几滴硝酸银溶液,有什么现象产生 写出化学方程式。
NaCl+AgNO3=AgCl↓+NaNO3
28
检验氯离子的方法
滴加AgNO3溶液,如果产生一种不溶于稀HNO3的白色沉淀,则该物质中含有Cl-。
29
氯化钠
碳酸钠
碳酸钙
NaCl == Na+ + Cl-
Na2CO3==2Na+ + CO32-
CaCO3 == Ca2+ + CO32-
金属
阳离子
酸根
阴离子
盐
=
+
盐
30
练习:
31
32
33
1.6 几种重要的盐
(三)盐的制取
34
1.盐的分类
(1).根据盐的溶解性的不同可将盐分为________盐和_______盐。
常见盐的溶解性表:
可溶性
不溶性
35
碱溶 钾钠钡钙氨
大多酸溶水中间
钾钠铵盐均易溶
硝酸 盐遇水影无踪
氯化物不溶 氯化银
硫酸 盐不 溶 硫酸 钡
碳酸 盐只溶 钾钠铵
硫酸 盐微溶 是银钙
36
(2).记忆规律:
可溶性盐:钾盐(含K+)、钠盐(含Na+)
大部分碳酸盐如CaCO3、BaCO3、MgCO3等
铵盐(含NH4+)、硝酸盐(含NO3-)
硫酸钡BaSO4、 氯化银AgCI
不可溶性盐:
不溶性碱:
Fe(OH)3、Cu(OH)2、Mg(OH)2等
可溶性碱:
KOH 、NaOH 、Ba(OH)2Ca(OH)2 、NH3.H2O
37
(3).溶解性口诀:
钾钠铵盐都可溶, 硝酸盐遇水无踪;
盐酸盐不溶氯化银,硫酸盐不溶硫酸钡;
碳酸盐只溶钾钠铵,碱类只溶钾钠钡钙。
38
根据溶解性口诀,判断下列物质的溶解性。
1. Zn(OH)2:______ 2. AgCl:________
3. NaNO3:________ 4. K2CO3:_______
5. BaSO4:________ 6. BaCl2:________
7. CaCO3:________ 8. Na2CO3:______
9. CuCl2:________ 10. AgNO3:_______
11. BaCO3:_______ 12. Mg(OH)2:______
13. H2SO4:_______ 14. H3PO4:________
不溶
不溶
不溶
不溶
不溶
不溶
溶
溶
溶
溶
溶
溶
溶
溶
39
2.盐的制取
(1)、有些盐是天然存在的。如:食盐、纯碱等,但有些是用化学方法制取。
课本P23活动:在盛有碳酸钠溶液的试管中加入氯化钙溶液,可发现: 。
试管中产生白色沉淀
40
Na2CO3 溶液中含有的离子
CaCl2溶液中含有的离子
2Na
+
CO3
2-
Ca
2+
2Cl
-
2NaCl
CaCO3↓
+
Na2CO3
CaCl2
=
+
碳酸钠溶液和氯化钙溶液反应生成两种新盐:氯化钠和碳酸钙,其反应的原理是:
41
(1)复分解反应概念:由两种化合物相互交换成分生成新的化合物的反应称为复分解反应。
3.复分解反应
为什么KNO3和NaCl不发生复分解反应?
KNO3溶液中含有离子
K+
NO3-
NaCl溶液中含有离子
Na+
Cl-
K+ + NO3- + Na+ + Cl- = Na+ + NO3- + K+ + Cl-
KNO3
NaCl
=
+
KCl
NaNO3
+
AB + CD = AD + CB
42
A发生范围:酸.碱.盐.金属氧化物四大类物质之间
B反应进行的环境:大多数在水溶液中进行
生成沉
淀或气
体或水
盐可以不溶
酸应是强酸
碱可以不溶
金氧可以不溶
两者均可溶
两者均可溶
(2)复分解反应发生的条件是:
43
思考:中和反应是否是复分解反应?
(3)复分解反应口诀:
复分解,两头顾; 先顾头,后顾尾;
顾头要看溶解性, 盐碱盐盐均可溶;
可以反应再顾尾, 产生气体沉淀水;
交换离子写反应, 气体沉淀标符号。
中和反应是复分解反应(它是复分解反应的一个特例,它要求参加反应的化合物必须是酸和碱)。
44
根据酸的共性和碱的共性,以及盐的有关性质,小结能够获得盐的途径有多少?比一比,谁想的多!
制取盐的可能途经:
(8)盐+盐——新盐+新盐
(7)金属+盐——新金属+新盐
(6)碱+酸性氧化物——盐+水
(5)碱+盐——新碱+新盐
(4)酸+盐——新酸+新盐
(2)酸+碱——盐+水
(3)酸+金属氧化物——盐+水
(1)金属+酸——盐+氢气
45
实例1 制硝酸钡:
(1)酸+碱:
(2)酸+盐:
(4)盐+盐:
(3)碱+盐:
HNO3 +Ba(OH)2
== Ba(NO3 )2+2H2O
HNO3 +BaCO3
== Ba(NO3 )2+ H2O + CO2↑
Ba(OH)2 + Cu(NO3 )2
== Ba(NO3 )2 + Cu(OH)2↓
BaCl 2 + Ag NO3
== Ba(NO3) 2 + AgCl↓
46
实例2 侯氏联合制碱法:
我国著名化学家候德榜,发明了候氏制碱法。
向浓氨水中通入足量的二氧化碳生成碳铵,再加入食盐粉未充分搅拌,由于碳酸氢钠在该状态下的溶解度较其他物质要少得多,便呈晶体析出;最后将析出的碳酸氢钠加热便制得了纯碱;请写出该过程的化学方程式并注明反应类型;指出该过程中反应的起始原料和最终产物.
47
思考:你能写出获得ZnCI2的途经有多少?用化学方程式表示。
(1)锌跟氯气反应: Zn + Cl2 === ZnCl2
(2)锌跟盐酸反应 : Zn + 2HCl == ZnCl2 + H2↑
(3)锌跟氯化铜溶液反应: Zn + CuCl2 == ZnCl2 + Cu
(4)氧化锌跟盐酸反应 : ZnO + 2HCl == ZnCl2 + H2O
(5)氢氧化锌跟盐酸反应:
Zn(OH)2 + 2HCl == ZnCl2 + 2H2O
(6)碳酸锌跟盐酸反应:
ZnCO3 + 2HCl == ZnCl2 + H2O + CO2↑
(7)硫酸锌跟氯化钡反应:
ZnSO4 + BaCl2 == ZnCl2 + BaSO4↓
点燃
48
练习:
49
50
51
52
1.6 几种重要的盐
(四)盐与化肥
53
1.什么是化肥
是用矿物、空气、水等做原料,经过化学加工精制而成的肥料。
54
2.化肥类型
① 氮肥:
② 钾肥:
③ 磷肥:
④ 复合肥:
主要含有氮元素的化肥
主要含有钾元素的化肥
主要含有磷元素的化肥
含有两种或两种以上元素的化肥
55
以下各属于哪一类肥料?用线条将它们连起来。
56
3.各种化肥
①氮肥:
常见的氮肥有:
尿素CO(NH2)2
NH4+(铵盐)
NO3-(硝酸盐)
能促使农作物的茎叶生长茂盛,含有组成叶绿素的重要元素。
主要作用有:
氮肥(铵盐)的制取:
常用酸与氨气反应制取
NH3+H2O+CO2 = NH4HCO3(碳铵)
2NH3+H2SO4 = (NH4)2SO4(硫铵)
57
4.铵盐的性质
⑴向硫酸铵浓溶液中滴加氢氧化钠溶液,发生了什么变化?
⑵把湿润的红色石蕊试纸放在试管口,试纸颜色是否发生变化?变化的原因是什么?
58
1.如何检验氮肥(铵盐)?
2.在农村,人们常取少量白色粉末状的化肥和消石灰一起放在手掌心搓,通过闻气味来检验是否是氮肥,这是根据什么原理?
59
②磷肥:
常见的磷肥有:
过磷酸钙 [CaSO4和Ca(H2PO4)的混合物]
重过磷酸钙Ca(H2PO4)2
主要作用有:
能促进农作物根系发达,增强吸收养分和抗寒抗旱能力,促进作物穗数增多、籽粒饱满。
60
③钾肥:
常见的钾肥有:
草木灰(K2CO3)
氯化钾(KCl)
硫酸钾(K2SO4)
主要作用有:
能促使农作物生长旺盛,茎秆粗壮,增强抗病虫害能力,促进糖和淀粉的生成。
61
氮肥(铵盐)是否可以与草木灰混合使用?
化肥有助于植物生长,长期使用化肥好吗?
使用化肥注意:长期使用会造成土壤板结,破坏土壤结构,所以需要施一些农家肥料(有机肥),有利于改良土壤结构,提高土壤肥力。
62
5. 农家肥料(有机肥)
农家肥料中含有大量有机物和多种营养元素(如微量元素硼、锌、铜、锰、钼等)
主要作用有:
有利于改良土壤结构,提高土壤肥力。使作物吸收多种营养元素。
63
练习:
64
65
66
67
68
69
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
