2.1.3钠盐与焰色试验(课件)(共38张PPT)2023-2024学年高一化学同步备课课件(人教版2019必修第一册)
文档属性
| 名称 | 2.1.3钠盐与焰色试验(课件)(共38张PPT)2023-2024学年高一化学同步备课课件(人教版2019必修第一册) |  | |
| 格式 | pptx | ||
| 文件大小 | 61.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-20 10:48:38 | ||
图片预览








文档简介
(共38张PPT)
第二章 海水中的重要元素—钠和氯
第一节 钠及其化合物
第3课时 钠盐、焰色试验
课程标准要求
结合真实情境中应用实例或通过实验探究,了解碳酸钠和碳酸氢钠的主要性质;
了解碳酸钠和碳酸氢钠在生产、生活中的应用;
了解焰色试验及操作过程。
课程标准要求与核心素养发展目标
核心素养发展目标
基于实验探究认识Na2CO3、NaHCO3的相关性质,理解并掌握Na2CO3、NaHCO3相互转化的途径;
了解焰色试验的现象及原理;
通过Na2CO3、NaHCO3的鉴别与除杂,培养学生的转化意识、宏观辨识与微观探析的核心素养。
课程标准要求与核心素养发展目标
本节重点
本节难点
Na2CO3、NaHCO3的鉴别与除杂
Na2CO3、NaHCO3的相关性质
本节重、难点
侯氏制碱法
侯德榜
Na2CO3
加工饼干、蛋糕等食品时常用到小苏打,小苏打起什么作用?
NaHCO3
用途
Na2CO3
纺织
制皂
制玻璃
造纸
合成洗涤剂
一
用途
NaHCO3
发酵剂 焙制糕点
发酵粉
治疗胃酸过多
一
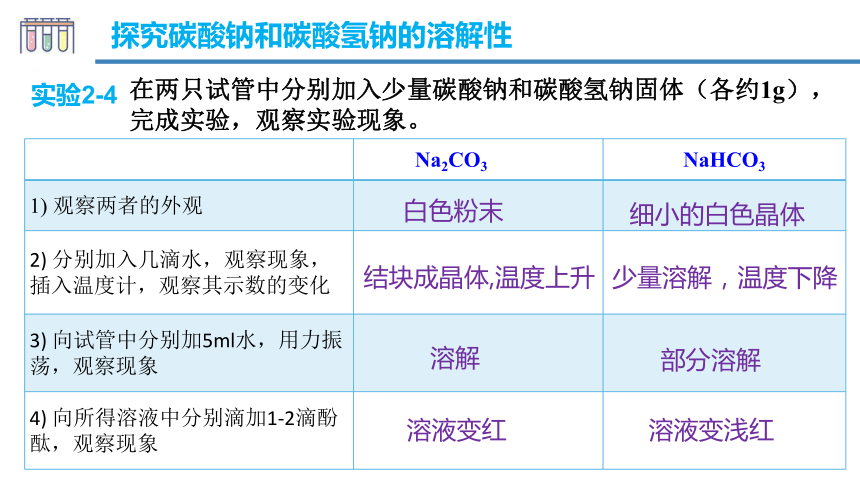
探究碳酸钠和碳酸氢钠的溶解性
在两只试管中分别加入少量碳酸钠和碳酸氢钠固体(各约1g),完成实验,观察实验现象。
实验2-4
探究碳酸钠和碳酸氢钠的溶解性
在两只试管中分别加入少量碳酸钠和碳酸氢钠固体(各约1g),完成实验,观察实验现象。
实验2-4
Na2CO3碳酸钠 碳酸NaHCO3氢钠
1) 观察两者的外观
2) 分别加入几滴水,观察现象,插入温度计,观察其示数的变化
3) 向试管中分别加5ml水,用力振荡,观察现象
4) 向所得溶液中分别滴加1-2滴酚酞,观察现象
白色粉末
细小的白色晶体
结块成晶体,温度上升
少量溶解,温度下降
溶解
部分溶解
溶液变红
溶液变浅红
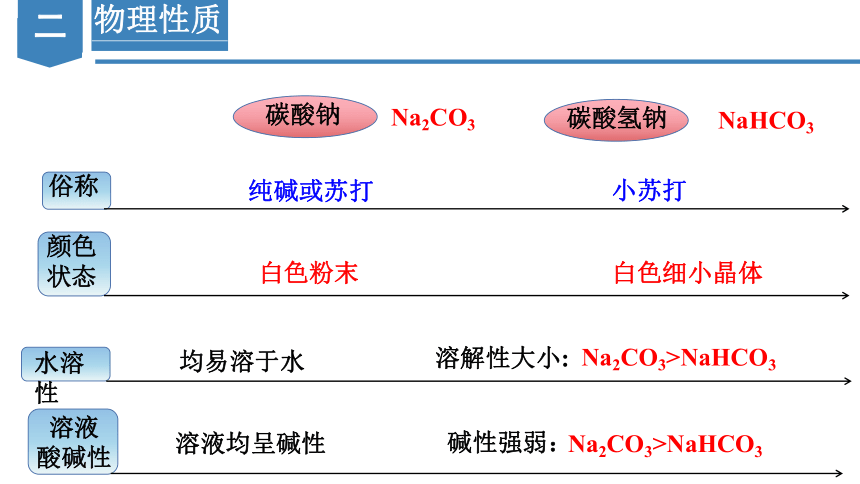
物理性质
俗称
碳酸钠
碳酸氢钠
颜色
状态
Na2CO3
NaHCO3
纯碱或苏打
小苏打
白色粉末
白色细小晶体
水溶性
均易溶于水
溶解性大小:
Na2CO3>NaHCO3
溶液
酸碱性
溶液均呈碱性
碱性强弱:
Na2CO3>NaHCO3
二
Na2CO3 · xH2O
(白色晶体)
Na2CO3
(白色粉末)
风化
失去结晶水
+ H2O
生活中的碳酸钠
防止受潮
化学性质
三
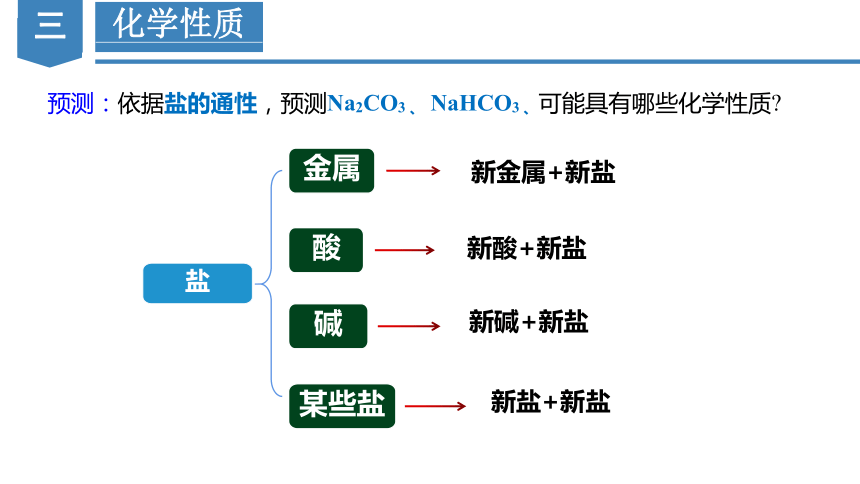
盐
金属
碱
酸
预测:依据盐的通性,预测Na2CO3 、 NaHCO3 、可能具有哪些化学性质
某些盐
新金属+新盐
新酸+新盐
新碱+新盐
新盐+新盐
面包为什么松软可口?
生活中的碳酸氢钠
避免阳光直射,置放阴凉干燥处。
探究碳酸钠和碳酸氢钠的热稳定性
实验2-5
取等量的碳酸氢钠和 碳酸钠 ( 约1g)分别置于两支试管加热。
探究碳酸钠和碳酸氢钠的热稳定性
实验2-5
取等量的碳酸氢钠和 碳酸钠 ( 约1g)分别置于两支试管加热。
碳Na2CO3酸钠 NaHCO3碳酸氢钠
装置
现象
结论
无现象
加热分解,不稳定
试管口有水珠,
澄清石灰水变浑浊
加热不分解,稳定
化学性质
三
热稳定性
Na2CO3 > NaHCO3
2NaHCO3 == Na2CO3 + H2O + CO2 ↑
思考:
如何同时实现对Na2CO3和NaHCO3稳定性的探究?
化学性质
三
与盐酸反应
【实验拓展】
在两支试管中分别加入等质量NaHCO3和Na2CO3,滴加等体积的稀盐酸,观察现象。
化学性质
Na2CO3
少量盐酸:
过量盐酸:
CO32- + H+ = HCO3-
Na2CO3 + HCl=== NaHCO3 + NaCl
Na2CO3 + 2HCl=== 2NaCl+H2O +CO2↑
CO32- + 2H+ = H2O + CO2↑
三
与盐酸反应
【实验拓展】
在两支试管中分别加入等质量NaHCO3和Na2CO3,滴加等体积的稀盐酸,观察现象。
现象:过一小段时间才产生气泡,速率较慢。
等质量的Na2CO3 NaHCO3与足量盐酸反应,NaHCO3产生CO2更多。
化学性质
NaHCO3 +HCl===NaCl+H2O+CO2↑
NaHCO3
HCO3- + H+ = H2O + CO2↑
三
与盐酸反应
现象:立即产生气泡,速率较快。
思考:为何不用碳酸钠来治疗胃酸过多,而是采用碳酸氢钠?
Na2CO3碱性较强,反应速率较慢;NaHCO3碱性较弱,反应速率快。
温馨提示:胃痛类型很多,胃溃疡不能吃含有
小苏打的药物进行治疗,反而会加重病情!
化学性质
三
向澄清石灰水持续通入二氧化碳,发现澄清石灰水先变浑浊后又变清,你知道为什么吗?
【类比】若将澄清石灰水换成饱和碳酸钠,会有什么现象呢?
现象:溶液变浑浊或有晶体析出
Na2CO3 + CO2 + H2O = 2NaHCO3↓
思考:
与CO2反应
Na2CO3
NaHCO3
不反应
化学性质
Na2CO3
NaHCO3
NaHCO3 + NaOH = Na2CO3 + H2O
HCO3- + OH- = H2O + CO32-
不反应
与碱:NaOH反应
三
与碱:Ca(OH)2反应
Na2CO3
Na2CO3 + Ca(OH)2 === CaCO3↓+ 2NaOH
CO32- + Ca2+ = CaCO3↓
NaHCO3
能反应,产生白色沉淀
化学性质
与盐:BaCl2反应
Na2CO3 + BaCl2 = BaCO3↓+ 2NaCl
Na2CO3
NaHCO3
不反应
三
与盐:CaCl2反应
Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl
Na2CO3
NaHCO3
不反应
鉴别与除杂
1.碳酸钠与碳酸氢钠的鉴别方法
固体
加热
无明显变化的是Na2CO3
放出无色无味的使澄清石灰水变浑浊的气体是NaHCO3
利用热稳定性不同
四
鉴别与除杂
固体
(或溶液)
盐酸
产生气泡速率快的是NaHCO3
反应速率
滴加盐酸
产生气泡速率慢的是Na2CO3
滴加盐酸立即产生气泡的是NaHCO3
滴加盐酸开始不产生气泡的是Na2CO3
利用和酸反应生成气体的速率不同(相同条件下)
1.碳酸钠与碳酸氢钠的鉴别方法
四
鉴别与除杂
1.碳酸钠与碳酸氢钠的鉴别方法
溶液
CaCl2或 BaCl2溶液
产生白色沉淀的是Na2CO3
不产生白色沉淀的是NaHCO3
利用阴离子的不同
四
鉴别与除杂
加热
通入足量的CO2气体
加入适量的NaOH溶液
2.碳酸钠与碳酸氢钠的除杂
四
Na2CO3 NaHCO3
①通入CO2②少量的盐酸
①固体加热
②溶液滴加NaOH溶液
我们在观察Na的燃烧时,发现火焰呈黄色,其实很多金属或者其化合物在灼烧时都会使火焰呈现出特殊的颜色。
焰色试验
定义
很多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色,这在化学上叫做焰色试验。
火焰颜色
元素的性质,物理变化
Na:黄色
K: 紫色( 透过蓝色钴玻璃 )
Cu:绿色
五
黄色
紫色
砖红色
洋红色
绿色
紫红色
黄绿色
焰色试验
实验步骤
洗 → 烧 → 蘸 → 烧 → 洗
(2)利用焰色反应制节日烟花
(1)检验金属元素的存在
如:鉴别NaCl和KCl溶液
应用
五
Na2CO3、NaHCO3的用途
Na2CO3、NaHCO3的
物理性质
Na2CO3、NaHCO3的
化学性质
焰色试验
课堂小结
1. 膨松剂指食品加工中添加于生产焙烤食品的主要原料小麦粉中,使面坯起发,形成致密多孔组织,从而使制品具有膨松、柔软或酥脆的一类物质。为使以面粉为原料的面包松软可口,通常用碳酸氢钠作膨松剂,因为它①热稳定性差 ②增加甜味 ③产生二氧化碳 ④提供钠离子。其中合理的是( )
A.②③ B.①③
C.①④ D.③④
B
2.下列有关焰色试验的叙述正确的是( )
A.可用铜丝代替铂丝进行试验
B.观察钾的焰色试验要透过蓝色钴玻璃
C.实验结束后,要用碳酸钠溶液洗净铂丝
D.焰色试验是指金属在加热灼烧时火焰呈现特殊的颜色,是物质的化学性质
B
3.下列有关Na2CO3与NaHCO3的性质比较中不正确的是( )
A.相同溶质质量分数两溶液的碱性:Na2CO3>NaHCO3
B.相同条件下在水中的溶解度:Na2CO3>NaHCO3
C.与相同溶质质量分数的稀硫酸反应放出气泡的速率:NaHCO3D.热稳定性:NaHCO3C
4. 下列可用于判断碳酸氢钠粉末中混有碳酸钠的实验方法及现象的是( )
A.加热时无气体放出
B.滴加盐酸时有气泡放出
C.溶于水后滴加BaCl2稀溶液有白色沉淀生成
D.溶于水后滴加澄清石灰水有白色沉淀生成
C
5.下列实验方法能达到实验目的的是( )
A.加热可除去NaHCO3固体中少量的Na2CO3
B.用澄清石灰水鉴别碳酸钠和碳酸氢钠溶液
C.用NaOH溶液鉴别BaCl2溶液和MgCl2溶液
D.用闻气味的方法鉴别CO2和CO
C
6.如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )
A.a先通入CO2,然后b通入NH3,c中放碱石灰
B.a先通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
C.b先通入NH3,然后a通入CO2,c中放碱石灰
D.b先通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
B
第3课时 钠盐、焰色试验
Thanks
谢谢观看
第二章 海水中的重要元素—钠和氯
第一节 钠及其化合物
第3课时 钠盐、焰色试验
课程标准要求
结合真实情境中应用实例或通过实验探究,了解碳酸钠和碳酸氢钠的主要性质;
了解碳酸钠和碳酸氢钠在生产、生活中的应用;
了解焰色试验及操作过程。
课程标准要求与核心素养发展目标
核心素养发展目标
基于实验探究认识Na2CO3、NaHCO3的相关性质,理解并掌握Na2CO3、NaHCO3相互转化的途径;
了解焰色试验的现象及原理;
通过Na2CO3、NaHCO3的鉴别与除杂,培养学生的转化意识、宏观辨识与微观探析的核心素养。
课程标准要求与核心素养发展目标
本节重点
本节难点
Na2CO3、NaHCO3的鉴别与除杂
Na2CO3、NaHCO3的相关性质
本节重、难点
侯氏制碱法
侯德榜
Na2CO3
加工饼干、蛋糕等食品时常用到小苏打,小苏打起什么作用?
NaHCO3
用途
Na2CO3
纺织
制皂
制玻璃
造纸
合成洗涤剂
一
用途
NaHCO3
发酵剂 焙制糕点
发酵粉
治疗胃酸过多
一
探究碳酸钠和碳酸氢钠的溶解性
在两只试管中分别加入少量碳酸钠和碳酸氢钠固体(各约1g),完成实验,观察实验现象。
实验2-4
探究碳酸钠和碳酸氢钠的溶解性
在两只试管中分别加入少量碳酸钠和碳酸氢钠固体(各约1g),完成实验,观察实验现象。
实验2-4
Na2CO3碳酸钠 碳酸NaHCO3氢钠
1) 观察两者的外观
2) 分别加入几滴水,观察现象,插入温度计,观察其示数的变化
3) 向试管中分别加5ml水,用力振荡,观察现象
4) 向所得溶液中分别滴加1-2滴酚酞,观察现象
白色粉末
细小的白色晶体
结块成晶体,温度上升
少量溶解,温度下降
溶解
部分溶解
溶液变红
溶液变浅红
物理性质
俗称
碳酸钠
碳酸氢钠
颜色
状态
Na2CO3
NaHCO3
纯碱或苏打
小苏打
白色粉末
白色细小晶体
水溶性
均易溶于水
溶解性大小:
Na2CO3>NaHCO3
溶液
酸碱性
溶液均呈碱性
碱性强弱:
Na2CO3>NaHCO3
二
Na2CO3 · xH2O
(白色晶体)
Na2CO3
(白色粉末)
风化
失去结晶水
+ H2O
生活中的碳酸钠
防止受潮
化学性质
三
盐
金属
碱
酸
预测:依据盐的通性,预测Na2CO3 、 NaHCO3 、可能具有哪些化学性质
某些盐
新金属+新盐
新酸+新盐
新碱+新盐
新盐+新盐
面包为什么松软可口?
生活中的碳酸氢钠
避免阳光直射,置放阴凉干燥处。
探究碳酸钠和碳酸氢钠的热稳定性
实验2-5
取等量的碳酸氢钠和 碳酸钠 ( 约1g)分别置于两支试管加热。
探究碳酸钠和碳酸氢钠的热稳定性
实验2-5
取等量的碳酸氢钠和 碳酸钠 ( 约1g)分别置于两支试管加热。
碳Na2CO3酸钠 NaHCO3碳酸氢钠
装置
现象
结论
无现象
加热分解,不稳定
试管口有水珠,
澄清石灰水变浑浊
加热不分解,稳定
化学性质
三
热稳定性
Na2CO3 > NaHCO3
2NaHCO3 == Na2CO3 + H2O + CO2 ↑
思考:
如何同时实现对Na2CO3和NaHCO3稳定性的探究?
化学性质
三
与盐酸反应
【实验拓展】
在两支试管中分别加入等质量NaHCO3和Na2CO3,滴加等体积的稀盐酸,观察现象。
化学性质
Na2CO3
少量盐酸:
过量盐酸:
CO32- + H+ = HCO3-
Na2CO3 + HCl=== NaHCO3 + NaCl
Na2CO3 + 2HCl=== 2NaCl+H2O +CO2↑
CO32- + 2H+ = H2O + CO2↑
三
与盐酸反应
【实验拓展】
在两支试管中分别加入等质量NaHCO3和Na2CO3,滴加等体积的稀盐酸,观察现象。
现象:过一小段时间才产生气泡,速率较慢。
等质量的Na2CO3 NaHCO3与足量盐酸反应,NaHCO3产生CO2更多。
化学性质
NaHCO3 +HCl===NaCl+H2O+CO2↑
NaHCO3
HCO3- + H+ = H2O + CO2↑
三
与盐酸反应
现象:立即产生气泡,速率较快。
思考:为何不用碳酸钠来治疗胃酸过多,而是采用碳酸氢钠?
Na2CO3碱性较强,反应速率较慢;NaHCO3碱性较弱,反应速率快。
温馨提示:胃痛类型很多,胃溃疡不能吃含有
小苏打的药物进行治疗,反而会加重病情!
化学性质
三
向澄清石灰水持续通入二氧化碳,发现澄清石灰水先变浑浊后又变清,你知道为什么吗?
【类比】若将澄清石灰水换成饱和碳酸钠,会有什么现象呢?
现象:溶液变浑浊或有晶体析出
Na2CO3 + CO2 + H2O = 2NaHCO3↓
思考:
与CO2反应
Na2CO3
NaHCO3
不反应
化学性质
Na2CO3
NaHCO3
NaHCO3 + NaOH = Na2CO3 + H2O
HCO3- + OH- = H2O + CO32-
不反应
与碱:NaOH反应
三
与碱:Ca(OH)2反应
Na2CO3
Na2CO3 + Ca(OH)2 === CaCO3↓+ 2NaOH
CO32- + Ca2+ = CaCO3↓
NaHCO3
能反应,产生白色沉淀
化学性质
与盐:BaCl2反应
Na2CO3 + BaCl2 = BaCO3↓+ 2NaCl
Na2CO3
NaHCO3
不反应
三
与盐:CaCl2反应
Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl
Na2CO3
NaHCO3
不反应
鉴别与除杂
1.碳酸钠与碳酸氢钠的鉴别方法
固体
加热
无明显变化的是Na2CO3
放出无色无味的使澄清石灰水变浑浊的气体是NaHCO3
利用热稳定性不同
四
鉴别与除杂
固体
(或溶液)
盐酸
产生气泡速率快的是NaHCO3
反应速率
滴加盐酸
产生气泡速率慢的是Na2CO3
滴加盐酸立即产生气泡的是NaHCO3
滴加盐酸开始不产生气泡的是Na2CO3
利用和酸反应生成气体的速率不同(相同条件下)
1.碳酸钠与碳酸氢钠的鉴别方法
四
鉴别与除杂
1.碳酸钠与碳酸氢钠的鉴别方法
溶液
CaCl2或 BaCl2溶液
产生白色沉淀的是Na2CO3
不产生白色沉淀的是NaHCO3
利用阴离子的不同
四
鉴别与除杂
加热
通入足量的CO2气体
加入适量的NaOH溶液
2.碳酸钠与碳酸氢钠的除杂
四
Na2CO3 NaHCO3
①通入CO2②少量的盐酸
①固体加热
②溶液滴加NaOH溶液
我们在观察Na的燃烧时,发现火焰呈黄色,其实很多金属或者其化合物在灼烧时都会使火焰呈现出特殊的颜色。
焰色试验
定义
很多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色,这在化学上叫做焰色试验。
火焰颜色
元素的性质,物理变化
Na:黄色
K: 紫色( 透过蓝色钴玻璃 )
Cu:绿色
五
黄色
紫色
砖红色
洋红色
绿色
紫红色
黄绿色
焰色试验
实验步骤
洗 → 烧 → 蘸 → 烧 → 洗
(2)利用焰色反应制节日烟花
(1)检验金属元素的存在
如:鉴别NaCl和KCl溶液
应用
五
Na2CO3、NaHCO3的用途
Na2CO3、NaHCO3的
物理性质
Na2CO3、NaHCO3的
化学性质
焰色试验
课堂小结
1. 膨松剂指食品加工中添加于生产焙烤食品的主要原料小麦粉中,使面坯起发,形成致密多孔组织,从而使制品具有膨松、柔软或酥脆的一类物质。为使以面粉为原料的面包松软可口,通常用碳酸氢钠作膨松剂,因为它①热稳定性差 ②增加甜味 ③产生二氧化碳 ④提供钠离子。其中合理的是( )
A.②③ B.①③
C.①④ D.③④
B
2.下列有关焰色试验的叙述正确的是( )
A.可用铜丝代替铂丝进行试验
B.观察钾的焰色试验要透过蓝色钴玻璃
C.实验结束后,要用碳酸钠溶液洗净铂丝
D.焰色试验是指金属在加热灼烧时火焰呈现特殊的颜色,是物质的化学性质
B
3.下列有关Na2CO3与NaHCO3的性质比较中不正确的是( )
A.相同溶质质量分数两溶液的碱性:Na2CO3>NaHCO3
B.相同条件下在水中的溶解度:Na2CO3>NaHCO3
C.与相同溶质质量分数的稀硫酸反应放出气泡的速率:NaHCO3
4. 下列可用于判断碳酸氢钠粉末中混有碳酸钠的实验方法及现象的是( )
A.加热时无气体放出
B.滴加盐酸时有气泡放出
C.溶于水后滴加BaCl2稀溶液有白色沉淀生成
D.溶于水后滴加澄清石灰水有白色沉淀生成
C
5.下列实验方法能达到实验目的的是( )
A.加热可除去NaHCO3固体中少量的Na2CO3
B.用澄清石灰水鉴别碳酸钠和碳酸氢钠溶液
C.用NaOH溶液鉴别BaCl2溶液和MgCl2溶液
D.用闻气味的方法鉴别CO2和CO
C
6.如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )
A.a先通入CO2,然后b通入NH3,c中放碱石灰
B.a先通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
C.b先通入NH3,然后a通入CO2,c中放碱石灰
D.b先通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
B
第3课时 钠盐、焰色试验
Thanks
谢谢观看
