2.1.2+氧化纳和过氧化钠(课件)(25张ppt)2023-2024学年高一化学同步备课课件(人教版2019必修第一册)
文档属性
| 名称 | 2.1.2+氧化纳和过氧化钠(课件)(25张ppt)2023-2024学年高一化学同步备课课件(人教版2019必修第一册) |

|
|
| 格式 | pptx | ||
| 文件大小 | 25.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-20 10:47:04 | ||
图片预览





文档简介
(共25张PPT)
第二章 海水中的重要元素—钠和氯
第一节 钠及其化合物
第2课时 钠的氧化物
课程标准要求与核心素养发展目标
课程标准要求
核心素养发展目标
结合真实情境中的应用实 例或通过实验探究,了解钠的氧化物的主要性质;
了解钠的氧化物在生产、生活中的应用
从物质类别、元素化合价的角度认识氧化钠与过氧化钠的性质,熟知过氧化钠与水和二氧化碳反应的应用;
会设计实验探究过氧化钠与水的反应,增强科学探究与创新意识;
掌握Na2O2的相关计算。
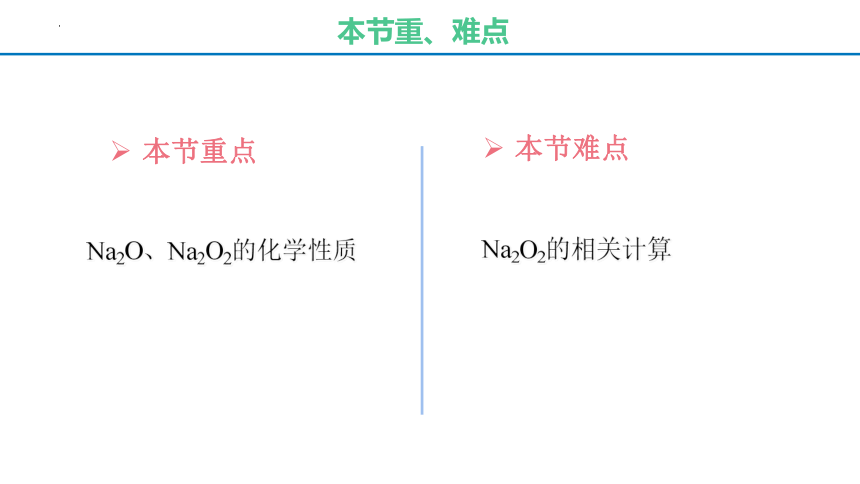
本节重、难点
本节重点
本节难点
Na2O2的相关计算
Na2O、Na2O2的化学性质
情境引入
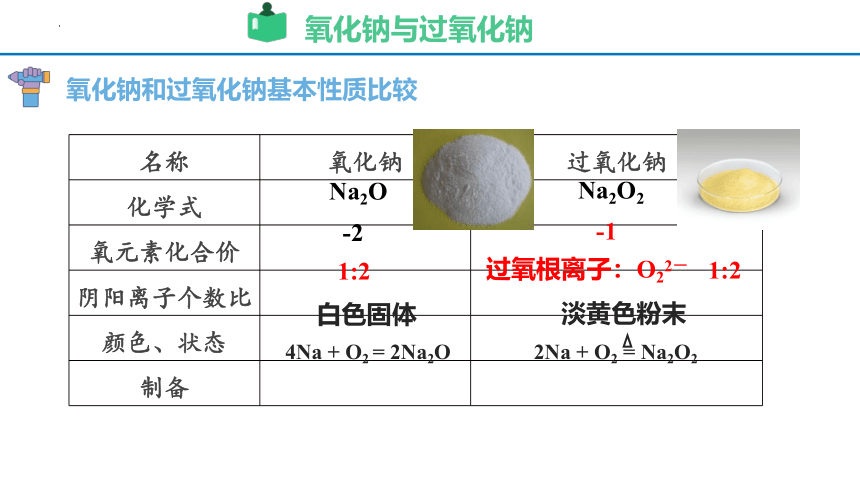
名称 氧化钠 过氧化钠
化学式
氧元素化合价
阴阳离子个数比
颜色、状态
制备
氧化钠和过氧化钠基本性质比较
Na2O
Na2O2
-2
-1
1:2
1:2
过氧根离子:O22-
白色固体
淡黄色粉末
4Na + O2 = 2Na2O
2Na + O2 = Na2O2
氧化钠与过氧化钠
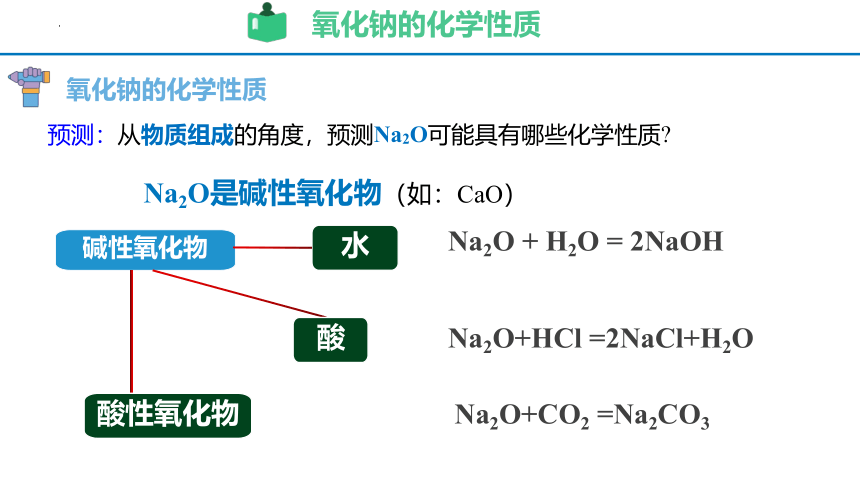
氧化钠的化学性质
预测:从物质组成的角度,预测Na2O可能具有哪些化学性质
Na2O + H2O = 2NaOH
Na2O+CO2 =Na2CO3
Na2O是碱性氧化物(如:CaO)
Na2O+HCl =2NaCl+H2O
氧化钠的化学性质
碱性氧化物
水
酸性氧化物
酸
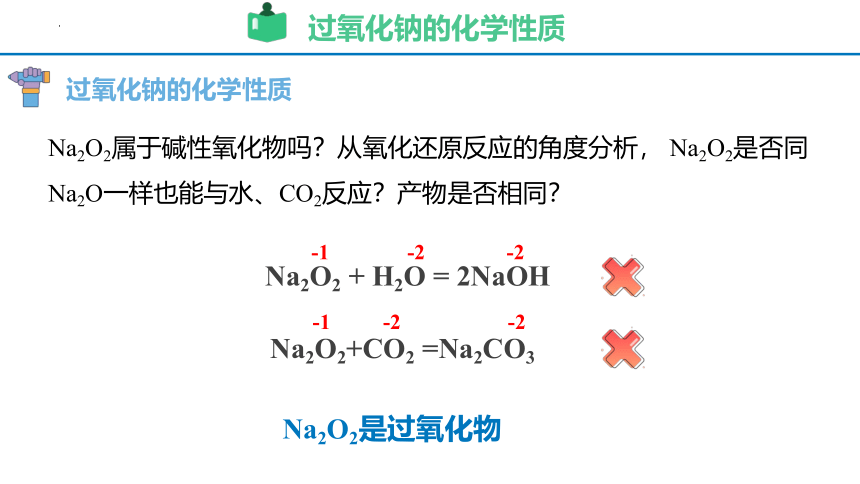
过氧化钠的化学性质
Na2O2属于碱性氧化物吗?从氧化还原反应的角度分析, Na2O2是否同Na2O一样也能与水、CO2反应?产物是否相同?
Na2O2 + H2O = 2NaOH
Na2O2+CO2 =Na2CO3
-1
-2
-2
-1
-2
-2
过氧化钠的化学性质
Na2O2是过氧化物
1. Na2O2与H2O的反应
过氧化钠的化学性质
预测:从物质组成和氧化还原反应的角度,预测Na2O2与H2O反应的产物可能为
Na2O2 + H2O
H+ 、OH-
将1~2mL水滴入盛有1~2g过氧化钠固体的试管中,立即把带火星的木条伸入试管中,检验生成的气体。用手轻轻触摸试管外壁,有什么感觉?用pH试纸检验溶液酸碱性。
实验2-3
思考:
如何设计实验去验证我们的推测?
实验现象 结论
1. Na2O2与H2O的反应
过氧化钠的化学性质
剧烈反应,产生大量气泡,带火星的木条复燃
试管壁发烫
pH试纸变蓝
有O2产生
反应放热
有碱性物质生成
2Na2O2+2H2O=4NaOH+O2↑
1. Na2O2与H2O的反应
-1 -2 -2 0
2Na2O2+2H2O=4NaOH+O2↑
化合价升高,失去e-×2,被氧化
化合价降低,得到e-×2 ,被还原
既是氧化剂又是还原剂
过氧化钠的化学性质
2Na2O2 + 2H2O === 4NaOH + O2↑
2e-
比例关系:2Na2O2 ~ O2 ~ 2e-
2. Na2O2与CO2的反应
过氧化钠的化学性质
取一小块脱脂棉放在石棉网上,再取半药匙过氧化钠粉末至于脱脂棉上,小心包裹后,向包有过氧化钠的脱脂棉吹气。
探究:
现象:
脱脂棉燃烧起来
2Na2O2 + 2CO2 = 2Na2CO3 + O2
-1 -2 -2 0
失去e-×2 ,化合价升高,被氧化
得到e-×2 ,化合价降低,被还原
既是氧化剂又是还原剂
2. Na2O2与CO2的反应
过氧化钠的化学性质
Na2O2可在呼吸面具或核潜艇中作为氧气的来源(供氧剂)
2Na2O2 + 2CO2 === 2Na2CO3 + O2
比例关系:2Na2O2 ~ O2 ~ 2e-
2e-
思考讨论
问题
类比Na与H2O反应的分析方法及Na2O2与H2O反应的化学方程式,分析以下问题。
(1)将适量Na2O2投入盐酸中,有什么现象。写出相应的化学方程式。
(2)将适量Na2O2投入CuSO4溶液中,有什么现象。写出相应的化学方程式。
有气泡产生
2Na2O2+4HCl=4NaCl+2H2O+O2↑
有气泡放出,溶液颜色变浅,有蓝色沉淀生成
2Na2O2 + 2H2O=4NaOH+O2↑ 2NaOH+CuSO4=Na2SO4+Cu(OH)2↓
过氧化钠的化学性质
思考讨论 过氧化钠的性质
【思考】 Na2O2是不是碱性氧化物?
不是,Na2O2是过氧化物。
过氧化钠的化学性质
【讨论】Na着火能否用泡沫灭火器灭火?
【思考】实验室如何保存Na2O2?
干燥、密闭保存
不能,泡沫灭火器含CO2
过氧化钠的用途
2. 常作漂白剂,漂白织物、
1.强氧化剂(消毒、杀菌)
麦秆、
羽毛等。
3. 过氧化钠可在呼吸面具或潜水艇中作为氧气的来源。
Na2CO3·10H2O
O2
H2O
Na2O
变暗
NaOH
变白色固体
Na2CO3
白色粉末状固体
CO2
Na
银白色
风化
H2O
潮解表面
形成溶液
白色块状固体
思考讨论钠长期暴露在空气中会发生什么变化?
综合提升
课堂小结
Na2O Na2O2
阴阳离子组成及个数比
氧元素化合价
物理性质
化学性质 与H2O反应
与盐酸反应
与CO2反应
白色固体
淡黄色固体
O2-:Na+ = 1 : 2
O22-:Na+ = 1 : 2
-2
-1
氧化性、漂白性
主要用途
转化
/
有
呼吸面具的供氧剂、强氧化剂
Na2O + 2HCl = 2NaCl + H2O
Na2O + CO2 = Na2CO3
Na2O + H2O = 2NaOH
2Na2O2 + 2H2O = 4NaOH + O2↑
2Na2O2 + 2CO2 = 2Na2CO3 + O2
2Na2O2 + 4HCl = 4NaCl + 2H2O + O2↑
2Na2O + O2 2Na2O2(更稳定)
保存 密封 密封、远离易燃物
/
1.下列对于Na2O、Na2O2的比较正确的一项是( )
A.Na2O2、Na2O都是钠的氧化物,都是碱性氧化物
B.Na2O、Na2O2都是易溶于水(与水反应)的白色固体
C.Na2O2在和CO2的反应中既是氧化剂又是还原剂
D.Na2O2、Na2O均可作供氧剂
C
2.向紫色石蕊溶液中加入过量Na2O2粉末,振荡,正确的叙述是( )
A.最后溶液变蓝色
B.溶液先变蓝色最后褪色
C.溶液仍为紫色
D.因为Na2O2与石蕊发生氧化还原反应而无气泡产生
B
3. 把Na2O2投入下列各物质的稀溶液中,充分反应后可能有浑浊产生的是( )
A.HCl B.NaOH
C.Na2CO3 D.CuSO4
D
4.下列反应中,水既不做氧化剂又不做还原剂的氧化还原反应是( )
A.钠与水反应 B.氧化钠与水反应
C.过氧化钠与水反应 D.二氧化碳与水反应
C
5.如图所示装置,试管中盛有水,气球a盛有干燥的固体过氧化钠颗粒,U形管中注有浅红色的水,已知过氧化钠与水反应是放热的。将气球用橡皮筋紧缚在试管口,实验时将气球中的固体颗粒抖落到试管b的水中,将不会出现的现象是( )
A.气球a变大
B.试管b内有气泡冒出
C.U形管内红色褪去
D.U形管水位d高于c
C
6.在一定条件下,使CO和O2的混合气体26 g充分反应,所得混合物在常温下跟足量的Na2O2固体反应,结果固体增重14 g,则原混合气体中O2和CO的质量比可能是( )
A.9∶4 B.1∶1
C.7∶6 D.6∶7
D
第2课时 钠的氧化物
Thanks
谢谢观看
第二章 海水中的重要元素—钠和氯
第一节 钠及其化合物
第2课时 钠的氧化物
课程标准要求与核心素养发展目标
课程标准要求
核心素养发展目标
结合真实情境中的应用实 例或通过实验探究,了解钠的氧化物的主要性质;
了解钠的氧化物在生产、生活中的应用
从物质类别、元素化合价的角度认识氧化钠与过氧化钠的性质,熟知过氧化钠与水和二氧化碳反应的应用;
会设计实验探究过氧化钠与水的反应,增强科学探究与创新意识;
掌握Na2O2的相关计算。
本节重、难点
本节重点
本节难点
Na2O2的相关计算
Na2O、Na2O2的化学性质
情境引入
名称 氧化钠 过氧化钠
化学式
氧元素化合价
阴阳离子个数比
颜色、状态
制备
氧化钠和过氧化钠基本性质比较
Na2O
Na2O2
-2
-1
1:2
1:2
过氧根离子:O22-
白色固体
淡黄色粉末
4Na + O2 = 2Na2O
2Na + O2 = Na2O2
氧化钠与过氧化钠
氧化钠的化学性质
预测:从物质组成的角度,预测Na2O可能具有哪些化学性质
Na2O + H2O = 2NaOH
Na2O+CO2 =Na2CO3
Na2O是碱性氧化物(如:CaO)
Na2O+HCl =2NaCl+H2O
氧化钠的化学性质
碱性氧化物
水
酸性氧化物
酸
过氧化钠的化学性质
Na2O2属于碱性氧化物吗?从氧化还原反应的角度分析, Na2O2是否同Na2O一样也能与水、CO2反应?产物是否相同?
Na2O2 + H2O = 2NaOH
Na2O2+CO2 =Na2CO3
-1
-2
-2
-1
-2
-2
过氧化钠的化学性质
Na2O2是过氧化物
1. Na2O2与H2O的反应
过氧化钠的化学性质
预测:从物质组成和氧化还原反应的角度,预测Na2O2与H2O反应的产物可能为
Na2O2 + H2O
H+ 、OH-
将1~2mL水滴入盛有1~2g过氧化钠固体的试管中,立即把带火星的木条伸入试管中,检验生成的气体。用手轻轻触摸试管外壁,有什么感觉?用pH试纸检验溶液酸碱性。
实验2-3
思考:
如何设计实验去验证我们的推测?
实验现象 结论
1. Na2O2与H2O的反应
过氧化钠的化学性质
剧烈反应,产生大量气泡,带火星的木条复燃
试管壁发烫
pH试纸变蓝
有O2产生
反应放热
有碱性物质生成
2Na2O2+2H2O=4NaOH+O2↑
1. Na2O2与H2O的反应
-1 -2 -2 0
2Na2O2+2H2O=4NaOH+O2↑
化合价升高,失去e-×2,被氧化
化合价降低,得到e-×2 ,被还原
既是氧化剂又是还原剂
过氧化钠的化学性质
2Na2O2 + 2H2O === 4NaOH + O2↑
2e-
比例关系:2Na2O2 ~ O2 ~ 2e-
2. Na2O2与CO2的反应
过氧化钠的化学性质
取一小块脱脂棉放在石棉网上,再取半药匙过氧化钠粉末至于脱脂棉上,小心包裹后,向包有过氧化钠的脱脂棉吹气。
探究:
现象:
脱脂棉燃烧起来
2Na2O2 + 2CO2 = 2Na2CO3 + O2
-1 -2 -2 0
失去e-×2 ,化合价升高,被氧化
得到e-×2 ,化合价降低,被还原
既是氧化剂又是还原剂
2. Na2O2与CO2的反应
过氧化钠的化学性质
Na2O2可在呼吸面具或核潜艇中作为氧气的来源(供氧剂)
2Na2O2 + 2CO2 === 2Na2CO3 + O2
比例关系:2Na2O2 ~ O2 ~ 2e-
2e-
思考讨论
问题
类比Na与H2O反应的分析方法及Na2O2与H2O反应的化学方程式,分析以下问题。
(1)将适量Na2O2投入盐酸中,有什么现象。写出相应的化学方程式。
(2)将适量Na2O2投入CuSO4溶液中,有什么现象。写出相应的化学方程式。
有气泡产生
2Na2O2+4HCl=4NaCl+2H2O+O2↑
有气泡放出,溶液颜色变浅,有蓝色沉淀生成
2Na2O2 + 2H2O=4NaOH+O2↑ 2NaOH+CuSO4=Na2SO4+Cu(OH)2↓
过氧化钠的化学性质
思考讨论 过氧化钠的性质
【思考】 Na2O2是不是碱性氧化物?
不是,Na2O2是过氧化物。
过氧化钠的化学性质
【讨论】Na着火能否用泡沫灭火器灭火?
【思考】实验室如何保存Na2O2?
干燥、密闭保存
不能,泡沫灭火器含CO2
过氧化钠的用途
2. 常作漂白剂,漂白织物、
1.强氧化剂(消毒、杀菌)
麦秆、
羽毛等。
3. 过氧化钠可在呼吸面具或潜水艇中作为氧气的来源。
Na2CO3·10H2O
O2
H2O
Na2O
变暗
NaOH
变白色固体
Na2CO3
白色粉末状固体
CO2
Na
银白色
风化
H2O
潮解表面
形成溶液
白色块状固体
思考讨论钠长期暴露在空气中会发生什么变化?
综合提升
课堂小结
Na2O Na2O2
阴阳离子组成及个数比
氧元素化合价
物理性质
化学性质 与H2O反应
与盐酸反应
与CO2反应
白色固体
淡黄色固体
O2-:Na+ = 1 : 2
O22-:Na+ = 1 : 2
-2
-1
氧化性、漂白性
主要用途
转化
/
有
呼吸面具的供氧剂、强氧化剂
Na2O + 2HCl = 2NaCl + H2O
Na2O + CO2 = Na2CO3
Na2O + H2O = 2NaOH
2Na2O2 + 2H2O = 4NaOH + O2↑
2Na2O2 + 2CO2 = 2Na2CO3 + O2
2Na2O2 + 4HCl = 4NaCl + 2H2O + O2↑
2Na2O + O2 2Na2O2(更稳定)
保存 密封 密封、远离易燃物
/
1.下列对于Na2O、Na2O2的比较正确的一项是( )
A.Na2O2、Na2O都是钠的氧化物,都是碱性氧化物
B.Na2O、Na2O2都是易溶于水(与水反应)的白色固体
C.Na2O2在和CO2的反应中既是氧化剂又是还原剂
D.Na2O2、Na2O均可作供氧剂
C
2.向紫色石蕊溶液中加入过量Na2O2粉末,振荡,正确的叙述是( )
A.最后溶液变蓝色
B.溶液先变蓝色最后褪色
C.溶液仍为紫色
D.因为Na2O2与石蕊发生氧化还原反应而无气泡产生
B
3. 把Na2O2投入下列各物质的稀溶液中,充分反应后可能有浑浊产生的是( )
A.HCl B.NaOH
C.Na2CO3 D.CuSO4
D
4.下列反应中,水既不做氧化剂又不做还原剂的氧化还原反应是( )
A.钠与水反应 B.氧化钠与水反应
C.过氧化钠与水反应 D.二氧化碳与水反应
C
5.如图所示装置,试管中盛有水,气球a盛有干燥的固体过氧化钠颗粒,U形管中注有浅红色的水,已知过氧化钠与水反应是放热的。将气球用橡皮筋紧缚在试管口,实验时将气球中的固体颗粒抖落到试管b的水中,将不会出现的现象是( )
A.气球a变大
B.试管b内有气泡冒出
C.U形管内红色褪去
D.U形管水位d高于c
C
6.在一定条件下,使CO和O2的混合气体26 g充分反应,所得混合物在常温下跟足量的Na2O2固体反应,结果固体增重14 g,则原混合气体中O2和CO的质量比可能是( )
A.9∶4 B.1∶1
C.7∶6 D.6∶7
D
第2课时 钠的氧化物
Thanks
谢谢观看
