2.3.4+物质的量浓度 课件(共22张PPT)2023-2024学年高一化学同步教学课件(人教版2019必修第一册)
文档属性
| 名称 | 2.3.4+物质的量浓度 课件(共22张PPT)2023-2024学年高一化学同步教学课件(人教版2019必修第一册) |  | |
| 格式 | pptx | ||
| 文件大小 | 9.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-20 13:05:37 | ||
图片预览







文档简介
(共22张PPT)
第四课时 物质的量浓度
第二章 海水中的重要元素—钠和氯
第三节 物质的量
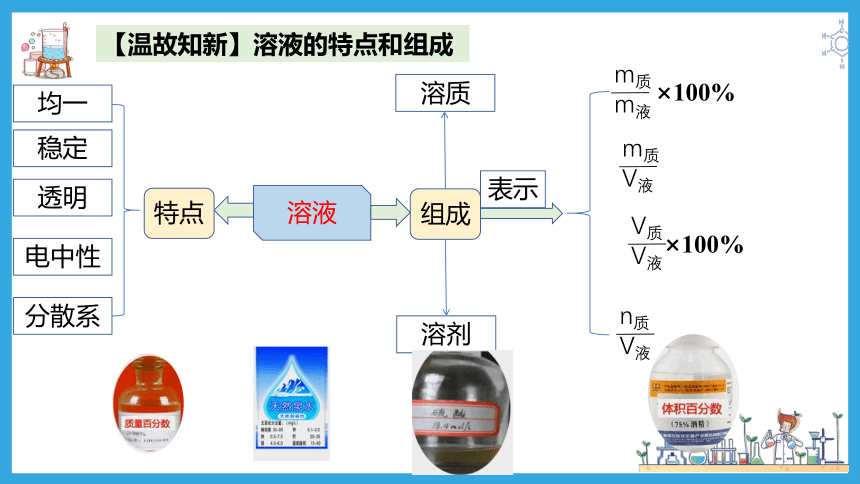
【温故知新】溶液的特点和组成
溶液
特点
组成
均一
稳定
透明
电中性
分散系
溶剂
溶质
表示
m质
m液
×100%
m质
V液
V质
V液
×100%
n质
V液
【思考】两个试剂瓶标签上“98%”、18.4mol/L 表示什么含义?
“98%”表示: 。
18.4mol/L 表示: 。
100g 浓硫酸中含有98g H2SO4
m质
m液
×100%
溶质质量分数=
某饱和溶液的质量百分数(ω)与溶解度(s)的关系是: 。
S
S+100g
×100%
1L 浓硫酸中含有18.4mol H2SO4
物质的量浓度
素养要求
1.了解物质的量浓度的概念,体会定量研究对化学科学的重要作用。
2.能运用物质的量、摩尔质量、气体摩尔体积、物质的量浓度之间的相互关系进行简单计算,逐步提升证据推理思维能力。
3.掌握配制一定物质的量浓度溶液的方法及操作,培养实验探究的能力,建立实验误差分析思维模型,并能应用模型解决实际问题。
任务1
物质的量浓度
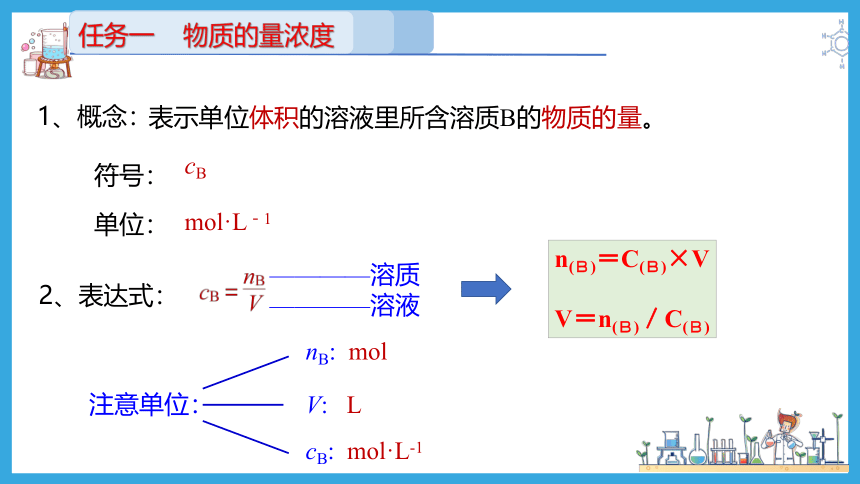
任务一 物质的量浓度
cB
mol·L-1
表示单位体积的溶液里所含溶质B的物质的量。
符号:
单位:
2、表达式:
————溶质
————溶液
注意单位:
nB: mol
V: L
cB: mol·L-1
1、概念:
n(B)=C(B)×V
V=n(B)/C(B)
概念辨析
1.正误判断
(1) 1mol/L NaCl溶液中含有1 mol Na+ ( )
(2)从100 L 5 mol/L H2SO4溶液中取出了10mL ,所得硫酸的物质的量浓度为 0.5 mol/L ( )
(3)将4.0g NaOH固体完全溶于1 L水中,所得溶质的物质的量浓度为0.1mol/L
( )
(4)0.5 mol/L的稀H2SO4,溶液中,c(H+)为1.0 mol/L ( )
(5) c(A13+)为1.0 mol/L的Al2(SO4)3溶液中,c(SO42-)为1.5 mol/L ( )
×
√
×
×
√
3、重点提示
(1)V指的是溶液的体积,而不是溶剂的体积;单位是L
(2)溶质的种类:
(3)带结晶水的物质作溶质时,溶质是除去结晶水的部分
(4)与溶液稀释或混合有关的计算
①浓溶液稀释
溶质的物质的量不变:________________________________________;
溶质的质量不变: ;
溶液的质量守恒: 。
单质、化合物、离子或者某种特定组合
c(浓)·V(浓)=c(稀)·V(稀)
m(浓)·w(浓)=m(稀)·w(稀)
m(稀)=m(浓)+m(水)
②相同溶质两溶液混合
溶质的物质的量不变: ;
溶质的质量不变:________________________________________。
m1w1+m2w2=m(混)·w(混)
c1V1+c2V2=c(混)·V(混)
4、推导公式
【例2】已知98%的浓H2SO4的密度为1.84g/mL,求98%的浓H2SO4的物质的量浓度?
C =
1000 ×ρ× ω
M
符号 物理量 单位
C 物质的量浓度 mol/L
ρ 密度 g/mL
w 溶质的质量分数
M 摩尔质量 g/mol
饱和溶液的变形公式
C =
1000 ×ρ× S
M·(S+100)
【例2】已知98%的浓H2SO4的密度为1.84g/mL,求98%的浓H2SO4的物质的量浓度?
C H2SO4=
1000 ×1.84g/mL× 98%
98g/mol
解:
=18.4mol/L
【例1】下列溶液中氯离子浓度最大的是( )
A.15mL 1mol L﹣1的AlCl3 B.50mL 5mol L﹣1的KClO3
C.20mL 2mol L﹣1的NH4Cl D.10mL 2mol L﹣1的CaCl2
D
典例分析
【例2】如图是某校化学实验室中硫酸试剂标签上的部分内容。据此下列说法错误的是( )
硫酸 化学纯(CP)(500mL)
品名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84 g·cm-3
质量分数:98%
A
A.该硫酸的物质的量浓度为9.2 mol·L-1
B.100 mL该硫酸的质量是184 g
C.硫酸的摩尔质量与磷酸(H3PO4)的摩尔质量相同
D.取该硫酸62.5 mL稀释至250 mL,得到稀硫酸的浓度为4.6 mol·L-1
典例分析
【总结归纳】
1.注意整体与部分的关系
2.溶液中溶质的几种特殊情况
3.混合后溶液的体积
(1)若指出不考虑溶液体积改变,可认为是原溶液的体积之和
(3) 在溶液中阳离子所带的正电荷总数=阴离子所带的负电荷总数,溶液呈电中性
小结
物质的量浓度
物质的量浓度
概念:
符号:cB
常用单位:mol/L(或 mol·L-1)
物质的量浓度的相关计算
1.与定义式有关的计算
2.有关溶液稀释或浓缩
3.相同溶质两溶液混合
n(溶质)=V(浓)×c(浓)= V(稀)×c(稀)
c1V1+c2V2=c(混)·V(混)
计算公式:
限时训练
任务3
任务三 限时训练
1.小明体检的血液化验单中,葡萄糖为5.9 mmol/L。表示该体检指标的物理量是
A.物质的量 B.物质的量浓度 C.质量分数 D.摩尔质量
B
2.(2022·德宏高一期末)下列溶液中Cl-的物质的量浓度最大的是( )
A.150 mL 4 mol·L-1 KClO溶液 B.200 mL 2.5 mol·L-1 KCl溶液
C.75 mL 1.5 mol·L-1 CaCl2溶液 D.100 mL 1 mol·L-1 MgCl2溶液
C
任务三 限时训练
3.某试剂瓶上贴有如下标签,对该试剂理解正确的是( )
A.1 mol NaCl溶于1 L水可配得该溶液
B.若取50 mL该溶液,其c(Cl-)=0.05 mol·L-1
C.该溶液与0.5 mol·L-1 Na2SO4溶液的c(Na+)相等
D.该溶液中含有的微粒主要有:NaCl、Na+、Cl-、H2O
C
任务三 限时训练
C
4.硫酸钠和硫酸溶液等体积混合后,H+浓度为0.3 mol/L,SO42-浓度0.4mol/L,则混合溶
液中Na+浓度为( )
A.0.15 mol·L-1 B.0.2 mol·L-1 C.0.25 mol·L-1 D.0.5 mol·L-1
D
任务三 限时训练
6.计算:
(1)已知某天然矿泉水中Na+为4.6 mg/L,则c(Na+)= .
(2)在250mL 1.0mol/L的CuS04溶液中,含有CuS04的质量为 .
(3)将 g 胆矶(CuS04·5H2O)固体溶于水中,可以配成500mL 1.0mol/L的CuS04溶液。
2×10-4mol/L
40g
125
【实验2-10】书59页
如何配制100mL 1.00mol/L的NaCl溶液?
第四课时 物质的量浓度
第二章 海水中的重要元素—钠和氯
第三节 物质的量
【温故知新】溶液的特点和组成
溶液
特点
组成
均一
稳定
透明
电中性
分散系
溶剂
溶质
表示
m质
m液
×100%
m质
V液
V质
V液
×100%
n质
V液
【思考】两个试剂瓶标签上“98%”、18.4mol/L 表示什么含义?
“98%”表示: 。
18.4mol/L 表示: 。
100g 浓硫酸中含有98g H2SO4
m质
m液
×100%
溶质质量分数=
某饱和溶液的质量百分数(ω)与溶解度(s)的关系是: 。
S
S+100g
×100%
1L 浓硫酸中含有18.4mol H2SO4
物质的量浓度
素养要求
1.了解物质的量浓度的概念,体会定量研究对化学科学的重要作用。
2.能运用物质的量、摩尔质量、气体摩尔体积、物质的量浓度之间的相互关系进行简单计算,逐步提升证据推理思维能力。
3.掌握配制一定物质的量浓度溶液的方法及操作,培养实验探究的能力,建立实验误差分析思维模型,并能应用模型解决实际问题。
任务1
物质的量浓度
任务一 物质的量浓度
cB
mol·L-1
表示单位体积的溶液里所含溶质B的物质的量。
符号:
单位:
2、表达式:
————溶质
————溶液
注意单位:
nB: mol
V: L
cB: mol·L-1
1、概念:
n(B)=C(B)×V
V=n(B)/C(B)
概念辨析
1.正误判断
(1) 1mol/L NaCl溶液中含有1 mol Na+ ( )
(2)从100 L 5 mol/L H2SO4溶液中取出了10mL ,所得硫酸的物质的量浓度为 0.5 mol/L ( )
(3)将4.0g NaOH固体完全溶于1 L水中,所得溶质的物质的量浓度为0.1mol/L
( )
(4)0.5 mol/L的稀H2SO4,溶液中,c(H+)为1.0 mol/L ( )
(5) c(A13+)为1.0 mol/L的Al2(SO4)3溶液中,c(SO42-)为1.5 mol/L ( )
×
√
×
×
√
3、重点提示
(1)V指的是溶液的体积,而不是溶剂的体积;单位是L
(2)溶质的种类:
(3)带结晶水的物质作溶质时,溶质是除去结晶水的部分
(4)与溶液稀释或混合有关的计算
①浓溶液稀释
溶质的物质的量不变:________________________________________;
溶质的质量不变: ;
溶液的质量守恒: 。
单质、化合物、离子或者某种特定组合
c(浓)·V(浓)=c(稀)·V(稀)
m(浓)·w(浓)=m(稀)·w(稀)
m(稀)=m(浓)+m(水)
②相同溶质两溶液混合
溶质的物质的量不变: ;
溶质的质量不变:________________________________________。
m1w1+m2w2=m(混)·w(混)
c1V1+c2V2=c(混)·V(混)
4、推导公式
【例2】已知98%的浓H2SO4的密度为1.84g/mL,求98%的浓H2SO4的物质的量浓度?
C =
1000 ×ρ× ω
M
符号 物理量 单位
C 物质的量浓度 mol/L
ρ 密度 g/mL
w 溶质的质量分数
M 摩尔质量 g/mol
饱和溶液的变形公式
C =
1000 ×ρ× S
M·(S+100)
【例2】已知98%的浓H2SO4的密度为1.84g/mL,求98%的浓H2SO4的物质的量浓度?
C H2SO4=
1000 ×1.84g/mL× 98%
98g/mol
解:
=18.4mol/L
【例1】下列溶液中氯离子浓度最大的是( )
A.15mL 1mol L﹣1的AlCl3 B.50mL 5mol L﹣1的KClO3
C.20mL 2mol L﹣1的NH4Cl D.10mL 2mol L﹣1的CaCl2
D
典例分析
【例2】如图是某校化学实验室中硫酸试剂标签上的部分内容。据此下列说法错误的是( )
硫酸 化学纯(CP)(500mL)
品名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84 g·cm-3
质量分数:98%
A
A.该硫酸的物质的量浓度为9.2 mol·L-1
B.100 mL该硫酸的质量是184 g
C.硫酸的摩尔质量与磷酸(H3PO4)的摩尔质量相同
D.取该硫酸62.5 mL稀释至250 mL,得到稀硫酸的浓度为4.6 mol·L-1
典例分析
【总结归纳】
1.注意整体与部分的关系
2.溶液中溶质的几种特殊情况
3.混合后溶液的体积
(1)若指出不考虑溶液体积改变,可认为是原溶液的体积之和
(3) 在溶液中阳离子所带的正电荷总数=阴离子所带的负电荷总数,溶液呈电中性
小结
物质的量浓度
物质的量浓度
概念:
符号:cB
常用单位:mol/L(或 mol·L-1)
物质的量浓度的相关计算
1.与定义式有关的计算
2.有关溶液稀释或浓缩
3.相同溶质两溶液混合
n(溶质)=V(浓)×c(浓)= V(稀)×c(稀)
c1V1+c2V2=c(混)·V(混)
计算公式:
限时训练
任务3
任务三 限时训练
1.小明体检的血液化验单中,葡萄糖为5.9 mmol/L。表示该体检指标的物理量是
A.物质的量 B.物质的量浓度 C.质量分数 D.摩尔质量
B
2.(2022·德宏高一期末)下列溶液中Cl-的物质的量浓度最大的是( )
A.150 mL 4 mol·L-1 KClO溶液 B.200 mL 2.5 mol·L-1 KCl溶液
C.75 mL 1.5 mol·L-1 CaCl2溶液 D.100 mL 1 mol·L-1 MgCl2溶液
C
任务三 限时训练
3.某试剂瓶上贴有如下标签,对该试剂理解正确的是( )
A.1 mol NaCl溶于1 L水可配得该溶液
B.若取50 mL该溶液,其c(Cl-)=0.05 mol·L-1
C.该溶液与0.5 mol·L-1 Na2SO4溶液的c(Na+)相等
D.该溶液中含有的微粒主要有:NaCl、Na+、Cl-、H2O
C
任务三 限时训练
C
4.硫酸钠和硫酸溶液等体积混合后,H+浓度为0.3 mol/L,SO42-浓度0.4mol/L,则混合溶
液中Na+浓度为( )
A.0.15 mol·L-1 B.0.2 mol·L-1 C.0.25 mol·L-1 D.0.5 mol·L-1
D
任务三 限时训练
6.计算:
(1)已知某天然矿泉水中Na+为4.6 mg/L,则c(Na+)= .
(2)在250mL 1.0mol/L的CuS04溶液中,含有CuS04的质量为 .
(3)将 g 胆矶(CuS04·5H2O)固体溶于水中,可以配成500mL 1.0mol/L的CuS04溶液。
2×10-4mol/L
40g
125
【实验2-10】书59页
如何配制100mL 1.00mol/L的NaCl溶液?
