1.2.1电解质的电离课件(共23张PPT)2023-2024学年上学期高一化学人教版(2019)必修第一册
文档属性
| 名称 | 1.2.1电解质的电离课件(共23张PPT)2023-2024学年上学期高一化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-20 14:58:43 | ||
图片预览








文档简介
(共23张PPT)
验收页
1、酸性氧化物、碱性氧化物相关化学方程式
2、六大强酸、弱酸、强碱、弱碱
3、胶体的制备原理
4、酸碱盐的通性及生成物
1.2.1电解质的电离
思考:湿手操作易触电?为什么?
01 电解质
02 电离方程式
03 从电离角度看待酸碱盐
CONTENTS
目录
一、电解质
实验
干燥的NaCl固体、KNO3固体都不导电、蒸馏水也不导电。NaCl溶液、KNO3溶液都能够导电,熔融NaCl能导电。
实验结论:
严格来说,蒸馏水也能导电,只是导电能力非常弱,只是用上述实验装置不能测出。
导电原因:有大量自由移动的带电的粒子
电解质
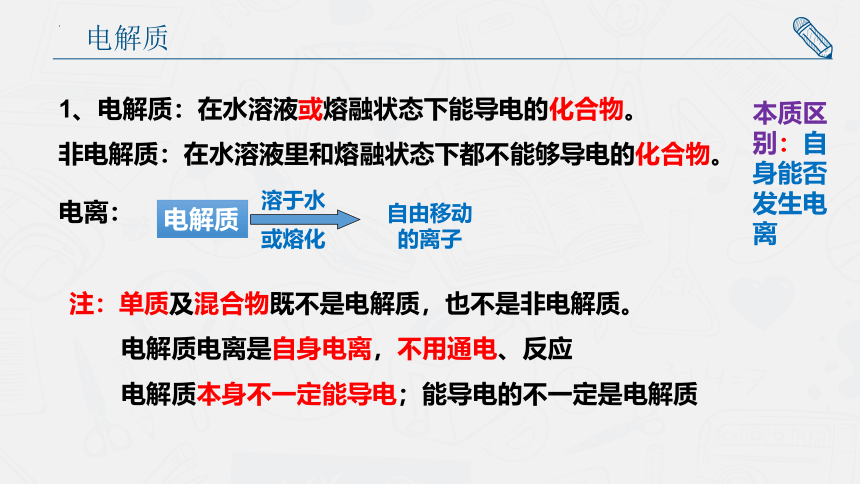
1、电解质:在水溶液或熔融状态下能导电的化合物。
非电解质:在水溶液里和熔融状态下都不能够导电的化合物。
电离:
注:单质及混合物既不是电解质,也不是非电解质。
电解质电离是自身电离,不用通电、反应
电解质本身不一定能导电;能导电的不一定是电解质
溶于水
或熔化
自由移动的离子
电解质
本质区别:自身能否发生电离
电解质
弱电解质
酸:
碱:
大多数的盐:
部分金属氧化物
水
非金属氧化物:
NH3
大部分有机物: 蔗糖、酒精
电解质
s、l、q×
aq√
固×
aq/熔√
熔融√
2、分类
HCl、HNO3、H2SO4、HClO4 、H2CO3、CH3COOH
NaOH、KOH、Cu(OH)2、Ba(OH)2、NH3 H2O
NaCl、AgCl、BaSO4……
CO2、SO2、SO3
MgO
电解质
弱电解质:
(水)部分电离
强酸:HCl、HNO3、H2SO4、HClO4 、HBr、HI;
强碱:NaOH、KOH、Ca(OH)2、Ba(OH)2;
大多数的盐:NaCl、AgCl、BaSO4……;
活泼金属氧化物
弱酸:CH3COOH、HF、HClO、H2S 、H2CO3、H2SO3、H3PO4;
弱碱:所有难溶性碱、 NH3 H2O;
水
极少数盐: (CH3COO)2Pb等
强电解质:
(水)完全电离
电解质
3、注意:
①导电能力强弱依靠
②在电解质溶液中,阳离子所带电荷=阴离子所带电荷(电中性)
单位体积内自由离子数目
所带电荷多少
a、强电解质导电能力不一定比弱电解质强
b、导电能力和溶液体积也没关系
练习
已知有下列物质:①氢氧化钠固体 ②铜丝 ③氯化氢气体 ④稀硫酸
⑤二氧化碳气体 ⑥氨水 ⑦碳酸钠粉末 ⑧蔗糖晶体 ⑨熔融氯化钠 ⑩CuSO4·5H2O晶体
请用序号回答:
(1)属于电解质的是________
(2)属于非电解质的是________。
(3)上述状态下可导电的是________。
(4)上述状态下的电解质不能导电的是____________。
①③⑦⑨⑩
⑤⑧
②④⑥⑨
①③⑦⑩
例1
二、电离
电离
1、定义:
电解质
钠离子、氯离子
溶于水
熔融
水合钠离子
水合氯离子
自由移动的离子
图a、b、c 分别为氯化钠在不同状态下的导电实验的微观示意图(X、Y均表示石墨电极,且与直流电源连接方式相同, 表示水分子),下列说法正确的是( )
A.图c 表示NaCl在水溶液中的导电情况
B.NaCl在三种状态也都存在自由移动的离子
C.NaCl固体不导电,所以NaCl不是电解质
D.图b 说明通电后发生了:NaCl = Na+ + Cl-
例2
练习
A
电离
2、(1)电离方程式:表示电解质电离过程的式子
化学式=离子符号
(2)原则
遵循原子守恒:种类、数目
遵循电荷守恒,左右电荷总数相等
练习
例3 书写下列电解质电离方程式
氯化钠
NaCl=Na+ + Cl-
氢氧化钡
Ba(OH)2=Ba2+ + 2OH-
碳酸钠
Na2 CO3 =2Na+ + CO3 2-
电离
(3)注意
①强电解质用 弱电解质用
②原子团不能拆开 : SO42-、NO3-、CO32-、NH4+ 、OH-
多元弱酸分步走
多元弱碱一步完
NH3·H2O
NH4+ + OH-
③
④酸式盐
强酸酸式盐
弱酸酸式盐
④BaSO4、Na2CO3是强电解质,用
练习
例4.
下列电离方程式错误的是( )
A.NaHCO3=Na++H++CO32-
B.NaHSO4=Na++H++SO42-
C.MgCl2=Mg2++2Cl-
D.Ba(OH)2=Ba2++2OH-
A
三、从电离角度看待酸碱盐
从电离的角度认识酸、碱、盐
(1) 酸:电离时生成的阳离子全部为H+的化合物;
(3) 盐:由金属阳离子或铵根离子 (NH4+)与酸根阴离子组成的化合物。
(2) 碱:电离时生成的阴离子全部为OH 的化合物;
盐不一定有金属元素
练习
例5 下列属于酸的是 ,碱 。
①NaCl ②Ba(OH)2 ③NH3·H2O ④CH3COOH
⑤HCl ⑥NaHCO3 ⑦Cu2(OH)2CO3 ⑧H2SO4
④⑤⑧
②③
下课
验收页
1、电解质、非电解质(例子)
2、强电解质、弱电解质
3、学会书写电离方程式
验收页
1、酸性氧化物、碱性氧化物相关化学方程式
2、六大强酸、弱酸、强碱、弱碱
3、胶体的制备原理
4、酸碱盐的通性及生成物
1.2.1电解质的电离
思考:湿手操作易触电?为什么?
01 电解质
02 电离方程式
03 从电离角度看待酸碱盐
CONTENTS
目录
一、电解质
实验
干燥的NaCl固体、KNO3固体都不导电、蒸馏水也不导电。NaCl溶液、KNO3溶液都能够导电,熔融NaCl能导电。
实验结论:
严格来说,蒸馏水也能导电,只是导电能力非常弱,只是用上述实验装置不能测出。
导电原因:有大量自由移动的带电的粒子
电解质
1、电解质:在水溶液或熔融状态下能导电的化合物。
非电解质:在水溶液里和熔融状态下都不能够导电的化合物。
电离:
注:单质及混合物既不是电解质,也不是非电解质。
电解质电离是自身电离,不用通电、反应
电解质本身不一定能导电;能导电的不一定是电解质
溶于水
或熔化
自由移动的离子
电解质
本质区别:自身能否发生电离
电解质
弱电解质
酸:
碱:
大多数的盐:
部分金属氧化物
水
非金属氧化物:
NH3
大部分有机物: 蔗糖、酒精
电解质
s、l、q×
aq√
固×
aq/熔√
熔融√
2、分类
HCl、HNO3、H2SO4、HClO4 、H2CO3、CH3COOH
NaOH、KOH、Cu(OH)2、Ba(OH)2、NH3 H2O
NaCl、AgCl、BaSO4……
CO2、SO2、SO3
MgO
电解质
弱电解质:
(水)部分电离
强酸:HCl、HNO3、H2SO4、HClO4 、HBr、HI;
强碱:NaOH、KOH、Ca(OH)2、Ba(OH)2;
大多数的盐:NaCl、AgCl、BaSO4……;
活泼金属氧化物
弱酸:CH3COOH、HF、HClO、H2S 、H2CO3、H2SO3、H3PO4;
弱碱:所有难溶性碱、 NH3 H2O;
水
极少数盐: (CH3COO)2Pb等
强电解质:
(水)完全电离
电解质
3、注意:
①导电能力强弱依靠
②在电解质溶液中,阳离子所带电荷=阴离子所带电荷(电中性)
单位体积内自由离子数目
所带电荷多少
a、强电解质导电能力不一定比弱电解质强
b、导电能力和溶液体积也没关系
练习
已知有下列物质:①氢氧化钠固体 ②铜丝 ③氯化氢气体 ④稀硫酸
⑤二氧化碳气体 ⑥氨水 ⑦碳酸钠粉末 ⑧蔗糖晶体 ⑨熔融氯化钠 ⑩CuSO4·5H2O晶体
请用序号回答:
(1)属于电解质的是________
(2)属于非电解质的是________。
(3)上述状态下可导电的是________。
(4)上述状态下的电解质不能导电的是____________。
①③⑦⑨⑩
⑤⑧
②④⑥⑨
①③⑦⑩
例1
二、电离
电离
1、定义:
电解质
钠离子、氯离子
溶于水
熔融
水合钠离子
水合氯离子
自由移动的离子
图a、b、c 分别为氯化钠在不同状态下的导电实验的微观示意图(X、Y均表示石墨电极,且与直流电源连接方式相同, 表示水分子),下列说法正确的是( )
A.图c 表示NaCl在水溶液中的导电情况
B.NaCl在三种状态也都存在自由移动的离子
C.NaCl固体不导电,所以NaCl不是电解质
D.图b 说明通电后发生了:NaCl = Na+ + Cl-
例2
练习
A
电离
2、(1)电离方程式:表示电解质电离过程的式子
化学式=离子符号
(2)原则
遵循原子守恒:种类、数目
遵循电荷守恒,左右电荷总数相等
练习
例3 书写下列电解质电离方程式
氯化钠
NaCl=Na+ + Cl-
氢氧化钡
Ba(OH)2=Ba2+ + 2OH-
碳酸钠
Na2 CO3 =2Na+ + CO3 2-
电离
(3)注意
①强电解质用 弱电解质用
②原子团不能拆开 : SO42-、NO3-、CO32-、NH4+ 、OH-
多元弱酸分步走
多元弱碱一步完
NH3·H2O
NH4+ + OH-
③
④酸式盐
强酸酸式盐
弱酸酸式盐
④BaSO4、Na2CO3是强电解质,用
练习
例4.
下列电离方程式错误的是( )
A.NaHCO3=Na++H++CO32-
B.NaHSO4=Na++H++SO42-
C.MgCl2=Mg2++2Cl-
D.Ba(OH)2=Ba2++2OH-
A
三、从电离角度看待酸碱盐
从电离的角度认识酸、碱、盐
(1) 酸:电离时生成的阳离子全部为H+的化合物;
(3) 盐:由金属阳离子或铵根离子 (NH4+)与酸根阴离子组成的化合物。
(2) 碱:电离时生成的阴离子全部为OH 的化合物;
盐不一定有金属元素
练习
例5 下列属于酸的是 ,碱 。
①NaCl ②Ba(OH)2 ③NH3·H2O ④CH3COOH
⑤HCl ⑥NaHCO3 ⑦Cu2(OH)2CO3 ⑧H2SO4
④⑤⑧
②③
下课
验收页
1、电解质、非电解质(例子)
2、强电解质、弱电解质
3、学会书写电离方程式
