1.3.1.氧化还原反应课件(共61页)2023-2024学年上学期高一化学人教版(2019)必修第一册
文档属性
| 名称 | 1.3.1.氧化还原反应课件(共61页)2023-2024学年上学期高一化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-20 17:17:55 | ||
图片预览






文档简介
(共61张PPT)
第一章 物质及其变化
第一节 氧化还原反应
第一课时 多角度认识氧化还原反应
1.通过对氧化还原反应概念的发展史料的了解,从得氧失氧、化合价变化和电子转移等多角度认识并判断氧化还原反应;
2.能从宏观和微观相结合的角度理解氧化还原反应与四种基本反应类型的关系;
3.认识元素在物质中可以具有不同价态,可通过氧化还原反应实现含有不同价态同种元素的物质的相互转化。
学习目标
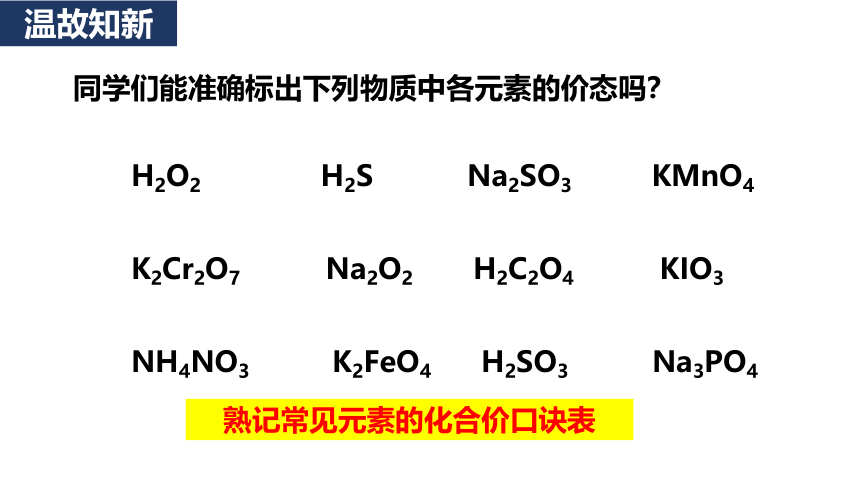
H2O2 H2S Na2SO3 KMnO4 K2Cr2O7 Na2O2 H2C2O4 KIO3 NH4NO3 K2FeO4 H2SO3 Na3PO4
同学们能准确标出下列物质中各元素的价态吗?
熟记常见元素的化合价口诀表
拉瓦锡
燃烧氧化学说
1774年,法国化学家拉瓦锡正式提出了氧化学说:燃烧的本质是物质与氧的化合。
人们把物质与氧结合的反应叫做氧化反应,把失去氧的反应叫做还原反应。
木炭与氧化铜反应,生成铜和二氧化碳
2CuO + C Cu + CO2
高温
得氧元素,发生氧化反应
失氧元素,发生还原反应
同时
发生
氧化还原反应:氧化反应和还原反应同时发生的反应
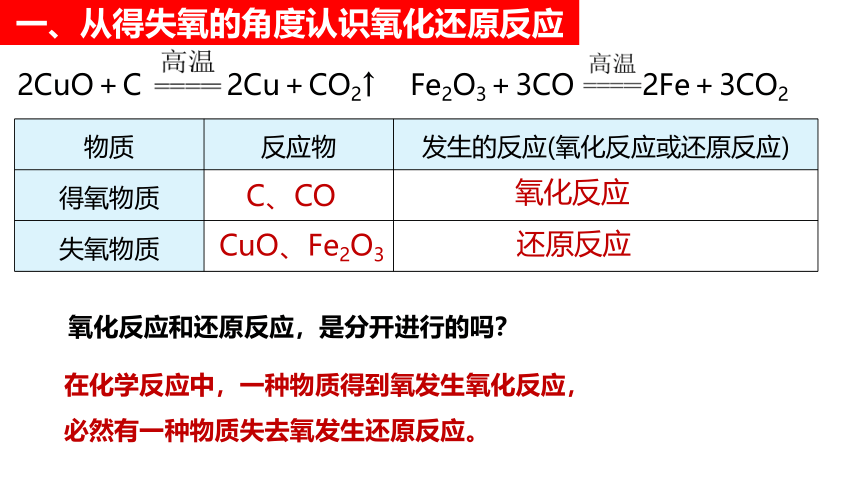
一、从得失氧的角度认识氧化还原反应
2CuO+C 2Cu+CO2↑ Fe2O3+3CO 2Fe+3CO2
物质 反应物 发生的反应(氧化反应或还原反应)
得氧物质
失氧物质
C、CO
氧化反应
CuO、Fe2O3
还原反应
从得失氧的角度认识氧化还原反应
一、从得失氧的角度认识氧化还原反应
氧化反应和还原反应,是分开进行的吗?
在化学反应中,一种物质得到氧发生氧化反应,必然有一种物质失去氧发生还原反应。
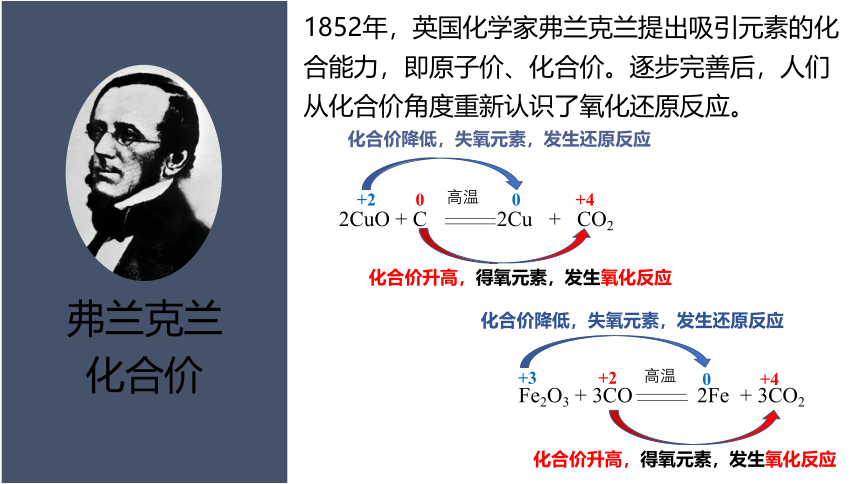
弗兰克兰
化合价
1852年,英国化学家弗兰克兰提出吸引元素的化合能力,即原子价、化合价。逐步完善后,人们从化合价角度重新认识了氧化还原反应。
2CuO + C 2Cu + CO2
高温
化合价升高,得氧元素,发生氧化反应
0
+4
+2
0
化合价降低,失氧元素,发生还原反应
化合价降低,失氧元素,发生还原反应
Fe2O3 + 3CO 2Fe + 3CO2
高温
化合价升高,得氧元素,发生氧化反应
+2
+4
+3
0
2CuO+C 2Cu+CO2↑ Fe2O3+3CO 2Fe+3CO2
物质 反应物 发生的反应(氧化反应或还原反应) 化合价变化
得氧物质
失氧物质
+2
+4
0
0
+3
+4
0
+2
升高
降低
C、CO
氧化反应
CuO、Fe2O3
还原反应
二、从化合价的角度认识氧化还原反应
请从元素化合价角度观察分析,上述化学方程式中有什么特征?
元素化合价在反应前后发生了改变
二、从化合价的角度认识氧化还原反应
1、氧化还原反应的定义
凡是有元素___________升降的化学反应称之为氧化还原反应。
化合价
2、氧化还原反应的特征
元素的化合价在反应前后发生了变化。
3、氧化反应、还原反应的定义(元素化合价角度)
(1)氧化反应:物质所含元素化合价_______的反应叫做氧化反应。
(2)还原反应:物质所含元素化合价_______的反应叫做还原反应。
升高
降低
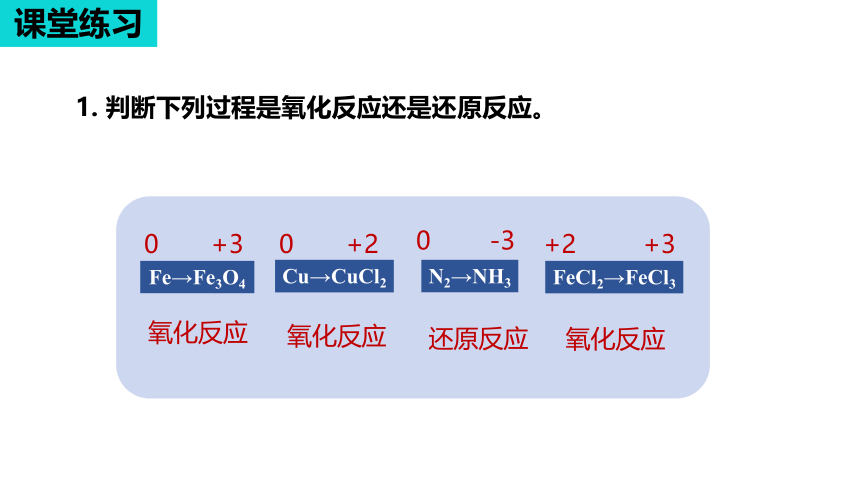
Fe→Fe3O4
Cu→CuCl2
N2→NH3
FeCl2→FeCl3
0 +3
0 +2
0 -3
+2 +3
氧化反应
氧化反应
氧化反应
还原反应
课堂练习
1. 判断下列过程是氧化反应还是还原反应。
0 -1 +1
+4 +5 +2
-1 +4 +6 -2
+1 +1 +4 -2 +1 +4 -2 +4 -2 +1 -2
课堂练习
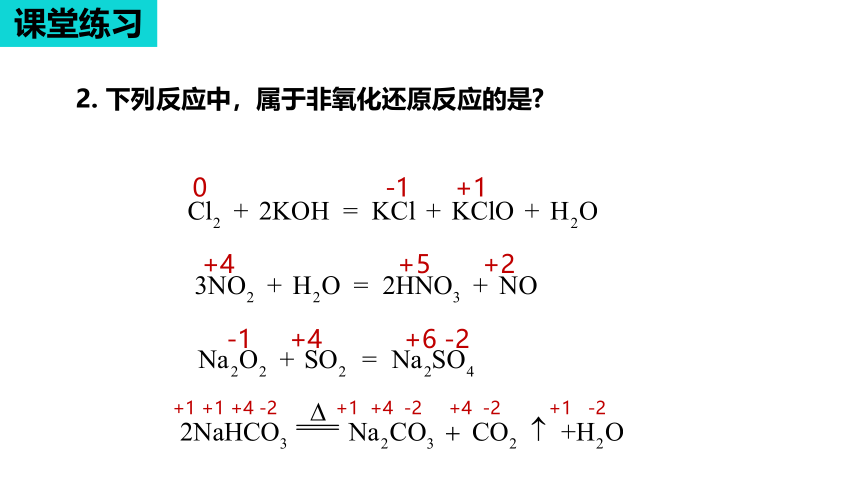
2. 下列反应中,属于非氧化还原反应的是
有单质参加
的化合反应
是氧化还原
反应
复分解反应
置换反应
氧化还原
反应
反应
反应
分解
化合
有单质生成的
分解反应是氧
化还原反应
总结:
①置换反应都是氧化还原反应;
②复分解反应都是非氧化还原反应;
总结:
③化合反应和分解反应可能为氧化还原反应;
④有单质参与的化合反应和有单质生成的分解反应是氧化还原反应.
有单质参与或生成的反应通常是氧化还原反应,但同素异形体之间的转化除外
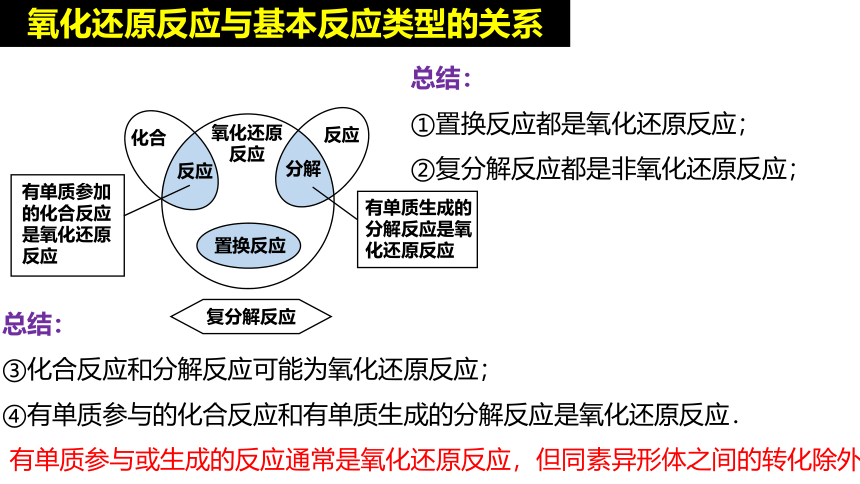
氧化还原反应与基本反应类型的关系
3. 氧化还原反应与四种基本反应类型的关系如图所示。下列化学反应属于阴影部分的是( )
2Na2O2+2CO2=2Na2CO3+O2
2NaHCO3=Na2CO3+H2O+CO2↑
4Fe(OH)3+O2+2H2O=4Fe(OH)3
Cl2+2KBr=Br2+2KCl
提示:2O3=3O2
A
课堂练习
4. 有单质参与的反应是否一定是氧化还原反应?
有单质参加的化合反应和有单质生成的分解反应属于氧化还原反应。
汤姆孙
发现电子
1897年,英国物理学家汤姆孙发现了电子。
在伏打、戴维、法拉第的电化学重大理论突破上,20世纪初,建立了化合价的电子理论。人们把化合价的升降与原子最外层电子的得失和共用联系起来。
阅读课本21页请回答
①什么原因导致元素的化合价变化?
②氧化还原反应的本质是什么?
+11
+17
+17
+11
Na+ Cl-
Na
Cl
Cl-
Na+
0 0 +1 -1
失去2×e-,化合价升高
得到2×e-,化合价下降
结论:1.通过电子得失可以达到稳定结构
2.电子得失导致元素化合价升降
三、从电子转移的角度认识氧化还原反应
H Cl
+17
+1
+1
+17
H Cl
+1 -1
H
Cl
HCl
0
0
+1-1
电子对偏离,化合价升高
H2 + Cl2 2 HCl
电子对偏向,化合价降低
结论: 1.通过形成共用电子对达到稳定结构
2.共用电子对的偏移(偏向或偏离)导致元素化合价升降
三、从电子转移的角度认识氧化还原反应
四、氧化还原反应的本质
氧化还原反应的本质,是发生了电子的________,包括电子________、共用电子对的________两种情况。
转移
得失
偏移
氧化还原反应的特征
氧化还原反应的本质
元素化合价的变化
电子的转移(电子的得失或共用电子对的偏移)
根本原因
电子转移、化合价升降、反应类型的关系:
得电子→化合价降低→ 被还原→还原反应(得降还)
失电子→化合价升高→ 被氧化→氧化反应(失升氧)
课堂小结
第一章 物质及其变化
第一节 氧化还原反应
第二课时 氧化还原反应中
电子转移的表示方法
CO
Fe2O3
CO2
2
+
3
3
Fe
+
双线桥法
标价态
正确标出反应前后各元素化合价明确变价元素的化合价升降关系
连双线
一条线始于反应物中的降价元素,止于产物中同种元素
另一条线始于反应物中的升价元素,止于产物中同种元素
注得失
正确标出反应前后“得到”电子或“失去”电子总数
基本步骤
表示反应前后同一元素由反应物转化为生成物时电子转移的情况。
价态变化原子个数 × 每个原子得失电子数
一、双线桥法表示电子转移
用双线桥法表示下列方程式电子转移的方向和数目
MnO2+4HCl(浓) = MnCl2+Cl2↑ + 2H2O
△
标价态
正确标出反应前后各元素化合价
明确变价元素的化合价升降关系
连单线
始于反应物中的升价元素,止于反应物中降价元素
注数目
正确标出反应中转移的电子总数
基本步骤
表示反应过程中不同元素原子间的电子转移情况。
二、单线桥法表示电子转移
单线桥法
CO
Fe2O3
CO2
2
+
3
3
Fe
+
用单线桥法表示下列方程式电子转移的方向和数目
MnO2+4HCl(浓) = MnCl2+Cl2↑ + 2H2O
△
CuO + H2 == Cu + H2O
第一章 物质及其变化
第一节 氧化还原反应
第三课时 氧化剂和还原剂
Fe2O3 + 3CO 2Fe + 3CO2
请用双线桥法表示下列反应的电子转移情况
+3
+2
+4
0
失去3×2e-,化合价升高,发生氧化反应
得到2×3e-,化合价降低,发生还原反应
氧化产物
还原产物
还原剂
氧化剂
一、氧化剂和还原剂
氧化剂
氧化性
得电子能力
还原反应
还原产物
具有
发生
生成
还原剂
还原性
失电子能力
氧化反应
氧化产物
具有
发生
生成
氧化剂 + 还原剂 = 还原产物 + 氧化产物
得到电子,化合价降低,发生还原反应
失去电子,化合价升高,发生氧化反应
氧化性、还原性的理解
氧化性指物质得电子的性质(或能力);
还原性指物质失电子的性质(或能力)。
物质的氧化性或还原性的强弱取决于物质得、失电子的难易程度,与得失电子数目的多少无关。
例如:Na - e- ===Na+,Al - 3e- ===Al3+,Al失去电子的数目较多,但Na比Al的还原性比铝强。
一、氧化剂和还原剂
物质失去电子越多,还原性越强吗?
(1)2Fe+3Cl2 2FeCl3
氧化剂是_____,还原剂是____;发生氧化反应的是____,发生还 原反应的是_____。
课堂练习
【例1】分析下列反应并按要求填空。
Cl2
Fe
Fe
Cl2
(2)2KMnO4 K2MnO4+MnO2+O2↑
氧化剂是________,还原剂是________;氧化产物是 ,
还原产物是
KMnO4
O2
KMnO4
K2MnO4、MnO2
(4)H2O2+2H++2Fe2+===2Fe3++2H2O
氧化剂是_____,还原剂是_____;氧化产物是_____,
还原产物是____。
课堂练习
(3)2H2S+SO2===3S↓+2H2O
氧化剂是_____,还原剂是_____;氧化产物是____,
还原产物是_____。
SO2
H2S
S
S
H2O2
Fe2+
Fe3+
H2O
2.下列变化中,必须需要加入合适的氧化剂才能实现的是
A.KClO3→O2 B.FeCl2→FeCl3
C.CaCO3→CO2 D.CuO→Cu
课堂练习
B
3.根据反应8NH3+3Cl2=6NH4Cl+N2,回答下列问题。
(1)氧化剂___________,还原剂___________;
(2)氧化产物___________,还原产物___________;
(3)用单线桥的方法表示该反应的电子转移情况___________。
(4)用双线桥的方法表示该反应的电子转移情况。___________。
(5)当有8个NH3分子参加反时,转移的电子个数为___________
常见的氧化剂 常见的还原剂
活泼的非金属单质 活泼的金属单质
高价态化合物 低价态化合物
过氧化物 某些非金属单质
Cl2、O2
Al、Fe、Zn
浓硫酸、KMnO4、HNO3、 FeCl3
CO、SO2、KI
Na2O2、H2O2
C、H2、S
一、氧化剂和还原剂
第一章 物质及其变化
第一节 氧化还原反应
第四课时 氧化还原反应的规律及应用
学习目标
1.方程式法
氧化剂 + 还原剂 = 还原产物 + 氧化产物
氧化性
还原性
弱还原性
弱氧化性
氧化性:
氧化剂>氧化产物
还原性:
还原剂>还原产物
同一反应
一、物质氧化性、还原性强弱判断规律
课堂练习
例1:常温下,发生下列反应:
①16H++10Cl-+ === 2Mn2++5Cl2↑+8H2O
②2Fe2++Br2===2Fe3++2Br-
③2Br-+Cl2===Br2+2Cl-
根据上述反应,可得知相关微粒氧化性由强到弱的顺序是_______________________。
MnO4- > Cl2 > Br2 > Fe3+
金属单质的还原性越强,对应阳离子的氧化性越弱
易失不易得
氧化性:Fe3+>Cu2+>Fe2+
Fe + Cu2+ = Fe2+ + Cu
2Fe3+ + Cu = 2Fe2+ + Cu2+
一、物质氧化性、还原性强弱判断规律
2.根据元素的活动性顺序比较
金属元素活动性顺序表
非金属元素活动性顺序表
易得不易失
非金属单质的氧化性越强,对应阴离子的还原性越弱
一、物质氧化性、还原性强弱判断规律
2.根据元素的活动性顺序比较
反应条件越低,对应物质的氧化性或还原性越强
氧化性:F2 > Cl2
F2+H2 2HF
暗处
Cl2+H2 2HCl
光照
一、物质氧化性、还原性强弱判断规律
3.根据反应条件
2KMnO4+16HCl(浓) = 2KCl+2MnCl2+5Cl2↑+8H2O
MnO2+4HCl(浓) MnCl2 +Cl2↑+2H2O
氧化性:KMnO4 > MnO2
2Fe+3Cl22FeCl3
Fe+SFeS
氧化性:Cl2 > S
Cu + 2Fe3+ = Cu2+ + 2Fe2+
3Zn + 2Fe3+ = 3Zn2+ + 2Fe
还原性:Zn > Cu
一、物质氧化性、还原性强弱判断规律
4.根据变价元素被氧化或被还原的程度
元素处于最高价态时只有氧化性;
元素处于最低价态时只有还原性;
元素处于中间价态时既具有氧化性又具有还原性。
如:H2S、S、SO2(SO32-)、SO3(SO42-)
一、物质氧化性、还原性强弱判断规律
5.价态规律
一般来说,同种元素价态越高,氧化性越强;价态越低,还原性越强。
如氧化性:Fe3+ > Fe2+ > Fe,SO3 > SO2;
还原性:H2S > S > SO2。
课堂练习
例1:下列变化中,需加氧化剂才能实现的是( )
A.NaClO→NaCl B.C→CO2
C.Fe2O3→Fe D.CaO→Ca(OH)2
B
例2:下列说法正确的是( )
A.盐酸中HCl既有氧化性又有还原性
B.阳离子只有氧化性,阴离子只有还原性
C.氧化剂在反应中被氧化,还原剂在反应中被还原
D.在氧化还原反应中,氧化剂与还原剂不可能是同一种物质
A
课堂练习
例3:已知常温下,在溶液中发生如下反应:
①16H++10Z-+2XO===2X2++5Z2+8H2O
②2A2++B2===2A3++2B-
③2B-+Z2===B2+2Z-
由此推断下列说法错误的是( )
A.反应Z2+2A2+===2A3++2Z-可以进行
B.Z元素在反应③中被还原,在反应①中被氧化
C.氧化性由强到弱的顺序是XO、Z2、B2、A3+
D.还原性由强到弱的顺序是Z-、B-、A2+、X2+
D
在氧化还原反应中
元素化合价降低的总数=元素化合价升高的总数
还原剂失电子的总数=氧化剂得电子的总数
应用:氧化还原反应方程的配平、氧化还原反应的相关计算
二、电子守恒规律
课堂练习
例1:在Fe+4HNO3(稀)===Fe(NO3)3+NO↑+2H2O的反应中,HNO3表现了________性和________性,则生成1分子NO转移电子数为________;56 g Fe参加反应时,被还原的HNO3为________g。
酸
还原
3个
63
三、反应先后规律
同一氧化剂与多种还原剂混合时,还原性强的先被氧化
例如:已知还原性:Fe2+>Br-,当把氯气通入FeBr2溶液时,因为还原性:Fe2+>Br-,所以氯气的量不足时首先氧化Fe2+
同一还原剂与多种氧化剂混合时,氧化性强的先被还原
例如:在含有Fe3+、Cu2+、H+的溶液中加入铁粉,因为氧化性:Fe3+>Cu2+>H+,所以铁粉先与Fe3+反应,然后再依次与Cu2+、H+反应。
先强后弱
四、价态规律
1.高低规律
元素处于最高价态时只有氧化性;
元素处于最低价态时只有还原性;
元素处于中间价态时既具有氧化性又具有还原性。
高价氧化,低价还原,中间价态两头兼
四、价态规律
2.归中规律
同种元素不同价态之间发生氧化还原反应时,高价态+低价态→中间价态,即“只靠拢,不交叉”“就近变价”。
-2
+4
0
+6
H2S + H2SO4(浓) S↓ + SO2↑ + 2H2O
==
失去2e-,化合价升高,被氧化
得到2e-,化合价降低,被还原
3.歧化规律
同种元素相同价态之间发生氧化还原反应时,
中间价态→高价态+低价态。
0
+1
-1
Cl2 + 2NaOH NaCl + NaClO + H2O
==
失去e-,化合价升高,被氧化
得到e-,化合价升高,被氧化
四、价态规律
课堂练习
例1:在S2-、Fe2+、Fe3+、Mg2+、S、I-、H+中,只有氧化性的是 ,只有还原性的是 ,既有氧化性又有还原性的是 。
Fe3+、Mg2+、H+
S2-、I-
Fe2+、S
例2:在氧化还原反应3S+6KOH=K2SO3+2K2S+3H2O中,被氧化与被还原的硫原子数之比为( )
A. 1:2 B. 2:1 C. 1:1 D. 3:2
A
课堂小结
第一章 物质及其变化
第一节 氧化还原反应
第五课时 氧化还原反应配平
一、配平三大原则
电子守恒
元素化合价降低的总数=元素化合价升高的总数
还原剂失电子的总数=氧化剂得电子的总数
原子守恒
反应前后原子的种类和个数不变
电荷守恒
反应前后电荷总数相等
二、配平步骤
标价态:标明反应前后变价元素的化合价
列变化:列出元素化合价的变化值
求总数:通过求最小公倍数使化合价的升降总数相等
配系数:先确定氧化剂、还原剂、氧化产物、还原产物的化学计量数,再确定其他物质
查守恒:检查原子、电荷得失电子是否守恒
三、配平技巧
1.全变左边配:
某元素化合价完全变化,先配氧化剂与还原剂的系数
类型:一般氧化还原反应、归中反应
H2S + SO2 —— S↓ + H2O
____ FeCl3 + _____ H2S —— _____ FeCl2 + ____HCl + _____S↓
2
1
2
1
2
——
——
2
2
3
1
2.自变右边配:
自身的氧化还原反应,先配氧化产物与还原产物的系数
类型:歧化反应
三、配平技巧
Cl2 + NaOH —— NaCl + NaClO + H2O
——
1
2
1
1
1
3.部分变两边配:
某元素化合价部分变,含该元素的物质先配生成物。
1
4
1
1
1
MnO2 + HCl(浓) MnCl2 + Cl2↑ + H2O
三、配平技巧
4.整体零价法:
将都升高或降低的两种或多种元素看做一个整体,都按0价
11
4
2
8
FeS2 + O2 Fe2O3 + SO2
三、配平技巧
5.缺项配平法:
指某些反应物或生成物的化学式没有写出来,一般为水、酸或碱
补项原则:
缺H补H+
缺O补H2O
酸性环境
缺H补H2O
缺O补OH-
碱性环境
三、配平技巧
例、配平下列化学反应。
(1)_____HCl(浓)+____MnO2 ____Cl2↑+____MnCl2+____H2O
(2)____Cu+______HNO3(稀) = _______Cu(NO3)2+_____NO↑+____H2O
(3)______ S+______KOH = ______K2S+_______K2SO3+_______H2O
(4)_____ ClO-+______Fe(OH)3+_______ = ______Cl-+_____ +_____H2O
课堂练习
△
课堂练习
例1:实验室制取少量的氮气,常利用的反应是NaNO2+NH4Cl===NaCl+N2↑+2H2O。关于该反应说法正确的是( )
A.NaNO2是还原剂
B.生成1分子N2时转移的电子为6个
C.NH4Cl中的氮元素被氧化
D.N2既是氧化剂又是还原剂
C
课堂练习
例2:(双选)某工厂的酸性废水中含有剧毒的H3AsO3,可加入SnCl2除去H3AsO3并回收As。反应的化学方程式为3SnCl2+12HCl+2H3AsO3===2As↓+3H2SnCl6+6M。下列关于该反应的说法中正确的是( )
A.还原剂是H3AsO3
B.还原性:AsC.M为H2O,是氧化产物
D.每生成2个As,还原剂失去6个电子
BD
第一章 物质及其变化
第一节 氧化还原反应
第一课时 多角度认识氧化还原反应
1.通过对氧化还原反应概念的发展史料的了解,从得氧失氧、化合价变化和电子转移等多角度认识并判断氧化还原反应;
2.能从宏观和微观相结合的角度理解氧化还原反应与四种基本反应类型的关系;
3.认识元素在物质中可以具有不同价态,可通过氧化还原反应实现含有不同价态同种元素的物质的相互转化。
学习目标
H2O2 H2S Na2SO3 KMnO4 K2Cr2O7 Na2O2 H2C2O4 KIO3 NH4NO3 K2FeO4 H2SO3 Na3PO4
同学们能准确标出下列物质中各元素的价态吗?
熟记常见元素的化合价口诀表
拉瓦锡
燃烧氧化学说
1774年,法国化学家拉瓦锡正式提出了氧化学说:燃烧的本质是物质与氧的化合。
人们把物质与氧结合的反应叫做氧化反应,把失去氧的反应叫做还原反应。
木炭与氧化铜反应,生成铜和二氧化碳
2CuO + C Cu + CO2
高温
得氧元素,发生氧化反应
失氧元素,发生还原反应
同时
发生
氧化还原反应:氧化反应和还原反应同时发生的反应
一、从得失氧的角度认识氧化还原反应
2CuO+C 2Cu+CO2↑ Fe2O3+3CO 2Fe+3CO2
物质 反应物 发生的反应(氧化反应或还原反应)
得氧物质
失氧物质
C、CO
氧化反应
CuO、Fe2O3
还原反应
从得失氧的角度认识氧化还原反应
一、从得失氧的角度认识氧化还原反应
氧化反应和还原反应,是分开进行的吗?
在化学反应中,一种物质得到氧发生氧化反应,必然有一种物质失去氧发生还原反应。
弗兰克兰
化合价
1852年,英国化学家弗兰克兰提出吸引元素的化合能力,即原子价、化合价。逐步完善后,人们从化合价角度重新认识了氧化还原反应。
2CuO + C 2Cu + CO2
高温
化合价升高,得氧元素,发生氧化反应
0
+4
+2
0
化合价降低,失氧元素,发生还原反应
化合价降低,失氧元素,发生还原反应
Fe2O3 + 3CO 2Fe + 3CO2
高温
化合价升高,得氧元素,发生氧化反应
+2
+4
+3
0
2CuO+C 2Cu+CO2↑ Fe2O3+3CO 2Fe+3CO2
物质 反应物 发生的反应(氧化反应或还原反应) 化合价变化
得氧物质
失氧物质
+2
+4
0
0
+3
+4
0
+2
升高
降低
C、CO
氧化反应
CuO、Fe2O3
还原反应
二、从化合价的角度认识氧化还原反应
请从元素化合价角度观察分析,上述化学方程式中有什么特征?
元素化合价在反应前后发生了改变
二、从化合价的角度认识氧化还原反应
1、氧化还原反应的定义
凡是有元素___________升降的化学反应称之为氧化还原反应。
化合价
2、氧化还原反应的特征
元素的化合价在反应前后发生了变化。
3、氧化反应、还原反应的定义(元素化合价角度)
(1)氧化反应:物质所含元素化合价_______的反应叫做氧化反应。
(2)还原反应:物质所含元素化合价_______的反应叫做还原反应。
升高
降低
Fe→Fe3O4
Cu→CuCl2
N2→NH3
FeCl2→FeCl3
0 +3
0 +2
0 -3
+2 +3
氧化反应
氧化反应
氧化反应
还原反应
课堂练习
1. 判断下列过程是氧化反应还是还原反应。
0 -1 +1
+4 +5 +2
-1 +4 +6 -2
+1 +1 +4 -2 +1 +4 -2 +4 -2 +1 -2
课堂练习
2. 下列反应中,属于非氧化还原反应的是
有单质参加
的化合反应
是氧化还原
反应
复分解反应
置换反应
氧化还原
反应
反应
反应
分解
化合
有单质生成的
分解反应是氧
化还原反应
总结:
①置换反应都是氧化还原反应;
②复分解反应都是非氧化还原反应;
总结:
③化合反应和分解反应可能为氧化还原反应;
④有单质参与的化合反应和有单质生成的分解反应是氧化还原反应.
有单质参与或生成的反应通常是氧化还原反应,但同素异形体之间的转化除外
氧化还原反应与基本反应类型的关系
3. 氧化还原反应与四种基本反应类型的关系如图所示。下列化学反应属于阴影部分的是( )
2Na2O2+2CO2=2Na2CO3+O2
2NaHCO3=Na2CO3+H2O+CO2↑
4Fe(OH)3+O2+2H2O=4Fe(OH)3
Cl2+2KBr=Br2+2KCl
提示:2O3=3O2
A
课堂练习
4. 有单质参与的反应是否一定是氧化还原反应?
有单质参加的化合反应和有单质生成的分解反应属于氧化还原反应。
汤姆孙
发现电子
1897年,英国物理学家汤姆孙发现了电子。
在伏打、戴维、法拉第的电化学重大理论突破上,20世纪初,建立了化合价的电子理论。人们把化合价的升降与原子最外层电子的得失和共用联系起来。
阅读课本21页请回答
①什么原因导致元素的化合价变化?
②氧化还原反应的本质是什么?
+11
+17
+17
+11
Na+ Cl-
Na
Cl
Cl-
Na+
0 0 +1 -1
失去2×e-,化合价升高
得到2×e-,化合价下降
结论:1.通过电子得失可以达到稳定结构
2.电子得失导致元素化合价升降
三、从电子转移的角度认识氧化还原反应
H Cl
+17
+1
+1
+17
H Cl
+1 -1
H
Cl
HCl
0
0
+1-1
电子对偏离,化合价升高
H2 + Cl2 2 HCl
电子对偏向,化合价降低
结论: 1.通过形成共用电子对达到稳定结构
2.共用电子对的偏移(偏向或偏离)导致元素化合价升降
三、从电子转移的角度认识氧化还原反应
四、氧化还原反应的本质
氧化还原反应的本质,是发生了电子的________,包括电子________、共用电子对的________两种情况。
转移
得失
偏移
氧化还原反应的特征
氧化还原反应的本质
元素化合价的变化
电子的转移(电子的得失或共用电子对的偏移)
根本原因
电子转移、化合价升降、反应类型的关系:
得电子→化合价降低→ 被还原→还原反应(得降还)
失电子→化合价升高→ 被氧化→氧化反应(失升氧)
课堂小结
第一章 物质及其变化
第一节 氧化还原反应
第二课时 氧化还原反应中
电子转移的表示方法
CO
Fe2O3
CO2
2
+
3
3
Fe
+
双线桥法
标价态
正确标出反应前后各元素化合价明确变价元素的化合价升降关系
连双线
一条线始于反应物中的降价元素,止于产物中同种元素
另一条线始于反应物中的升价元素,止于产物中同种元素
注得失
正确标出反应前后“得到”电子或“失去”电子总数
基本步骤
表示反应前后同一元素由反应物转化为生成物时电子转移的情况。
价态变化原子个数 × 每个原子得失电子数
一、双线桥法表示电子转移
用双线桥法表示下列方程式电子转移的方向和数目
MnO2+4HCl(浓) = MnCl2+Cl2↑ + 2H2O
△
标价态
正确标出反应前后各元素化合价
明确变价元素的化合价升降关系
连单线
始于反应物中的升价元素,止于反应物中降价元素
注数目
正确标出反应中转移的电子总数
基本步骤
表示反应过程中不同元素原子间的电子转移情况。
二、单线桥法表示电子转移
单线桥法
CO
Fe2O3
CO2
2
+
3
3
Fe
+
用单线桥法表示下列方程式电子转移的方向和数目
MnO2+4HCl(浓) = MnCl2+Cl2↑ + 2H2O
△
CuO + H2 == Cu + H2O
第一章 物质及其变化
第一节 氧化还原反应
第三课时 氧化剂和还原剂
Fe2O3 + 3CO 2Fe + 3CO2
请用双线桥法表示下列反应的电子转移情况
+3
+2
+4
0
失去3×2e-,化合价升高,发生氧化反应
得到2×3e-,化合价降低,发生还原反应
氧化产物
还原产物
还原剂
氧化剂
一、氧化剂和还原剂
氧化剂
氧化性
得电子能力
还原反应
还原产物
具有
发生
生成
还原剂
还原性
失电子能力
氧化反应
氧化产物
具有
发生
生成
氧化剂 + 还原剂 = 还原产物 + 氧化产物
得到电子,化合价降低,发生还原反应
失去电子,化合价升高,发生氧化反应
氧化性、还原性的理解
氧化性指物质得电子的性质(或能力);
还原性指物质失电子的性质(或能力)。
物质的氧化性或还原性的强弱取决于物质得、失电子的难易程度,与得失电子数目的多少无关。
例如:Na - e- ===Na+,Al - 3e- ===Al3+,Al失去电子的数目较多,但Na比Al的还原性比铝强。
一、氧化剂和还原剂
物质失去电子越多,还原性越强吗?
(1)2Fe+3Cl2 2FeCl3
氧化剂是_____,还原剂是____;发生氧化反应的是____,发生还 原反应的是_____。
课堂练习
【例1】分析下列反应并按要求填空。
Cl2
Fe
Fe
Cl2
(2)2KMnO4 K2MnO4+MnO2+O2↑
氧化剂是________,还原剂是________;氧化产物是 ,
还原产物是
KMnO4
O2
KMnO4
K2MnO4、MnO2
(4)H2O2+2H++2Fe2+===2Fe3++2H2O
氧化剂是_____,还原剂是_____;氧化产物是_____,
还原产物是____。
课堂练习
(3)2H2S+SO2===3S↓+2H2O
氧化剂是_____,还原剂是_____;氧化产物是____,
还原产物是_____。
SO2
H2S
S
S
H2O2
Fe2+
Fe3+
H2O
2.下列变化中,必须需要加入合适的氧化剂才能实现的是
A.KClO3→O2 B.FeCl2→FeCl3
C.CaCO3→CO2 D.CuO→Cu
课堂练习
B
3.根据反应8NH3+3Cl2=6NH4Cl+N2,回答下列问题。
(1)氧化剂___________,还原剂___________;
(2)氧化产物___________,还原产物___________;
(3)用单线桥的方法表示该反应的电子转移情况___________。
(4)用双线桥的方法表示该反应的电子转移情况。___________。
(5)当有8个NH3分子参加反时,转移的电子个数为___________
常见的氧化剂 常见的还原剂
活泼的非金属单质 活泼的金属单质
高价态化合物 低价态化合物
过氧化物 某些非金属单质
Cl2、O2
Al、Fe、Zn
浓硫酸、KMnO4、HNO3、 FeCl3
CO、SO2、KI
Na2O2、H2O2
C、H2、S
一、氧化剂和还原剂
第一章 物质及其变化
第一节 氧化还原反应
第四课时 氧化还原反应的规律及应用
学习目标
1.方程式法
氧化剂 + 还原剂 = 还原产物 + 氧化产物
氧化性
还原性
弱还原性
弱氧化性
氧化性:
氧化剂>氧化产物
还原性:
还原剂>还原产物
同一反应
一、物质氧化性、还原性强弱判断规律
课堂练习
例1:常温下,发生下列反应:
①16H++10Cl-+ === 2Mn2++5Cl2↑+8H2O
②2Fe2++Br2===2Fe3++2Br-
③2Br-+Cl2===Br2+2Cl-
根据上述反应,可得知相关微粒氧化性由强到弱的顺序是_______________________。
MnO4- > Cl2 > Br2 > Fe3+
金属单质的还原性越强,对应阳离子的氧化性越弱
易失不易得
氧化性:Fe3+>Cu2+>Fe2+
Fe + Cu2+ = Fe2+ + Cu
2Fe3+ + Cu = 2Fe2+ + Cu2+
一、物质氧化性、还原性强弱判断规律
2.根据元素的活动性顺序比较
金属元素活动性顺序表
非金属元素活动性顺序表
易得不易失
非金属单质的氧化性越强,对应阴离子的还原性越弱
一、物质氧化性、还原性强弱判断规律
2.根据元素的活动性顺序比较
反应条件越低,对应物质的氧化性或还原性越强
氧化性:F2 > Cl2
F2+H2 2HF
暗处
Cl2+H2 2HCl
光照
一、物质氧化性、还原性强弱判断规律
3.根据反应条件
2KMnO4+16HCl(浓) = 2KCl+2MnCl2+5Cl2↑+8H2O
MnO2+4HCl(浓) MnCl2 +Cl2↑+2H2O
氧化性:KMnO4 > MnO2
2Fe+3Cl22FeCl3
Fe+SFeS
氧化性:Cl2 > S
Cu + 2Fe3+ = Cu2+ + 2Fe2+
3Zn + 2Fe3+ = 3Zn2+ + 2Fe
还原性:Zn > Cu
一、物质氧化性、还原性强弱判断规律
4.根据变价元素被氧化或被还原的程度
元素处于最高价态时只有氧化性;
元素处于最低价态时只有还原性;
元素处于中间价态时既具有氧化性又具有还原性。
如:H2S、S、SO2(SO32-)、SO3(SO42-)
一、物质氧化性、还原性强弱判断规律
5.价态规律
一般来说,同种元素价态越高,氧化性越强;价态越低,还原性越强。
如氧化性:Fe3+ > Fe2+ > Fe,SO3 > SO2;
还原性:H2S > S > SO2。
课堂练习
例1:下列变化中,需加氧化剂才能实现的是( )
A.NaClO→NaCl B.C→CO2
C.Fe2O3→Fe D.CaO→Ca(OH)2
B
例2:下列说法正确的是( )
A.盐酸中HCl既有氧化性又有还原性
B.阳离子只有氧化性,阴离子只有还原性
C.氧化剂在反应中被氧化,还原剂在反应中被还原
D.在氧化还原反应中,氧化剂与还原剂不可能是同一种物质
A
课堂练习
例3:已知常温下,在溶液中发生如下反应:
①16H++10Z-+2XO===2X2++5Z2+8H2O
②2A2++B2===2A3++2B-
③2B-+Z2===B2+2Z-
由此推断下列说法错误的是( )
A.反应Z2+2A2+===2A3++2Z-可以进行
B.Z元素在反应③中被还原,在反应①中被氧化
C.氧化性由强到弱的顺序是XO、Z2、B2、A3+
D.还原性由强到弱的顺序是Z-、B-、A2+、X2+
D
在氧化还原反应中
元素化合价降低的总数=元素化合价升高的总数
还原剂失电子的总数=氧化剂得电子的总数
应用:氧化还原反应方程的配平、氧化还原反应的相关计算
二、电子守恒规律
课堂练习
例1:在Fe+4HNO3(稀)===Fe(NO3)3+NO↑+2H2O的反应中,HNO3表现了________性和________性,则生成1分子NO转移电子数为________;56 g Fe参加反应时,被还原的HNO3为________g。
酸
还原
3个
63
三、反应先后规律
同一氧化剂与多种还原剂混合时,还原性强的先被氧化
例如:已知还原性:Fe2+>Br-,当把氯气通入FeBr2溶液时,因为还原性:Fe2+>Br-,所以氯气的量不足时首先氧化Fe2+
同一还原剂与多种氧化剂混合时,氧化性强的先被还原
例如:在含有Fe3+、Cu2+、H+的溶液中加入铁粉,因为氧化性:Fe3+>Cu2+>H+,所以铁粉先与Fe3+反应,然后再依次与Cu2+、H+反应。
先强后弱
四、价态规律
1.高低规律
元素处于最高价态时只有氧化性;
元素处于最低价态时只有还原性;
元素处于中间价态时既具有氧化性又具有还原性。
高价氧化,低价还原,中间价态两头兼
四、价态规律
2.归中规律
同种元素不同价态之间发生氧化还原反应时,高价态+低价态→中间价态,即“只靠拢,不交叉”“就近变价”。
-2
+4
0
+6
H2S + H2SO4(浓) S↓ + SO2↑ + 2H2O
==
失去2e-,化合价升高,被氧化
得到2e-,化合价降低,被还原
3.歧化规律
同种元素相同价态之间发生氧化还原反应时,
中间价态→高价态+低价态。
0
+1
-1
Cl2 + 2NaOH NaCl + NaClO + H2O
==
失去e-,化合价升高,被氧化
得到e-,化合价升高,被氧化
四、价态规律
课堂练习
例1:在S2-、Fe2+、Fe3+、Mg2+、S、I-、H+中,只有氧化性的是 ,只有还原性的是 ,既有氧化性又有还原性的是 。
Fe3+、Mg2+、H+
S2-、I-
Fe2+、S
例2:在氧化还原反应3S+6KOH=K2SO3+2K2S+3H2O中,被氧化与被还原的硫原子数之比为( )
A. 1:2 B. 2:1 C. 1:1 D. 3:2
A
课堂小结
第一章 物质及其变化
第一节 氧化还原反应
第五课时 氧化还原反应配平
一、配平三大原则
电子守恒
元素化合价降低的总数=元素化合价升高的总数
还原剂失电子的总数=氧化剂得电子的总数
原子守恒
反应前后原子的种类和个数不变
电荷守恒
反应前后电荷总数相等
二、配平步骤
标价态:标明反应前后变价元素的化合价
列变化:列出元素化合价的变化值
求总数:通过求最小公倍数使化合价的升降总数相等
配系数:先确定氧化剂、还原剂、氧化产物、还原产物的化学计量数,再确定其他物质
查守恒:检查原子、电荷得失电子是否守恒
三、配平技巧
1.全变左边配:
某元素化合价完全变化,先配氧化剂与还原剂的系数
类型:一般氧化还原反应、归中反应
H2S + SO2 —— S↓ + H2O
____ FeCl3 + _____ H2S —— _____ FeCl2 + ____HCl + _____S↓
2
1
2
1
2
——
——
2
2
3
1
2.自变右边配:
自身的氧化还原反应,先配氧化产物与还原产物的系数
类型:歧化反应
三、配平技巧
Cl2 + NaOH —— NaCl + NaClO + H2O
——
1
2
1
1
1
3.部分变两边配:
某元素化合价部分变,含该元素的物质先配生成物。
1
4
1
1
1
MnO2 + HCl(浓) MnCl2 + Cl2↑ + H2O
三、配平技巧
4.整体零价法:
将都升高或降低的两种或多种元素看做一个整体,都按0价
11
4
2
8
FeS2 + O2 Fe2O3 + SO2
三、配平技巧
5.缺项配平法:
指某些反应物或生成物的化学式没有写出来,一般为水、酸或碱
补项原则:
缺H补H+
缺O补H2O
酸性环境
缺H补H2O
缺O补OH-
碱性环境
三、配平技巧
例、配平下列化学反应。
(1)_____HCl(浓)+____MnO2 ____Cl2↑+____MnCl2+____H2O
(2)____Cu+______HNO3(稀) = _______Cu(NO3)2+_____NO↑+____H2O
(3)______ S+______KOH = ______K2S+_______K2SO3+_______H2O
(4)_____ ClO-+______Fe(OH)3+_______ = ______Cl-+_____ +_____H2O
课堂练习
△
课堂练习
例1:实验室制取少量的氮气,常利用的反应是NaNO2+NH4Cl===NaCl+N2↑+2H2O。关于该反应说法正确的是( )
A.NaNO2是还原剂
B.生成1分子N2时转移的电子为6个
C.NH4Cl中的氮元素被氧化
D.N2既是氧化剂又是还原剂
C
课堂练习
例2:(双选)某工厂的酸性废水中含有剧毒的H3AsO3,可加入SnCl2除去H3AsO3并回收As。反应的化学方程式为3SnCl2+12HCl+2H3AsO3===2As↓+3H2SnCl6+6M。下列关于该反应的说法中正确的是( )
A.还原剂是H3AsO3
B.还原性:As
D.每生成2个As,还原剂失去6个电子
BD
