1.6 物质的分离 同步练习(含解析)
文档属性
| 名称 | 1.6 物质的分离 同步练习(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 67.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-09-21 00:00:00 | ||
图片预览



文档简介
1.6 物质的分离
一 、选择题
1.在 5 月 12 日 15 时 05 分在尼泊尔发生 7.5 级地震, 在地震灾区为防止疟疾传染, 河水需处理后方可
饮用。常用的处理方法有:①加热煮沸, ②过滤, ③药水消毒,④自然沉降.较合理的顺序为( )
A. ③②④① B. ③①④② C. ④②③① D. ④①③②
2.下列各组物质能用过滤法分离的是( )
A.水和汽油 B.糖和食盐
C.沙子和硫酸铜 D.氧气和氮气
3.水文化是存在于不同民族、国家和地区中关于水的相关文化, 它包括人们对水的认识和感受、关于 水的观念等。2022 年 3 月 22 日是第 30 个世界水日,今年的主题是“珍惜地下水、珍视隐藏的资源 ”,
下列对于水的认识不正确的是( )
A.水是最常见的溶剂
B.水是由氢和氧组成的
C.含硫酸的工业废水要处理达标后才能排入河流
D.单一净化过程中,过滤是净化程度最高的
4.20℃时,将硝酸钾饱和溶液 100g 和 200g,分别加热蒸发掉 20g 水后,冷却到原来的温度, 各析
出了晶体 a g 和 b g,则 a 和 b 的关系是( )
A. a<b B.2a=b C.2b=a D.a=b
5.以下是净水的操作, 单一操作相对净化程度由低到高的排列顺序正确的是( )
①静置沉淀 ②过滤 ③吸附沉淀 ④蒸馏
A. ①②③④ B. ①④②③ C. ①③②④ D. ③①②④
6.从海水中提取食盐的流程如下, 下列说法错误的是( )
A.经过第①步操作,海水中的成分基本不变
B.蒸发池中, 氯化钠溶液逐渐变浓
第 1 页(共 10 页)
C.经过第③步的操作, 进入结晶池后,继续蒸发水,有④发生
D.析出食盐晶体后的母液是氯化钠的不饱和溶液
7.下列混合物的分离方法不正确的是( )
A.酒精和水——蒸馏 B.泥沙和水——过滤
C.食盐和碘——加热 D.汽油和水——过滤
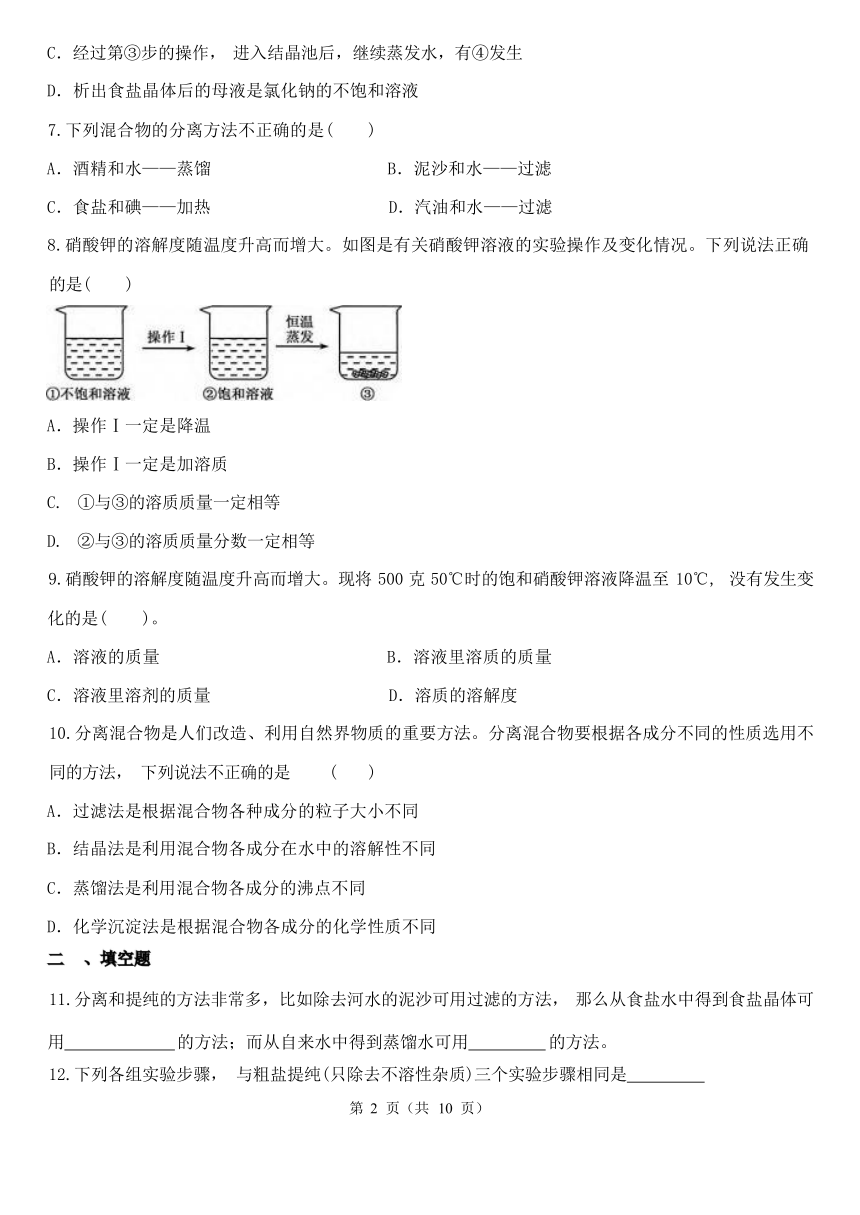
8.硝酸钾的溶解度随温度升高而增大。如图是有关硝酸钾溶液的实验操作及变化情况。下列说法正确
的是( )
A.操作Ⅰ一定是降温
B.操作Ⅰ一定是加溶质
C. ①与③的溶质质量一定相等
D. ②与③的溶质质量分数一定相等
9.硝酸钾的溶解度随温度升高而增大。现将 500 克 50℃时的饱和硝酸钾溶液降温至 10℃, 没有发生变
化的是( )。
A.溶液的质量 B.溶液里溶质的质量
C.溶液里溶剂的质量 D.溶质的溶解度
10.分离混合物是人们改造、利用自然界物质的重要方法。分离混合物要根据各成分不同的性质选用不
同的方法, 下列说法不正确的是 ( )
A.过滤法是根据混合物各种成分的粒子大小不同
B.结晶法是利用混合物各成分在水中的溶解性不同
C.蒸馏法是利用混合物各成分的沸点不同
D.化学沉淀法是根据混合物各成分的化学性质不同
二 、填空题
11.分离和提纯的方法非常多,比如除去河水的泥沙可用过滤的方法, 那么从食盐水中得到食盐晶体可
用 的方法;而从自来水中得到蒸馏水可用 的方法。
12.下列各组实验步骤, 与粗盐提纯(只除去不溶性杂质)三个实验步骤相同是
第 2 页(共 10 页)
①从空气中分离出氧气②从医用酒精中提纯酒精③从草木灰中提取碳酸钾(不考虑其他可溶性杂质)④
从双氧水制取氧气的废液中回收二氧化锰
13.下表是硝酸钾、食盐在不同温度下的溶解度(单位:g)
温度(℃) 0 10 20 30 40 50 60 70 80 90 100
硝酸钾 13.3 20.9 32 45.8 64 85.5 110 138 169 202 246
食盐 35.7 35.8 36 36.3 36.6 37 37.3 37.8 38.4 39 39.8
(1)60℃时, 硝酸钾的溶解度是 ;
(2)若两种物质的溶解度相等, 此时所对应的温度范围在 之间;
(3)硝酸钾溶液中含有少量食盐时, 可通过 的方法提纯;
(4)要使 60℃时,硝酸钾的饱和溶液变为不饱和溶液,可采取的方法是 (写出一种)。
三 、实验题
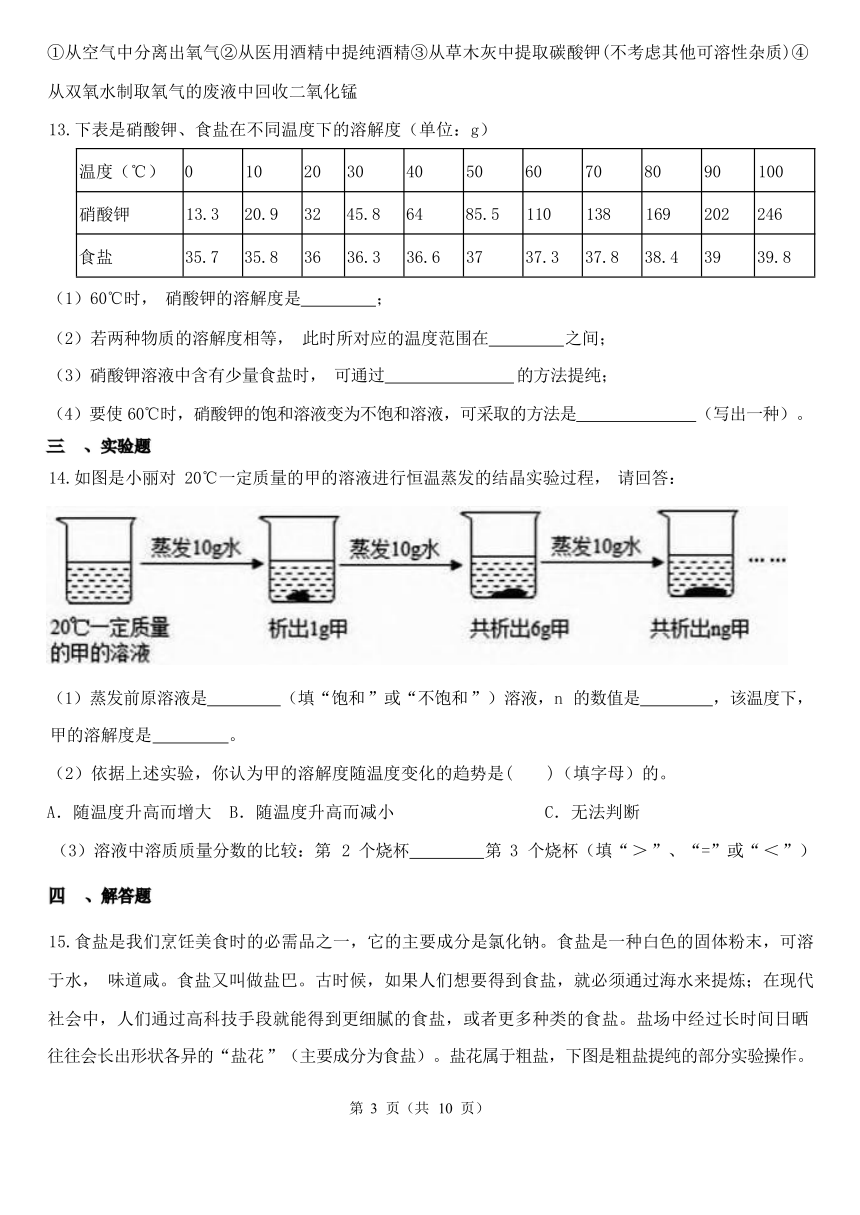
14.如图是小丽对 20℃一定质量的甲的溶液进行恒温蒸发的结晶实验过程, 请回答:
(1)蒸发前原溶液是 (填“饱和 ”或“不饱和 ”)溶液,n 的数值是 ,该温度下,
甲的溶解度是 。
(2)依据上述实验,你认为甲的溶解度随温度变化的趋势是( )(填字母)的。
A.随温度升高而增大 B.随温度升高而减小 C.无法判断
(3)溶液中溶质质量分数的比较:第 2 个烧杯 第 3 个烧杯(填“ > ”、“=”或“ < ”)
四 、解答题
15.食盐是我们烹饪美食时的必需品之一,它的主要成分是氯化钠。食盐是一种白色的固体粉末,可溶 于水, 味道咸。食盐又叫做盐巴。古时候,如果人们想要得到食盐,就必须通过海水来提炼;在现代 社会中,人们通过高科技手段就能得到更细腻的食盐,或者更多种类的食盐。盐场中经过长时间日晒
往往会长出形状各异的“盐花 ”(主要成分为食盐)。盐花属于粗盐,下图是粗盐提纯的部分实验操作。
第 3 页(共 10 页)
(1)一定质量粗盐提纯实验的正确操作顺序为 。(填字母)
(2)盐池中食盐的质量分数始终保持在 25%左右不再升高,试分析原
因 。
(3)提纯的精盐可用于一定质量分数食盐溶液的配置。现需要配置质量分数为 10%的食盐溶液 100
克,理论上需要 25%的盐池溶液多少克? (写出计算过程)
第 4 页(共 10 页)
1.6 物质的分离答案解析
一 、选择题
1.C
【解析】水的净化有:自然沉降,过滤, 药水消毒,加热煮沸。
自然沉降主要把不溶性杂质沉在水底,过滤是分离液体与不溶性杂质, 药水消毒是初步消灭水中的有
害元素和微生物,加热煮沸主要是消灭微生物和降低水的硬度。故较合理的顺序为④②③①。
故答案为: C。
2.C
【解析】根据过滤的原理分析, 过滤是固体和液体分离的一种操作。
A. 水和汽油都是液体, 不能用过滤分离,不符合题意;
B、 糖和食盐都是可溶性固体, 不符合题意;
C、沙子不溶于水, 硫酸铜易溶于水, 可用过滤方法分离, 符合题意;
D、氧气和氮气都属于气体,不能用过滤分离, 不符合题意;
故选 C。
3.D
【解析】根据对水的组成和净化的知识判断。
A.水是最常见的溶剂, 故 A 正确不合题意;
B.水在通直流电的条件下分解, 生成氢气和氧气, 说明水是由氢和氧组成的,故 B 正确不合题意;
C.含硫酸的工业废水要处理达标后才能排入河流, 防止造成水体污染, 故 C 正确不合题意;
D.单一净化过程中, 过滤只能除去水中大颗粒的不溶物, 因此净化程度最高的是蒸馏, 故 D 错误符合
题意。
故选 D。
4.D
【解析】同温度下同一种物质等量溶剂达到饱和状态时溶解物质质量相等。
20℃时,将硝酸钾饱和溶液 100g 和 200g,分别加热蒸发掉 20g 水,则溶解在 20g 水中的硝酸钾析
出,所以析出固体质量相等;
故答案为:D。
第 5 页(共 10 页)
5.C
【解析】根据静置沉淀、过滤、吸附沉淀、蒸馏的原理进行分析。
①静置沉淀是使大密度的固体沉淀, ②过滤能除去不溶性物质,③吸附沉淀是用絮凝剂使悬浮的固体 沉淀, ④蒸馏可得到纯净的水, 所以净化程度由低到高的排列顺序为①静置沉淀 ③吸附沉淀 ②过滤
④蒸馏;
故答案为: C。
6.D
【解析】(1)海水流动, 不会改变海水的成分;
(2)溶质不变,溶剂减少,溶液的质量分数增大, 即溶液变浓;
(3)有晶体析出的溶液一定是该溶质的饱和溶液。 A.第①步操作是将海水引入贮水池, 经过第①步
操作, 海水中的成分基本不变, 故 A 正确不合题意;
B.蒸发池中,水分蒸发而氯化钠的质量不变, 因此氯化钠溶液逐渐变浓,故 B 正确不合题意;
C.经过第③步的操作,进入结晶池后,继续蒸发水,溶液达到饱和状态后, 继续蒸发, 有氯化钠晶体
析出, 故 C 正确不合题意;
D.析出食盐晶体后的母液不能继续溶解氯化钠,是氯化钠的饱和溶液, 故 D 错误符合题意。
故选 D。
7.D
【解析】根据各种分离方法的原理判断。
A.酒精和水都是液体, 且沸点不同, 因此可用蒸馏的方法分离,故 A 正确不合题意;
B.泥沙是不溶于水的固体物质, 可以使用过滤的方法分离,故 B 正确不合题意;
C.食盐受热后几乎不变化,而碘受热会升华变成碘蒸气, 因此可以使用加热的方法分离,故 C 正确不
合题意;
D.过滤操作用于分离液体和不溶于液体的固体物质,而汽油和水都是液体, 故 D 错误符合题意。
故选 D。
8.D
【解析】硝酸钾的溶解度随温度的升高而增大,降温或增加溶质或蒸发溶剂能使不饱和溶液变为饱和
溶液。
第 6 页(共 10 页)
AB、操作 I 是将不饱和溶液转化为饱和溶液, 不一定是降温, 也可能是增加溶质、蒸发溶剂,故 AB 错
误;
C、从图中可以看出,、 ①是一定温度下的不饱和溶液, ②转化为③的过程中,有硝酸钾析出,①与③
的溶质质量不相等, 故 C 错误;
D、②与③均为相同温度下的饱和溶液,溶质质量分数一定相等,故 D 正确;
故答案为: D。
9.C
【解析】根据硝酸钾热饱和溶液降温会析出晶体, 溶质质量、溶液质量、溶解度都会改变, 溶剂质量
不变分析。
A.将 500 克 50℃时的饱和硝酸钾溶液降温至 10℃, 会析出硝酸钾晶体, 溶液质量减少, 不符合题意;
B、析出晶体溶质减少, 不符合题意;
C、析出晶体, 溶剂质量不变,符合题意;
D、温度改变, 溶解度发生改变, 不符合题意;
故选 C。
10.B
【解析】根据过滤、结晶及蒸馏的原理及方法进行分析。
A.过滤是将固体与液体分离的一种方法,是根据混合物各种成分的粒子大小不同进行分离,说法正确;
B.结晶法是利用各物质溶解度受温度的影响不同进行分离的一种方法, 说法错误;
C.蒸馏法是利用混合物各成分的沸点不同分离混合物的方法, 说法正确;
D.化学沉淀法是根据混合物各成分的化学性质不同发生化学反应产生沉淀分离的方法, 说法正确;
故答案为: B。
二 、填空题
11.蒸发结晶; 蒸馏
【解析】①过滤:用来分离溶液和不溶性固体的混合物;
②蒸发:用来分离可溶性固体和液体的混合物;
③蒸馏:它利用混合液体或液-固体系中各组分沸点不同,使低沸点组分蒸发,再冷凝以分离整个组分
的操作过程。因为河水中的泥沙不溶于水,所以可以用过滤的方法除去水中的泥沙;用蒸发结晶的方
法从食盐溶液中得到食盐晶体; 蒸馏水是指用蒸馏的方法制备的纯水。
第 7 页(共 10 页)
12.③
【解析】盐提纯的步骤如下:溶解、过滤、蒸发、结晶, 分析各选项的分离方法是否符合粗盐的提纯
步骤即可.
①从空气中分离氧气的方法是先将空气液化, 然后蒸发, 利用液氮的沸点(-196℃)低于液氧的沸点 (--183℃) 把氮气首先蒸发出来剩下的主要就是液态氧了. ②从医用酒精中提纯酒精是利用水和酒精 的沸点不同,加热将酒精先蒸馏出来. ③草木灰的主要成分是碳酸钾和一些不溶性杂质,碳酸钾是可 溶性的,通过溶解、过滤、蒸发和结晶等步骤,可以把草木灰中的碳酸钾提取出来. ④从双氧水制取 氧气的废液中回收二氧化锰,分解后得水和氧气, 所以残渣中主要成分为水和二氧化锰.二氧化锰不
溶于水,故溶解后, 过滤时,二氧化锰在滤渣中.将滤渣烘干即可得二氧化锰固体。
13.(1)110 克
(2)20—30
(3)冷却饱和溶
(4)加水或升温
【解析】(1)根据表格填空即可;
(2)分析表格,哪两个温度之间,二者的溶解度存在包容关系, 那么这两个温度就是所求温度范围;
(3)如果物质的溶解度受温度的影响比较明显,那么可以使用冷却热饱和溶液的方式结晶提纯;
(4)使饱和溶液转变为不饱和溶液的方法:①增加溶剂;②增大溶解度。
(1)根据表格可知,60℃时,硝酸钾的溶解度是 110g;
(2)当温度在 20~30℃之间时, 硝酸钾的溶解度范围为 32g~45.8g,食盐的溶解度在 36~36.3g,那么
食盐的溶解度范围正好在硝酸钾的溶解度范围内, 因此它们的溶解度相等的温度范围为:20~30℃;
(3)硝酸钾的溶解度随温度的升高而明显增大,因此可通过冷却热饱和溶液的方法提纯;
(4)要使 60℃时, 硝酸钾的饱和溶液变为不饱和溶液, 可采取的方法是加水或升温。
三 、实验题
14.(1)不饱和; 11;50g
(2)C
(3)=
【解析】本题有一定难度,理解第一次析出晶体后所得溶液为该温度下的饱和溶液是正确解答本题的
关键。
第 8 页(共 10 页)
20℃一定质量甲的溶液, 蒸发前的烧杯底部没有固体, 第一次蒸发 10g 水, 析出 1g 晶体, 所得溶液为 该温度下的饱和溶液;第二次蒸发 10g 水析出 6g-1g=5g 晶体,两次析出的晶体质量不相同;溶解度是
在一定温度下, 某固体溶质在 100g 溶剂里达到饱和状态所溶解的溶质质量, 进行分析解答。
(1)20℃一定质量甲的溶液,蒸发前的烧杯底部没有固体,第一次蒸发 10g 水,析出 1g 晶体, 所得 溶液为该温度下的饱和溶液;第二次蒸发 10g 水析出 6g-1g=5g 晶体,则蒸发前原溶液是不饱和溶液, 第二次蒸发溶液是饱和溶液, 故第三次蒸发 10g 水会析出 5g 晶体,共析出 6g+5g=11g 晶体,故 n 的数 值是 11;20℃,该饱和溶液蒸发 10g 水, 会析出 5g 晶体, 则 20℃ , 100g 水溶解 50g 固体甲能达到饱
和状态,故甲物质在 20℃时的溶解度是 50g;
(2)在实验过程中,是蒸发水分析出晶体,过程中温度不变,无法确定甲的溶解度随温度变化的趋势,
故选 C;
(3)第 2 个烧杯和第 3 个烧杯中溶液均为该温度下的饱和溶液,2 和 3 烧杯中溶液的质量分数相等。
故答案为:(1)不饱和; 11;50g;(2)C;(3)=。
四 、解答题
15.(1)ABCD
(2)食盐溶液已经是该温度下的饱和溶液
(3)理论上需要 25%的盐池溶液的质量为: 100g×10%÷25%=40g
【解析】(1)根据粗盐提纯的实验过程分析解答;
(2)在温度不变时, 物质的溶解度不变, 即该物质的饱和溶液的溶质质量分数不变,而且此时溶质质
量分数最大;
(3)首先用溶液质量×溶质质量分数计算出 100g 溶液中的溶质质量,再根据“溶液质量=溶质质量分 (溶质质量)数 ”
计算出 25%的溶液质量。
(1)粗盐提纯的实验过程如下:
A.用天平称量规定质量的粗盐;
B.将食盐倒入烧杯, 并倒入适量的水,用玻璃棒搅拌直到全部溶解;
C.对得到的食盐溶液进行过滤;
D.将滤液倒入蒸发皿,用酒精灯进行加热。
则正确顺序为 ABCD。
第 9 页(共 10 页)
(2)盐池中食盐的质量分数始终保持在 25%左右不再升高,原因: 食盐溶液已经是该温度下的饱和溶
液。
第 10 页(共 10 页)
一 、选择题
1.在 5 月 12 日 15 时 05 分在尼泊尔发生 7.5 级地震, 在地震灾区为防止疟疾传染, 河水需处理后方可
饮用。常用的处理方法有:①加热煮沸, ②过滤, ③药水消毒,④自然沉降.较合理的顺序为( )
A. ③②④① B. ③①④② C. ④②③① D. ④①③②
2.下列各组物质能用过滤法分离的是( )
A.水和汽油 B.糖和食盐
C.沙子和硫酸铜 D.氧气和氮气
3.水文化是存在于不同民族、国家和地区中关于水的相关文化, 它包括人们对水的认识和感受、关于 水的观念等。2022 年 3 月 22 日是第 30 个世界水日,今年的主题是“珍惜地下水、珍视隐藏的资源 ”,
下列对于水的认识不正确的是( )
A.水是最常见的溶剂
B.水是由氢和氧组成的
C.含硫酸的工业废水要处理达标后才能排入河流
D.单一净化过程中,过滤是净化程度最高的
4.20℃时,将硝酸钾饱和溶液 100g 和 200g,分别加热蒸发掉 20g 水后,冷却到原来的温度, 各析
出了晶体 a g 和 b g,则 a 和 b 的关系是( )
A. a<b B.2a=b C.2b=a D.a=b
5.以下是净水的操作, 单一操作相对净化程度由低到高的排列顺序正确的是( )
①静置沉淀 ②过滤 ③吸附沉淀 ④蒸馏
A. ①②③④ B. ①④②③ C. ①③②④ D. ③①②④
6.从海水中提取食盐的流程如下, 下列说法错误的是( )
A.经过第①步操作,海水中的成分基本不变
B.蒸发池中, 氯化钠溶液逐渐变浓
第 1 页(共 10 页)
C.经过第③步的操作, 进入结晶池后,继续蒸发水,有④发生
D.析出食盐晶体后的母液是氯化钠的不饱和溶液
7.下列混合物的分离方法不正确的是( )
A.酒精和水——蒸馏 B.泥沙和水——过滤
C.食盐和碘——加热 D.汽油和水——过滤
8.硝酸钾的溶解度随温度升高而增大。如图是有关硝酸钾溶液的实验操作及变化情况。下列说法正确
的是( )
A.操作Ⅰ一定是降温
B.操作Ⅰ一定是加溶质
C. ①与③的溶质质量一定相等
D. ②与③的溶质质量分数一定相等
9.硝酸钾的溶解度随温度升高而增大。现将 500 克 50℃时的饱和硝酸钾溶液降温至 10℃, 没有发生变
化的是( )。
A.溶液的质量 B.溶液里溶质的质量
C.溶液里溶剂的质量 D.溶质的溶解度
10.分离混合物是人们改造、利用自然界物质的重要方法。分离混合物要根据各成分不同的性质选用不
同的方法, 下列说法不正确的是 ( )
A.过滤法是根据混合物各种成分的粒子大小不同
B.结晶法是利用混合物各成分在水中的溶解性不同
C.蒸馏法是利用混合物各成分的沸点不同
D.化学沉淀法是根据混合物各成分的化学性质不同
二 、填空题
11.分离和提纯的方法非常多,比如除去河水的泥沙可用过滤的方法, 那么从食盐水中得到食盐晶体可
用 的方法;而从自来水中得到蒸馏水可用 的方法。
12.下列各组实验步骤, 与粗盐提纯(只除去不溶性杂质)三个实验步骤相同是
第 2 页(共 10 页)
①从空气中分离出氧气②从医用酒精中提纯酒精③从草木灰中提取碳酸钾(不考虑其他可溶性杂质)④
从双氧水制取氧气的废液中回收二氧化锰
13.下表是硝酸钾、食盐在不同温度下的溶解度(单位:g)
温度(℃) 0 10 20 30 40 50 60 70 80 90 100
硝酸钾 13.3 20.9 32 45.8 64 85.5 110 138 169 202 246
食盐 35.7 35.8 36 36.3 36.6 37 37.3 37.8 38.4 39 39.8
(1)60℃时, 硝酸钾的溶解度是 ;
(2)若两种物质的溶解度相等, 此时所对应的温度范围在 之间;
(3)硝酸钾溶液中含有少量食盐时, 可通过 的方法提纯;
(4)要使 60℃时,硝酸钾的饱和溶液变为不饱和溶液,可采取的方法是 (写出一种)。
三 、实验题
14.如图是小丽对 20℃一定质量的甲的溶液进行恒温蒸发的结晶实验过程, 请回答:
(1)蒸发前原溶液是 (填“饱和 ”或“不饱和 ”)溶液,n 的数值是 ,该温度下,
甲的溶解度是 。
(2)依据上述实验,你认为甲的溶解度随温度变化的趋势是( )(填字母)的。
A.随温度升高而增大 B.随温度升高而减小 C.无法判断
(3)溶液中溶质质量分数的比较:第 2 个烧杯 第 3 个烧杯(填“ > ”、“=”或“ < ”)
四 、解答题
15.食盐是我们烹饪美食时的必需品之一,它的主要成分是氯化钠。食盐是一种白色的固体粉末,可溶 于水, 味道咸。食盐又叫做盐巴。古时候,如果人们想要得到食盐,就必须通过海水来提炼;在现代 社会中,人们通过高科技手段就能得到更细腻的食盐,或者更多种类的食盐。盐场中经过长时间日晒
往往会长出形状各异的“盐花 ”(主要成分为食盐)。盐花属于粗盐,下图是粗盐提纯的部分实验操作。
第 3 页(共 10 页)
(1)一定质量粗盐提纯实验的正确操作顺序为 。(填字母)
(2)盐池中食盐的质量分数始终保持在 25%左右不再升高,试分析原
因 。
(3)提纯的精盐可用于一定质量分数食盐溶液的配置。现需要配置质量分数为 10%的食盐溶液 100
克,理论上需要 25%的盐池溶液多少克? (写出计算过程)
第 4 页(共 10 页)
1.6 物质的分离答案解析
一 、选择题
1.C
【解析】水的净化有:自然沉降,过滤, 药水消毒,加热煮沸。
自然沉降主要把不溶性杂质沉在水底,过滤是分离液体与不溶性杂质, 药水消毒是初步消灭水中的有
害元素和微生物,加热煮沸主要是消灭微生物和降低水的硬度。故较合理的顺序为④②③①。
故答案为: C。
2.C
【解析】根据过滤的原理分析, 过滤是固体和液体分离的一种操作。
A. 水和汽油都是液体, 不能用过滤分离,不符合题意;
B、 糖和食盐都是可溶性固体, 不符合题意;
C、沙子不溶于水, 硫酸铜易溶于水, 可用过滤方法分离, 符合题意;
D、氧气和氮气都属于气体,不能用过滤分离, 不符合题意;
故选 C。
3.D
【解析】根据对水的组成和净化的知识判断。
A.水是最常见的溶剂, 故 A 正确不合题意;
B.水在通直流电的条件下分解, 生成氢气和氧气, 说明水是由氢和氧组成的,故 B 正确不合题意;
C.含硫酸的工业废水要处理达标后才能排入河流, 防止造成水体污染, 故 C 正确不合题意;
D.单一净化过程中, 过滤只能除去水中大颗粒的不溶物, 因此净化程度最高的是蒸馏, 故 D 错误符合
题意。
故选 D。
4.D
【解析】同温度下同一种物质等量溶剂达到饱和状态时溶解物质质量相等。
20℃时,将硝酸钾饱和溶液 100g 和 200g,分别加热蒸发掉 20g 水,则溶解在 20g 水中的硝酸钾析
出,所以析出固体质量相等;
故答案为:D。
第 5 页(共 10 页)
5.C
【解析】根据静置沉淀、过滤、吸附沉淀、蒸馏的原理进行分析。
①静置沉淀是使大密度的固体沉淀, ②过滤能除去不溶性物质,③吸附沉淀是用絮凝剂使悬浮的固体 沉淀, ④蒸馏可得到纯净的水, 所以净化程度由低到高的排列顺序为①静置沉淀 ③吸附沉淀 ②过滤
④蒸馏;
故答案为: C。
6.D
【解析】(1)海水流动, 不会改变海水的成分;
(2)溶质不变,溶剂减少,溶液的质量分数增大, 即溶液变浓;
(3)有晶体析出的溶液一定是该溶质的饱和溶液。 A.第①步操作是将海水引入贮水池, 经过第①步
操作, 海水中的成分基本不变, 故 A 正确不合题意;
B.蒸发池中,水分蒸发而氯化钠的质量不变, 因此氯化钠溶液逐渐变浓,故 B 正确不合题意;
C.经过第③步的操作,进入结晶池后,继续蒸发水,溶液达到饱和状态后, 继续蒸发, 有氯化钠晶体
析出, 故 C 正确不合题意;
D.析出食盐晶体后的母液不能继续溶解氯化钠,是氯化钠的饱和溶液, 故 D 错误符合题意。
故选 D。
7.D
【解析】根据各种分离方法的原理判断。
A.酒精和水都是液体, 且沸点不同, 因此可用蒸馏的方法分离,故 A 正确不合题意;
B.泥沙是不溶于水的固体物质, 可以使用过滤的方法分离,故 B 正确不合题意;
C.食盐受热后几乎不变化,而碘受热会升华变成碘蒸气, 因此可以使用加热的方法分离,故 C 正确不
合题意;
D.过滤操作用于分离液体和不溶于液体的固体物质,而汽油和水都是液体, 故 D 错误符合题意。
故选 D。
8.D
【解析】硝酸钾的溶解度随温度的升高而增大,降温或增加溶质或蒸发溶剂能使不饱和溶液变为饱和
溶液。
第 6 页(共 10 页)
AB、操作 I 是将不饱和溶液转化为饱和溶液, 不一定是降温, 也可能是增加溶质、蒸发溶剂,故 AB 错
误;
C、从图中可以看出,、 ①是一定温度下的不饱和溶液, ②转化为③的过程中,有硝酸钾析出,①与③
的溶质质量不相等, 故 C 错误;
D、②与③均为相同温度下的饱和溶液,溶质质量分数一定相等,故 D 正确;
故答案为: D。
9.C
【解析】根据硝酸钾热饱和溶液降温会析出晶体, 溶质质量、溶液质量、溶解度都会改变, 溶剂质量
不变分析。
A.将 500 克 50℃时的饱和硝酸钾溶液降温至 10℃, 会析出硝酸钾晶体, 溶液质量减少, 不符合题意;
B、析出晶体溶质减少, 不符合题意;
C、析出晶体, 溶剂质量不变,符合题意;
D、温度改变, 溶解度发生改变, 不符合题意;
故选 C。
10.B
【解析】根据过滤、结晶及蒸馏的原理及方法进行分析。
A.过滤是将固体与液体分离的一种方法,是根据混合物各种成分的粒子大小不同进行分离,说法正确;
B.结晶法是利用各物质溶解度受温度的影响不同进行分离的一种方法, 说法错误;
C.蒸馏法是利用混合物各成分的沸点不同分离混合物的方法, 说法正确;
D.化学沉淀法是根据混合物各成分的化学性质不同发生化学反应产生沉淀分离的方法, 说法正确;
故答案为: B。
二 、填空题
11.蒸发结晶; 蒸馏
【解析】①过滤:用来分离溶液和不溶性固体的混合物;
②蒸发:用来分离可溶性固体和液体的混合物;
③蒸馏:它利用混合液体或液-固体系中各组分沸点不同,使低沸点组分蒸发,再冷凝以分离整个组分
的操作过程。因为河水中的泥沙不溶于水,所以可以用过滤的方法除去水中的泥沙;用蒸发结晶的方
法从食盐溶液中得到食盐晶体; 蒸馏水是指用蒸馏的方法制备的纯水。
第 7 页(共 10 页)
12.③
【解析】盐提纯的步骤如下:溶解、过滤、蒸发、结晶, 分析各选项的分离方法是否符合粗盐的提纯
步骤即可.
①从空气中分离氧气的方法是先将空气液化, 然后蒸发, 利用液氮的沸点(-196℃)低于液氧的沸点 (--183℃) 把氮气首先蒸发出来剩下的主要就是液态氧了. ②从医用酒精中提纯酒精是利用水和酒精 的沸点不同,加热将酒精先蒸馏出来. ③草木灰的主要成分是碳酸钾和一些不溶性杂质,碳酸钾是可 溶性的,通过溶解、过滤、蒸发和结晶等步骤,可以把草木灰中的碳酸钾提取出来. ④从双氧水制取 氧气的废液中回收二氧化锰,分解后得水和氧气, 所以残渣中主要成分为水和二氧化锰.二氧化锰不
溶于水,故溶解后, 过滤时,二氧化锰在滤渣中.将滤渣烘干即可得二氧化锰固体。
13.(1)110 克
(2)20—30
(3)冷却饱和溶
(4)加水或升温
【解析】(1)根据表格填空即可;
(2)分析表格,哪两个温度之间,二者的溶解度存在包容关系, 那么这两个温度就是所求温度范围;
(3)如果物质的溶解度受温度的影响比较明显,那么可以使用冷却热饱和溶液的方式结晶提纯;
(4)使饱和溶液转变为不饱和溶液的方法:①增加溶剂;②增大溶解度。
(1)根据表格可知,60℃时,硝酸钾的溶解度是 110g;
(2)当温度在 20~30℃之间时, 硝酸钾的溶解度范围为 32g~45.8g,食盐的溶解度在 36~36.3g,那么
食盐的溶解度范围正好在硝酸钾的溶解度范围内, 因此它们的溶解度相等的温度范围为:20~30℃;
(3)硝酸钾的溶解度随温度的升高而明显增大,因此可通过冷却热饱和溶液的方法提纯;
(4)要使 60℃时, 硝酸钾的饱和溶液变为不饱和溶液, 可采取的方法是加水或升温。
三 、实验题
14.(1)不饱和; 11;50g
(2)C
(3)=
【解析】本题有一定难度,理解第一次析出晶体后所得溶液为该温度下的饱和溶液是正确解答本题的
关键。
第 8 页(共 10 页)
20℃一定质量甲的溶液, 蒸发前的烧杯底部没有固体, 第一次蒸发 10g 水, 析出 1g 晶体, 所得溶液为 该温度下的饱和溶液;第二次蒸发 10g 水析出 6g-1g=5g 晶体,两次析出的晶体质量不相同;溶解度是
在一定温度下, 某固体溶质在 100g 溶剂里达到饱和状态所溶解的溶质质量, 进行分析解答。
(1)20℃一定质量甲的溶液,蒸发前的烧杯底部没有固体,第一次蒸发 10g 水,析出 1g 晶体, 所得 溶液为该温度下的饱和溶液;第二次蒸发 10g 水析出 6g-1g=5g 晶体,则蒸发前原溶液是不饱和溶液, 第二次蒸发溶液是饱和溶液, 故第三次蒸发 10g 水会析出 5g 晶体,共析出 6g+5g=11g 晶体,故 n 的数 值是 11;20℃,该饱和溶液蒸发 10g 水, 会析出 5g 晶体, 则 20℃ , 100g 水溶解 50g 固体甲能达到饱
和状态,故甲物质在 20℃时的溶解度是 50g;
(2)在实验过程中,是蒸发水分析出晶体,过程中温度不变,无法确定甲的溶解度随温度变化的趋势,
故选 C;
(3)第 2 个烧杯和第 3 个烧杯中溶液均为该温度下的饱和溶液,2 和 3 烧杯中溶液的质量分数相等。
故答案为:(1)不饱和; 11;50g;(2)C;(3)=。
四 、解答题
15.(1)ABCD
(2)食盐溶液已经是该温度下的饱和溶液
(3)理论上需要 25%的盐池溶液的质量为: 100g×10%÷25%=40g
【解析】(1)根据粗盐提纯的实验过程分析解答;
(2)在温度不变时, 物质的溶解度不变, 即该物质的饱和溶液的溶质质量分数不变,而且此时溶质质
量分数最大;
(3)首先用溶液质量×溶质质量分数计算出 100g 溶液中的溶质质量,再根据“溶液质量=溶质质量分 (溶质质量)数 ”
计算出 25%的溶液质量。
(1)粗盐提纯的实验过程如下:
A.用天平称量规定质量的粗盐;
B.将食盐倒入烧杯, 并倒入适量的水,用玻璃棒搅拌直到全部溶解;
C.对得到的食盐溶液进行过滤;
D.将滤液倒入蒸发皿,用酒精灯进行加热。
则正确顺序为 ABCD。
第 9 页(共 10 页)
(2)盐池中食盐的质量分数始终保持在 25%左右不再升高,原因: 食盐溶液已经是该温度下的饱和溶
液。
第 10 页(共 10 页)
同课章节目录
- 第1章 水和水的溶液
- 第1节 地球上的水
- 第2节 水的组成
- 第3节 水的浮力
- 第4节 物质在水中的分散状况
- 第5节 物质的溶解
- 第6节 物质的分离
- 第7节 水资源的利用、开发和保护
- 第2章 天气与气候
- 第1节 大气层
- 第2节 气温
- 第3节 大气的压强
- 第4节 风和降水
- 第5节 天气预报
- 第6节 气候和影响气候的因素
- 第7节 我国的气候特征与主要气象灾害
- 第3章 生命活动的调节
- 第1节 植物生命活动的调节
- 第2节 人体的激素调节
- 第3节 神经调节
- 第4节 动物的行为
- 第5节 体温的控制
- 第4章 电路探秘
- 第1节 电荷与电流
- 第2节 电流的测量
- 第3节 物质的导电性与电阻
- 第4节 变阻器
- 第5节 电压的测量
- 第6节 电流与电压、电阻的关系
- 第7节 电路分析与应用
- 研究性学习课题
- 一 测定本地区的“酸雨”情况及分析原因
- 二 太阳黑子活动与本地区降水的关系
- 三 训练小动物建立某种条件反射
- 四 调查在自然界或生命活动中的电现象
