四川省广安市岳池县2023-2024学年高二上学期入学考试化学试卷(含答案)
文档属性
| 名称 | 四川省广安市岳池县2023-2024学年高二上学期入学考试化学试卷(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 719.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-20 00:00:00 | ||
图片预览


文档简介
岳池县2023-2024学年高二上学期入学考试化学试卷
试卷满分:100分
可能用到的相对原子质量:H:1 C:12 O:16
一、选择题(每题3分,共42分,每小题只有一个选项符合题意)
1.下列有关说法正确的是( )
A.动力电池使用的石墨烯属于烯烃 B.光导纤维是应用最为广泛的半导体材料
C.青蒿素是抗击疟疾的有效成分 D.向燃煤中加入生石灰可以减少温室气体的排放
2.制作糕点时常用到下列四种原料。其中不属于基本营养物质的是( )
A.小苏打 B.牛奶 C.食用油 D.面粉
3.下列表示不正确的是( )
A.乙烯的结构简式:CH2CH2 B.的电子式:
C.乙烷的空间填充模型: D.硫离子的结构示意图:
4.下列各组性质的比较中,不正确的是( )
A.碱性:NaOH>Mg(OH)2 B.热稳定性:NH3>PH3
C.金属性:K>Na D.原子半径:Cl>S
5.某同学设计的原电池装置如图所示,下列说法错误的是( )
A.该装置能将化学能直接转化为电能
B.Fe电极的电极反应式:Fe—2e— = Fe2+
C.电子从Fe电极流出,通过电解质溶液流向石墨电扱
D.石墨电极为正级,在该电极上发生还原反应
6.下列反应的能量变化过程与图像一致的是( )
A.晶体与混合搅拌 B.与的化合
C.碳酸氢钠与盐酸的反应 D.固体溶于水
7.表示阿伏加德罗常数的值,下列说法正确的是( )
A.一定条件下,与充分反应,得到分子数小于
B.常温下,足量的浓硝酸与56g铁粉充分反应,转移电子数为
C.标准状况下,22.4L H218O中含有的中子数为
D.溶液中含钠离子数为
8.阿司匹林是家中常备药,其结构如图所示,下列说法中正确的是( )
A.分子式为 B.分子中所有原子可能共面
C.能和乙醇发生酯化反应 D.是一种不饱和烃
9.在四个不同容器中、不同条件下进行合成氨反应,根据下列在相同时间内测得的结果判断,生成氨的反应速率最快的是( )
A.v(H2)=0.01mol·L-1·s-1 B.v(NH3)=0.25mol·L-1·min-1
C.v(H2)=0.3mol·L-1·min-1 D.v(N2)=0.1mol·L-1·min-1
10.氮及其化合物的“价—类”二维图如下所示。下列说法正确的是( )
A.X可通过加热氯化铵固体制取
B.从物质类别角度分析,P和Z都属于酸性氧化物
C.将X转化为Q的过程,属于氮的固定
D.浓的Y溶液保存在棕色试剂瓶中,并置于冷暗处
11.下列实验描述、解释或结论均正确的是( )
选项 实验描述 解释或结论
A 用镁、铝做电极材料,以NaOH溶液为电解质溶液的原电池中,铝逐渐溶解 金属的活动性顺序:铝>镁
B 向蔗糖中加入浓硫酸,蔗糖逐渐变黑并有刺激性气味的气体产生 浓硫酸具有脱水性、氧化性
C 既能与HF溶液反应,又能与溶液反应 属于两性氧化物
D 在试管中加入0.5g淀粉和4mL 2mol/L 溶液,加热。待溶液冷却后,再加入少量新制悬浊液,加热,无砖红色沉淀产生 淀粉没有水解
12.下列实验装置或操作能达到实验目的的是( )
A B C D
制取氯气 得到纯净的甲烷 稀释浓硫酸 演示喷泉实验
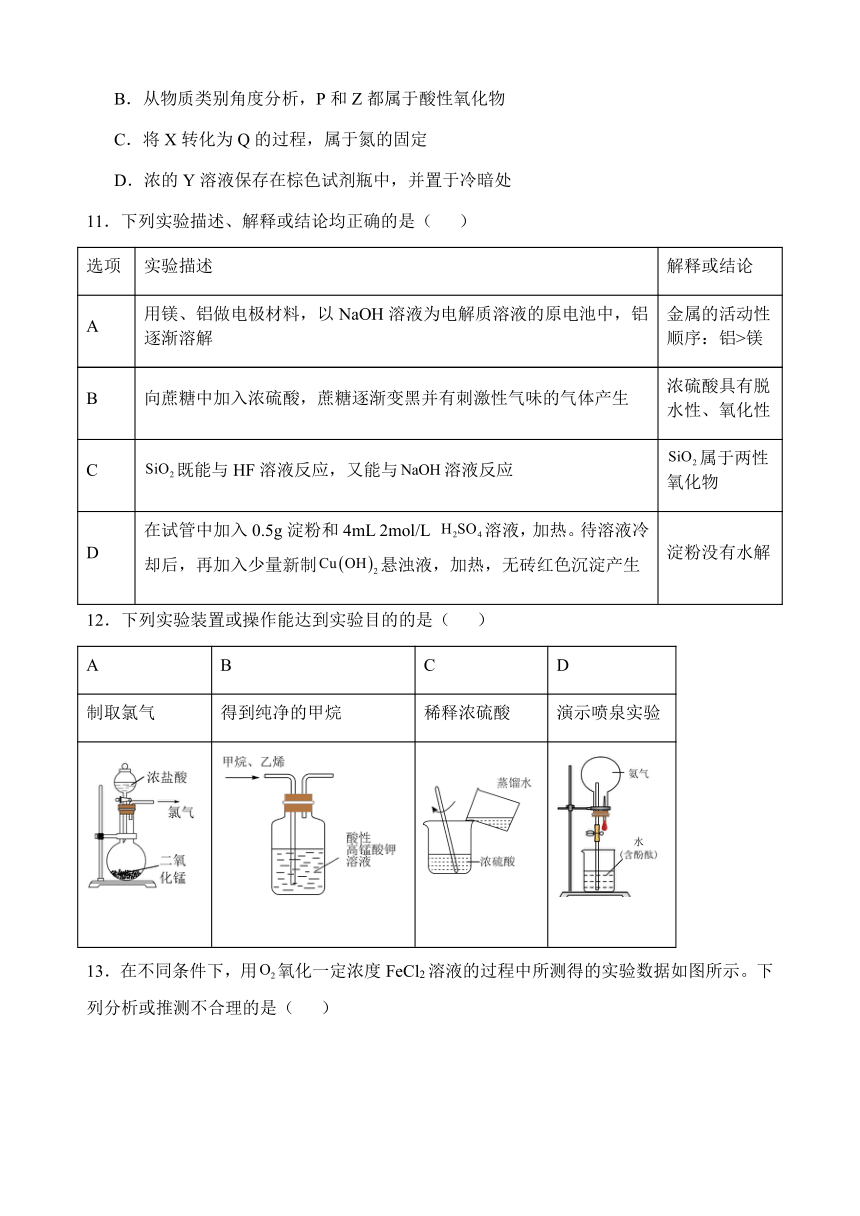
13.在不同条件下,用氧化一定浓度FeCl2溶液的过程中所测得的实验数据如图所示。下列分析或推测不合理的是( )
A.0~6h内,的氧化率随时间延长而逐渐增加
B.由曲线②和③可知,pH越大,的氧化速率越快
C.由曲线①和③可知,温度越高,的氧化速率越快
D.氧化过程的离子方程式为
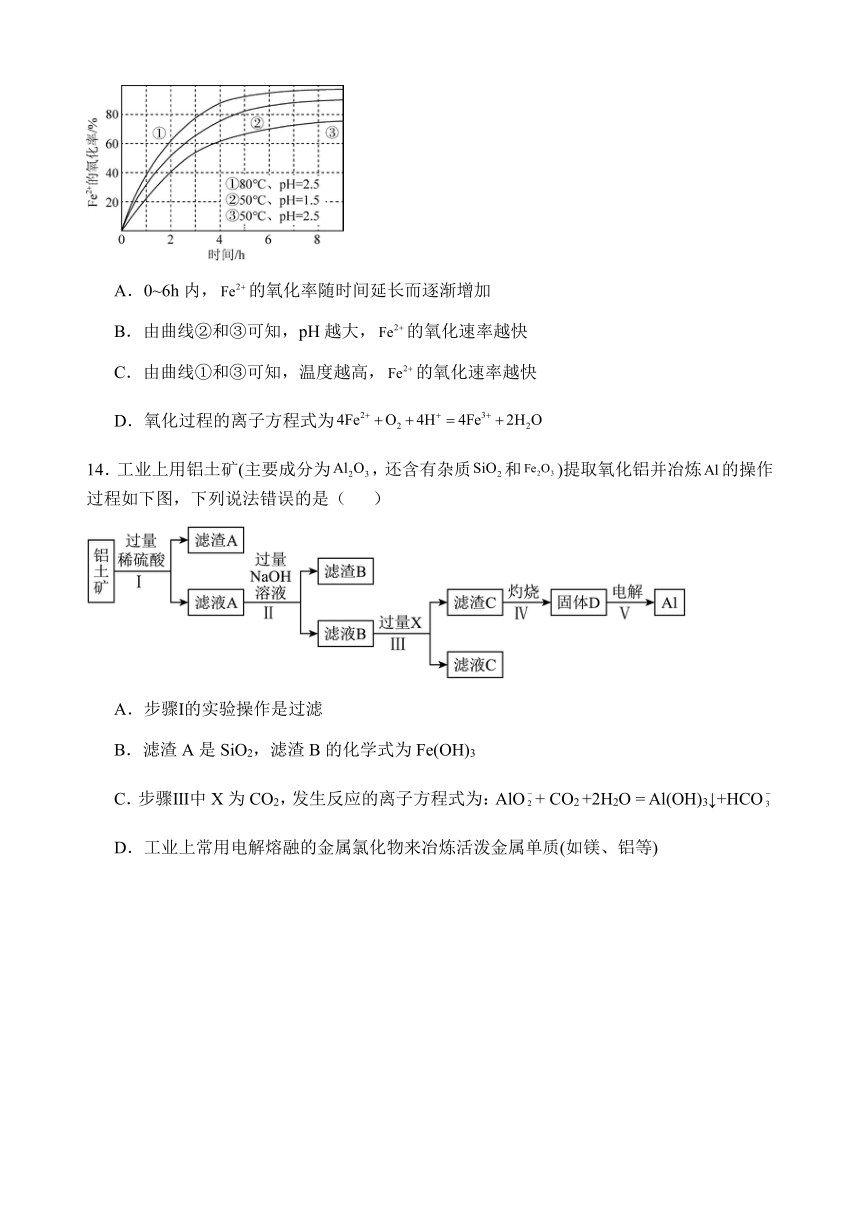
14.工业上用铝土矿(主要成分为,还含有杂质和)提取氧化铝并冶炼的操作过程如下图,下列说法错误的是( )
A.步骤Ⅰ的实验操作是过滤
B.滤渣A是SiO2,滤渣B的化学式为Fe(OH)3
C.步骤Ⅲ中X为CO2,发生反应的离子方程式为:AlO+ CO2 +2H2O = Al(OH)3↓+HCO
D.工业上常用电解熔融的金属氯化物来冶炼活泼金属单质(如镁、铝等)
二、非选择题(共58分)
15.(16分,每空2分)Ⅰ.下表是元素周期表的一部分,针对元素①~⑥回答下列问题。
④ ⑤
① ③ ⑥
②
(1)④元素在周期表中的位置为 。
(2)金属性最强的元素为 (填元素符号),其最高价氧化物对应的水化物中含有的化学键为 。
(3)元素的非金属性⑥ Br(填“>”“<”或“=”)。
Ⅱ.空气吹出法是目前“海水提溴”的主要方法之一,其主要工艺流程如图所示:
(4)步骤①的离子方程式为 。
(5)步骤②说明溴单质具有 性,步骤③④的目的是 。
(6)步骤③的还原剂若为溶液,则其离子方程式为 。
16.(14分,每空2分)已知A主要用于植物生长调节剂,在一定条件下,A能发生下图所示的转化关系。
(1)B和D中官能团的名称分别是 ;
(2)A→B的反应类型是 ;
(3)写出B→C的反应方程式 ;
(4)F的同分异构体结构简式为 ;
(5)已知G是A的同系物,相对分子质量比A大14,请写出由G生成聚合物的反应方程式 ;
(6)下图是实验室制备E的装置示意图:
①写出E的结构简式 ;
②上图中,右侧试管中物质的作用是 ;
17.(14分,每空2分)某温度下CO2加氢制甲醇的的总反应为CO2(g)+3H2(g) CH3OH(g)+H2O(g),该反应为放热反应,在固定容积为2.0 L的密闭容器中充入0.8 mol的CO2和2.4 mol的H2,测得CO2和CH3OH的物质的量随时间变化如图。
(1)对于该反应,反应物的化学键断裂要吸收的能量 (填“大于”、“小于”或“等于”)生成物的化学键形成要放出的能量。
(2)下列措施能加快反应速率的是 (填序号,下同)。
A.往容器中充入N2 B.往容器充入H2 C.及时分离出CH3OH D.减小容器体积 E.选择高效的催化剂
(3)2 min内CH3OH的反应速率为 ,2 min末时v正 v逆(填“<”“>”或“=”)。
(4)恒温恒容条件下,能说明反应已达平衡状态的是 。
A.CO2(g)体积分数保持不变 B.容器中气体压强保持不变
C.容器中CH3OH浓度与H2O浓度之比为1∶1
D.混合气体的密度保持不变 E.H2的生成速率是H2O生成速率的3倍
(5)该反应平衡时CO2的转化率为 。
(6)甲醇是优质的清洁燃料,可制作碱性甲醇燃料电池,其工作原理如图所示,其总反应式为:2CH3OH+3O2+4OH =2+6H2O,则电极A的反应式为 。
18.(14分,每空2分)氨既是一种重要的化工产品,又是一种重要的化工原料。某化学兴趣小组利用如图装置制备氨气并探究相关性质。
(1)A装置用Ca(OH)2和NH4Cl的固体混合物制备NH3的化学方程式为 。
(2)B装置中的药品是 。
(3)D装置后接尾气吸收装置。下列能用来吸收尾气的装置是 (填序号)。
(4)若将D与a相连,在E中产生白色沉淀,其化学式为 。若向a处分别通入下列
(填字母)气体,在E中也会产生白色沉淀。
A.Cl2 B.NO2 C.N2 D.CO
(5)实验后C中固体完全变红,D中无水硫酸铜变蓝,还产生一种单质气体。
①若红色固体为单质,实验后将C中固体与浓硫酸混合加热,其化学方程式为 ;
②若红色固体为Cu和Cu2O的混合物,且物质的量之比为2∶1,则C中发生反应的化学方程式为 。
岳池县2023-2024学年高二上学期入学考试化学试卷参考答案
1 2 3 4 5 6 7
C A A D C B A
8 9 10 11 12 13 14
C A D B D B D
15.(1)第IVA族第二周期
(2) K 离子键、共价键(极性共价键)
(3) >
(4) Cl2+2Br-=2Cl-+Br2
(5) 挥发 富集溴单质,便于后续提取液溴
(6)Br2+SO+H2O=SO+2Br-+2H+
16.(1)羟基、羧基
(2)加成反应
(3)
(4)
(5)
(6) (或) 中和乙酸、溶解乙醇、降低乙酸乙酯在水中的溶解度、提高水溶液的密度以加速乙酸乙酯与水溶液的分层
17.(1)小于
(2)BDE
(3) 0.1 mol/(L·min) >
(4)ABE
(5)75%
(6)CH3OH-6e +8OH =+6H2O
18.(1)Ca(OH)2+2NH4ClCaCl2+2NH3↑+2H2O
(2)碱石灰
(3) ②③
(4) BaSO3 AB
(5) Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O 2NH3+4CuO2Cu+Cu2O+N2+3H2O
试卷满分:100分
可能用到的相对原子质量:H:1 C:12 O:16
一、选择题(每题3分,共42分,每小题只有一个选项符合题意)
1.下列有关说法正确的是( )
A.动力电池使用的石墨烯属于烯烃 B.光导纤维是应用最为广泛的半导体材料
C.青蒿素是抗击疟疾的有效成分 D.向燃煤中加入生石灰可以减少温室气体的排放
2.制作糕点时常用到下列四种原料。其中不属于基本营养物质的是( )
A.小苏打 B.牛奶 C.食用油 D.面粉
3.下列表示不正确的是( )
A.乙烯的结构简式:CH2CH2 B.的电子式:
C.乙烷的空间填充模型: D.硫离子的结构示意图:
4.下列各组性质的比较中,不正确的是( )
A.碱性:NaOH>Mg(OH)2 B.热稳定性:NH3>PH3
C.金属性:K>Na D.原子半径:Cl>S
5.某同学设计的原电池装置如图所示,下列说法错误的是( )
A.该装置能将化学能直接转化为电能
B.Fe电极的电极反应式:Fe—2e— = Fe2+
C.电子从Fe电极流出,通过电解质溶液流向石墨电扱
D.石墨电极为正级,在该电极上发生还原反应
6.下列反应的能量变化过程与图像一致的是( )
A.晶体与混合搅拌 B.与的化合
C.碳酸氢钠与盐酸的反应 D.固体溶于水
7.表示阿伏加德罗常数的值,下列说法正确的是( )
A.一定条件下,与充分反应,得到分子数小于
B.常温下,足量的浓硝酸与56g铁粉充分反应,转移电子数为
C.标准状况下,22.4L H218O中含有的中子数为
D.溶液中含钠离子数为
8.阿司匹林是家中常备药,其结构如图所示,下列说法中正确的是( )
A.分子式为 B.分子中所有原子可能共面
C.能和乙醇发生酯化反应 D.是一种不饱和烃
9.在四个不同容器中、不同条件下进行合成氨反应,根据下列在相同时间内测得的结果判断,生成氨的反应速率最快的是( )
A.v(H2)=0.01mol·L-1·s-1 B.v(NH3)=0.25mol·L-1·min-1
C.v(H2)=0.3mol·L-1·min-1 D.v(N2)=0.1mol·L-1·min-1
10.氮及其化合物的“价—类”二维图如下所示。下列说法正确的是( )
A.X可通过加热氯化铵固体制取
B.从物质类别角度分析,P和Z都属于酸性氧化物
C.将X转化为Q的过程,属于氮的固定
D.浓的Y溶液保存在棕色试剂瓶中,并置于冷暗处
11.下列实验描述、解释或结论均正确的是( )
选项 实验描述 解释或结论
A 用镁、铝做电极材料,以NaOH溶液为电解质溶液的原电池中,铝逐渐溶解 金属的活动性顺序:铝>镁
B 向蔗糖中加入浓硫酸,蔗糖逐渐变黑并有刺激性气味的气体产生 浓硫酸具有脱水性、氧化性
C 既能与HF溶液反应,又能与溶液反应 属于两性氧化物
D 在试管中加入0.5g淀粉和4mL 2mol/L 溶液,加热。待溶液冷却后,再加入少量新制悬浊液,加热,无砖红色沉淀产生 淀粉没有水解
12.下列实验装置或操作能达到实验目的的是( )
A B C D
制取氯气 得到纯净的甲烷 稀释浓硫酸 演示喷泉实验
13.在不同条件下,用氧化一定浓度FeCl2溶液的过程中所测得的实验数据如图所示。下列分析或推测不合理的是( )
A.0~6h内,的氧化率随时间延长而逐渐增加
B.由曲线②和③可知,pH越大,的氧化速率越快
C.由曲线①和③可知,温度越高,的氧化速率越快
D.氧化过程的离子方程式为
14.工业上用铝土矿(主要成分为,还含有杂质和)提取氧化铝并冶炼的操作过程如下图,下列说法错误的是( )
A.步骤Ⅰ的实验操作是过滤
B.滤渣A是SiO2,滤渣B的化学式为Fe(OH)3
C.步骤Ⅲ中X为CO2,发生反应的离子方程式为:AlO+ CO2 +2H2O = Al(OH)3↓+HCO
D.工业上常用电解熔融的金属氯化物来冶炼活泼金属单质(如镁、铝等)
二、非选择题(共58分)
15.(16分,每空2分)Ⅰ.下表是元素周期表的一部分,针对元素①~⑥回答下列问题。
④ ⑤
① ③ ⑥
②
(1)④元素在周期表中的位置为 。
(2)金属性最强的元素为 (填元素符号),其最高价氧化物对应的水化物中含有的化学键为 。
(3)元素的非金属性⑥ Br(填“>”“<”或“=”)。
Ⅱ.空气吹出法是目前“海水提溴”的主要方法之一,其主要工艺流程如图所示:
(4)步骤①的离子方程式为 。
(5)步骤②说明溴单质具有 性,步骤③④的目的是 。
(6)步骤③的还原剂若为溶液,则其离子方程式为 。
16.(14分,每空2分)已知A主要用于植物生长调节剂,在一定条件下,A能发生下图所示的转化关系。
(1)B和D中官能团的名称分别是 ;
(2)A→B的反应类型是 ;
(3)写出B→C的反应方程式 ;
(4)F的同分异构体结构简式为 ;
(5)已知G是A的同系物,相对分子质量比A大14,请写出由G生成聚合物的反应方程式 ;
(6)下图是实验室制备E的装置示意图:
①写出E的结构简式 ;
②上图中,右侧试管中物质的作用是 ;
17.(14分,每空2分)某温度下CO2加氢制甲醇的的总反应为CO2(g)+3H2(g) CH3OH(g)+H2O(g),该反应为放热反应,在固定容积为2.0 L的密闭容器中充入0.8 mol的CO2和2.4 mol的H2,测得CO2和CH3OH的物质的量随时间变化如图。
(1)对于该反应,反应物的化学键断裂要吸收的能量 (填“大于”、“小于”或“等于”)生成物的化学键形成要放出的能量。
(2)下列措施能加快反应速率的是 (填序号,下同)。
A.往容器中充入N2 B.往容器充入H2 C.及时分离出CH3OH D.减小容器体积 E.选择高效的催化剂
(3)2 min内CH3OH的反应速率为 ,2 min末时v正 v逆(填“<”“>”或“=”)。
(4)恒温恒容条件下,能说明反应已达平衡状态的是 。
A.CO2(g)体积分数保持不变 B.容器中气体压强保持不变
C.容器中CH3OH浓度与H2O浓度之比为1∶1
D.混合气体的密度保持不变 E.H2的生成速率是H2O生成速率的3倍
(5)该反应平衡时CO2的转化率为 。
(6)甲醇是优质的清洁燃料,可制作碱性甲醇燃料电池,其工作原理如图所示,其总反应式为:2CH3OH+3O2+4OH =2+6H2O,则电极A的反应式为 。
18.(14分,每空2分)氨既是一种重要的化工产品,又是一种重要的化工原料。某化学兴趣小组利用如图装置制备氨气并探究相关性质。
(1)A装置用Ca(OH)2和NH4Cl的固体混合物制备NH3的化学方程式为 。
(2)B装置中的药品是 。
(3)D装置后接尾气吸收装置。下列能用来吸收尾气的装置是 (填序号)。
(4)若将D与a相连,在E中产生白色沉淀,其化学式为 。若向a处分别通入下列
(填字母)气体,在E中也会产生白色沉淀。
A.Cl2 B.NO2 C.N2 D.CO
(5)实验后C中固体完全变红,D中无水硫酸铜变蓝,还产生一种单质气体。
①若红色固体为单质,实验后将C中固体与浓硫酸混合加热,其化学方程式为 ;
②若红色固体为Cu和Cu2O的混合物,且物质的量之比为2∶1,则C中发生反应的化学方程式为 。
岳池县2023-2024学年高二上学期入学考试化学试卷参考答案
1 2 3 4 5 6 7
C A A D C B A
8 9 10 11 12 13 14
C A D B D B D
15.(1)第IVA族第二周期
(2) K 离子键、共价键(极性共价键)
(3) >
(4) Cl2+2Br-=2Cl-+Br2
(5) 挥发 富集溴单质,便于后续提取液溴
(6)Br2+SO+H2O=SO+2Br-+2H+
16.(1)羟基、羧基
(2)加成反应
(3)
(4)
(5)
(6) (或) 中和乙酸、溶解乙醇、降低乙酸乙酯在水中的溶解度、提高水溶液的密度以加速乙酸乙酯与水溶液的分层
17.(1)小于
(2)BDE
(3) 0.1 mol/(L·min) >
(4)ABE
(5)75%
(6)CH3OH-6e +8OH =+6H2O
18.(1)Ca(OH)2+2NH4ClCaCl2+2NH3↑+2H2O
(2)碱石灰
(3) ②③
(4) BaSO3 AB
(5) Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O 2NH3+4CuO2Cu+Cu2O+N2+3H2O
同课章节目录
