化学人教版(2019)必修第一册1.2.4.离子共存、离子推断专题(共24张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.2.4.离子共存、离子推断专题(共24张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 523.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-21 18:53:36 | ||
图片预览








文档简介
(共24张PPT)
第4课时
离子共存、离子推断
第一章 第二节 离子反应
学习目标
1.掌握离子共存的本质,会判断溶液中离子能否大量共存
2.能根据四项基本原则进行离子推断
温故知新
【练一练】下列能发生离子反应的是并说明原因。
①NaCl溶液与AgNO3溶液 ②KNO3溶液与NaOH溶液
③稀硫酸与BaCl2溶液 ④盐酸与Na2CO3溶液
⑤Na2CO3溶液与Ca(OH)2溶液 ⑥Na2SO4溶液和CuCl2溶液
离子共存
一、离子共存本质:
离子能否大量共存,本质上是看离子之间能否发生反应。
若能反应,则不能大量共存;
若不反应,则能大量共存。
专题一:离子共存
离子共存
生成水
生成气体
生成沉淀(包括难溶盐、弱碱)
生成NH3·H20
生成弱酸
离子反应发生的条件:
离子共存
反应条件之一生成水:
H++OH-=
HCO3-+OH-=
HSO3-+OH-=
HS-+OH-=
H2O
H2O+CO32-
H2O+SO32-
H2O+S2-
离子共存
反应条件之二生成气体:
CO32-+2H+
HCO3-+H+
SO32-+2H+
HSO3-+H+
S2-+2H+
HS-+H+
=H2O+CO2↑
=H2O+CO2↑
=H2O+SO2↑
=H2O+SO2↑
=H2S↑
=H2S↑
离子共存
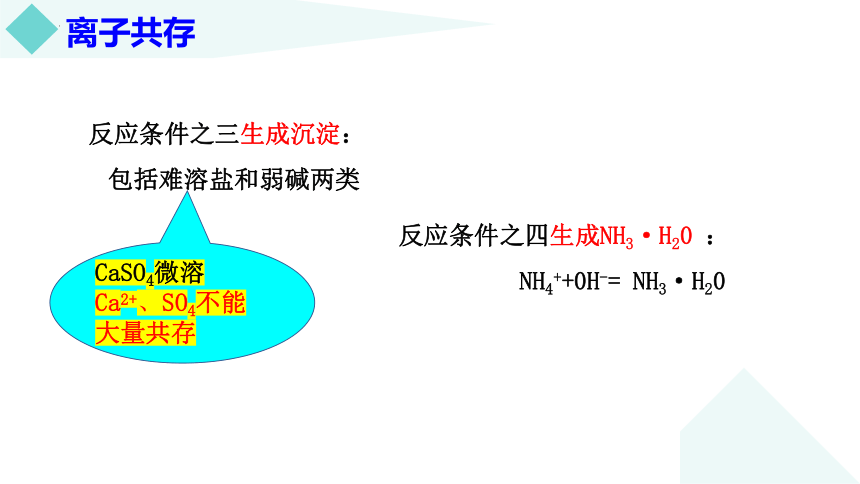
反应条件之三生成沉淀:
包括难溶盐和弱碱两类
反应条件之四生成NH3·H20 :
NH4++0H-= NH3·H20
CaSO4微溶
Ca2+、SO4不能大量共存
离子共存
反应条件之五弱酸:
强酸制弱酸:
CH3COONa+HCl=CH3COOH+NaCl
NaClO+HCl=HClO+NaCl
CH3COO-+H+=CH3COOH
ClO-+H+=HClO
离子共存
D
【对点训练】
离子共存
2、下列各组离子,能在溶液中大量共存的是( )
C
离子共存
二、有隐含条件的离子共存问题
(1)无色透明溶液:
“无色透明”是指溶液中不含带有颜色的离子。
例如:Cu2+、Fe3+、Fe2+、MnO4-
“透明溶液” 并不意味着溶液无色。
澄清透明
无色透明
离子共存
(2)隐藏离子:
隐藏H+的不同描述:
①酸性溶液
②常温下,pH<7的溶液
③使紫色石蕊试液变红的溶液
④使pH试纸变红的溶液
⑤与Zn、Fe等反应放出H2的溶液
隐藏OH-的不同描述:
①碱性溶液
②常温下,pH>7的溶液
③使紫色石蕊试液变蓝色的溶液
④使无色酚酞溶液变红的溶液
⑤使pH试纸变蓝的溶液
有隐藏离子时,考虑共存要将隐藏离子一并考虑进去。
巩固训练
1、下列各组离子中,在碱性溶液中能大量共存,且溶液为无色透明的是( )
A.K+、MnO4-、Cl-、SO42-
B.Na+、CO32-、SO42-、Cl-
C.NO3-、Na+、HCO3-、Ba2+
D.Na+、 NO3- 、H+、 SO42-
B
巩固训练
2、在强酸性无色透明溶液中,下列各组离子能大量共存的是( )
A.Fe3+、K+、Cl-、 NO3-
B.Ag+、Na+、 NO3- 、Cl-
C.Zn2+、Al3+、 SO42- 、Cl-
D.Ba2+、NH4+、Cl-、 HCO3-
C
巩固训练
3、在给定的四种溶液中加入以下各种离子,能在原溶液中大量共存的是( )
A.常温下pH<7的溶液:Cu2+、Na+、Mg2+、NO3-
B.滴加酚酞溶液显红色的溶液:Fe3+、 NH4+ 、Cl-、 NO3-
C.所含溶质为NaOH的溶液:K+、 SO42- 、 NO3- 、H+
D.碱性溶液:K+、 HCO3- 、Br-、Ba2+
A
巩固训练
4、以下各组离子能在溶液中大量共存的是( )
A.含有大量SO42-的溶液中:Mg2+、Cu2+、Cl-、 NO3-
B.滴加酚酞变红的溶液中: SO42- 、Cu2+、K+、Cl-
C.NaHSO4溶液中:K+、 CO32- 、 NO3- 、Na+
D.常温下,加入Fe粉能生成H2的溶液中:Na+、Ca2+、Cl-、 HCO3-
A
巩固训练
5、如图是某矿物质饮用水的部分标签,则该饮用水中还可能大量存在的是( )
A.OH- B.Ag+ C.Na+ D.Ca2+
C
离子推断
专题二:离子推断
1、三种离子的检验方法
熟记两个不溶与酸的沉淀:BaSO4、AgCl
离子推断
2、离子推断的“四项基本原则”
(1)肯定性原则:据现象推断肯定存在或肯定不存在的离子。
(2)互斥性原则:例如溶液中含有Ba2+,则不存在CO32- 、 SO42- 。
(3)进出性原则:例如前面操作中滴加了BaCl2溶液,之后检测出有Cl-,则无法确定原溶液中有没有Cl-。
(4)电中性原则:阳离子和阴离子同时存在于溶液中且正负电荷数相等。
巩固训练
1、某无色透明的溶液中只含有Cu2+、Mg2+、Ba2+、H+、Ag+、 SO42- 、 HCO3- 、OH-、 NO3-中的三种离子,若向其中加入石蕊溶液,溶液显蓝色,则原溶液中存在的离子是( )
A.Ba2+、OH-、 NO3- B.Ag+、 HCO3- 、 NO3-
C.Mg2+、Ag+、 SO42- D.Mg2+、 SO42- 、OH-
A
巩固训练
2、某无色溶液中只可能含有K+、Ag+、Ba2+、Cu2+、Cl-、OH-、 CO32- 、 SO42-中的一种或几种,对其进行如下实验操作,下列对该溶液的说法正确的是( )
①取少量溶液,滴加无色酚酞溶液,酚酞溶液变红
②另取少量溶液,加入足量BaCl2溶液,产生白色沉淀
③向②所得混合物中加足量盐酸,沉淀部分溶解,并有无色气体生成
④将③所得混合物过滤,向滤液中加入AgNO3溶液,有白色沉淀生成
A.一定含K+、OH-、 CO32- 、 SO42- B.可能含Cl-、OH-
C.一定不含Ag+、Ba2+、Cu2+、Cl- D.无法判断离子种类
A
巩固训练
3、有一瓶无色透明溶液,含Cl-、 CO32- 、 SO42- 、Na+、K+、Mg2+、Cu2+中的某几种。
①取少量原溶液加入足量的Ba(OH)2溶液产生白色沉淀;
②取少量原溶液加入足量的BaCl2溶液不产生沉淀;
③取少量原溶液加入足量的AgNO3溶液产生白色沉淀,再加稀硝酸,白色沉淀不溶解。
回答下列问题:
(1)原溶液中一定含有的离子是______________,一定不含有的阴离子是______________,可能含有的离子是______________。
(2)有的同学认为实验③可以省略,你认为是否正确(填“是”或“否”) ________,说明理由
________________________________________________________________。
(3)写出①中反应的离子方程式:____________________________________。
Cl-、Mg2+
Na+、K+
CO32- 、 SO42-
是
根据电中性原则,原溶液中一定有Cl-
Mg2++2OH-=Mg(OH)2 ↓
巩固训练
4、有A、B、C、D四种化合物,分别由K+、Ba2+、 SO42- 、 CO32- 、OH-中的两种组成,它们具有下列性质:
①A不溶于水和盐酸;②B不溶于水,但溶于盐酸,并放出无色无刺激性气味的气体E;③C的水溶液呈碱性,与硫酸反应生成A;④D可溶于水,与硫酸作用时放出气体E,E可使澄清石灰水变浑浊。
(1)推断A、B、C、D的化学式:A.________,B.________,C.________,D.________
(2)写出下列反应的离子方程式。
B与盐酸反应:_________________________________________________
C与硫酸反应:_________________________________________________
E(少量)与澄清石灰水反应:______________________________________
BaSO4
BaCO3
Ba(OH)2
K2CO3
2H++BaCO3===CO2↑+H2O+Ba2+
Ba2++2OH-+2H++SO42-===BaSO4↓+2H2O
Ca2++2OH-+CO2===CaCO3↓+H2O
第4课时
离子共存、离子推断
第一章 第二节 离子反应
学习目标
1.掌握离子共存的本质,会判断溶液中离子能否大量共存
2.能根据四项基本原则进行离子推断
温故知新
【练一练】下列能发生离子反应的是并说明原因。
①NaCl溶液与AgNO3溶液 ②KNO3溶液与NaOH溶液
③稀硫酸与BaCl2溶液 ④盐酸与Na2CO3溶液
⑤Na2CO3溶液与Ca(OH)2溶液 ⑥Na2SO4溶液和CuCl2溶液
离子共存
一、离子共存本质:
离子能否大量共存,本质上是看离子之间能否发生反应。
若能反应,则不能大量共存;
若不反应,则能大量共存。
专题一:离子共存
离子共存
生成水
生成气体
生成沉淀(包括难溶盐、弱碱)
生成NH3·H20
生成弱酸
离子反应发生的条件:
离子共存
反应条件之一生成水:
H++OH-=
HCO3-+OH-=
HSO3-+OH-=
HS-+OH-=
H2O
H2O+CO32-
H2O+SO32-
H2O+S2-
离子共存
反应条件之二生成气体:
CO32-+2H+
HCO3-+H+
SO32-+2H+
HSO3-+H+
S2-+2H+
HS-+H+
=H2O+CO2↑
=H2O+CO2↑
=H2O+SO2↑
=H2O+SO2↑
=H2S↑
=H2S↑
离子共存
反应条件之三生成沉淀:
包括难溶盐和弱碱两类
反应条件之四生成NH3·H20 :
NH4++0H-= NH3·H20
CaSO4微溶
Ca2+、SO4不能大量共存
离子共存
反应条件之五弱酸:
强酸制弱酸:
CH3COONa+HCl=CH3COOH+NaCl
NaClO+HCl=HClO+NaCl
CH3COO-+H+=CH3COOH
ClO-+H+=HClO
离子共存
D
【对点训练】
离子共存
2、下列各组离子,能在溶液中大量共存的是( )
C
离子共存
二、有隐含条件的离子共存问题
(1)无色透明溶液:
“无色透明”是指溶液中不含带有颜色的离子。
例如:Cu2+、Fe3+、Fe2+、MnO4-
“透明溶液” 并不意味着溶液无色。
澄清透明
无色透明
离子共存
(2)隐藏离子:
隐藏H+的不同描述:
①酸性溶液
②常温下,pH<7的溶液
③使紫色石蕊试液变红的溶液
④使pH试纸变红的溶液
⑤与Zn、Fe等反应放出H2的溶液
隐藏OH-的不同描述:
①碱性溶液
②常温下,pH>7的溶液
③使紫色石蕊试液变蓝色的溶液
④使无色酚酞溶液变红的溶液
⑤使pH试纸变蓝的溶液
有隐藏离子时,考虑共存要将隐藏离子一并考虑进去。
巩固训练
1、下列各组离子中,在碱性溶液中能大量共存,且溶液为无色透明的是( )
A.K+、MnO4-、Cl-、SO42-
B.Na+、CO32-、SO42-、Cl-
C.NO3-、Na+、HCO3-、Ba2+
D.Na+、 NO3- 、H+、 SO42-
B
巩固训练
2、在强酸性无色透明溶液中,下列各组离子能大量共存的是( )
A.Fe3+、K+、Cl-、 NO3-
B.Ag+、Na+、 NO3- 、Cl-
C.Zn2+、Al3+、 SO42- 、Cl-
D.Ba2+、NH4+、Cl-、 HCO3-
C
巩固训练
3、在给定的四种溶液中加入以下各种离子,能在原溶液中大量共存的是( )
A.常温下pH<7的溶液:Cu2+、Na+、Mg2+、NO3-
B.滴加酚酞溶液显红色的溶液:Fe3+、 NH4+ 、Cl-、 NO3-
C.所含溶质为NaOH的溶液:K+、 SO42- 、 NO3- 、H+
D.碱性溶液:K+、 HCO3- 、Br-、Ba2+
A
巩固训练
4、以下各组离子能在溶液中大量共存的是( )
A.含有大量SO42-的溶液中:Mg2+、Cu2+、Cl-、 NO3-
B.滴加酚酞变红的溶液中: SO42- 、Cu2+、K+、Cl-
C.NaHSO4溶液中:K+、 CO32- 、 NO3- 、Na+
D.常温下,加入Fe粉能生成H2的溶液中:Na+、Ca2+、Cl-、 HCO3-
A
巩固训练
5、如图是某矿物质饮用水的部分标签,则该饮用水中还可能大量存在的是( )
A.OH- B.Ag+ C.Na+ D.Ca2+
C
离子推断
专题二:离子推断
1、三种离子的检验方法
熟记两个不溶与酸的沉淀:BaSO4、AgCl
离子推断
2、离子推断的“四项基本原则”
(1)肯定性原则:据现象推断肯定存在或肯定不存在的离子。
(2)互斥性原则:例如溶液中含有Ba2+,则不存在CO32- 、 SO42- 。
(3)进出性原则:例如前面操作中滴加了BaCl2溶液,之后检测出有Cl-,则无法确定原溶液中有没有Cl-。
(4)电中性原则:阳离子和阴离子同时存在于溶液中且正负电荷数相等。
巩固训练
1、某无色透明的溶液中只含有Cu2+、Mg2+、Ba2+、H+、Ag+、 SO42- 、 HCO3- 、OH-、 NO3-中的三种离子,若向其中加入石蕊溶液,溶液显蓝色,则原溶液中存在的离子是( )
A.Ba2+、OH-、 NO3- B.Ag+、 HCO3- 、 NO3-
C.Mg2+、Ag+、 SO42- D.Mg2+、 SO42- 、OH-
A
巩固训练
2、某无色溶液中只可能含有K+、Ag+、Ba2+、Cu2+、Cl-、OH-、 CO32- 、 SO42-中的一种或几种,对其进行如下实验操作,下列对该溶液的说法正确的是( )
①取少量溶液,滴加无色酚酞溶液,酚酞溶液变红
②另取少量溶液,加入足量BaCl2溶液,产生白色沉淀
③向②所得混合物中加足量盐酸,沉淀部分溶解,并有无色气体生成
④将③所得混合物过滤,向滤液中加入AgNO3溶液,有白色沉淀生成
A.一定含K+、OH-、 CO32- 、 SO42- B.可能含Cl-、OH-
C.一定不含Ag+、Ba2+、Cu2+、Cl- D.无法判断离子种类
A
巩固训练
3、有一瓶无色透明溶液,含Cl-、 CO32- 、 SO42- 、Na+、K+、Mg2+、Cu2+中的某几种。
①取少量原溶液加入足量的Ba(OH)2溶液产生白色沉淀;
②取少量原溶液加入足量的BaCl2溶液不产生沉淀;
③取少量原溶液加入足量的AgNO3溶液产生白色沉淀,再加稀硝酸,白色沉淀不溶解。
回答下列问题:
(1)原溶液中一定含有的离子是______________,一定不含有的阴离子是______________,可能含有的离子是______________。
(2)有的同学认为实验③可以省略,你认为是否正确(填“是”或“否”) ________,说明理由
________________________________________________________________。
(3)写出①中反应的离子方程式:____________________________________。
Cl-、Mg2+
Na+、K+
CO32- 、 SO42-
是
根据电中性原则,原溶液中一定有Cl-
Mg2++2OH-=Mg(OH)2 ↓
巩固训练
4、有A、B、C、D四种化合物,分别由K+、Ba2+、 SO42- 、 CO32- 、OH-中的两种组成,它们具有下列性质:
①A不溶于水和盐酸;②B不溶于水,但溶于盐酸,并放出无色无刺激性气味的气体E;③C的水溶液呈碱性,与硫酸反应生成A;④D可溶于水,与硫酸作用时放出气体E,E可使澄清石灰水变浑浊。
(1)推断A、B、C、D的化学式:A.________,B.________,C.________,D.________
(2)写出下列反应的离子方程式。
B与盐酸反应:_________________________________________________
C与硫酸反应:_________________________________________________
E(少量)与澄清石灰水反应:______________________________________
BaSO4
BaCO3
Ba(OH)2
K2CO3
2H++BaCO3===CO2↑+H2O+Ba2+
Ba2++2OH-+2H++SO42-===BaSO4↓+2H2O
Ca2++2OH-+CO2===CaCO3↓+H2O
