人教版必修一第二章海水中的重要元素第三节第三课时物质的量浓度(共17张PPT)
文档属性
| 名称 | 人教版必修一第二章海水中的重要元素第三节第三课时物质的量浓度(共17张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 6.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-21 19:12:09 | ||
图片预览




文档简介
(共17张PPT)
物质的量浓度
学习
目标
1.构建物质的量浓度这一概念的模型,掌握物质的量浓度的含义和应用。
2.学会配制一定物质的量浓度的实验,进一步理解物质的量、物质的质量和物质的量浓度之间的转化关系,从定量的角度体会宏观和微观的结合。
生活中溶液的浓度是如何表示的呢?
【思考】
0.9%表示氯化钠的什么物理量呢?
溶质的质量与溶液的质量之比是用来表示溶液中溶质与溶液的质量关系的。
环节
一
物质的量浓度-一定质量分数的溶液配制
【交流讨论】如何设计实验配制100g质量分数为5%的NaCl溶液?
1、取多少?(溶质NaCl、溶剂H2O的量各取多少?)
2、如何取?(用到什么仪器?)
3、如何溶解?(用到什么仪器?)
环节
一
物质的量浓度-一定质量分数的溶液配制
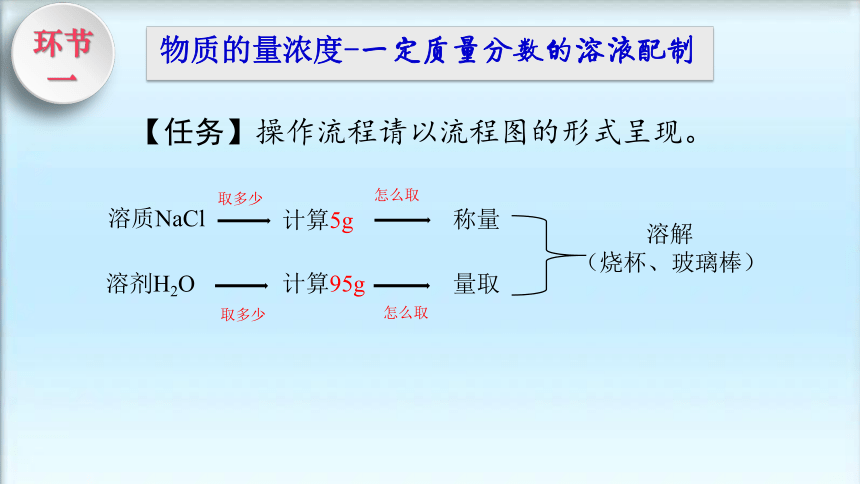
【任务】操作流程请以流程图的形式呈现。
溶质NaCl
溶剂H2O
计算5g
计算95g
称量
量取
溶解
(烧杯、玻璃棒)
取多少
取多少
怎么取
怎么取
环节
二
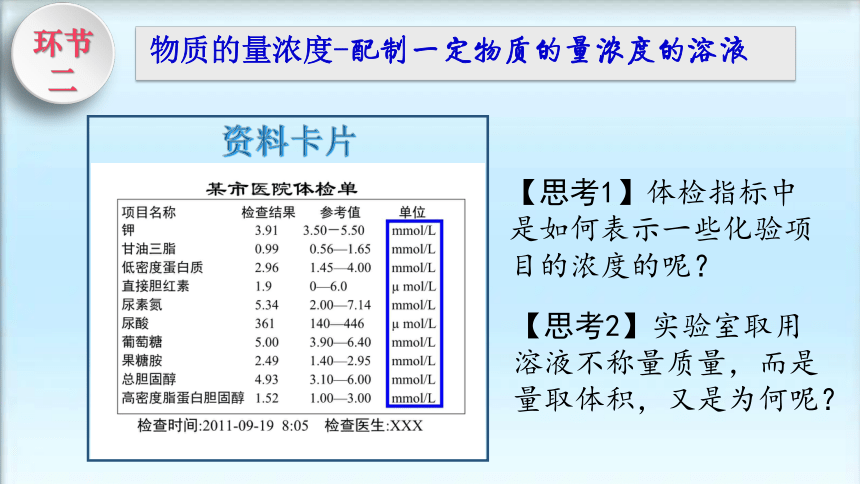
资料卡片
物质的量浓度-配制一定物质的量浓度的溶液
【思考1】体检指标中是如何表示一些化验项目的浓度的呢?
【思考2】实验室取用溶液不称量质量,而是量取体积,又是为何呢?
【交流讨论】
如何准确配制0.1LNaCl溶液 ,溶质为0.1mol?
物质的量浓度-配制一定物质的量浓度的溶液
环节
二
基本思路:
物质的量浓度-配制一定物质的量浓度的溶液
环节
二
【思考1】精确配制溶液的浓度,需要用到哪些精准的仪器呢?
【思考2】容量瓶有哪些规格和特点呢?使用有何注意事项?
一条刻度线
专用活塞
温度和容积
物质的量浓度-配制一定物质的量浓度的溶液
环节
二
选用原则:等大或稍大。
实验步骤
【任务】以小组为单位配制0.1L溶质为0.1mol的NaCl溶液
物质的量浓度-配制一定物质的量浓度的溶液
环节
二
计算
物质的量浓度-配制一定物质的量浓度的溶液
环节
二
【交流讨论1】在定容操作中,当液面距离容量瓶颈部刻度线1~2cm时,如何操作呢?
【交流讨论2】若判断凹液面与刻度线位置时俯视或仰视会造成什么结果?
俯视
偏高
仰视
偏低
【任务】归纳配制溶液的基本步骤
物质的量浓度-配制一定物质的量浓度的溶液
环节
二
计算
计算需要的固体质量
称量
托盘天平(左物右码)
溶解
用烧杯,加蒸馏水,玻璃棒搅拌
转移
玻璃棒引流,蒸馏水洗涤2-3次
定容
溶液凹液面与刻度线相切
溶解
用烧杯,加蒸馏水,玻璃棒搅拌
环节
三
物质的量浓度-概念
2.单位mol/L或mol·L-1
【交流讨论】结合配制过程,请同学们讨论可以怎样表示该溶液的组成?
【思考】我们刚刚配制的0.1L含0.1molNaCl 的溶液,其物质的量浓度是多少?
C ?
(Na+)
1.表达式: CB=
n
B
V
环节
三
物质的量浓度-概念
【思考】
(1)将40g NaOH 配成2L溶液,其物质的量浓度为多少?
(2)物质的量浓度为2mol/L的硫酸溶 液500mL, 含硫酸的物质的量为多少?
课堂
小结
STEP
01
STEP
02
STEP
03
STEP
04
从生活中发现浓度概念,引发学生思考,构建物质的量浓度概念,宏微结合。
构建物质的量浓度模型,并应用此模型计算配制一定浓度溶液所需溶质的质量。
提高学生实验能力,在实验中认识物质的量在化学定量研究中的重要作用。
激发学生探索未知、崇尚真理的意识,运用化学知识重新看待生活中的现象。
迁移应用
环节
四
【交流讨论】怎么用18.4 mol·L-1的浓硫酸配制100 mL 1.84 mol·L-1的稀硫酸?
基本思路:
谢谢!
物质的量浓度
学习
目标
1.构建物质的量浓度这一概念的模型,掌握物质的量浓度的含义和应用。
2.学会配制一定物质的量浓度的实验,进一步理解物质的量、物质的质量和物质的量浓度之间的转化关系,从定量的角度体会宏观和微观的结合。
生活中溶液的浓度是如何表示的呢?
【思考】
0.9%表示氯化钠的什么物理量呢?
溶质的质量与溶液的质量之比是用来表示溶液中溶质与溶液的质量关系的。
环节
一
物质的量浓度-一定质量分数的溶液配制
【交流讨论】如何设计实验配制100g质量分数为5%的NaCl溶液?
1、取多少?(溶质NaCl、溶剂H2O的量各取多少?)
2、如何取?(用到什么仪器?)
3、如何溶解?(用到什么仪器?)
环节
一
物质的量浓度-一定质量分数的溶液配制
【任务】操作流程请以流程图的形式呈现。
溶质NaCl
溶剂H2O
计算5g
计算95g
称量
量取
溶解
(烧杯、玻璃棒)
取多少
取多少
怎么取
怎么取
环节
二
资料卡片
物质的量浓度-配制一定物质的量浓度的溶液
【思考1】体检指标中是如何表示一些化验项目的浓度的呢?
【思考2】实验室取用溶液不称量质量,而是量取体积,又是为何呢?
【交流讨论】
如何准确配制0.1LNaCl溶液 ,溶质为0.1mol?
物质的量浓度-配制一定物质的量浓度的溶液
环节
二
基本思路:
物质的量浓度-配制一定物质的量浓度的溶液
环节
二
【思考1】精确配制溶液的浓度,需要用到哪些精准的仪器呢?
【思考2】容量瓶有哪些规格和特点呢?使用有何注意事项?
一条刻度线
专用活塞
温度和容积
物质的量浓度-配制一定物质的量浓度的溶液
环节
二
选用原则:等大或稍大。
实验步骤
【任务】以小组为单位配制0.1L溶质为0.1mol的NaCl溶液
物质的量浓度-配制一定物质的量浓度的溶液
环节
二
计算
物质的量浓度-配制一定物质的量浓度的溶液
环节
二
【交流讨论1】在定容操作中,当液面距离容量瓶颈部刻度线1~2cm时,如何操作呢?
【交流讨论2】若判断凹液面与刻度线位置时俯视或仰视会造成什么结果?
俯视
偏高
仰视
偏低
【任务】归纳配制溶液的基本步骤
物质的量浓度-配制一定物质的量浓度的溶液
环节
二
计算
计算需要的固体质量
称量
托盘天平(左物右码)
溶解
用烧杯,加蒸馏水,玻璃棒搅拌
转移
玻璃棒引流,蒸馏水洗涤2-3次
定容
溶液凹液面与刻度线相切
溶解
用烧杯,加蒸馏水,玻璃棒搅拌
环节
三
物质的量浓度-概念
2.单位mol/L或mol·L-1
【交流讨论】结合配制过程,请同学们讨论可以怎样表示该溶液的组成?
【思考】我们刚刚配制的0.1L含0.1molNaCl 的溶液,其物质的量浓度是多少?
C ?
(Na+)
1.表达式: CB=
n
B
V
环节
三
物质的量浓度-概念
【思考】
(1)将40g NaOH 配成2L溶液,其物质的量浓度为多少?
(2)物质的量浓度为2mol/L的硫酸溶 液500mL, 含硫酸的物质的量为多少?
课堂
小结
STEP
01
STEP
02
STEP
03
STEP
04
从生活中发现浓度概念,引发学生思考,构建物质的量浓度概念,宏微结合。
构建物质的量浓度模型,并应用此模型计算配制一定浓度溶液所需溶质的质量。
提高学生实验能力,在实验中认识物质的量在化学定量研究中的重要作用。
激发学生探索未知、崇尚真理的意识,运用化学知识重新看待生活中的现象。
迁移应用
环节
四
【交流讨论】怎么用18.4 mol·L-1的浓硫酸配制100 mL 1.84 mol·L-1的稀硫酸?
基本思路:
谢谢!
